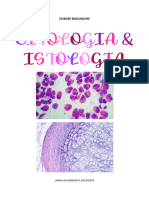
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Legami Chimici
Caricato da
ciao ciaoneTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Legami Chimici
Caricato da
ciao ciaoneCopyright:
Formati disponibili
LEGAME CHIMICO
permette agli atomi di unirsi e formare molecole e agli ioni di carica opposta
di attrarsi reciprocamente.
REGOLA DELL’OTTETTO
un atomo è particolarmente stabile quando ha 8 elettroni nello strato di
valenza
LEGAME COVALENTE
viene messa in condivisione una coppia di elettroni tra due atomi, dopodiché
si va a formare a molecola
(puro 0,4/polare 0,9/ ionico)
LEGAME IONICO
avviene quando i 2 atomi che si legano hanno caratteristiche completamente
diverse e avviene anche il trasferimento degli elettroni verso l’atomo che li
attrae maggiormente
LEGAME A IDROGENO
può avvenire solo nell’azoto, ossigeno e fluoro. Non consiste nella
condivisione di elettroni, ma nell’attrazione di natura elettrica tra poli diversi
di molecole diverse
RETICOLO CRISTALLINO
è la posizione che assumono le molecole dell’acqua allo stato solido
TENSIONE SUPERFICIALE
tendenza delle molecole dell’acqua a lasciarsi attrarre verso l’interno
CAPILLARITÀ
capacità dell’acqua di risalire lungo i tubicini
DISSOCIAZIONE IONICA
processo per mezzo del quale le molecole dell’acqua indeboliscono i legami
dei composti ionici riuscendo a liberare gli ioni dal reticolo cristallino
ELETTRONEGATIVITÀ
tendenza di un atomo ad attrarre a sé gli elettroni coinvolti in 1 legame
IONIZZAZIONE
capacità delle molecole d’acqua che interagiscono con sostanze polari e sono
in grado di rompere i legami covalenti polare(parte positiva-parte negativa)
IONI IDRATI O SOLVATATI
cioè circondati da molecole d’acqua
SOLUZIONI ELETTROLITICHE
soluzioni con ioni che conducono corrente elettrica
PH=7 NEUTRA
PH<7 ACIDA
PH>7 BASICA
NUMERO ATOMICO(Z)
numero di protoni nel nucleo
(atomo neutro, questo numero uguale a quello degli elettroni)
NUMERO DI MASSA(A)
somma numero di protoni Z e numero neutroni n
ISOTOPI
atomi dello stesso elemento aventi le stesse proprietà chimiche ma masse
diverse, perché contengono un numero diverso di neutroni
Potrebbero piacerti anche
- Accumulatori per impianti ad energia rinnovabileDa EverandAccumulatori per impianti ad energia rinnovabileValutazione: 2 su 5 stelle2/5 (1)
- Lezione 10 Chimica - YMP1 - Classe 1 - Allegato - 2Documento16 pagineLezione 10 Chimica - YMP1 - Classe 1 - Allegato - 2Francesco CarrozzoNessuna valutazione finora
- Legami ChimiciDocumento5 pagineLegami ChimiciadamNessuna valutazione finora
- Schemi BiochimicaDocumento52 pagineSchemi BiochimicachefeelingbroNessuna valutazione finora
- Legami ChimiciDocumento28 pagineLegami ChimiciasdfNessuna valutazione finora
- 1 La Chimica Della VitaDocumento12 pagine1 La Chimica Della Vita7h5sd2gqxpNessuna valutazione finora
- Biologia 03 - Molecole e Legami ChimiciDocumento2 pagineBiologia 03 - Molecole e Legami ChimicigigikozNessuna valutazione finora
- I Legami ChimiciDocumento7 pagineI Legami Chimicipasquale.perciavalleNessuna valutazione finora
- I Legami ChimicaDocumento4 pagineI Legami ChimicaMaddalena LavinoNessuna valutazione finora
- La Varietà Dei LegamiDocumento5 pagineLa Varietà Dei Legamiclasse 1 ANessuna valutazione finora
- I Legami Chimici: Capitolo 10Documento67 pagineI Legami Chimici: Capitolo 10sphereneroNessuna valutazione finora
- LEZIONE 6. I Legami Chimici e L'acqua (DEFINITIVA)Documento29 pagineLEZIONE 6. I Legami Chimici e L'acqua (DEFINITIVA)Ruben CantasanoNessuna valutazione finora
- I LEGAMI-CHIMICI (Chimica)Documento6 pagineI LEGAMI-CHIMICI (Chimica)Maria SperanzaNessuna valutazione finora
- Biologia ApplicataDocumento204 pagineBiologia ApplicataGiulia SantarelliNessuna valutazione finora
- Valitutti Concettiblu Acqua Cap8Documento21 pagineValitutti Concettiblu Acqua Cap8Valeria Amato100% (1)
- UD5 Legami ChimiciDocumento27 pagineUD5 Legami ChimiciLucy FilettiNessuna valutazione finora
- I Legami ChimiciDocumento13 pagineI Legami ChimiciFrancesco MunafóNessuna valutazione finora
- Legame ChimicoDocumento4 pagineLegame ChimicoStefanoManzoniNessuna valutazione finora
- LEGATURA CHIMICA - LEGATURI INTRAMOLECULARE Si INTERMOLECULAREDocumento54 pagineLEGATURA CHIMICA - LEGATURI INTRAMOLECULARE Si INTERMOLECULAREcondecuse100% (4)
- RIASSUNTI CHIMICA - Spettri A Righe, Legami Chimici, Regola Dell'Ottetto, Legame Ionico, Legame Covalente, Polarità Di Legame, Carica Formale, Carica ParzialeDocumento5 pagineRIASSUNTI CHIMICA - Spettri A Righe, Legami Chimici, Regola Dell'Ottetto, Legame Ionico, Legame Covalente, Polarità Di Legame, Carica Formale, Carica ParzialeSebastianHollandLusentiNessuna valutazione finora
- Riassunto Slide Esame Biologia Università Di TorinoDocumento24 pagineRiassunto Slide Esame Biologia Università Di TorinoAmesNessuna valutazione finora
- Legami ChimiciDocumento9 pagineLegami ChimiciAurora EpifanìNessuna valutazione finora
- Tecnologie Dei MaterialiDocumento5 pagineTecnologie Dei MaterialiMarco IzzoNessuna valutazione finora
- CHIMICADocumento13 pagineCHIMICAAnna Chiara CavedonNessuna valutazione finora
- Chimica Della CellulaDocumento31 pagineChimica Della CellulaSaraNessuna valutazione finora
- L'acqua in ChimicaDocumento2 pagineL'acqua in ChimicaLucrezia MazzieroNessuna valutazione finora
- Chimica Riassunti CapitoliDocumento7 pagineChimica Riassunti CapitoliEdoardo ColucciNessuna valutazione finora
- I Legami ChimiciDocumento2 pagineI Legami ChimiciRoberto SavocaNessuna valutazione finora
- Legame ChimicoDocumento2 pagineLegame ChimicoAlexia SchirripaNessuna valutazione finora
- Dispensa Di Scienze Dei Materiali 1 ParteDocumento53 pagineDispensa Di Scienze Dei Materiali 1 ParteAntonio ScaranoNessuna valutazione finora
- I LegamiDocumento2 pagineI LegamiMariella SiervoNessuna valutazione finora
- Legami ChimiciDocumento52 pagineLegami ChimiciMarica ChiarielloNessuna valutazione finora
- ChimicaDocumento9 pagineChimicaEnrico AurelioNessuna valutazione finora
- Biologia ApplicataDocumento51 pagineBiologia Applicatasimone cirilloNessuna valutazione finora
- PW 6Documento3 paginePW 6GiorgioNessuna valutazione finora
- Chi MicaDocumento2 pagineChi MicabenedettaNessuna valutazione finora
- I Legami ChimiciDocumento37 pagineI Legami ChimiciALICE USAINessuna valutazione finora
- Il Legame ChimicoDocumento40 pagineIl Legame Chimicomyr2x52qcxNessuna valutazione finora
- 06 - Il Legame Chimico PDFDocumento101 pagine06 - Il Legame Chimico PDFluca benvenutoNessuna valutazione finora
- I Legami ChimiciDocumento5 pagineI Legami ChimiciAlessioContuNessuna valutazione finora
- Il Legame Chimico - Capitolo 9Documento4 pagineIl Legame Chimico - Capitolo 9Miryea CasertaNessuna valutazione finora
- Elettronica DigitaleDocumento416 pagineElettronica DigitaleFranco Terranova100% (1)
- Strutture Di LewisDocumento2 pagineStrutture Di Lewiseleonora pratiNessuna valutazione finora
- Biochimica e ChimicaDocumento15 pagineBiochimica e ChimicaAnissa BertacchiniNessuna valutazione finora
- Il Legami ChimiciDocumento3 pagineIl Legami Chimiciaffaoui salwaNessuna valutazione finora
- Appunti Universitari Online - ChimicaDocumento46 pagineAppunti Universitari Online - Chimicacicciobellos100% (1)
- Le Forze IntermolecolariDocumento17 pagineLe Forze IntermolecolariMOHAMED ELARAISHINessuna valutazione finora
- Legame ChimicoDocumento1 paginaLegame Chimicogasperoni.1990498Nessuna valutazione finora
- Biologia Appunti+libroDocumento36 pagineBiologia Appunti+libroboh2345Nessuna valutazione finora
- Fondamenti Di Chimica Della VitaDocumento3 pagineFondamenti Di Chimica Della VitaDeborah CeolottoNessuna valutazione finora
- Scienze ProgrammaDocumento15 pagineScienze Programmaelena tinelliNessuna valutazione finora
- Riassunto Chimica InorganicaDocumento4 pagineRiassunto Chimica InorganicaMarco MontresorNessuna valutazione finora
- Com'è Fatta La Materia: Atomi e MolecoleDocumento7 pagineCom'è Fatta La Materia: Atomi e Molecolekaesar68Nessuna valutazione finora
- La Corrente Nei Liquidi e Nei GasDocumento4 pagineLa Corrente Nei Liquidi e Nei GasPietro Di MariaNessuna valutazione finora
- 1 AcquaDocumento6 pagine1 AcquaLuana LeonardiNessuna valutazione finora
- CITOLOGIADocumento25 pagineCITOLOGIANicole MiranteNessuna valutazione finora
- Biochimica DispenseDocumento55 pagineBiochimica DispenseSofia Rivera GalaNessuna valutazione finora
- Forze Intermolecolari 2Documento5 pagineForze Intermolecolari 2annaNessuna valutazione finora
- Il Legame ChimicoDocumento7 pagineIl Legame ChimicoIkram LazarNessuna valutazione finora
- FisicaDocumento1 paginaFisicaciao ciaoneNessuna valutazione finora
- I Promessi SposiDocumento7 pagineI Promessi Sposiciao ciaoneNessuna valutazione finora
- Edipo ReDocumento4 pagineEdipo Reciao ciaoneNessuna valutazione finora
- ArteeDocumento5 pagineArteeciao ciaoneNessuna valutazione finora
- Letteratura Settecento e Ottocento ProtagonistiDocumento10 pagineLetteratura Settecento e Ottocento Protagonisticiao ciaoneNessuna valutazione finora
- LIBIA Power Point Con ImmaginiDocumento19 pagineLIBIA Power Point Con Immaginiciao ciaoneNessuna valutazione finora