Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Riassunto Neuroscienze Esplorando Il Cervello Bear Connor
Caricato da
gigioTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Riassunto Neuroscienze Esplorando Il Cervello Bear Connor
Caricato da
gigioCopyright:
Formati disponibili
lOMoARcPSD|6322212
Riassunto-neuroscienze-esplorando-il-cervello-bear-connor
Psicobiologia (Università degli Studi di Padova)
StuDocu non è sponsorizzato o supportato da nessuna università o ateneo.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
2. I NEURONI E LE CELLULE GLIALI.
INTRODUZIONE.
Tutti i tessuti e gli organi del corpo umano sono costituiti da cellule. Le funzioni delle cellule e il
loro modo di interagire specificano la funzione dei vari organi. Il cervello è l’organo più
complesso, costituito da due tipi di cellule: i neuroni e la glia che a loro volta si differenziano
per struttura, chimica e tipo di funzioni svolte. I neuroni sono le cellule più importanti: rilevano
i cambiamenti nell’ambiente, comandano le risposte del corpo alle sensazioni. La glia, o cellule
gliali, contribuiscono isolando, sostenedo e nutrendo i neuroni vicini.
LA TEORIA DEL NEURONE.
Il progresso delle neuroscienze è stato possibile grazie ad una serie di scoperte scientifiche:
- La scoperta del microscopio composto (fine 1600);
- L’utilizzo della formaldeide per “fissare” i tessuti cerebrali gelatinosi (inizio 1800);
- L’utilizzo del microtomo per il taglio dei tessuti.
L’introduzione di questi strumenti produsse un nuovo campo di ricerche chiamato Istologia,
ovvero, lo studio tramite microscopia della struttura dei tessuti.
Successivamente, l’uso di coloranti consentì di evidenziare parti differenti delle cellule nervose:
- colorante di Nissl (violetto Cresyl) evidenzia il nucleo e gruppi di materiale circostante
(fine 1800);
- colorante di Golgi (cromato d’argento) evidenzia oltre al corpo cellulare i neuriti divisi
in due categorie: assoni e dentriti (1873).
Cajal sviluppò la tecnica introdotta da Golgi sostenendo, a differenza di questi, che la teoria
cellulare, secondo la quale le cellule non sono connesse per continuità ma per contatto,
valesse anche per i neuroni (Teoria del neurone).
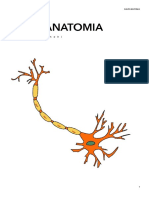
IL NEURONE PROTOTIPICO.
Il Soma: la parte centrale del neurone composta da citosol ed organuli.
- Citosol: soluzione salina, ricca di potassio, interna alla cellula e separata dall’esterno
dalla membrana neuronale;
- Citoplasma: tutto quanto si trova all’interno della cellula ad esclusione del nucleo;
- Nucleo: contenuto all’interno di un doppio involucro chiamato membrana nucleare.
Nel nucleo ci sono i cromosomi che contengono il materiale genetico, il DNA (acido
desossiribonucleico). Il DNA presente nei neuroni è lo stesso di ogni altra cellula, ciò
che lo distingue sono le specifiche porzioni di DNA che vengono utilizzate per
assemblare le cellule. Questi segmenti sono chiamati geni. La “lettura” del DNA viene
chiamata espressione genetica e il prodotto finale è la sintesi di particolari molecole, le
proteine, che avviene nel citoplasma. Poichè il DNA non lascia mai il nucleo, il
trasporto avviene attraverso una molecola chiamata mRNA (acido ribonucleico
messaggero). Le molecole di RNA sono sintetizzate dall’RNA polimerasi. Il processo di
trascrizione inizia nella regione promotrice del gene e finisce nella sequenza di
terminazione. L’iniziale RNA deve essere tagliato e ricucito (splicing) per mantenere gli
esoni ed eliminare gli introni (frammenti di DNA che non codificano per le proteine).
Successivamente l’mRNA passa dal nucleo al citoplasma dove viene usato per la sintesi
proteica, verrà cioè tradotto dai ribosomi del RE rugoso o dai ribosomi liberi, in
proteine.
La Biologia molecolare studia questo processo, così riassunto:
DNA trascrizione mRNA traduzione Proteina.
- Reticolo endoplasmatico rugoso (RE rugoso): gruppi di membrane cosparse di
strutture globulari chiamate ribosomi. La presenza di RE rugosi nei neuroni è molto
alta rispetto la glia o le altre cellule non neuronali. Il RE rugoso è il sito dove avviene la
gran parte della sintesi proteica dei neuroni. Gli RNA trascritti si legano ai ribosomi e
questi traducono le istruzioni contenute nell’mRNA per assemblare una molecola
proteica.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Le proteine sintetizzate su un RE rugoso sono destinate a essere inglobate (in un
organulo) o inserite nella membrana, quelle sintetizzate nei ribosomi liberi sono
destinate a rimanere all’interno del citosol.
- Reticolo endoplasmatico liscio (RE liscio): compie diverse funzioni in diversi siti. Alcuni
si legano al RE rugoso, altri regolano la concentrazione interna di sostanze come il
calcio (es. cellule del muscolo, RE sarcoplasmatici).
- Apparato del Golgi: una funzione importante sembra sia quella di selezionare alcune
proteine destinate a dentriti ed assone (granuli secretori).
- Mitocondrio: è la sede della respirazione cellulare. Quando inspira, introduce acido
piruvico (derivato da grasso, zucchero e proteine) e ossigeno presenti nel citosol.
Attraverso una serie di reazioni (ciclo di Krebs), l’acido piruvico viene trasformato in
adenosinfosfato (ATP). Quando espira, vengono rilasciate 17 molecole di ATP per
ognuna di acido piruvico. L’energia chimica immagazzinata tramite l’ATP viene usata
come carburante per gran parte delle reazioni biochimiche neuronali.
Acido Piruvico + O2 ATP + CO2
La Membrana neuronale: serve come barriera per contenere il citoplasma all’interno del
neurone e per escludere alcune sostanze presenti nel fluido extracellulare. La sua
composizione proteica è diversa tra soma, dentriti ed assone.
Il Citoscheletro: struttura che sostiene la cellula e composta da:
- Microtubuli (20nm): disposti longitudinalmente in direzione dei neuriti, sono composti
da più cavi intrecciati come una corda attorno alla cavità centrale. Ciascuno dei cavi è
formato da molecole di tubulina unite come una collana di perle. Il processo di unione
di piccole proteine per formare un lungo cavo è detto polimerizzazione e il cavo
risultante è chiamato polimero. Una classe di proteine che partecipa all’assemblaggio
ed al funzionamento dei microtubuli sono le MAP, (proteine associate ai microtubuli)
che ancorano i microtubuli uno all’altro e ad altre parti del neurone. Modificazioni
patologiche di una MAP assonale, dette tau, sono implicate nella demenza che
accompagna la malattia di Alzheimer.
- Microfilamenti (5nm): si possono trovare in molte parti del neurone, disposti
longitudinalmente verso il centro dei neuriti e, strettamente associati alla membrana,
alla quale sono ancorati come una tela di un ragno. Sono composti da sottili cavi,
polimeri della proteina actina.
- Neurofilamenti (10nm): presenti in tutte le cellule con il nome di filamenti intermedi,
hanno lievi differenze strutturali da un tessuto all’altro (es. cheratina/capelli). Sono
molto solidi dal punto di vista meccanico essendo composti, a differenza dei
precedenti, da lunghe molecole attorcigliate.
INSERTO: La malattia di Alzheimer e il citoscheletro neuronale.
Caratterizzata dalla distruzione del citoscheletro dei neuroni della corteccia cerebrale. La
gravità della demenza è strettamente correlata con il numero e la distribuzione di grovigli
neurofibrillari composti principalmente dalla proteina tau associata ai microtubuli. Questa
normalmente funziona come un ponte tra i microtubuli nell’assone, assicurando il decorso
rettilineo e parallelo. Nella malattia di Alzheimer la proteina tau, in seguito a difunzioni nella
secrezione da parte del neurone della proteina amiloide, si distacca dai microtubuli e si
accumula nel soma impedendo il normale flusso di informazioni e causando l’avvizzimento
dell’assone e poi la morte del neurone.
L’Assone: struttura esclusiva dei neuroni, altamente specializzata per il trasporto
dell’informazione a distanza nel sistema nervoso. Nessun RE rugoso si estende nell’assone
quindi non vi sono ribosomi e di conseguenza, non avviene alcuna sintesi proteica; le proteine
vengono pertanto originate nel soma. La composizione della membrana assonica è diversa da
quella somatica. Le proteine della membrana fungono da filo telegrafico per spedire
informazioni a grandi distanze.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
- Cono di integrazione: segmento iniziale dell’assone.
- Terminale dell’assone: parte terminale dell’assone (bottone). Il citoplasma del
terminale si differenzia da quello dell’assone per varie ragioni:
o i microtubuli non si estendono nel terminale;
o presenza di cavità membranose dette vescicole sinaptiche (contenenti
neurotrasmettitori);
o superficie interna della membrana di fronte alla sinapsi ricca di proteine;
o alta presenza di mitocondri (alto consumo di energia).
- Sinapsi: punto di contatto. Si divide in due parti indicanti la direzione del flusso di
informazioni: la parte presinaptica (terminale assonico) e la parte postsinaptica
(dentrite, soma). Lo spazio intermedio tra le due membrane è detto spazio
intersinaptico.
Il trasferimento dell’informazione da un neurone all’altro è detto trasmissione
sinaptica. Presso la maggior parte delle sinapsi l’informazione in forma di impulsi
elettrici viene convertita in un segnale chimico (neurotrasmettitore), riconvertito poi,
nella membrana postsinaptica, in segnale elettrico. La modificazione di questo
processo è coinvolta nei processi di memoria e di apprendimento e la disfunzione della
trasmissione sinaptica è responsabile di alcuni disturbi mentali oltre che influenzata da
droghe psicoattive e gas nervino.
- Trasporto assoplasmatico: movimento di materiale dal soma verso la terminazione
dell’assone e viceversa. Se l’assone viene separato (tagliato) dal soma non sopravvive
(degenerazione walleriana). Il trasporto può essere lento, ovvero attraverso il
citoplasma dell’assone o veloce grazie all’incapsulamento del materiale che viaggia
lungo i microtubuli per mezzo di una proteina alimentata dall’ ATP. Nel trasporto
anterogrado (dal soma al terminale), interviene la proteina chinesina mentre nel
trasporto retrogrado (dal terminale al soma), interviene la proteina dineina.
I Dendriti: ramificazioni che partono dal soma di un neurone, chiamati collettivamente albero
dendritico. Funzionano come le antenne del neurone e sono coperti da migliaia di sinapsi. La
parte della membrana interna al dendrite (postsinaptica) possiede molte molecole di proteine
specializzate chiamate recettori che percepiscono il neurotrasmettitore nello spazio
intersinaptico. I dentriti di alcuni neuroni sono ricoperti da strutture chiamate spine dentritiche
(protuberanze elastiche). La struttura delle spine è sensibile al tipo e alla quantità si attività
sinaptica. Insolite modificazioni alle spine sono state riscontrate in individui con danni cognitivi
o ritardo mentale.
INSERTO: Ritardo mentale e spine dentritiche.
Il ritardo mentale ha molte cause, le più gravi sono associate a malattie genetiche: nella
fenilchetonuria (PKU), i bambini presentano un livello abnorme di fenilalanina nel sangue e nel
cervello in seguito ad un deficit dell’enzima che dovrebbe metabolizzarlo. Se non curata, la
crescita cerebrale si arresta. Nella sindrome di Down, la normale espressione genetica è
compromessa dalla copia extranumeraria del cromosoma 21. Una seconda causa riguarda gli
incidenti durante la gravidanza e l’infanzia: infezione materna da rosolia o asfissia durante il
parto. Una terza causa è l’alimentazione insufficienbte durante la gravidanza: sindrome
fetoalcolica in figli di donne alcoliste. Una quarta causa è l’impoverimento ambientale:
mancanza di buona alimentazione, socializzazione e stimolazione sensoriale durante l’infanzia.
Un ulteriore causa dipende dallo sviluppo delle spine dendritiche. Nei bambini con ritardo
mentale, i dentriti presentano un numero inferiore di spine dendritiche, insolitamente lunghe e
sottili. Queste somigliano a quelle del feto normale lasciando supporre che il loro sviluppo
dipenda strettamente dall’ambiente durante il periodo neonatale e la prima infanzia. Molti
cambiamenti indotti nel cervello dalla deprivazione possono essere invertiti, intervenendo
precocemente.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
TIPI DI NEURONI.
Il tentativo di comprendere il contributo di una categoria di cellule rispetto la singola cellula, ha
prodotto svariate classificazioni:
- Classificazione sul numero di neuriti;
- Classificazione sui dentriti: cellule piramidali, cellule stellate. Neuroni con dendriti che
presentano o meno spine (spinosi e non spinosi);
- Classificazione sulle connessione;
- Classificazione sulla lunghezza dell’assone;
- Classificazione sul neurotrasmettitore.
La Glia:
- Astrociti: cellule di riempimento dello spazio tra i neuroni. Il loro ruolo principale è
quello di regolare il contenuto chimico di tale spazio cellulare. Limitano la diffusione di
molecole di neurotrasmettitore rilasciate avvolgendo le giunzioni sinaptiche,
attraverso speciali proteine rimuovono molti neurotrasmettitori dallo spazio
intersinaptico, controllano la concentrazione extracellulare da sostanze ostacolo alla
funzione neuronale, in particolare degli ioni potassio.
- Oligodendroglia (SN centrale, mielinizza più assoni) e cellule di Schwann (SN
periferico, mielinizza un solo assone): forniscono strati si membrana che isolano gli
assoni avvolgendoli a spirale. Tale guaina chiamata mielina, serve a rendere più veloce
la propagazione degli impulsi lungo l’assone e si interrompe periodicamente in regioni
chiamate nodi di Ranvier.
- Cellule ependimali: forniscono il rivestimento dei ventricoli del cervello, determinano
la direzione della migrazione di cellule nella fase di sviluppo cerebrale.
- Microglia: cellule che rimuovono gli avanzi del neurone e di glia morti o in via di
degenerazione.
- Parte vascolare: arterie e capillari.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
3. LA MEMBRANA DEL NEURONE A RIPOSO.
INTRODUZIONE.
Il neurone conduce le informazioni per una certa distanza usando segnali che si muovono
rapidamente lungo l’assone. La carica elettrica è condotta nel citoplasma dell’assone da atomi
(ioni) elettricamente carichi e non da elettroni liberi (come nei fili elettrici). Il citosol è pertanto
un conduttore peggiore del filo di rame. In più, l’assone non è particolarmente isolato ed è
immerso nel fluido extracellulare salato che conduce elettricità. La membrana assonica è però
capace di condurre un particolare tipo di segnale, l’impulso nervoso o potenziale d’azione. Le
cellule capaci di generare e condurre potenziali d’azione (cellule nervose e muscolari) si dice
che possiedono una membrana eccitabile. In un neurone a riposo, la membrana eccitabile non
sta generando impulsi e il citosol adiacente alla membrana è carico negativamente rispetto
l’esterno (potenziale di membrana a riposo). Il potenziale d’azione è l’inversione di questa
condizione per un istante, sufficiente a far si che il versante interno della membrana diventi
carico positivamente rispetto l’esterno.
I COSTITUENTI CHIMICI.
I tre attori principali sono: i fluidi ricchi di sali su entrambe le facce della membrana, la
membrana stessa e le proteine che attraversano la membrana:
Il citosol e il fluido extracellulare:
- Acqua: principale costituente del fluido intracellulare ed extracellulate. La proprietà
principale della molecola d’acqua è la sua ineguale distribuzione di carica elettrica
(H2O). I due atomi di idrogeno e l’atomo di ossigeno sono tenuti insieme da un legame
polare (O carica positiva e H carica negativa) covalente (condividono gli elettroni).
Questa polarità rende l’acqua un solvente efficace verso altre molecole cariche o
polari.
- Ioni: atomi o molecole che hanno carica elettrica netta. La carica elettrica di un atomo
dipende dalla differenza tra il numero di protoni e di elettroni (differenza 1,2,... >
monovalente, bivalente,...). Gli ioni con carica positiva sono detti cationi, quelli con
carica negativa anioni. Gli ioni particolarmente importanti per la neurofisiologia
cellulare sono i cationi monovalenti Na+ (sodio) e K+ (potassio), il catione bivalente
Ca2+ (calcio) e l’anione monovalente Cl- (cloro)
La membrana fosfolipidica: le sostanze con carica elettrica diversa si dissolveranno in acqua
(idrofile), le sostanze unite da legami covalenti non polari (condividono lo stesso numero di
elettroni) saranno idrorepellenti (idrofobe). I lipidi, costituenti la membrana, sono una classe di
molecole insolubili in acqua.
- Doppio strato fosfolipidico: disposizione fissa che isola il citosol dal fluido
extracellulare composta da un doppio strato di fosfolipidi formati da una lunga catena
non polare formata da atomi di carbonio legati ad atomi di idrogeno e una testa polare
idrofila. Le catene sono rivolte una all’altra mentre le teste sono esposte verso gli
ambienti esterno ed interno della cellula.
Le proteine: tutto il mondo del neurone dipende dai diversi tipi e funzioni di proteine.
- Struttura delle proteine: sono assemblate partendo da 20 differenti aminoacidi. Ogni
aminoacido contiene un atomo centrale di carbonio (carbonio alfa), legato
covalentemente a quattro gruppi molecolari: un atomo di idrogeno, un gruppo
aminoacidico (NH3+), un gruppo carbossilico (COO-) e un gruppo residuo variabile
(gruppo R). Nella sintesi delle proteine nei ribosomi, gli aminoacidi si uniscono tramite
legami peptidici (collegano il gruppo aminico di un aminoacido con il gruppo
carbossilico di un altro) in una catena denominata polipeptide. La struttura della
proteina si sviluppa su 4 livelli:
o struttura primaria: sequenza di aminoacidi del polipeptide;
o struttura secondaria: il polipeptide si avvolge a formare un’alfa elica;
o struttura terziaria: ripiegamento tridimensionale del polipeptide;
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
o struttura quaternaria: legame tra differenti peptidi a formare una proteina più
grande.
- Canali ionici: classi di proteine a forma di bastone con gruppi polari alle estremità e
gruppi idrofobici nella porzione mediana. 4/6 molecole proteiche simili assemblate a
formare un poro di diametro e gruppo R variabili in relazione alla loro selettività
ionica. Altra proprietà è la dipendenza che determina l’apertura o la chiusura in
relazione ai cambiamenti del microambiente locale della membrana.
- Pompe ioniche: gruppi di proteine che, mediante l’uso di ATP, trasportano ioni
attraverso la membrana.
IL MOVIMENTO DEGLI IONI.
I movimenti ionici attraverso i canali sono influenzati da 2 fattori:
- La diffusione: movimento di ioni, dipendente dalla temperatura, che distruibuisce in
modo uniforme gli ioni da regioni ad alta concentrazione a regioni a bassa
concentrazione. La conduzione di ioni attraverso la membrana per diffusione,
necessita di canali permeabili agli ioni e di un gradiente di concentrazione (differenza)
attraverso la membrana.
- L’elettricità: movimento di ioni attraverso l’uso di un campo elettrico. La quantità di
cariche elettriche in movimento è detta corrente elettrica (I-ampère), positiva
(dall’anodo+ > al catodo-) o negativa (dal catodo- > all’anodo+) ed è determinata dal
potenziale elettrico o voltaggio (V-volt), ovvero la differenza di carica tra anodo e
catodo e dalla conduttanza ellettrica, (g-siemens), ovvero la facilità con cui una carica
può migrare da un punto ad un altro. La resistenza elettrica (R-ohm) rappresenta la
difficoltà con cui può migrare una carica elettrica ed è l’inverso della conduttanza (R=1/
g).
La Legge di Ohm, mette in relazione quanto sopra: I = gV.
La conduzione elettrica di ioni attraverso la membrana richiede canali permeabili a
quella specie ionica e la presenza di una differenza di potenziale elettrico attraverso la
membrana.
LE BASI IONICHE DEL POTENZIALE DI MEMBRANA A RIPOSO.
Il potenziale di membrana di un neurone (Vm) è misurabile inserendo un microelettrodo nel
citoplasma ed uno esterno alla cellula. L’interno del neurone è elettricamente negativo rispetto
l’esterno. Questa differenza (potenziale di riposo) viene mantenuta quando il neurone non
genera impulsi (Vm= -65mV).
Il potenziale di equilibrio (Eion) è la differenza di potenziale elettrico che equilibra esattamente
un gradiente di concentrazione ionica.
L’equazione di Nernst, conoscendo la carica elettrica dello ione, la temperatura e la differenza
di concentrazione attraverso la membrana (interna ed esterna), calcola il valore del potenziale
di equilibrio per ogni ione.
I gradienti di concentrazione sono indotti dall’azione di pompe ioniche presenti nella
membrana neuronale, in particolare dalla:
- pompa sodio-potassio, importa 2 ioni potassio ed esporta 3 ioni sodio contro il
gradiente di concentrazione attraverso il consumo di ATP (70% della quantità totale
del cervello);
- pompa del calcio, trasporta attivamente gli ioni Ca2+ fuori dal citoplasma.
Se la membrana fosse permeabile solo al potassio, il potenziale di membrana a riposo
equivarrebbe al potenziale di equilibrio per il potassio (E K= -80mV), se fosse invece permeabile
solo al sodio equivarrebbe a quello pe ril sodio (E Na= 62mV). In realtà è permeabile ad
entrambe ma in diversa proporzione (circa 1:40). Il potenziale di membrana a riposo, Vm= -
65mV, è pertanto prossimo a quello del potassio senza però raggiungerlo a causa della perdita
di ioni Na+. L’equazione di Goldman, calcola il potenziale di membrana a riposo prendendo in
considerazione la permeabilità relativa della membrana a differenti ioni (nel nostro caso, K+ e
Na+).
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
I canali del potassio shaker della membrana neuronale del moscerino della frutta, sono
composti da 4 subunità disposte come le doghe di una botte a formare un poro. Una parte
della catena polipeptidica forma una curva a forcina che si ripiega sul poro divenendo il filtro
critico del canale. Mutazioni che coinvolgaono anche solo un aminoacido in questa regione
possono gravemente alterare la funzionalità neuronale. L’aumento della permeabilità al sodio
fa in modo che il potenziale di membrana del neurone diventi meno negativo, danneggiando
così la funzione neuronale. Molti disturbi neurologici ereditari nell’uomo, come alcune forme
di epilessia, possono essere spiegati da mutazioni in specifici canali del potassio.
La regolazione della concentrazione esterna di potassio è un altro fattore di rilievo. Un
aumento di dieci volte, innalzerebbe il potenziale di membrana portandolo da -65mv a -17mv
depolarizzando i neuroni. La sensibilità all’innalzamento dei livelli del potassio ha portato
all’evoluzione di meccanismi di regolazione:
- la barriera ematoencefalica è una specializzazione delle pareti capillari cerebrali per
limitare il movimento del potassio nel fluido extracellulare del cervello;
- il tampone spaziale del potassio, è la regolazione da parte degli astrociti, i quali
assorbono il potassio per liberarlo in altre aree.
Non tutte le cellule sono però protette da incrementi del potassio (es. cellule muscolari)
INSERTO: La morte mediante iniezione letale.
Dopo una dose di anestetico, che serve a sopprimere l’attività dei neuroni della formazione
reticolare del cervello, la morte sopravviene, per arresto cardiaco, con un’iniezione di cloruro di
potassio. Le cellule eccitabili per poter funzionare richiedono che le loro membrane vengano
mantenute al potenziale di riposo fin tanto che non stiano generando degli impulsi. L’aumento
della concentrazione di potassio extracellulare annulla il potenziale a riposo non consentendo
alle cellule muscolari cardiache di generare gli impulsi così a lungo da provocare la contrazione
del muscolo cardiaco che cessa di battere.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
4. IL POTENZIALE D’AZIONE.
INTRODUZIONE.
Il citosol del neurone a riposo risulta caricato negativamente rispetto il fluido extracellulare. Il
potenziale d’azione (o impulso nervoso) è un rapido cambiamento di questa situazione, tanto
che, per un istante l’interno della membrana si carica positivamente rispetto l’esterno. Tali
segnali, generati da una cellula, sono simili in ampiezza e durata e non si riducono mentre si
propagano lungo l’assone. La frequenza e la struttura dei potenziali d’azione, costituiscono il
codice usato dai neuroni per trasferire l’informazione da un luogo a un altro.
LE PROPRIETA’ DEL POTENZIALE D’AZIONE.
Durante il potenziale d’azione la parte interna della cellula si carica positivamente per un
brevissimo istante (1msec). Il grafico visualizzato su di un oscilloscopio evidenzia una fase
crescente (rapida depolarizzazione della membrana), il potenziale a punta (interno caricato
positivamente rispetto l’esterno), una fase decrescente (ripolarizzazione della membrana) la
cui ultima parte è detta iperpolarizzazione.
Il livello critico di depolarizzazione che deve essere ottenuto per causare un potenziale
d’azione è chiamato livello di soglia (tutto o niente).
La frequenza di scarica del potenziale d’azione dipende dall’intensità della corrente continua
depolarizzante. Al livello di soglia è di circa 1impulso/sec, se invece aumentiamo di poco la
corrente otteniamo 50impulsi/sec e così via sino ad un massimo di 1000impulsi/sec. Perciò la
frequenza di scarica dipende dall’intensità della corrente depolarizzante. Questo è il modo in
cui l’intensità di stimolazione viene codificata nel SN.
Una volta cominciato il potenziale d’azione, è impossibile iniziarne un altro per almeno 1/msec
(periodo refrattario assoluto) e difficile cominciarne un altro dopo il periodo refrattario
assoluto (periodo refrattario relativo) in quanto la quantità di corrente richiesta per la
depolarizzazione si eleva rispetto la soglia normale.
IL POTENZIALE D’AZIONE NELLA TEORIA.
La depolarizzazione della cellula durante il potenziale d’azione è dovuta all’entrata di ioni
sodio, mentre la ripolarizzazione è dovuta all’uscita di ioni potassio.
Ipotizzando un neurone ideale con membrana permeabile solo agli ioni K+ e quindi con Vm=E k,
se i canali per il sodio si aprono in modo tale che g Na>gK, vi sarà una notevole forza sugli ioni
sodio che li spingerà verso l’interno della cellula portando Vm verso E Na. Chiudendo i canali per
il sodio ed aprendo quelli per il potassio, in modo che g K>gNa, ci sarà una forza significativa che
spingerà gli ioni potassio ad uscire dalla cellula, essendo questa, caricata positivamente. Il
deflusso di ioni potassio, riporterà allo stato di riposo: Vm=E K.
IL POTENZIALE D’AZIONE NELLA REALTA’.
Per spiegare i cambiamenti transitori di gNa venne proposta l’esistenza di “cancelli” del sodio
nella membrana assonica. Questi vengono attivati (aperti) dalla depolarizzazione, oltre il livello
di soglia, e inattivati (chiusi) quando la membrana acquista un potenziale positivo. La
disattivazione perdura sino a che il potenziale di membrana ritorna a un valore negativo.
Il canale voltaggio-dipendente selettivo per il sodio, è una proteina che forma un poro nella
membrana altamente selettivo per gli ioni Na+. È composto da quattro subunità ciascuna delle
quali formata da 6 alfa eliche, unite in modo da formare un poro. Quando la membrana si
depolarizza, la molecola si deforma (ripiegamento interno), assumendo una conformazione
che consente il passaggio di Na+ attraverso il poro. Tale filtro rende il canale 12 volte più
permeabile al Na+ che al K+. L’acqua che accompagna lo ione nel passaggio è necessaria per il
filtro di selettività (H2O+K > H2O+Na). I canali per il sodio voltaggio-dipendenti si aprono con
un piccolo ritardo, rimangono aperti per circa 1msec per poi disattivarsi sino che il potenziale
di membrana non torna al valore negativo vicino alla soglia.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Il potenziale d’azione è generato dall’apertura di migliaia canali del sodio che si attivano
quando la depolarizzazione raggiunge un livello critico (soglia). Mutazioni di un singolo
aminoacido nelle regioni extracellulari di un canale del sodio, possono causare nei bambini una
malattia ereditaria, nota come epilessia generalizzata con crisi febbrili. Le mutazioni rallentano
i meccanismi di inattivazione del canale del sodio, prolungando il potenziale d’azione. Gli
attacchi
epilettici derivano da un’esplosiva e altamente sincronizzata attività elettrica cerebrale.
La tetrodotossina (TTX) ostruisce il canale permeabile agli ioni Na+ legandosi ad un sito
esterno al canale. Blocca tutti i potenziali d’azione sodio-dipendenti e quindi risulta fatale se
ingerita.
Anche la saxitossina, contenuta nei molluschi bivalvi, i mitili e altri crostacei, agisce similmente
così come le tossine prodotte da scorpioni e anemoni di mare.
Altre tossine determinano invece l’apertura inappropriata dei canali del sodio come la
batracotossina (rana colombiana), veratridina (gigli), aconitina (ranucoli).
INSERTO: Il metodo del patch-clamp.
Permette di registrare le correnti ioniche attraverso i singoli canali. Introducendo un elettrodo
dentro la membrana di un neurone ed estraendo la parte di membrana di contatto si forma un
piccolo canale (gigaohm) tra l’elettrodo e la membrana sottostante consentendo di misurare le
correnti ioniche che lo attraversano, mentre il potenziale di membrana è mantenuto bloccato
ad un valore selezionato dall'operatore.
Per spiegare l’aumento transitorio di gK che rende più rapido il ritorno alla negatività del
potenziale di membrana, venne proposta l’esistenza di “cancelli” per il potassio che, come
quelli del sodio si aprono in risposta alla depolarizzazione della membrana. Questi cancelli
però, si aprono dopo 1msec, un ritardo che serve per rettificare il potenziale di membrana.
Il canale voltaggio-dipendente selettivo per il potassio, è una proteina simile a quella del
canale per il sodio, composta da 4 subunità che danno origine al poro. Queste proteine sono
sensibili ai cambiamenti del campo elettrico attraverso la membrana: la depolarizzazione
modifica la loro struttura e consente al potassio di attraversare il poro.
Caratteristiche del potenziale d’azione:
- soglia, il potenziale di membrana raggiunge i valori di soglia e i canali voltaggio-
dipendenti selettivi del sodio si aprono; il sodio è favorito riapetto il potassio.
- fase crescente, l’ingresso di ioni sodio attraverso i canali, causa una rapida
depolarizzazione della membrana.
- potenziale a punta, il potenziale di membrana si sposta a un valore vicino a E Na che è
superiore a 0mV.
- fase decrescente, i canali selettivi per il sodio si inattivano e si aprono i canali per il
potassio che viene spinto al di fuori riportando il potenziale di membrana a un valore
negativo.
- iperpolarizzazione, i canali voltaggio-dipendenti per il potassio si aggiungono alla
restante permeabilità al potassio della membrana, riportando il potenziale di
membrana verso EK causando una iperpolarizzazione relativa fino a che i canali per il
potassio si chiudono di nuovo.
- periodo refrattario assoluto, i canali per il sodio restano inattivi fino a che il potenziale
di membrana non diventa sufficientemente negativo da attivarli nuovamente.
- periodo refrattario relativo, il potenziale di membrana rimane iperpolarizzato fino a
che i canali per il potassio si chiudono. È pertanto necessaria una maggiore corrente
depolarizzante per portare il potenziale di membrana al livello di soglia.
INSERTO: L’anestesia locale.
Gli anestetici locali sono farmaci che bloccano temporaneamente i potenziali d’azione negli
assoni. Il primo anestetico introdotto è stata la cocaina, oggi sostituita dalla lidocaina che,
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
legandosi internamente ai canali per il sodio voltaggio-dipendenti, interferisce con il flusso di
sodio che normalmente segue la depolarizzazione del canale.
LA CONDUZIONE DEL POTENZIALE D’AZIONE.
Per trasferire l’informazione da un punto all’altro del sistema nervoso è necessario che il
potenziale d’azione, una volta generato, si propaghi lungo l’assone. Nella depolarizzazione, il
flusso di cariche positive verso l’interno, depolarizza il segmento di membrana fino a che
raggiunge la soglia creando una successione di potenziali d’azione che dirigono in un’unica
direzione grazie all’inattivazione dei canali del sodio nella fase discendente post-potenziale.
La velocità con cui si propaga il potenziale dipende da quanto lontano si propaga la
depolarizzazione lungo l’assone e, a sua volta, dalle caratteristiche fisiche dell’assone. Sono
due le strade che la carica positiva può seguire: una lungo l’interno dell’assone, l’altra
attraverso la membrana assonica. Se l’assone è stretto e vi sono molti pori aperti nella
membrana, una grande quantità di corrente fluirà attraverso la membrana; se l’assone è largo
e vi sono pochi pori aperti nella membrana, gran parte della corrente fluirà lungo l’interno
dell’assone. La velocità di conduzione del potenziale d’azione aumenterà quindi con
l’aumentare del diametro dell’assone.
Assoni grandi (calamaro) conducono velocemente i potenziali d’azione ma occupano molto
spazio. I vertebrati hanno sviluppato un meccanismo differente per velocizzare la conduzione:
l’assone è rivestito di un isolante chiamato mielina. La guaina mielinica non si estende per
continuità ma si interrompe in alcuni punti (nodi di Ranvier) dove gli ioni attraversano la
membrana per generare potenziali d’azione. Negli assoni avvolti da mielina, il potenziale
d’azione salta così, da nodo a nodo (conduzione saltatoria).
INSERTO: La demielinizzazione causa della sclerosi multipla.
I malati affetti da scelrosi multipla (SM), spesso si sentono deboli, perdono la coordinazione
motoria, presentano la visione indebolita e il linguaggio in progressivo deterioramento. È una
malattia caratterizzata da remissioni e ricadute lungo gli anni. La SM attacca le guaine di
mielina di gruppi di assoni nel cervello, nel midollo spinale e nei nervi ottici.
La sindrome di Guillain-Barrè attacca la mielina dei nervi periferici che innervano i muscoli e la
pelle, sembra essere una risposta immunologica anomala contro la mielina dello stesso
soggetto.
Entrambe sono caratterizzate da un notevole rallentamento dei tempi di risposta in quanto la
conduzione saltatoria è ostacolata.
I POTENZIALI D’AZIONE, ASSONE E DENDRITI.
In genere le membrane eccitabili, capaci di generare potenziali d’azione sodio-dipendenti, si
trovano solo negli assoni. Di conseguenza, il cono d’integrazione, dove si origina l’assone, viene
definita zona di inizio dello spike. In molti neuroni sensoriali tuttavia, la zona di origine dello
spike si trova vicino alle terminazioni del nervo sensitivo, dove la depolarizzazione causata
dalla stimolazione sensoriale porta alla generazione di potenziali d’azione che si propagano
lungo i nervi sensitivi.
INSERTO: Il comportamento eclettico dell’attività dei neuroni.
I neuroni variano in grandezza, forma, connessioni e proprietà elettriche. La corteccia cerebrale
possiede due tipi principali di neuroni, le cellule stellate senza spine che rispondono all’arrivo di
una corrente depolarizzante con una scarica di potenziali d’azione a una frequenza costante e
le cellule piramidali che invece, scaricano rapidamente all’inizio e poi rallentano anche se lo
stimolo non scema. Un altro pattern di scarica è il burst, un rapido gruppo di potenziali
d’azione seguito da una pausa
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
5. LA TRASMISSIONE SINAPTICA.
INTRODUZIONE.
Affinchè i potenziali d’azione possano, una volta propagati attraverso i canali voltaggio-
dipendenti lungo i nervi sensitivi, integrarsi con altre parti del SN, è necessario che siano
trasmessi ad altri neuroni (motoneuroni, neuroni del cervello e del midollo spinale) che
presiedono alla coordinazione delle risposte riflesse. L’informazione viene trasferita attraverso
la sinapsi e viene detta trasmissione sinaptica.
I TIPI DI SINAPSI.
Una sinapsi è una giunzione specializzata nella quale un terminale assonico prende contatto
con un altro neurone o qualche altra cellula. L’informazione tende ad essere unidirezionale.
- Le sinapsi elettriche si rinvengono in siti chiamati giunzioni comunicanti (3,5nm), dove
le membrane delle due cellule sono separate da un sottile spazio attraversato da
speciali proteine (connessine). Sei connessine formano un connessone che, unito a
quello dell’altra cellula, forma il canale della giunzione comunicante il quale, consente
agli ioni di passare direttamente dal proprio citoplasma a quello dell’altra cellula. Gran
parte delle giunzioni comunicanti consente alla corrente di viaggiare in entrambe le
direzioni, pertanto a differenza delle sinapsi chimiche, quelle elettriche sono
bidirezionali.
Quando due neuroni sono connessi elettricamente, un potenziale d’azione nel
neurone presinaptico provoca una piccola quantità di corrente ionica (1mv) che fluisce
sul neurone postsinaptico causando un potenziale d’azione postsinaptico.
Generalmente le sinapsi elettriche sono presenti dove la funzione normale richiede
che l’azione dei neuroni vicini sia altamente sincronizzata, veloce e sicura.
- Le sinapsi chimiche rappresentano la maggior parte della trasmissione del SN. Le
membrane presinaptiche e postsinaptiche sono separate da uno spazio detto fessura
sinaptica. La terminazione presenta delle vescicole sinaptiche (50nm) contenenti il
neurotrasmettitore e, a volte, dei granuli secretori (100nm) contenenti proteine
solubili. Entrambe i versanti della fessura sinaptica presentano densi accumuli di
proteine chiamate specializzazioni di membrana (I TIPO DI GRAY, specializzazioni di
membrana più dense sul lato postsinaptico (eccitatorie) - II TIPO DI GRAY,
specializzazioni di membrana simmetriche (inibitorie)).
Le proteine associate alle membrana presinaptica si presentano a forma di piramide e
si configurano come la zona attiva dove avviene il rilascio del neurotrasmettitore. La
proteina che attraversa la membrana postsinaptica (densità postsinaptica), contiene i
recettori per il neurotrasmettitore, i quali convertono il segnale chimico intercellulare
in segnale intracellulare (chimico o elettrico).
Nel SNC possono essere distinti differenti tipi di sinapsi a seconda di quale parte del
neurone vada a costituire l’elemento postsinaptico rispetto il terminale assonico:
assodendritica (dendriti), assosomatica (soma), assoassonica (assone). In alcuni casi i
dendriti formano invece sinapsi tra di loro (dendrodendritica).
Sinapsi chimiche si ritrovano anche tra assoni dei motoneuroni del midollo spinale e
dei muscoli scheletrici o nel SNA dove innervano ghiandole, muscoli lisci e cuore
(giunzione neuromuscolare). Si tratta di una delle sinapsi più grandi del corpo. La
membrana postsinaptica (placca motrice) contiene una serie di pieghe nelle quali sono
allineate le zone attive ed i recettori, garantendo un alto rapporto tra rilascio di
neurotrasmettitore e chemiocettori associati.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Malattie, farmaci o veleni che interferiscono con queste sinapsi hanno effetti diretti
sulle funzioni vitali dell’organismo.
I PRINCIPI DELLA TRASMISSIONE SINAPTICA CHIMICA.
Perchè avvenga una trasmissione sinaptica chimica deve esistere un meccanismo per la sintesi
e il rifornimento di neurotrasmettitore nelle vescicole sinaptiche, un meccanismo che induca le
vescicole a riversare il loro contenuto nella fessura sinaptica in risposta ad un potenziale
d’azione presinaptico, un meccanismo per produrre una risposta al neurotrasmettitore e un
meccanismo per rimuovere il neurotrasmettitore dalla fessura sinaptica.
I neurotrasmettitori sono raggruppati in tre principali categorie:
- aminoacidi (glutammato, glicina, GABA);
- amine (acetilcolina, noradrenalina, dopamina, adrenalina, istamina, serotonina);
- peptidi (Sostanza P, dinorfina, encefaline, olecistochinina, etc).
Aminoacidi e amine sono piccole molecole incorporate e poi rilasciate dalle vescicole
sinaptiche mentre i neurotrasmettitori peptidici sono grandi molecole incorporate e
rilasciate dai granuli secretori in particolari condizioni di stimolazione.
Neuroni differenti rilasciano neurotrasmettitori differenti. La trasmissione sinaptica veloce
del SNC, è mediata dal glutammato, dal GABA e dalla glicina. La trasmissione sinaptica
veloce nelle giunzioni neuromuscolari è mediata dall’acetilcolina. Forme più lente di
trasmissione sinaptica nel SNC e in periferia sono mediate da trasmettitori di altre classi.
Differenti neurotrasmettitori vengono sintetizzati in modi differenti. Glutammato e glicina ad
esempio, appartengono ai 20 aminoacidi implicati nella costruzione delle proteine perciò li
troviamo in ogni cellula. Il GABA e le amine sono prodotti esclusivamente nei neuroni che li
rilasciano. In ogni modo:
- neurotrasmettitori aminoacidi e aminici vengono sintettizzati nel citosol del terminale
assonico e qui incorporati attraverso particolari proteine di membrana (trasportatori)
nelle vescicole sinaptiche;
- neurotrasmettitori peptidici la sintesi avviene nel RE rugoso, quindi un lungo peptide
viene scisso nell’apparato del Golgi dove i granuli secretori, che contengono la parte
attiva, gemmano; infine vengono condotti al terminale (trasporto assoplasmatico).
Il rilascio del neurotrasmettitore è attivato dall’arrivo di un potenziale d’azione nel
terminale assonico. La depolarizzazione della membrana induce l’apertura dei canali calcio
voltaggio-dipenedenti nelle zone attive. Gli ioni calcio entrano nella cellula e
l’innalzamento di questo livello è il segnale che causa il rilascio del neurotrasmettitore da
parte delle vescicole. Queste liberano i loro contenuti mediante esocitosi, ovvero la
fusione della membrana della vescicola con la membrana presinaptica nella zona attiva
favorisce il rilascio del contenuto nello spazio sinaptico. La membrana della vescicola viene
quindi recuperata per endocitosi per essere riciclata e riempita nuovamente con il
neurotrasmettitore.
Benchè esistano molti recettori ed effettori, possiamo classificarli in 2 categorie:
- Canali ionici trasmettitori-dipendenti: sono delle proteine transmembrana composte
da subunità che si uniscono a formare un poro (chiuso in assenza di
neurotrasmettitore). Quando il neurotrasmettitore si lega a specifici siti sulla regione
extracellulare del canale, la proteina modifica la sua conformazione ed il poro si apre.
Le conseguenze dipendono da quali ioni possono attraversare il poro. Questi canali
sono comunque meno selettivi rispetto i canali voltaggio-dipendenti.
Una depolarizzazione della membrana postsinaptica determinata dal rilascio
presinaptico di neurotrasmettitore viene detta potenziale postsinaptico eccitatorio
(PPSE), ad esempio i canali Ach-dipendenti e Glu-dipendenti. Una iperpolarizzazione
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
della membrana postsinaptica causata dal rilascio di neurotrasmettitore viene detta
potenziale postsinaptico inibitorio (PPSI), ad esempio i canali Gly-GABA-dipendenti.
- Recettori accoppiati alla proteina G. Gli stessi neurotrasmettitori possono avere azioni
postsinaptiche più lente, durature e diversificate sviluppate in 3 fasi:
o il neurotrasmettitore si lega alle proteine recettrici incastonate nella
membrana postsinaptica;
o le proteine recettrici attivano piccole proteine chiamate proteine G libere di
muoversi sulla regione intracellulare della membrana postsinaptica;
o le proteine G, attivano delle proteine effettori.
Le proteine effettori possono essere canali ionici proteina G-dipendenti presenti nella
membrana oppure enzimi che sintetizzano molecole chiamate secondi messaggeri che
si diffondono lontano nel citosol. I secondi messaggeri possono a loro volta attivare
enzimi in grado di regolare la funzione dei canali ionici e alterare il metabolismo
cellulare. Proprio perchè i recettori accoppiati alla proteina G possono innescare un
gran numero di processi metabolici sono detti recettori metabotropici.
Lo stesso neurotrasmettitore può avere differenti effetti postsinaptici a seconda del
recettore a cui viene legato (l’Ach rallenta le contrazioni ritmiche del cuore provocando
una lenta iperpolarizzazione delle cellule del muscolo cardiaco; nel muscolo scheletrico
invece induce la contrazione tramite una rapida depolarizzazione delle fibre
muscolari).
- Autorecettori: sono recettori presinaptici sensibili al neurotrasmettitore rilasciato dalla
terminazione sinaptica. Sembrano funzionare come una valvola di sicurezza per ridurre
la liberazione di neurotrasmettitore quando la sua concentrazione raggiunge livelli
troppo elevati nella fessura sinaptica.
Una volta liberato e interagito con i recettori, il neurotrasmettitore deve essere eliminato dalla
fessura sinaptica in vari modi:
- diffusione;
- riassorbimento del neurotrasmettitore nel terminale e poi distrutto per via enzimatica
o riassorbito nelle vescicole sinaptiche;
- distruzione enzimatica nella fessura sinaptica.
L’importanza della rimozione del neurotrasmettitore non deve essere sottovalutata. Nella
giunzione muscolare ad esempio, un’esposizione ininterrotta ad alte concentrazioni di Ach
porta ad un effetto di desensibilizzazione che chiude i canali trasmettitore-dipendenti
nonostante la presenza del neurotrasmettitore. Se l’AchE viene inibita (gas nervino) la
trasmissione muscolare non potrà aver luogo. Gli inibitori dei recettori per il
neurotrasmettitore (recettori-antagonisti) si legano al recettore e bloccano l’azione del
trasmettitore (curaro). Altri (recettori-agonisti) si legano ai recettori simulando l’azione dei
neurotrasmettitori normalmente presenti (nicotina).
INSERTO: Come intrappolare una vescicola e far rilasciare il neurotrasmettitore.
La funzione sinaptica rapida è dovuta al fatto che le vescicole si trovino nel posto giusto della
membrana e che si possano fondere con questa quando un potenziale d’azione genera un
rapido aumento della concentrazione di calcio nel citoplasma. Questo processo di esocitosi si è
evoluto grazie ad un meccanismo molecolare dipendente dalle proteine SNARE (v-SNARE nelle
vescicole e t-SNARE nelle membrane esterne), che permettono ad una membrana di
intrappolarne un’altra, grazie a terminali in grado di agganciarsi tra loro in specifici siti.
INSERTO: I potenziali inversi.
Il valore critico del potenziale di membrana, a cui la direzione del flusso di corrente si inverte è
detto potenziale inverso. Un neurotrasmettitore sarà eccitatorio (canali permeabili al sodio) se,
cambiando la permeabilità relativa della membrana, induce Vm ad avvicinarsi al valore di
soglia per il potenziale d’azione; sarà inibitorio (canali permeabili al cloro e potassio) se, porta
Vm ad avvicinarsi ad un valore più negativo rispetto la soglia per il potenziale d’azione.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
INSERTO: I batteri, i serpenti, i ragni e l’uomo.
Batteri, serpenti, ragni e l’uomo producono tossine che attaccano la trasmissione sinaptica
nelle giunzioni muscolari. Le tossine botuliniche sono enzimi straordinariamente specifici che
distruggono alcune delle proteine SNARE nei terminali presinaptici, critiche nel rilascio del
neurotrasmettitore. Il veleno della vedova nera, si lega sul versante esterno della membrana
presinaptica, creando un poro che depolarizza il terminale e consente al Ca+ di entrare e
attivare la deplezione rapida del trasmettitore. Incrementa, e poi sopprime il rilascio di Ach
nella giunzione provocando l’ingrossamneto di terminali sinaptici e la distruzione delle
vescicole. Il morso del cobra, contiene una molecola che si lega ai recettori nicotinici
postsinaptici dell’Ach, prevenendone l’attivazione da parte del trasmettitore e paralizzando i
muscoli respiratori. Gli organofosfati, sono sono composti chimici che inibiscono
irreversibilmente l’azione dell’AchE.
I PRINCIPI DELL’INTEGRAZIONE SINAPTICA.
L’integrazione sinaptica è il processo attraverso cui potenziali sinaptici multipli si integrano nel
neurone postsinaptico. La membrana postsinaptica può contenere da poche decine a molte
migliaia di canali trasmettitore-dipendenti; il numero di questi che vengono attivati durante la
trasmissione sinaptica dipende dalla quantità di neurotrasmettitore che viene liberato.
L’unità elementare del neurotrasmettitore equivale al contenuto di una vescicola sinaptica
(quanto), la quantità totale di neurotrasmettitore liberato sarà quindi un suo multiplo. L’analisi
quantica viene utilizzata per determinare quante vescicole rilascino neurotrasmettitore
durante la normale trasmissione sinaptica.
La sommazione di PPSE è la forma più semplice di integrazione sinaptica nel SNC:
- la sommazione spaziale si ha quando vengono sommati simultaneamente PPSE
generati da diverse sinapsi su uno stesso dendrite;
- la sommazione temporale si ha quando vengono sommati più PPSE generati in rapida
successione dalla stessa sinapsi.
La corrente sinaptica può prendere due strade: la prima all’interno del dendrite, la seconda
attraverso la membrana. In ogni modo, a una certa distanza dal sito di ingresso, l’ampiezza del
PPSE si riduce a zero a causa della dissipazione della corrente attraverso la membrana. La
distanza a cui la depolarizzazione diviene il 37% di quella originaria, prende il nome di costante
di spazio dendritica, un indice di quanto lontano la depolarizzazione possa diffondersi lungo un
dendrite o un assone.
L’azione di alcune sinapsi allontana il potenziale di membrana dal valore di soglia del
potenziale d’azione, queste sono chiamate sinapsi inibitorie. I canali trasmettitore-dipendendi
di molte sinapsi inibitorie sono permeabili solo ad uno ione naturale, il cloro. L’apertura dei
canali del cloro permette agli ioni Cl+ di entrare portando il potenziale di membrana vicino al
potenziale di equilibrio per il cloro (E cl= -65mV).
Se il potenziale di membrana fosse sempre negativo quando il neurotrasmettitore viene
rilasciato, l’attivazione di questi canali provocherebbe un PPSI iperpolarizzante. Questo tipo di
sinapsi agisce come una derivazione elettrica impedendo alla corrente di scorrere attraverso il
corpo cellulare sino al cono di emergenza dell’assone (inibizione per derivazione).
Esistono molte sinapsi con recettori accoppiati alla proteina G che non sono direttamente
associati a canali ionici. L’attivazione sinaptica di questi recettori non genera direttamente
PPSE e PPSI ma modifica l’efficacia dei PPSE generati da altre sinapsi. Questo tipo di
trasmissione sinaptica è detto modulazione (effetti associati alla cascata di eventi conseguente
all’attivazione della proteina G).
INSERTO: Mutazioni startling e veleni.
Una vasta gamma di stimoli possono, in condizioni di “sorpresa”, farci trasalire.
Fortunatamente alla loro ripresentazione siamo meno reattivi, ovvero siamo maggiormente
preparati. Per una minoranza di soggetti invece la vita è una successione di risposte di
trasalimento (startlie) esagerate. Il termine clinico di tale disturbo è iperplessia, una condizione
ereditaria. Le basi molecolari coinvolgono i recettori inibitori della glicina in due modalità
differenti: nella prima (uomo e topo mutante spasmodico), il recettore ha un solo aminoacido,
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
su oltre 400, codificato in modo errato che può produce un canale del cloro che si apre meno
frequentemente quando esposto al neurotrasmettitore (glicina); nella seconda (specie bovina e
topi mutanti spastici), i recettori sono normali ma in numero inferiore al normale. Le mutazioni
del sistema neurotrasmettitore della glicina assomigliano agli effetti di una potente tossina
vegetale, la stricnina che agisce come antagonista della glicina a livello del suo recettore. A
basso dosaggio, aumenta il trasalimento facendola assomigliare all’iperplessia; ad alto
dosaggio elimina l’inibizione dipendente dalla glicina nei circuiti del midollo spinale e del tronco
dell’encefalo comportando così: crisi incontrollate, sfrenate contrazioni muscolari, spasmi e
paralisi dei muscoli respiratori e infine morte per soffocamento. Poichè la glicina non è un
neurotrasmettitore localizzato nei livelli superiori del cervello, la stricnina non danneggia le
funzioni cognitive e sensoriali.
6. I SISTEMI NEUROTRASMETTITORI.
LO STUDIO DEI SISTEMI NEUROTRASMETTITORI.
I ricercatori utilizzano principalmente due metodi per dimostrare che la molecola si localizza e
viene sintetizzata in particolari neuroni:
- L’immunocitochimica localizza anatomicamente alcune particolari molecole in
determinate cellule. Il neurotrasmettitore, una volta purificato, viene iniettato nel
sangue di un animale dove stimola una risposta immunitaria ovvero la produzione di
grandi proteine (anticorpi) in grado di legarsi al neurotrasmettitore. Questi verranno
recuperati con prelievo sanguigno e marcati con coloranti, quindi applicati a una
sezione di tessuto coloreranno solo i neuroni che contengono il neurotrasmettitore.
- L’ibridazione in situ, è utile per confermare l’ipotesi che una cellula è in grado di
sintetizzare una particolare proteina o peptide. Conoscendo la sequenza di acidi
nucleici in un filamento di mRNA è possibile creare un filamento complementare
(sonda), la quale, marcata radioattivamente si legherà attrraverso un processo detto
ibridazione alle molecole di mRNA. Per sapere se la molecola di mRNA è localizzata in
un neurone si applica la sonda evidenziata ad una sezione di tessuto cerebrale e si
osserva quali sonde si sono agganciate cercando i neuroni che contengono “l’etichetta
chimica”.
Una volta verificato che il neurotrasmettitore viene sintetizzato dal neurone e si localizza nel
terminale presinaptico dobbiamo dimostrare che esso viene rilasciato nel momento in cui il
neurone è stimolato:
- Utilizzando sezioni di tessuto cerebrale mantenute vive in vitro, viene stimolato il
rilascio di neurotrasmettitore immergendo i tessuti in una soluzione con alta
concentrazione di K+.
Stabilire che una molecola è localizzata, sintetizzata e rilasciata da un neurone non è
sufficiente per qualificarla come neurotrasmettitore. La molecola deve infatti causare la stessa
risposta prodotta dal rilascio naturale del neurotrasmettitore dal neurone presinaptico:
- La microionoforesi permette di applicare alcuni farmaci o neurotrasmettitori in
quantità molto piccole sulla superficie postsinaptica dei neuroni attraverso il passaggio
di corrente elettrica. Un microelettrodo sul versante postsinaptico misura gli effetti del
neurotrasmettitore poi comparati con quelli derivati dalla stimolazione sinaptica
naturale.
Come regola due neurotrasmettitori non si legano allo stesso recettore tuttavia, lo stesso
neurotrasmettitore può legarsi a diversi recettori, ciascun differente recettore al quale si lega il
neurotrasmettitore viene chiamato sottotipo del recettore.
- l’analisi neurofarmacologica ha fornito la conoscenza circa i sottotipi dei recettori: la
nicotina (tabacco) è un recettore agonista dei muscoli scheletrici ma non ha alcun
effetto sul muscolo cardiaco; la muscarina (funghi) non ha effetti sui muscoli scheletrici
ma è un agonista del sottotipo del recettore colinergico del muscolo cardiaco dove
provoca il crollo della pressione arteriosa e del battito cardiaco.
Si possono perciò distinguere due sottotipi del recettore per l’ACh:
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
o recettore colinergico nicotinico nei muscoli sceletrici;
o recettore colinergico muscarinico nel muscolo cardiaco.
Un altro modo per distinguere i sottotipi dei recettori consiste nell’uso degli
antagonisti selettivi:
o il curaro è un veleno che inibisce l’azione dell’Ach presso i recettori nicotinici
provocando paralisi muscolare;
o l’atropina, derivata dalla belladonna, si comporta come antagonista dei
recettori muscarinici per l’Ach (collirio usato per la dilatazione pupillare).
Altri farmaci hanno evidenziato 3 sottotipi del recettore per il Glu (sinapsi eccitatorie),
denominati in base ai relativi agonisti chimici:
o recettori AMPA, NMDA (NMD Aspartato) e kainato.
Il glutammato attiva tutti tre i sottotipi di recettore ma ogni agonista agisce solo sul
proprio recettore.
Si usano analisi farmacologiche simili per dividere i sottotipi del rettore per la NA:
o recettori alfa e beta.
Sottotipi del recettore per il GABA:
o recettori GABAA e GABAB.
- Ogni composto chimico che si lega ad un sito specifico viene chiamato ligando per quel
recettore. La tecnica di studiare i recettori usando i ligandi marcati radioattivamente
viene denominata metodo per legare i ligandi. Il ligando per un recettore può essere
sia un agonista che un antagonista del trasmettitore, sia il neurotrasmettitore stesso.
- L’analisi molecolare, studiando la composizione proteica dei sottotipi dei recettori ha
evidenziato una diversità estremamente ampia di possibili combinazioni. Quelli
descritti in precedenza sono quindi una minima parte, sottostimata, dei diversi
sottotipi di un recettore nel cervello.
LA CHIMICA DEI NEUROTRASMETTITORI.
Gran parte dei neurotrasmettitori sono: aminoacidi, amine derivate dagli aminoacidi e peptidi
composti da aminoacici. L’ACh è un’eccezione infatti deriva da acetil-coenzima (acetil CoA) un
prodotto proveniente dalla respirazione dei mitocondri e dalla colina. Gli aminoacidi e i
trasmettitori aminici sono generalmente immagazzinati da gruppi separati di neuroni. L’ipotesi
che un neurone abbia un solo trasmettitore viene chiamata principio di Dale. Quando due o
più trasmettitori sono rilasciati da una terminazione nervosa vengono chiamati
cotrasmettitori.
- Neuroni colinergici. L’acetilcolina (ACh) è il neurotrasmettitore presente nella
giunzione neuromuscolare, e viene sintetizzato da tutti i motoneuroni del midollo
spinale e del tronco dell’encefalo. La sintesi richiede un enzima, la colin-acetil-
transferasi (AChT) che viene prodotta nel soma della cellula nervosa e trasportata nel
terminale assonico. Qui sintetizza ACh e il neurotrasmettitore rimane concentrato
nelle vescicole sinaptiche grazie all’attività dell’ACh trasportatore.
La disponibilità di colina limita la quantità di ACh che può essere sintetizzata.
I neuroni colinergici producono anche un enzima tra i più veloci, l’acetilcolinesterasi
(AChE), che degrada l’ACh. L’AChE viene secreto nello spazio intersinaptico e degrada
chimicamente l’ACh in colina e acido acetico. Gran parte della colina risultante viene
trattenuta nel terminale e usata nuovamente per la sintesi di ACh.
L’inibizione di AChE ostacola il decremento di ACh modificando la trasmissione nervosa
presso le sinapsi colinergiche dei muscoli scheletrici e del muscolo cardiaco. Gli effetti
acuti sono il rallentamento del battito cardiaco e della pressione arteriosa, tuttavia la
morte, dovuta ad inibizione irreversibile di AChE, sopraggiunge per paralisi
respitaroria.
- Neuroni catecolaminergici. L’aminoacido tirosina è il precursore di tre diversi
neurotrasmettitori aminici detti catecolamine: dopamina (DA), noradrenalina (NA) e
adrenalina. I neuroni catecolaminergici sono presenti nelle regioni sel SN coinvolte
nella regolazione del movimento, dell’umore, dell’attenzione e delle funzioni viscerali.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Tutti contengono l’enzima tirosin-idrossilasi (TH) che catalizza la conversione di tirosina
in dopa. L’enzima dopa-decarbossilasi trasforma il dopa in dopamina. Nella malattia
di Parkinson che colpisce il controllo dei movimenti corporei, i neuroni dopaminergici
degenerano lentamente sino alla morte.
I neuroni che usano la NA come neurotrasmettitore contengono, oltre al TH e al dopa-
decarbossilasi, anche l’enzima dopamina beta-idrossilasi (DBH) che trasforma la
dopamina in noradrenalina. Questo è contenuto nelle vescicole sinapitche.
I neuroni adrenalinergici contengono l’enzima fentolamina N-metiltransferasi (PNMT)
che trasforma la NA in adrenalina. Questo è presente nel citosol dei terminali assonici
perciò la NA deve prima essere sintetizzata nelle vescicole, poi rilasciata nel citosol per
essere convertita in adrenalina ed infine quest’ultima viene nuovamente trasportata
nelle vescicole per essere rilasciata. Oltre a servire come neurotrasmettitore viene
anche rilasciata dalla ghiandola surrenale nel circolo sanguigno.
Per i sistemi colaminergici non esiste un enzima degradativo veloce come l’AChE. La
ricaptazione selettiva dello stesso neurotrasmettitore viene svolta dai trasportatori
Na+ dipendenti (questo passaggio è sensibile a molte droghe; l’anfetamina e la
cocaina, ad esempio, bloccano la ricaptazione delle catecolamine prolungando l’azione
del neurotrasmettitore). Una volta all’interno del terminale assonico, le catecolamine
possono essere reinserite nelle vescicole o degradarsi per mezzo dell’enzima
monoaminossidasi (MAO) che si trova nella membrana dei mitocondri.
- Neuroni serotoninergici. La serotonina (5-HT) deriva dall’aminoacido triptofano. I
neuroni serotoninergici non sono numerosi ma giocano un ruolo importante nel
cervello regolando i l tono dell’umore, il comportamento emozionale e il sonno. Come
la DA, la serotonina viene sintetizzata in due passaggi. Il triptofano viene convertito in
5-HTP tramite l’enzima triptofano idrosillasi. Il 5-HTP diventa poi 5-HT grazie all’azione
dell’enzima 5-HTP decarbossilasi.
La sintesi di serotonina è limitata dalla quantità di triptofano disponibile nel fluido
extracellulare dei neuroni che arriva dal sangue.
Dopo il rilascio dal terminale assonico, la 5-HT viene rimossa dallo spazio intersinaptico
da uno specifico trasportatore. Il processo di ricaptazione, come per le catecolamine, è
sensibile alle droghe: molti antidepressivi come la fluoxentina (prozac), sono degli
inibitori selettivi della ricaptazione della serotonina. Una volta all’interno del terminale
assonico, la serotonina viene reinserita nelle vescicole o degradata per mezzo
dell’enzima monoaminossidasi (MAO).
- Neuroni aminoacidi. Gli aminoacidi glutammato (Glu), glicina (Gly) e acido gamma-
aminobutirrico (GABA) servono da trasmettitori in gran parte delle sinapsi del SNC.
Il glutammato e la glicina vengono sintetizzati dal glucosio e da altri precursori che
usano gli enzimi preesistenti nelle cellule. La differenza tra le cellule è
prevalentemente in termini di quantità. Nei terminali assonici glutamminergici, ma
non in altri, il trasportatore del glutammato concentra la sostanza nelle vescicole
sinaptiche fino ad alte concentrazioni.
Siccome il GABA non fa parte dei 20 aminoacidi che danno origine alle proteine, viene
sintetizzato solo dai neuroni che lo usano come neurotrasmettitore. Il precursore del
GABA è il glutammato e l’enzima che lo sintetizza è la decarbossilasi dell’acido
glutammico (GAD). I neuroni GABAergici sono la sorgente principale dell’inibizione
sinaptica nel SN. Inoltre, straordinariamente, in un solo passaggio il maggior
neurotrasmettitore eccitatorio nel cervello è convertito nel maggior
neurotrasmettitore inibitorio.
- Altri neurotrasmettitori e messsaggeri intercellulari . Oltre le amine e gli aminoacidi
esistono altre molecole che fungono da messaggeri chimici tra i neuroni.
L’ATP, molecola chiave del metabolismo cellulare funziona anche da
neurotrasmettitore, risulta infatti concentrato in molte vescicole del SNC e del SNP e
viene rilasciata in modo Ca2+ dipendente come i classici trasmettitori.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Gli endocannabinoidi (piccole molecole lipidiche), possono essere rilasciate dai
neuroni postsinaptici e agire sui terminali presinaptici fungendo da regolatori: vengono
pertanto considerati messaggeri retrogradi (dal tipo di trasmissione utilizzata,
retrograda). Scariche ad alta frequenza di potenziale d’azione nel neurone
postsinaptico comportano l’apertura di canali calcio voltaggio-dipendenti. Gli ioni Ca 2+
entrano nella cellula aumentandone la concentrazione intracellulare e stimolando la
sintesi di endocannabinoidi da parte della membrana. Gli endocannabinoidi:
o non sono immagazzinati in vescicole ma sintetizzati al momento;
o sono piccoli e impermeabili alla membrana, una volta sintetizzati possono
quindi muoversi rapidamente entrando in contatto con altre cellule;
o si legano selettivamente al recettore cannabinoide CB1 (accoppiato alla
proteina G) localizzato principalmente in alcuni terminali presinaptici.
Il ruolo dei recettori CB1 è quello di ridurre l’apertura dei canali del calcio che si
trovano nel versante presinaptico, compromettendo la capacità di questo versante di
rilasciare neurotrasmettitore (GABA o Glu). Quindi quando un neurone postsinaptico è
molto attivo rilascia endocannabinoidi che sopprimono l’azione eccitatoria o inibitoria
sul neurone.
Il monossido d’azoto (NO) è una molecola gassosa tra i più instabili messaggeri chimici
per la comunicazione cellulare. Sintetizzato dall’aminoacido arginina in molte cellule
del corpo, ha un ruolo significativo nella regolazione della circolazione del sangue. Nel
SN è un altro esempio di messaggero retrogrado (poichè la molecola è di piccole
dimensioni come gli endocannabinoidi).
Una sostanza chimica serve generalmente per due cose: mediare la comunicazione nel SN e
compiere funzioni completamente diverse in altre parti del corpo. Gli aminoacidi sono i
principali costruttori delle proteine; l’ATP è la fonte principale di energia per tutte le cellule;
l’NO viene rilasciato dalle cellule endoteliali e provoca il rilassamento dei muscoli lisci che
rivestono le vene (erezione del pene); le cellule con il più alto livello di ACh sono quelle della
cornea oculare dove non esistono recettori per l’Ach; i livelli più alti di serotonina si trovano
nelle piastrine.
INSERTO: Gli endocannabinoidi.
La maggior parte dei neurotrasmettitori è stato conosciuto prima dei propri recettori: oggi la
situazione si è invertita. Il principio attivo della cannabis è il THC che, nel cervello è in grado di
legarsi a specifici recettori accoppiati alla proteina G nelle aree del controllo motorio, nella
corteccia cerebrale e nelle vie del dolore. Oggi sappiamo che ci sono due tipi di recettori: CB1
nel cervello e CB2 nei tessuti del sistema immunitario. Il cervello contiene più recettori CB1 che
qualunque altro tipo di recettori accoppiati alla proteina G probabilmente per legare alcune
molecole prodotte naturalmente come gli endocannabinoidi.
I CANALI TRASMETTITORI-DIPENDENTI.
L’attività di un sistema neurotrasmettitore si divide in due fasi: la prima si svolge nella parte
presinaptica e culmina nell’aumento della concentrazione del neurotrasmettitore nello spazio
intersinaptico, la seconda, si verifica con la generazione di segnali elettrici e biochimici nel
neurone postsinaptico. Gli attori principali sono i canali dipendenti dal trasmettitore e i
recettori associati alla proteina G.
La struttura di base dei canali trasmettitori-dipendenti (il più studiato è il recettore nicotinico
ACh dei muscoli scheletrici) è un pentamero di 5 subunità proteiche (2 alfa, beta, gamma,
delta), composte da 4 alfa eliche. Il legame simultaneo su ciascuna subunità alfa è necessario
per l’apertura del canale (anche il recettore nicotinico Ach sui neuroni è un pentamero ma
comprende solo unità alfa e beta). Vi sono molte somiglianze sulla struttura delle unità di base
di molti canali trasmettitori-dipendenti presenti nel cervello. Tra le più importanti eccezioni
rientrano i canali glutammatergici costituiti da 4 subunità con la regione M2 formata da una
serie di ripiegamenti che entrano ed escono dal versante interno della membrana, simile a
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
quella del canale del potassio. I recettori purinergici (ATP) hanno anch’essi una struttura
inusuale, ogni subunità contiene solo due segmenti che attraversano la membrana.
I canali dipendenti per gli aminoacidi, mediano la maggior parte della trasmissione sinaptica
veloce nel SNC e sono fondamentali in ambiti quali i sistemi sensoriali, la memoria e la
malattia.
- i canali dipendenti per il glutammato, prendono il nome dai loro agonisti selettivi:
o i canali AMPA sono permeabili a Na+ e K+ e generalmente non al Ca 2+.
L’effetto della loro attivazione è quello di far entrare ioni Na+ causando una
rapida depolarizzazione. Perciò essi mediano la trasmissione eccitatoria nelle
sinapsi del SNC più o meno come i recettori nicotinici mediano l’eccitazione
sinaptica nelle giunzioni muscolari;
o i canali NMDA, mediano anch’essi la trasmissione eccitatoria attraverso
l’ingresso di ioni Na+, ma si differenziano dai precedenti per la loro
permeabilità agli ioni Ca 2+ e per essere anche voltaggio-dipendenti. Quando il
potenziale di membrana è a riposo gli ioni magnesio (Mg 2+) ostruiscono il poro
del canale. Quando la membrana viene depolarizzata, solitamente dopo
l’attivazione dei canali AMPA nelle sinapsi vicine della stessa cellula, gli ioni
Mg2+ escono dal poro, e il canale si apre.
il Ca2+ può stimolare il rilascio presinaptico del neurotrasmettitore. Dal punto di vista
postsinaptico può invece attivare molti enzimi, regolare l’apertura di notevoli canali e
influenzare l’espressione genetica. Se la quantità di Ca 2+ è troppo alta la cellula può
anche morire.
- i canali dipendenti per il GABA e la glicina mediano gran parte dell’inibizione sinaptica
del SNC. Sia il recettore GABA A che quello per la glicina controllano un canale selettivo
per il Cl- ed hanno struttura simile ai recettori nicotinici per l’ACh essendo però
selettivi per gli anioni.
L’inibizione sinaptica viene regolata nel cervello. Troppa inibizione porta alla perdita di
coscienza e al coma; poco inibizione porta ad una crisi parziale. Per esempio le
benzodiazepine (valium) e i barbiturici si uniscono ai loro siti specifici sulla faccia
esterna del GABAA; da sole, queste sostanze influenzano in misura minima il canale ma
quando il GABA è presente, le benzodiazepine aumentano la frequenza di apertura del
canale ed i barbiturici aumentano la durata di apertura del canale. Il risultato è sempre
un aumento di corrente inibitoria per il Cl-, dei PPSI più forti e una maggiore inibizione
comportamentale. Un’altra sostanza che aumenta la funzione del GABA A è l’etanolo
(alcool disciolto in bevande) che ha effetti anche sui recettori NMDA, sui recettori per
la glicina, sul recettore nicotinico per l’ACh e sul recettore della serotonina. Questo
spiega perchè l’etanolo aumenti l’inibizione su alcune aree cerebrali ma non su altre.
Altri candidati modulatori natuali per il GABA A sono i neurosteroidi, ormoni sintetizzati
dalle gonadi e dalle ghiandole surrenali ma anche dalle cellule gliali del cervello. Alcuni
aboliscono la funzione inibitoria, altri l’aumentano agendo su un sito pecifico del
recettore per il GABAA.
INSERTO: I veleni eccitanti del cervello.
Il più importante neurotrasmettitore cerebrale, il glutammato, immagazzinato in grandi
quantità in tutti i neuroni, è anche uno dei maggiori veleni per le cellule nervose. Un arresto
cardiaco, un infarto, un trauma cerebrale, una crisi parziale, una mancanza di ossigeno sono in
grado di provocare un circolo vizioso di rilascio di Glu in eccesso. Se i neuroni non sono in grado
di produrre ATP sufficiente per mantenere le pompe ioniche in funzione, la membrana si
depolarizza e gli ioni Ca2+ entrano nella cellula provocando il rilascio sinaptico di Glu che
depolarizza il neurone aumentando la concentrazione intracellulare di Ca2+ provocando
ulteriore rilascio di Glu. Quando tale sostanza raggiunge livelli troppo elevati uccide i neuroni
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
sovraeccitandoli (eccitototossicità). Il glutammato semplicemente attiva i suoi recettori che
permettono agli ioni Na+, K+ e Ca2+ di fluire attraverso la membrana in quantità eccessive. Il
canale NMDA gioca un ruolo importante essendo il principale passaggio di ingresso degli ioni
Ca2+. Questo processo è coinvolto in molte malattie di degenerazione neuronale come la
sclerosi laterale amiotrofica (SLA), che coinvolge i motoneuroni spinali, il morbo di Alzheimer
che coinvolge i neuroni cerebrali, il morbo di Parkinson. I recettori antagonisti al glutammato
possono bloccare l’attività a cascata di queste eccitotossine e ridurre il “suicidio neuronale”.
I RECETTORI E GLI EFFETTORI ASSOCIATI ALLA PROTEINA G.
La struttura di base dei recettori associati alla proteina G consiste in un singolo polipeptide
contenente 7 alfa eliche che attraversano la membrana. Due cappi esterni rappresentano il sito
dove si lega il neurotrasmettitore. Variazioni in questa regione determinano quali
neurotrasmettitori, agonisti e antagonisti si legano al recettore. Due cappi interni possono
legarsi e attivare le proteine G e le variazioni su questa regione determinano quale proteina G
e di conseguenza quali sistemi effettori vengono attivati in risposta al legame iniziale.
Il funzionamento delle proteine G è il medesimo:
- ciascuna proteina possiede 3 subunità (alfa, beta e gamma). Durante lo stato di riposo
una molecola di guanosindifosfato (GDP) si lega a una subunità G alfa e l’intero
complesso galleggia sulla membrana interna;
- se la molecola di GDP legata alla proteina G si trova vicino al recettore adatto e questo
contiene il neurotrasmettitore, la proteina G rilascia la molecola di GDP e la cambia
con una di GTP presa dal citosol;
- la molecola attivata di GTP, legata alla proteina G, si divide in due parti, la subunità
Galfa+GTP e la subunità Gbeta-gamma. Entrambe possono spostarsi per stimolare diverse
proteine effettrici;
- la subunità Galfa è un enzima che spezza la molecola GTP in GDP terminando la propria
attività tornando insieme alla subunità G beta-gamma.
I sistemi effettori associati alla proteina G sono due tipi di proteine effetrici:
- la via più breve (canali ionici dipendenti dalla proteina G), è la più rapida tra i sistemi
accoppiati alla proteina G (30-100msec) ed è estremamente localizzata influenzando
così solo i canali vicini. È utilizzata da molti neurotrasmettitori e va dal recettore, alla
proteina G al canale ionico. Un esempio sono i recettori muscarinici del muscolo
cardiaco, i recettori colinergici associati ai canali per il potassio tramite la proteina G
(l’Ach riduce il battito cardiaco) o i recettori GABA B anch’essi associati ai canali per il
potassio in questa modalità.
- le cascate del secondo messaggero, sono un’elaborata successione di reazioni di
attivazione di enzimi che provocano la modificazione di funzioni neuronali. Tra il primo
enzima e l’ultimo vi sono numerosi secondi messaggeri (cascata).
Un esempio è dato dal neurotrasmettitore NA che legandosi al beta-recettore, attiva la
proteina Ge (eccitatoria) che a sua volta attiva una proteina effettrice, l’enzima
intracellulare adelinato-ciclasi, il quale converte l’ATP in un composto denominato
AMPC (adenosinmonofosfato ciclico) che è libero di diffondersi nel citosol. Quindi il
primo messaggero chimico (il rilascio di NA) è convertito dal beta-recettore nel
secondo messaggeto AMPC. L’effetto dell’AMPc (aumento) è la stimolazione di un altro
enzima “a valle” chiamato protein-chinasi A (PKA). Molti processi biochimici sono
regolati da una componente stimolatoria ed una inibitoria. Così nell’esempio prima
descritto, l’attivazione di un secondo tipo di recettore NA (alfa-recettore) porta
all’attivazione della proteina Gi (inibitoria) che sopprime l’attività dell’adenilato-ciclasi.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Altre cascate del secondo messaggero possono ramificarsi: la proteina G può stimolare
la fosfolipasi C (PLC) che agisce su un fosfolipide della membrana (PIP2) dividendolo in
due molecole che fungono da secondo messaggero, diacilglicerolo (DAG) e inotolo-
1,4,5-trifosfato (IP3). Il DAG che è liposolubile rimane presso la membrana dove attiva
un enzima “a valle” detto protein-chinasi C (PKC). Nello stesso tempo, IP3, che è
solubile in acqua si diffonde nel citosol legandosi a recettori del RE liscio e di altri
organuli. Questi recettori, sono canali IP3 selettivi per il calcio. Come detto, l’aumento
di calcio nel citosol provoca effetti a lungo termine, uno di questi è l’attivazione
dell’enzima protein-chinasi dipendente dalla calcio-calmodulina (CaMK) implicato nei
meccanismi molecolari della memoria.
- Gli enzimi “a valle”, indispensabili in molte cascate dei secondi messaggeri, sono
protein-chinasi (PKA, PKC, CaMK). Queste trasferiscono il fosfato ATP che galleggia nel
citosol, alle proteine, in una reazione chimica chiamata fosforilazione in grado di
cambiare la conformazione di una proteina e quindi l’attività stessa della proteina.
Se la protein-chinasi (PKA, PKC, CaMK) stimolata dal trasmettitore, fosse libera di
fosforillare senza controllo, per controllare il processo, tutte le proteine verrebbero
saturate dai fosfati e un’ulteriore regolazione risultererbbe impossibile. Gli enzimi
denominati protein-fosfatasi risolvono questo problema rimuovendo i gruppi fosfato.
Il grado di fosforilazione del canale in ogni istante dipende dall’equilibrio della
fosforilazione della chinasi e della defosforilazione della fosfatasi.
- La trasmissione che coinvolge i recettori associati alla proteina G è lenta e complessa. Il
vantaggio è l’amplificazione del segnale, l’attivazione di un recettore associato alla
proteina G, può portare all’attivazione di moltissimi canali ionici in ogni fase del
processo di cascata, generando processi chimici di lunga durata (base della durata
memoria).
LA DIVERGENZA E LA CONVERGENZA NEI SISTEMI NEUROTRASMETTITORI.
Il glutammato è il più comune neurotrasmettitore eccitatorio presente nel cervello mentre il
GABA è il più comune trasmettitore inibitorio. Una molecola di glutammato è in grado di
legarsi a tutti i numerosi tipi di recettori per il glutammato e ciascun recettore può dare origine
a un effetto diverso. L’abilità di un trasmettitore di attivare più di un sottotipo del recettore e di
provocare più di un tipo di risposta postsinaptica è denominata divergenza. L’attivazione di un
recettore da parte di più trasmettitori è detta invece convergenza.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
7. LA STRUTTURA DEL SISTEMA NERVOSO.
INTRODUZIONE.
Il nostro cervello è essenzialmente una variante di un’organizzazione comune ai cervelli di tutti
i mammiferi. Il cervello umano sembra complicato perchè viene ripiegato in seguito alla
crescita selettiva di alcune parti entro i confini del cranio e dal fatto che stiamo su due gambe
anzichè quattro zampe.
L’ORGANIZZAZIONE GENERALE DEL SN DEI MAMMIFERI.
Il sistema nervoso (SN) di tutti i mammiferi è costituito da due divisioni: il sistema nervoso
centrale (SNC) e il sistema nervoso periferico (SNP).
I punti di riferimento per identificare alcune parti del cervello vengono chiamati riferimenti
anatomici:
- rostrale o anteriore (direzione verso il naso);
- caudale o posteriore (direzione verso la coda);
- dorsale (direzione verso l’alto);
- ventrale (direzione verso il basso);
la parte destra del cervello e del midollo è speculare alla parte sinistra (simmetria bilaterale) e
la maggior parte delle strutture si trovano a coppie, una a destra l’altra a sinistra divise da una
linea centrale invisibile (linea mediana), nello specifico:
- mediale (posizione interna);
- laterale (posizione esterna).
Per osservare la struttura interna del cervello è necessario sezionarlo. L’approccio standard
prevede 3 piani di sezione anatomica:
- piano saggitale (sezioni verticali rostro-caudali);
- piano orizzontale (sezioni orizzontali dorsali-ventrali) maggiormente usato;
- piano coronale (sezioni verticali laterali-mediali) nella pratica lievemente inclinato.
Il sistema nervoso centrale (SNC) è costituito da quella parte del SN racchiuso nelle ossa:
- l’encefalo è la parte più rostrale e più grande del cervello. Diviso in due emisferi
cerebrali separati da una profonda scissura interemisferica. In genere l’emisfero destro
riceve sensazioni dal lato sinistro del corpo e viceversa per l’emisfero sinistro.
- il cervelletto (piccolo cervello) è un centro di controllo con numerose connessioni con
encefalo e midollo spinale. L’emisfero cerebellare sinistro è implicato nel controllo dei
movimenti della parte sinistra del corpo e viceversa per l’emisfero cerebellare destro.
- il tronco dell’encefalo è un complesso insieme di fibre e cellule che, in parte,
funzionano come stazioni di ritrasmissione delle informazioni che vanno dall’encefalo
al midollo spinale ed al cervelletto e viceversa. È anche la zona dove vengono regolate
funzioni come la respirazione, il livello della coscienza ed il controllo della temperatura
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
corporea. È forse la parte più primitiva del cervello ma la più importante: una lesione
in questa parte solitamente porta alla morte.
- il midollo spinale è racchiuso nella spina dorsale e collegato al tronco dell’encefalo. È il
principale mezzo di trasporto delle informazioni dalla pelle, dalle giunture e dai
muscoli del corpo al cervelletto e viceversa. Una frattura al midollo spinale provoca
anestesia della pelle (assenza di sensazione) e paralisi dei muscoli caudali alla frattura
(i muscoli non possono essere controllati dal cervello). Il midollo comunica con il corpo
attraverso i nervi spinali (SNP) che fuoriescono attraverso incavi posizionati tra
ciascuna vertebra e si uniscono al midollo spinale attraverso la radice dorsale (porta
informazioni al midollo) e la radice ventrale (porta informazioni dal midollo).
Il sistema nervoso periferico (SNP) comprende le parti del SN esclusi cervello e midollo:
- il SNP somatico, comprende i nervi spinali che innervano la cute, le giunture e i
muscoli posti sotto il controllo volontario. Gli assoni motori somatici provengono dai
motoneuroni del midollo spinale ventrale, i cui corpi, si trovano nel SNC ma hanno
assoni nel SNP. Gli assoni somatosensitivi penetrano nel midollo spinale dorsale ma i
loro corpi si trovano fuori, in ammassi detti gangli delle radici dorsali (rigonfiamenti).
- il SNP viscerale detto anche sistema nervoso autonomo (SNA) è costituito da neuroni
che innervano gli organi interni, i vasi sanguigni e le ghiandole. Reazioni emozionali che
non sono sotto il nostro controllo, sono mediate dal SNA.
Oltre ai nervi che fuoriescono dal midollo spinale e innervano il corpo, esistono 12 paia di nervi
cranici che nascono dal tronco dell’encefalo ed innervano principalemente il capo. Alcuni
fanno parte del SNC altri del SNP somatico altri ancora del SNP viscerale.
Il SNC racchiuso nel cranio e nella colonna vertebrale non è in diretto contatto con le ossa che
lo rivestono ma protetto da 3 membrane chiamate meningi:
- la dura madre, il rivestimento più esterno, forte ed anaelastico (simile al cuoio);
- la membrana aracnoidea, simile alla tela di un ragno sottostante la dura madre;
- la pia madre, una membrana sottile aderente al cervello attraverso la quale passano i
vasi sanguigni che alla fine si immergono nella sostanza del cervello sottostante. Lo
spazio subaracnoideo è riempito da una sostanza liquida detta liquido cerebrospinale
(LCS)
Il sistema ventricolare è composto dalle cavità ed i canali del cervello pieni di liquido
cerebrospinale prodotto da uno speciale tessuto, il plesso coroideo, contenuto nei ventricoli. Il
LCS esce dal sistema ventricolare per entrare nello spazio aracnoideo attraverso piccole
aperture nei punti di contatto tra cervelletto e tronco dell’encefalo. Nello spazio aracnoideo, il
LCS viene assorbito dai vasi sanguigni in speciali strutture chiamati villi aracnoidei.
INSERTO: Acqua nel cervello.
Se il flusso del LCS fosse compromesso, tornerebbe indietro e causerebbe il rigonfiamneto dei
ventricoli. Questa condizione è denominata idrocefalia. Nei neonati, poichè il cranio è cedevole
e non completamente formato, la testa si espande per compensare l’aumento di liquido. Negli
adulti, il cranio non può espandersi aumenta pertanto la pressione cranica e il tessuto
cerebrale molle viene compresso con deterioramento delle funzioni. Il trattamento consiste
nella formazione di un foro e nell’applicazione di un tubo per il drenaggio del liquido in
eccesso.
LA STRUTTURA DEL SNC ATTRAVERSO LO SVILUPPO.
L’intero SNC deriva dalle pareti del tubo pieno di liquido che si forma ad uno stadio precoce
dello sviluppo embrionale. Lo stesso tubo si trasforma nel sistema ventricolare adulto.
- L’embrione inizialmente è formato da un disco piatto composto da 3 strati di cellule:
endoderma (organi interni), mesoderma (ossa dello scheletro e muscoli), ectoderma
(sistema nervoso e cute). La parte centrale dell’ecotderma (placca neurale) si ripiega
poi su se stessa, formando prima un canale le cui pareti si fonderanno in seguito,
formando il tubo neurale dal quale si svilupperà il sistema nervoso centrale. Dalla
parte di ectoderma che viene spinto fuori dal tubo e che rimane quindi esterno ad esso
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
(cresta neurale), si svilupperanno i neuroni e i corpi cellulari del sistema nervoso
periferico. Il processo di trasformazione della placca neurale in tubo neurale prende il
nome di neurulazione. Dal mesoderma si formano delle protuberanze su entrambe i
lati del tubo neurale detti somiti dai quali si svilupperanno le 33 vertebre della colonna
vertebrale ed i relativi muscoli scheletrici.
INSERTO: La nutrizione e il tubo neurale.
La formazione del tubo neurale avviene tre settimane dopo il concepimento.
L’insuccesso della corretta chiusura, viene attribuito alla carenza di acido folico nella
dieta materna durante queste settimane. Il complesso processo di formazione, dipende
da una precisa sequenza di cambiamenti nella forma tridimensionale delle singole
cellule e dalla loro adesione alle cellule circostanti. Il fallimento della chiusura anteriore
del tubo, determina una condizione detta anencefalia, sempre fatale. Il fallimento della
chiusura posteriore del tubo, determina la spina bifida, nei casi più gravi con mancata
formazione del midollo spinale, nei casi meno gravi con difetti delle meningi e delle
vertebre a livello del midollo.
Tutto il cervello deriva dalle 3 vescicole del tubo neurale: il proencefalo in posizione rostrale, il
mesencefalo in posizione centrale e, in posizione caudale, connesso alla parte del tubo che
darà origine al midollo spinale, il rombencefalo.
La differenziazione del proencefalo:
- dai lati del proencefalo si sviluppano le vescicole secondarie, le vescicole
telencefaliche (telencefalo) e le vescicole ottiche (che crescendo, formeranno steli e
calici ottici, nell’adulto i nervi ottici e le due retine). La parte centrale rispetto alle
vescicole è chiamata diencefalo;
- le vescicole telencefaliche (telencefalo) crescono posteriormente, sopra e di lato al
diencefalo, le cellule delle pareti si dividono e si differenziano in varie strutture:
o le vescicole telencefaliche appaiono rigonfie a causa della proliferazione
neuronale, che genera due diversi tipi di sostanza grigia nel telencefalo: la
corteccia cerebrale e il telencefalo basale;
o i neuroni estendono i loro assoni formando 3 sistemi di sostanza bianca: la
sostanza bianca corticale (contiene gli assoni che vanno e vengono dalla
corteccia cerebrale), il corpo calloso (forma un ponte assonico che collega i
neuroni corticali dei due emisferi) la capsula interna (mette in comunicazione
la corteccia col tronco encefalico, in particolare il talamo).
o dalle superfici ventrali degli emisferi cerebrali (telencefalo), nascono un paio di
vescicole che danno vita al bulbo olfattivo e alle relative strutture di
percezione;
o le superfici ventromediali degli emisferi sono fuse con le superfici mediali del
diencefalo. Gli spazi colmi di liquido che si trovano negli emisferi sono chiamati
ventricoli laterali, mentre lo spazio al centro del diencefalo, terzo ventricolo.
- il diencefalo si divide in talamo e ipotalamo (parte inferiore).
ll proencefalo è la sede della percezione, della coscienza, del pensiero e dell’azione volontaria.
La parte più importante è la corteccia cerebrale i cui neuroni ricevono informazioni sensoriali,
formano percezioni del mondo esterno e governano i movimenti volontari. Le informazioni
provenienti da occhi, orecchi e cute fanno tappa, prima di giungere alla corteccia, nel talamo i
cui neuroni inviano assoni alla corteccia attraverso la capsula interna. Gli assoni del corpo
calloso costituiscono un’importante via di comunicazione tra gli emisferi. I neuroni corticali
proiettano i loro assoni attraverso la capsula interna verso il tronco dell’encefalo, altri
percorrono un tratto lungo sino al midollo spinale (tratto corticospinale, movimento
volontario). Un’altra via di comunicazione è quella dei gangli ella base, un agglomerato di
cellule del telencefalo basale.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
L’ipotalamo controlla il SNA (viscerale), è implicato nelle funzioni corporee in risposta ai
bisogni dell’organismo, media le risposte attraverso l’ipofisi (libera ormoni nel flusso
sanguigno), localizzata sotto il diencefalo.
La differenziazione del mesencefalo:
- la superficie dorsale si trasforma in una parte chiamata tetto che si differenzia in 2
strutture, i collicoli superiori (ricevono afferenze dagli occhi, movimenti oculari) e i
collicoli inferiori (ricevono informazioni dalle orecchie);
- il pavimento viene costituito dal tegmento (una delle regioni più colorate perchè
contiene la substantia nigra e il nucleus rubis, implicati nel controllo del movimento
volontario).
- Lo spazio interno colmo di liquido si restringe a formare uno stretto canale chiamato
acquedotto cerebrale.
La differenziazione del rombencefalo:
si divide in 3 importanti strutture: le prime due derivanti dalla parte rostrale (metencefalo) e la
terza dalla parte caudale (mielencefalo):
- il cervelletto, si sviluppa dalla parte rostrale partendo dal tessuto della parete dorso-
laterale del cilindro originario (rombencefalo), denominato plica romboidale;
- il ponte (parte inferiore), si sviluppa dall’espansione della parete ventrale del cilindro;
- il bulbo (midollo allungato), lungo le sue pareti transitano i due principali sistemi di
sostanza bianca (piramidi bulbari).
- il canale colmo di liquido cerebrospinale diventa il quarto ventricolo.
Come il mesencefalo, il rombencefalo è un punto di passaggio importante per le informazioni
che vanno dal proencefalo al midollo spinale e viceversa. Il cervelletto è un importante centro
per il controllo del movimento, le afferenze dal midollo danno indicazioni circa la localizzione
del corpo nello spazio; le afferenze dal ponte portano informazioni provenienti dalla corteccia
specificando i bersagli dei movimenti volontari.
Di tutti gli assoni discendenti che passano per il mesencefalo, circa 20 milioni (90%)
contraggono sinapsi con neuroni del ponte, questo funge da pannello di controllo tra corteccia
e cervelletto.
In prossimità del punto di giunzione del bulbo col midollo spinale, ciascun tratto piramidale
attraversa la linea mediana dall’altro lato (decussazione) spiegando così perchè un lato della
corteccia controlli i movimenti del corpo del lato opposto. Il bulbo contiene neuroni che
trasportano informazioni sensoriali dal midollo al talamo (la distruzione di queste cellule
produce anestesia).
La differenziazione del midollo spinale:
con l’espansione del tessuto, il lume del tubo si riduce per dare origine allo stretto canale
spinale. In sezione la sostanza grigia (corpi cellulari dei neuroni) ha l’aspetto di una farfalla, la
parte superiore è detta corno dorsale, la parte inferiore, corno ventrale.
Il midollo spinale è il principale mezzo di conduzione di informazioni dalla cute, dalle giunture e
dai muscoli al cervello e viceversa. I neuroni della sostanza grigia spinale iniziano l’analisi delle
informazioni sensoriali, svolgono un ruolo critico nella coordinazione dei movimenti e regolano
i riflessi semplici.
LA CORTECCIA CEREBRALE.
I canali sulla superficie dell’encefalo sono detti solchi, mentre le protuberanze sono chiamate
giri. Entrambe sono il risultato della notevole estensione della superficie della corteccia
cerebrale. L’encefalo si divide in lobo frontale (parte rostrale), lobo parietale parte centrale
successiva al solco centrale), lobo occipitale (parte caudale) e lobi temporali (parti laterali
sottostanti la scissura di Silvio).
I tipi di corteccia cerebrale:
i corpi cellulari dei neuroni sono sempre orgsanizzati in strati paralleli alla superficie del
cervello. Lo strato più vicino alla superficie è separato dalla pia madre da uno strato
molecolare (privo di neuroni I strato), almeno uno strato contiene cellule piramidali che
emettono grossi dendriti (apicali) che si estendono sino al I strato.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Brodmann intuì che le aree corticali aventi aspetti differenti sottendono funzioni differenti.
Durante l’evoluzione, è cambiata la quantità di corteccia con l’inserimento di nuove aree, ma
non la sua struttura di base. I suoi studi suggeriscono che la neocorteccia primordiale fosse
divisa in 3 tipi: aree sensoriali primarie, le prime a ricevere i segnali dalle vie sensoriali; aree
sensoriali secondarie interconnesse con le prime e aree motorie preposte al movimento
volontario. Quanto si è evoluto si individua nelle regioni che si trovano in mezzo a queste aree.
INTEGRAZIONE: nervi cranici.
1. Olfattivo Telencefalo (senso olfatto, non porta info al talamo)
2. Ottico Diencefalo (senso visione, info dalla retina alla corteccia occipitale)
3. Oculomotore Mesencefalo (controllo muscoli oculari, info movimenti)
4. Trocleare Mesencefalo (innerva e muove l’occhio)
5. Trigemino Ponte (senso tatto facciale, movimenti dei muscoli masticatori)
6. Abducente Ponte (movimenti oculari)
7. Facciale Ponte (muscoli espressioni facciali, sensibilità lingua, gusto)
8. Vestibolococleare Ponte (senso udito ed equilibrio, orientamento)
9. Glossofaringeo Bulbo (deglutizione, saliva, lingua, pressione sangue)
10. Vago Bulbo (controllo sistema viscerale, dolore viscerale, gola)
11. Accessorio spinale Bulbo (muscoli gola e collo)
12. Ipoglosso Bulbo (lingua)
La neuroanatomia è stata rivoluzionata con l’introduzione di nuovi strumenti che permettono
di riprodurre immagini del cervello vivente:
- tomografia computerizzata (TC), una fonte di raggi X viene fatta ruotare intorno alla
testa secondo il piano della sezione desiderata. Dal lato opposto alla traiettoria del
fascio di raggi sono posizionati dei sensori sensibili alle radiazioni X. Il risultato finale è
la ricostruzione digitale della posizione e della quantità di materiale radioopaco
all’interno del piano della sezione;
- risonanza magnetica (RM), utilizza informazioni sul modo in cui gli atomi di idrogeno
nel cervello rispondono alle perturbazoni di un intenso campo magnetico. Si ottengono
immagini straordianariamente dettagliate dell’intero cervello sviluppate su qualsiasi
piano desiderato e senza utilizzare radiazioni;
La TC e la RM sono valide per osservare i cambiamenti strutturali nel cervello vivente
(anatomia cerebrale), come tumori o edemi post-traumatici, ma non per comprendere
quanto avviene, a livello chimico ed elettrico: tomografia ad emissione di positroni (PET) e
risonanza magnetica funzionale (fRMI), rilevano le modificazioni del flusso ematico
regionale e del metabolismo cerebrale seguendo il principio secondo cui i neuroni attivi
hanno bisogno di più glucosio e ossigeno. I vasi cerebrali rispondono all’attività neurale
facendo affluire una maggior quantità di sangue alle regioni attive, pertanto, registrando i
cambiamenti del flusso ematico, le due tecniche rilevano le regioni del cervello che sono
più attive in circostanze differenti.
INSERTO: La risonanza magnetica.
Quando un atomo di idrogeno viene immerso in un campo magnetico, il suo nucleo, formato da
un solo protone, si può trovare in uno stato di alta o bassa energia. Facendo passare un’onda
elettromagnetica attraverso la testa, posizionata tra i poli di un potente magnete, si fornisce
energia ai protoni (assorbimento alla frequenza di risonanza) che passano da uno stato di
bassa energia allo stato di alta energia. Quando il segnale cessa alcuni protoni tornano allo
stato di bassa energia emettendo un segnale che viene raccolto. Più il segnale è forte,
maggiore è il numero di atomi di idrogeno tra i poli del magnete. La frequenza alla quale i
protoni emettono energia è proporzionale alle dimensioni del piano magnetico. I segnali ad
alta frequenza provengono da atomi di idrogeno vicini alla porzione più intensa del campo
magnetico, i segnali a bassa frequneza da aree in cui il campo magnetico è più debole.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
INSERTO: Le immagini funzionali dell’attività cerebrale PET e fRMI.
Nella PET, una soluzione radioattiva contenente atomi che emettono positroni (elettroni con
carica positiva) viene introdotta nel circolo sanguigno. Qui, i positroni interagiscono con gli
elettroni producendo fotoni di radiazione elettromagnetica. La posizione degli atomi che
emettono positroni, viene rilevata attraverso sensori che raccolgono i fotoni. L’immagine PET
deriva dalla sottrazione tra l’immagine dell’attività in assenza di stimolazione e l’immagine
dell’attività cerebrale associata ad un compito.
La fRMI rileva, in modalità veloce e non invasiva, la posizione dell’aumentata attività cerebrale
misurando il rapporto tra ossiemoglobina (forma ossigenata dell’emoglobina) e
deossiemoglobina (emoglobina che ha donato il suo ossigeno).
INTEGRAZIONE: Visualizzazione del cervello in vivo (Kandel).
Tecniche strutturali.
Le tecniche di visualizzazione mediante raggi x permettono di mettere in evidenza strutture
aventi capacità di assorbimento delle radiazioni molto diverse:
- radiografia convenzionale, rappresentazione bidimensionali di strutture
tridimensionali, che mette in evidenza l’asimmetria delle strutture cerebrali come
fratture o tumori ossei, senza però distinguere o evidenziare, la sostanza grigia e
bianca.
- pneumoencefalografia, esamina la struttura dei ventricoli introducendo aria nello
spazio aracnoideo e seguendone il percorso.
- Angiografia, attraverso l’iniezione di materiale radiopaco fornisce informazioni
sull’anatomia dei vasi cerebrali e sulla velocità di circolazione del sangue nelle regioni
del SNC (aneurismi, malformazioni vascolari, tumori vascolari, lesioni del sistema
ventricolare intracranico).
- tomografia computerizzata (TC-TAC), rappresentazione bidimensionale di una
struttura bidimensionale in quanto studia un piano di sezione; simile alla radiografia
convenzionale, permette però di distinguere la sostanza grigia da quella bianca. Si
ottengono immagini delle ossa, del tessuto cerebrale e del liquido cerebrospinale; si
possono riconoscere il talamo, i nuclei della base, i ventricoli (ictus,emorragie)
- diffusion tensor imaging (DTI).
Tecniche funzionali a bassa risoluzione temporale.
- tomografia ad emissione di positroni (PET), fornisce immagini ad alta risoluzione, dei
processi funzionali cerebrali localizzati tridimensionalmente. Utilizza isotopi che
decadono emettendo positroni (elettronini caricati positivamente) incorporati nelle
molecole di interesse. Ad esempio, il metabolismo glucidico mette in evidenza l’attività
delle cellule nervose.
- risonanza magnetica per immagini (fMRI). È basata sulla TC e può venir usata per
studiare sia lo stato funzionale che la struttura del cervello con un grado di risoluzione
molto superiore. Elementi con peso atomico dispari, se esposti ad un campo
magnetico, allineano i loro assi rispetto il campo magnetico applicato. Quando gli
impulsi vengono interrotti, i nuclei tendono a tornare alla posizione originaria
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
liberando energia. La capacità dei nuclei atomici di assorbire energia dalle radio-onde
viene detta risonanza magnetica nucleare. Si possono rilevare:
o differenze nel contenuto d’acqua dei tessuti (lesioni cerebrali);
o concentrazioni di ferro evidenziando aree come i nuclei della base, il globo
pallido, la substantia nigra e il nucleo rosso (morbo di Parkinson, distonia,
emorragia intracranica);
o concentrazioni di sodio (ictus, alterazione neoplastica) e fosforo (produzione di
energia ATP);
o
Tecniche funzionali ad alta risoluzione temporale.
- elettroencefalografia (EEG), rileva l’attività elettrica dei giri.
- potenziali evocati, stimoli a intervalli regolari che producono oscillazioni dell’EEG.
- magnetoencefalografia (MEG), rileva le attività dei solchi attraverso campi magnetici
debolissimi prodotti dal cervello;
- transcranial doppler sonografy (fDTS), utilizza ultrasuoni (parti molli scatola cranica);
- transcranial magnetic simulation (TMS) campo elettrico indotto magneticamente;
- transcranial current stimulation (tDCS), induzione di corrente che sposta ioni K.
Tecniche miste.
- TAC + PET;
- fMRI + RM;
- correlazione volume-cognizione.
9. L’OCCHIO.
INTRODUZIONE.
Il sistema visivo parte dall’occhio. Sul lato posteriore dell’occhio si trova la retina (una parte
del cervello) che contiene fotorecettori specializzati nel convertire l’energia luminosa in attività
neurale. Gli assoni dei neuroni retinici si uniscono a formare i nervi ottici: questi trasmettono
l’informazione visiva, sottoforma di potenziali d’azione, a diverse strutture cerebrali che
eseguono funzioni differenti. La prima stazione sinaptica si trova in un gruppo di cellule del
talamo dorsale chiamato nucleo genicolato laterale, da cui le informazioni risalgono sino alla
corteccia dove vengono interpretate e memorizzate.
LE PROPRIETA’ DELLA LUCE.
La luce è la radiazione elettromagnetica visibile ai nostri occhi. Un’onda d’energia,
caratterizzata da: - lunghezza (distanza tra due onde successive)
- frequenza (numero di onde al secondo)
- ampiezza (differenza tra un picco e un cavo).
Solo un piccola parte dello spettro elettromagnetico è rilevabile dal nostro sistema visivo, le
onde comprese tra i 400 (blu) e i 700 nm (rosso).
Nel vuoto un’onda di radiazione viaggerà lungo una linea retta (raggio) sino a che non
interagisce con atomi e molecole dell’atmosfera e di oggetti dell’ambiente.
- La riflessione è il rimbalzare dei raggi di luce su una superficie.
- L’assorbimento è il trasferimento dell’energia luminosa su una particella o su una
superficie.
- La rifrazione è la deviazione dei raggi di luce quando questi passano da un mezzo
trasparente a un altro.
LA STRUTTURA DELL’OCCHIO.
L’occhio è un organo specializzato per la detenzione, la localizzazione e l’analisi della luce.
La pupilla è l’apertura che permette alla luce di entrare nell’occhio e raggiungere la retina;
appare nera a causa dei pigmenti della retina che assorbono la luce. Le dimensioni della pupilla
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
sono controllate da un muscolo circolare: l’iride. La pupilla e l’iride sono ricoperte dalla
superficie esterna vitrea e trasperente dell’occhio: la cornea. La cornea continua nella sclera,
la parte bianca e dura del globo oculare. I muscoli extraoculari, inseriti nella sclera muovono il
globo oculare nella cavità ossea. Questi muscoli non sono visibili perchè sono sotto la
congiuntiva, una membrana ripiegata che nasce dalla parte interna delle palpebre e si
congiunge alla sclera. Il nervo ottico che trasporta gli assoni della retina, fuoriesce dal retro
dell’occhio, passa attraverso l’orbita e raggiunge il cervello alla sua base, in prossimità
dell’ipofisi.
Nel mezzo di ciascuna retina si trova una regione più scura, di colore giallognolo e priva di vasi
sanguigni, detta macula, la parte della retina deputata alla visione centrale. Sempre nella
retina è presente una macchia scura, la fovea, una piccola fossa (zona più sottile della retina)
rappresentante il centro della retina.
Il cristallino, localizzato dietro l’iride è sostenuto da legamenti sospensori uniti ai muscoli
ciliari, i quali sono connessi alla scela formando un anello all’interno dell’occhio.
L’umor acqueo è il fluido acquoso che si trova tra cornea e cristallino, l’umor vitreo è il liquido
più viscoso e gelatinoso che si trova tra cristallino e retina; con la sua pressione mantiene la
forma sferica del globo oculare. Modificazioni nella forma del cristallino permettono ai nostri
occhi di aggiustare la messa a fuoco alle diverse distanze.
INSERTO: Disturbi dell’occhio.
Nello strabismo, la direzione degli occhi si incrocia (esotropia) o diverge (exotropia); gli occhi
sono in conflitto e provocano la perdita della percezione della profondità e la soppressione
dell’input da un occhio. La cataratta è un annebbiamento del cristallino che riduce
significativamente la visione. Il glaucoma deriva dall’aumento della pressione dell’umor
acqueo che danneggia gli assoni del nervo ottico; la vista viene meno dalla perifieria verso il
centro. Il distacco della retina avviene a causa di un trauma o di una contrazione dell’umor
vitreo; in entrambe i casi quest’ultimo fluisce attraverso piccoli strappi nella retina. La retinite
pigmentosa è provocata da una degenerazione dei fotorecettori e comporta perdita della
visione periferica e notturna (visione a tunnel). La degenerazione maculare provoca invece
perdita della visione centrale.
L’ANATOMIA MICROSCOPICA DELLA RETINA.
La via più diretta per il flusso di informazione visiva va dai fotorecettori alle cellule bipolari alle
cellule gangliari. Quest’ultime generano potenziali d’azione in risposta alla luce, e questi
impulsi si propagano lungo il nervo ottico verso il resto del cervello.
L’elaborazione retinica è anche influenzata dalle cellule orizzontali (tra fotorecettori e cellule
bipolari) e dalle cellule amacrine (tra cellule bipolari e cellule gangliari).
Le uniche cellule fotosensibili sono i fotorecettori e le uniche cellule che costituiscono la via
efferente che lascia la retina sono le cellule gangliari.
Gli strati cellulari della retina (struttura laminare), partendo dal centro del globo oculare, sono:
- Strato delle cellule gangliari (corpi delle cellule gangliari);
- Strato plessiforme interno (sinapsi tra cellule gangliari e cellule bipolari e amacrine);
- Strato nucleare interno (corpi delle cellule bipolari, orizzontali e amacrine);
- Strato plessiforme esterno (sinapsi tra fotorecettori e cellule bipolari e orizzontali);
- Strato nucleare esterno (corpi cellulari dei fotorecettori);
- Strato dei segmenti esterni ai recettori ();
- Epitelio pigmentato.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
La struttura dei fotorecettori.
La conversione della radiazione elettromagnetica in segnale nervoso viene attuata da 125
milioni di fotorecettori sul fondo della retina. Ogni fotorecettore è suddiviso in 4 regioni: un
segmento esterno, un segmento interno, un corpo cellulare e una terminazione sinaptica. I
segmenti esterni assorbono la luce attraverso dischi membranosi.
I bastoncelli fotorecettori hanno un segmento esterno lungo e cilindrico, i coni fotorecettori
hanno un segmento esterno più corto che si assottiglia. I bastoncelli sono 1000 volte più
sensibili alla luce rispetto i coni, infatti in condizione di luminosità notturna (condizione
scotopica) solo i bastoncelli contribuiscono alla visione. Al contrario in condizioni di luminosità
diurna (condizione fotopica) sono i coni ad eseguire la maggior parte del lavoro. Tutti i
bastoncelli contengono lo stesso pigmento mente esistono tre tipi di coni con diversi pigmenti
che li rendono sensibili a diverse lunghezze d’onda luminose (diversi colori).
In genere la retina periferica possiede un maggior numero di bastoncelli e un minor numero di
coni e un rapporto maggiore tra fotorecettori e cellule gangliari. L’effetto combinato di questa
organizzazione si manifesta attraverso una maggior sensibilità alla luce.
La regione della retina più specializzata per una visione ad elevata risoluzione è la fovea. Il suo
infossamento, permette alla luce di colpire i recettori, senza passare attraverso gli altri strati
cellulari della retina disposti lateralmente alla “fossa”.
Gli unici fotorecettori della fovea sono in coni.
LA FOTOTRASDUZIONE.
I fotorecettori convertono o trasducono, l’energia luminosa in modificazioni del potenziale di
membrana.
La fototrasduzione nei bastoncelli.
In completa oscurità, il potenziale di membrana del segmento esterno dei bastoncelli è di -
30mV a causa del continuo ingresso, attraverso specifici canali, di ioni Na+ (corrente al buio)
stimolati ad aprirsi da un secondo messaggero intracellulare, il guanosinmonofosfato ciclico
(GMPc). La luce riduce il GMPc causando la chiusura dei canali per il sodio e abbassando così il
potenziale di membrana ( -60 mv). Quindi, i fotorecettori si iperpolarizzano in risposta alla luce.
La rodopsina, il fotopigmento che assorbe le radiazioni elettromagnetiche, è costituita
dall’opsina, una proteina recettrice composta da 7 alfa eliche, e dal retinale, l’agonista chimico
ad essa associato. In presenza di luce, il retinale cambia conformazione attivando l’opsina
(sbiancamento). Questo processo stimola una proteina G presente sulla membrana dei dischi
(trasducina) che a sua volta attiva l’enzima effettore fosfodiesterasi (PDE) il quale riduce
drasticamente la concentrrazione di GMPc con la conseguente chiusura dei canali Na+. Questo
processo viene amplificato: ogni molecola di pigmento attiva molte proteine G e ogni enzima
PDE disattiva più di una molecola di GMPc.
La fototrasduzione nei coni.
La visione diurna dipende interamente dai coni i cui fotopigmenti hanno bisogno di una
maggiore quantità di energia per sbiancare. Il processo di fototrasduzione è lo stesso dei
bastoncelli, l’unica differenza consiste nel tipo di opsina dei dischi membranosi dei segmenti
esterni dei coni. Parleremo pertanto di coni blu, verdi e rossi a seconda della lunghezza d’onda
della loro attivazione (sensibilità spettrali diverse).
La perceazione del colore è determinata dall’attivazione relativa dei coni blu, verdi e rossi del
segnale della retina. Secondo la teoria tricromatica, il cervello attribuisce il colore in base alle
risposte dei tre tipi di coni, quando tutti i tre tipi sono ugualmente attivi percepiamo il bianco.
Se i coni fossero interamente responsabili della percezione dei colori, non potremmo
percepire differenze di colore quando i coni sono inattivi (luce notturna).
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
L’adattamento al buio, ovvero l’abituarsi all’oscurità richiede circa 20 minuti. La sua principale
componenete è la rigenerazione di rodopsina (che era sbiancata) ed una convergenza delle
informazioni portate dai bastoncelli sulle cellule gangliari. il passaggio dal buio alla luce implica
circa 5 minuti, nei quali gli occhi vanno incontro ad un adattamento alla luce.
Il calcio sembra influenzare i fotopigmenti e la fosfodiesterasi in modo da ridurre la risposta
alla luce, registrando i cambiamenti relativi dei livelli di luminosità anche se l’informazione,
rispetto i valori assoluti viene persa.
INSERTO: Genetica della visione dei colori.
Il colore che percepiamo è determinato dalla quantità di luce che viene assorbita dai pigmenti
visivi per il rosso, il verde e il blu che sono nei nostri coni. Dato che usiamo un sistema a 3
colori, veniamo definiti tricromati. La maggior parte delle anomalie nella visione dei colori
deriva da piccoli errori genetici che portano alla perdita di un pigmento visivo o ad un suo
slittamento della sensibilità spettrale.
I deficit più comuni riguardano i pigmenti rosso e verde, più frequenti nei maschi in quanto
presenti nel cromosoma X che viene ereditato dalla madre (nelle donne solo se ereditato da
entrambe i genitori). I tricromati anomali sono maschi con pigmenti per il rosso e verde con
assorbimenti a lunghezze d’onda diverse rispetto la norma. I dicromati hanno una mancanza
del pigmento rosso o verde. I monocromati per i coni blu, non possiedono nessun pigmento per
il colore e vivono in un mondo che varia solo in gradazioni di chiaro-scuro.
10. IL SISTEMA VISIVO CENTRALE.
INTRODUZIONE.
Il nostro sistema visivo consente una visione unificata del mondo che ci circonda che deriva da
molteplici caratteristiche: la forma, il colore la posizione di oggetti nello spazio, il loro
movimento. In più, percepiamo nella corteccia visiva due immagini dello stesso oggetto che
vengono unificate. Da 100 milioni di fotorecettori, solo un milione di assoni lasciano l’occhio.
Ciò che percepiamo del mondo circostante dipende quindi da quali informazioni vengono
estratte dalla retina e da come queste informazioni vengono analizzate e interpretate dal resto
del SNC.
LA PROIEZIONE RETINICA.
La via neurale che parte dall’occhio e arriva al tronco dell’encefalo, viene chiamata proiezione
retinofuga (che si allontana dalla retina). Essa attraversa: i nervi ottici, escono da entrambe gli
occhi presso i dischi ottici, attraversano le orbite craniche e i fori del pavimento cranico, il
chiasma ottico, che giace alla base del cervello, dove solo gli assoni originati nelle emiretine
nasali si incrociano (decussazione parziale). Successivamente, gli assoni entrano nei tratti ottici
che corrono sotto la pia madre lungo le superfici laterali del diencefalo.
Il campo visivo totale è quella regione dello spazio (misurata in gradi) che può essere vista da
entrambe gli occhi quando lo sguardo viene tenuto fermo su un punto. Immaginando di
dividere a metà il campo visivo, otteniamo l’emicampo visivo destro e l’emicampo visivo
sinistro. chiudendo alternativamente gli occhi la parte centrale di entrambe gli emicampi resta
visibile (campo visivo binoculare). Gli oggetti appartenenti all’area binoculare dell’emisfero
sinistro verranno proiettati sulla porzione della retina nasale dell’occhio sinistro e sulla retina
temporale dell’occhio destro. Di conseguenza alla decussazione nel chiasma ottico, l’emicampo
visivo sinistro “viene visto” dall’emisfero destro e l’emicampo visivo destro “viene visto”
dall’emisfero destro.
Proiezioni del nervo ottico.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Un piccolo numero di assoni del tratto ottico si allontana per fare sinapsi con cellule
dell’ipotalamo (importanti nella sincronizzazione di vari ritmi biologici), un altro (10%) supera il
talamo per innervare il mesencefalo e la gran parte (90%) innerva il nucleo genicolato laterale
(NGL) del talamo dorsale. I neuroni del NGL danno origine ad assoni che proiettano sulla
corteccia visiva primaria (radiazione ottica). Quest’ultima via rappresenta la percezione visiva
cosciente.
Se il nervo ottico sinistro viene resecato si perderà completamente la vista dall’occhio sinistro
(perdita della vista periferica sinistra). Se il tratto ottico di sinistra viene resecato, si perderà la
visione dei campi visivi destri di entrambe gli occhi (perdita dell’emicampo visivo destro). Se il
chiasma ottico viene diviso nel punto mediale, verranno danneggiate le fibre che si incrociano
(perdita delle visioni periferiche destra e sinistra).
Circa il 10% delle cellule gangliari nella retina proiettano ad una parte del tetto del
mesencefalo chiamata collicolo superiore. Nel collicolo superiore un gruppo di neuroni
comanda i movimenti degli occhi e della testa eseguiti per portare sulla fovea l’immagine di
questo punto nello spazio.
INSERTO: Davide e Golia.
La grandezza del corpo è regolata dall’ormone della crescita da parte del lobo anteriore della
ghiandola pituitaria che talvolta diventa ipertrofico e produce una quantità eccessiva di
ormone portando a dimensioni eccessive del corpo (giganti pituitari). L’ipertrofia pituitaria crea
anche problemi alla visione normale. Le fibre del nervo ottico provenienti dalle emiretine nasali
si incrociano nel nervo ottico premendo sul peduncolo della ghiandola pituitaria. L’aumento di
questa ghiandola comprime le fibre di decussazione provocando la perdita della vista periferica
chiamata emianopsia bitemporale (visione a tunnel).
Probabilmente Davide riuscì ad atterrare Golia , perchè, raggiunta linea di battaglia, non era in
grado di vederlo.
IL NUCLEO GENICOLATO LATERALE.
I nuclei genicolati destro e sinistro, localizzati nel talamo dorsale, sono i principali bersagli dei
due tratti ottici e le vie principali verso la corteccia visiva (percezione visiva cosciente).
La suddivisione dei neuroni del nucleo genicolato laterale in vari strati suggerisce che in questo
nucleo talamico diversi tipi di informazioni vengono tenuti separati. Gli strati ventrali 1 e 2
contengono neuroni di grosse dimensioni (strati magnocellulari del NGL), mentre gli strati
dorsali 3, 4, 5 e 6 contengono cellule di minori dimensioni (strati parvocellulari del NGL).
L’ANATOMIA DELLA CORTECCIA STRIATA.
Il nucleo genicolato laterale ha un singolo bersaglio principale: proietta i suoi assoni alla
corteccia visiva primaria (area di Brodmann 17), localizzata nel lobo occipitale del cervello e
sulla superficie mediale dell’emisfero, circondando la scissura calcarina. La corteccia visiva
primaria viene anche chiamata V1 o corteccia striata.
La proiezione che dalla retina si estende fino al NGL e a V1, è un esempio di organizzazione
retinotopica, ovvero, le cellule che nella retina sono spazialmente vicine, inviano informazioni
a zone limitrofe delle loro strutture bersaglio, in questo caso il NGL e la corteccia striata. La
percezione è comunque basata sull’interpretazione da parte del cervello.
OLTRE LA CORTECCIA STRIATA.
La corteccia striata è chiamata area visiva uno (V1) perchè è la prima area corticale a ricevere
informazioni dal NGL. Esistono molte altre aree sulla superficie corticale che possono venire
ricondotte a due flussi di elaborazione visiva, uno che si allunga dorsalmente dalla corteccia
striata verso il lobo parietale, detto via dorsale, implicata nell’analisi del movimento e del
controllo visivo dell’azione, e l’altro, che che si proietta ventralmente verso il lobo temporale,
detto via ventrale, coinvolta nella percezione del mondo visivo e nel riconoscimento di oggetti.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
La via extrastriata è comunque determinata da input di particolari vie in V1 piuttosto che una
loro estensione.
La via dorsale (dove).
Sembra esserci una progressione di aree nelle quali si sviluppa una rappresentazione visiva via
via più complessa o specializzata. Dall’area V1, l’informazione proietta in aree chiamate V2 e
V3.
- area MT o V5, dove ha luogo una elaborazione specializzata dell’informazione relativa
al movimento degli oggetti; i neuroni sono selettivi per diversi tipi di movimento, come
lo spostamento improvviso di punti luminosi che non sono stimoli ottimali per le
cellule in altre aree.
- area MST,ci sono cellule selettive per i movimenti lineari, movimenti radiali e
movimenti circolari.
via dorsale: V1 V2 V3 V5 (MT) MST
La via ventrale (cosa)
Parallelamente alla via dorsale, una progressione di aree, a partire dalla V1, V2, V3 che corrono
ventralmente verso il lobo temporale, sembra essere specializzata per l’analisi di attributi visivi,
diversi dal movimento.
- area V4, sembra essere importante per la percezione sia della forma che del colore; si
presume che danni a quest’area siano associabili all’acromatopsia caratterizzata da
perdita completa o parziale nella visione dei colori nonostante sia integra la
funzionalità di coni e area V1.
- area IT, risponde molto intensamente a immagini di facce, infatti, una lesione alla
corteccia extrastriata sembra implicata nella sindrome chiamata prosopagnosia,
caratterizzata dalla difficoltà a riconoscere le facce pur con le altre funzioni visive
normali.
via ventrale: V1 V2 V3 V4 IT
14. IL CONTROLLO CEREBRALE DEL MOVIMENTO.
INTRODUZIONE.
Il sistema motorio centrale è strutturato in una gerarchia divisa in tre livelli. Il livello alto
comprende le aree della corteccia associativa e i gangli della base e riguarda la capacità del
cervello di produrre strategie motorie (scopo del movimento). Il livello intermedio, che
comprende la corteccia motrice e il cervelletto, riguarda la tattica, cioè le sequenze spazio-
temporali delle contrazioni muscolari per giungere in modo accurato e omogeneo allo scopo. Il
livello basso, costituito dal tronco dell’encefalo e dal midollo spinale, riguarda l’esecuzione
motoria, cioè l’attivazione di gruppi di motoneuroni ed interneuroni che generano il
movimento diretto allo scopo e permettono ogni aggiustamento della postura corporea.
LA PIANIFICAZIONE DEL MOVIMENTO DA PARTE DELLA CORTECCIA CEREBRALE.
La corteccia motrice è una regione del lobo frontale costituita dall’area 4 (corteccia motrice
primaria M1), che giace in posizione anteriore rispetto il solco centrale del giro precentrale e
dall’area 6 (movimenti volontari specializzati), posta anteriormente all’area 4 e divisa in area
premotoria (APM) importante nella selezione di quale movimento compiere e area motoria
supplementare (AMS) importante nel coordinamento di entrambe le parti del corpo.
L’area 6 e l’area 4 contribuiscono alla maggior parte degli assoni che formano il tratto corticale
discendente.
La corteccia parietale posteriore è una regione del lobo parietale costituita dall’area 5 che
giace in posizione caudale rispetto le aree corticali somatosensoriali 1, 2, 3, dalle quali riceve
gli input, e dall’area 7, caudale all’area 5, che riceve informazioni dalle aree visive corticali di
ordine superiore come la MT.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
L’aprassia indica l’incapacità selettiva di compiere atti motori complessi (semplici si).
I GANGLI DELLA BASE.
L’input subcorticale che viene inviato all’area 6 proviene dal nucleo ventrale laterale (VL), un
nucleo del talamo dorsale, una cui parte (VLo), viene stimolata dai gangli della base posizionati
in profondità nel telencefalo. Questi sono a loro volta, bersaglio della corteccia cerebrale
frontale, prefrontale e parietale.
L’anatomia dei gangli della base. I gangli della base sono costituiti dallo striato (nucleo
caudato e putamen), dal globo pallido e dal nucleo subtalamico ai quali si aggiunge la
substantia nigra del mesencefalo connessa reciprocamente con i gangli.
Il circuito motorio. La via diretta, il circuito (loop) motorio attraverso i gangli della base,
comincia con una connessione eccitatoria fra la corteccia e le cellule del putamen. Tramite
sinapsi inibitorie il putamen si connette ai neuroni del globo pallido, i quali si connettono con il
nucleo ventrale laterale attraverso sinapsi inibitorie. La connessione talamo-corticale è una
connessione eccitatoria.
Corteccia Striato Globo pallido VLo Corteccia (AMS)
I disordini neurali dei gangli della base.
L’ipocinesia, una riduzione del movimento è dovuta all’aumento dell’inibizione del talamo da
parte dei gangli della base.
L’ipercinesia, un eccesso di movimento è dovuta alla diminuzione dell’inibizione del talamo da
parte dei gangli della base.
La malattia di Parkinson, riproduce la prima condizione. La base organica è una degenerazione
degli input che dalla substatia nigra vanno allo striato; questi usano dopamina che
generalmente facilita il circuito motorio attivando le cellule del putamen. La diminuzione di
dopamina chiude l’imbuto che fornisce l’attivazione della AMS tramite i gangli della base e del
VLo. Il dopa, precursore della dopamina, attraversa la barriera ematoencefalica e fa aumentare
la sintesi di dopamina nelle cellule della substantia nigra che sono sopravvissute, alleviando
alcuni sintomi ma non il decorso della malattia.
La malattia di Huntington è una sindrome ereditaria e progressiva caratterizzata da
ipercinesia, discinesia (movimenti anormali) e demenza. I pazienti mostrano corea, movimenti
incontrollati e inconsulti e movimenti a scatto di varie parti del corpo. La patologia cerebrale
più evidente è una grave perdita di neuroni del nucleo caudato, del putamen, nel globo pallido
e nella corteccia cerebrale. I sintomi compaiono in età adulta.
Il ballismo è una forma di ipercinesia dovuta a lesione dei gangli della base, caratterizza da
movimenti violenti e incontrollati delle estremità provocati da un’interruzione del flusso
sanguigno in seguito ad apoplessia o ischemia.
L’INIZIO DEL MOVIMENTO DA PARTE DELLA CORTECCIA MOTRICE PRIMARIA.
L’area AMS è fortemente connessa con l’area M1, l’area corticale 4 nel giro precentrale, la
quale possiede delle connessioni sinaptiche molto potenti o forti con i motoneuroni, in grado
di attivarsi ad un livello di stimolazione elettrica più basso rispetto ad altre aree corticali.
L’organizzazione input-output della M1.
La via attraverso la quale la corteccia motrice attiva i motoneuroni periferici, origina nello
strato corticale V, costituita da grandi cellule piramidali (cellule di Betz) che ricevono input
dalle aree corticali adiacenti l’area 4 e dal nucleo ventrale laterale del talamo (VLc) che fa da
relè all’informazione proveniente dal cervelletto.
Aree corticali (6,3,1,2)/VLc strato corticale V (M1) motoneuroni
La codificazione del movimento nella M1.
Singole cellule piramidali, possono guidare l’attività di numerosi gruppi di motoneuroni di un
gruppo di diversi muscoli implicati nel movimento di un arto verso un bersaglio. In M1, si
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
registra un innalzamento dell’attività elettrica neuronale immediatamente prima e durante un
movimento volontario, al fine di codificarne la forza e la direzione.
Gran parte della corteccia è quindi attivata per ogni movimento e ciascuna cellula rappresenta
un “voto” singolo per una particolare direzione. La direzione del movimento, è detereminata
da un conteggio (media) dei voti, registrati da ciascuna cellula facente parte della popolazione
(movimenti oculari).
Le modificazioni della mappa motoria.
Più grande è l’ampiezza della popolazione che rappresenta un tipo di movimento, più preciso è
il controllo del movimento stesso. Dalla lettura della mappa motoria (Homunculus) siamo in
grado di predire che il controllo più preciso riguarda i movimenti manuali e facciali. Le cellule
della M1 possono spostarsi dalla partecipazione a un tipo di movimento ad un’altra in seguito
ad abilità apprese (violinista).
IL CERVELLETTO.
Il cervelletto è una struttura che domina la parte dorsale del cervello. Importante per il
controllo motorio (contrazioni muscolari sincronizzate ed estremamente precise) è diviso in
due emisferi e una regione mediana chiamata verme.
Una volta che il cervelletto ha ricevuto un segnale che implichi l’intenzione di attuare un
movimento, esso invia le istruzioni alla corteccia motrice primaria circa la direzione, la
sincronizzazione e la forza del movimento specifico pianificato. Per i movimenti balistici, tali
istruzioni sono basate completamente sulle previsioni del risultato (movimenti veloci). Tali
previsioni sono basate sull’esperienza passata, ovvero, vengono apprese. Il cervelletto è
dunque molto importante per l’apprendimento motorio e per le successive modificazioni
compensatorie. Una volta acquisite specifiche sequenze motorie (guidare l’auto) non
necessitiamo più di un controllo di tipo cosciente.
Lesioni del cervelletto provocano dei movimenti non coordinati e imprecisi noti come atassia.
L’incapacità di muovere le articolazioni in maniera sequenziale si definisce come disinergia,
caratterizzata da movimenti dismetrici (simili agli effetti dell’etanolo) che non consentono il
raggiungimento del bersaglio.
15. IL CONTROLLO CHIMICO DEL CERVELLO E DEL COMPORTAMENTO.
INTEGRAZIONE (Rosenzweig).
Gli ormoni sono sostanze chimiche secrete nella circolazione sanguigna da parte di cellule
specializzate e trasportate in altre parti del corpo dove agiscono su cellule bersaglio per
produrre effetti fisiologici specifici. Gli organi che producono la maggior parte degli ormoni
sono le:
- ghiandole esocrine (lacrimali, salivari, sudoripare) che secernono i loro prodotti
all’esterno del corpo attraverso dotti;
- ghiandole endocrine, che secernono i loro prodotti all’interno del corpo.
La comunicazione chimica nell’organismo e tra organismi avviene in diverse modalità:
- comunicazione sinaptica, il segnale chimico dopo il rilascio si diffonde provocando un
cambiamento nella polarizzazione della membrana postsinaptica;
- comunicazione autocrina, implica il rilascio o la secrezione di un ormone che
successivamentre agisce sulla stessa cellula che lo rilascia regolandone l’attività;
- comunicazione paracrina, il segnale chimico si diffonde e agisce su cellule bersaglio
adiacenti attraverso lo spazio extracellulare;
- comunicazione endocrina, il segnale chimico è rilasciato nel flusso sanguigno e
raccolto selettivamente dagli organi bersaglio posti anche a grande distanza dal sito di
rilascio;
- attraverso i feromoni, ormoni rilasciati all’esterno del corpo per influenzare altri
individui della stessa specie;
- attraverso gli allomoni, ormoni rilasciati da membri di una specie per influenzare il
comportamento di individui di un’altra specie.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Le cellule neuroendocrine uniscono i meccanismi nervosi a quelli endocrini:
neurone cellula neuroendocrina flusso sanguigno cellula bersaglio
Gli ormoni possono essere classificati in:
- ormoni aminici, composti da un singolo aminoacido.
- ormoni proteici, formati da aminoacidi;
o si legano ai recettori, presenti sulla superficie di membrana delle cellule
bersaglio, causando il rilascio di un secondo messaggero nella cellula
modificandone proteine già esistenti al loro interno;
agiscono velocemente, nell’ordine di secondi o minuti;
- ormoni steroidei, formati da 4 anelli carboniosi condensati, facilmente solubili nei lipidi
e quindi permeabili alle membrane cellulari;
o attraversano la membrana e si legano a specifiche proteine recettrici
all’interno della cellula, quindi il complesso (ormone steroideo+recettore) si
lega al DNA del nucleo influenzando la trascrizione di specifici geni e la
produzione o diminuzione di proteine.
agiscono lentamente, nell’ordine di ore.
La secrezione di ormoni è regolata da meccanismi di controllo a feedback:
- sistema semplice: una ghiandola endocrina rilascia l’ormone che agisce sulla cellula
bersaglio producendo una risposta fisiologica; se l’effetto, in termini di ampiezza e
caratteristiche, è piccolo, l’ormone viene rilasciato ancora;
- sistema complesso I: l’ipotalamo controlla il rilascio di ormoni da parte della ghiandola
endocrina; il feedback coinvolgerà separatamente l’ipotalamo (inibizione) e la
ghiandola endocrina;
- sistema complesso II: l’ipotalamo attraverso il rilascio di ormoni rilascianti, controlla il
rilascio da parte dell’ipofisi di ormoni tropici che a loro volta influenzano il rilascio di
ormoni da parte di una ghiandola endocrina; il feedback arriverà congiuntamente a
ipotalamo e ipofisi anteriore.
Le principali ghiandole endocrine e i loro ormoni:
Ipofisi posteriore (neuroipofisi), contiene due ormoni prodotti nell’ipotalamo:
- ossitocina, provoca le contrazioni uterine e facilita l’espulsione del nascituro, stimola
l’eiezione di latte dalle ghiandole mammarie;
- vasopressina, (ormone antidiuretico ADH) regola il corretto volume e la concentrazione
salina del sangue.
Ipofisi anteriore (adenoipofisi):
- ormone della crescita (GH), influenza la crescita delle cellule e dei tessuti attraverso il
metabolismo proteico in tutto il corpo:
somatocrinina (ipotalamo - stimola) GH corpo intero
somatostatina (ipotalamo - inibisce) GH corpo intero
- ormone tireotropo (TSH), aumenta il rilascio di ormoni tiroidei da parte della tiroide:
TRH (ipotalamo) TSH tiroide
- ormone adrenocorticotropo (ACHT), controlla gli ormoni della corticale surrenale:
CRH (ipotalamo) ACHT > corticale surrenale
- ormone follico-stimolante (FSH), stimola la secrezione di estrogeni e testosterone:
GnRH (ipotalamo) FSH gonadi
- ormone luteinizzante (LH), simola l’ovulazione e la produzione di testosterone:
GnRH (ipotalamo) FSH gonadi
- prolattina (PRL), stimola lo sviluppo della ghiandola mammaria:
fattore inibitorio (PIF) PRL ghiandole mammarie
Surrenale corticale, la parte esterna delle ghiandole poste all’apice dei reni, produce e rilascia
ormoni steroidei definiti adrenocorticoidi:
- glucocorticoidi (es. cortisolo), hanno effetto sul metabolismo di carboidrati e glucosio,
influenzano l’appetito e l’attività muscolare. Ad alte concentrazioni possono avere un
effetto anti-infiammatorio inibendo il gonfiore attorno a ferite e infezioni, producendo
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
una momentanea diminuzione delle risposte ai danni tissutali. Alti livelli di
corticosteroidi possono anche uccidere le cellule nervose.
- mineralcorticoidi, hanno effetto sulla concentrazione ionica in alcuni tessuti,
specialmente i reni (es. aldosterone: aumenta la ritenzione di sodio da parte dei reni e
di conseguenza riduce la produzione di urina).
- ormoni sessuali, simili a quelli prodotti nelle gonadi (es. androstenedione: mantiene la
caratteristica distribuzione di pelo nel corpo maschile e femminile).
Surrenale midollare, la parte interna delle ghiandole poste all’apice dei reni, rilascia ormoni
amminici:
- adrenalina;
- noradrenalina;
Tiroide, si trova al di sotto dell’apparato vocale, nella gola; secerne ormoni che regolano la
crescita e il metabolismo ed è l’unica ghiandola in grado di immagazzinare grandi quantitativi
di ormoni (riserva per 100 giorni):
- calcitronina, stimola il deposito di calcio nelle ossa;
- tiroxina e triiodotirosina (ormoni tiroidei):
pur essendo ammine, si comportano come gli steroidi nella regolazione
dell’espressione genica. Sono le uniche sostanze prodotte dal corpo che contengono
iodio. Nel caso di precoce insufficienza tiroidea viene pregiudicata la crescita corporea,
facciale ecerebrale (cretinismo).
Gonadi, maschili (testicoli) e femminili (ovaie) producono ormoni e gameti (spermatozoi e
uova) che derivano dal colesterolo. I progestinici sintetizzano gli androgeni che a loro volta
sintetizzano gli estrogeni. I due sessi si differenziano solo per le proporzioni di questi steroidi.
- androgeni, sono ormoni maschili (es. testosterone) regolati da ipotalamo e ipofisi:
GnRH gonadotropina (ipotalamo) LH (adenoipofisi) testosterone
- estrogeni e progestinici, sono ormoni femminili regolati da ipotalamo e ipofisi:
GnRH (ipotalamo) FSH (adenoipofisi) estradiolo
GnRH (ipotalamo) LH (adenoipofisi) progesterone
Epifisi (ghiandola pineale) è una struttura singola, posta al di sopra del tronco encefalico,
sormontata dagli emisferi cerebrali. In risposta all’attività delle cellule del ganglio cervicale
superiore, secerne un ormone amminico:
- melatonina, prodotto quasi esclusivamente di notte. L’ipotalamo risponde alla
prolungata esposizione alla melatonina divenendo molto sensibile all’effetto del
feedback negativo degli steroidi prodotti dalle gonadi, rilasciando meno GnRH
determinando così l’atrofia delle gonadi.
Pancreas, è posto nel retro della cavità addominale. All’interno gruppi di cellule (isole di
Langerhans) secernono ormoni direttamente nel sangue con effetti potenti e contrastanti nella
regolazione del glucosio.
- insulina, viene rilasciata quando il livello di glucosio cresce sopra una certa soglia,
comportando l’aumento dell’assorbimento di glucosio da parte di muscoli e altri tessuti
in modo da ridurre il rilascio di questo zucchero da parte del fegato e la sua presenza
nel sangue.
- glucagone, antagonista rispetto l’insulina, aumenta i livelli di glucosio.
L’azione reciproca dei due ormoni e quindi gli effetti sulla glicemia, sia all’interno del
pancreas che nella via endocrina, contribisce a mantenere il livello di glucosio entro valori
necessari per il giusto funzionamento del cervello e degli altri organi.
LE SECREZIONI IPOTALAMICHE.
L’ipotalamo giace sotto il talamo, lungo le pareti del terzo ventricolo. Esso è connesso
attraverso un peduncolo all’ipofisi, che è sospesa sotto la base del cervello, sopra il palato.
L’ipotalamo integra le risposte viscerali e somatiche conformemente alle necessità del cervello.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Una piccola lesione può provocare sconvolgimenti drammatici e spesso fatali delle funzioni
corporee.
- L’omeostasi, ovvero il mantenimento di un ambiente interno relativamente costante,
è il processo attraverso il quale l’ipotalamo regola meccanismi fisiologici come la
temperatura corporea, la pressione e la presenza, entro certi intervalli, di molte
sostanze chimiche disciolte nel sangue (salinità, acidità, ossigeno, glucosio).
Ciascun lato dell’ipotalamo è suddivso in 3 zone funzionali: laterale, mediale e periventricolare
(posta di fianco al terzo ventricolo). All’interno di quest’ultima zona si trovano neuroni che
svolgono varie funzioni: il controllo dei ritmi circadiani di luce-buio (cellule del nucleo
soprachiasmatico che ricevono informazioni dall’innervazione retinica), il controllo del SNA, la
regolazione dell’innervazione simpatica e parasimpatica degli organi viscerali, l’invio di assoni
sino al peduncolo ipofisario (neuroni secretori).
L’ipofisi si configura come la struttura attraverso la quale l’ipotalamo comunica con il corpo e
presenta due lobi controllati in modo differente:
- le più grandi cellule secretrici dell’ipotalamo, i neuroni neurosecretori magnocellulari
inviano i loro assoni giù verso il peduncolo ipofisario e dentro l’ipofisi posteriore
rilasciando due principali neurormoni:
o l’ossitocina, provoca le contrazioni uterine e facilita l’espulsione del nascituro,
stimola l’eiezione di latte dalle ghiandole mammarie;
o la vasopressina (ormone antidiuretico ADH) regola il corretto volume e la
concentrazione salina del sangue. Quando la quantità di acqua del corpo si
riduce, il volume sanguigno diminuisce e la concentrazione di sali aumenta. Il
rilascio di vasopressina agisce sui reni portando ad una ritenzione idrica e
riducendo la produzione di urina.
- l’ipofisi anteriore è sotto il controllo di cellule della zona periventricolare
dell’ipotalamo; i neuroni neurosecretori parvocellulari, non inviano i loro assoni
all’ipofisi ma comunicano con questa, attraverso il rilascio di ormoni ipofisiotropici nel
flusso sanguigno, in piccoli vasi che discendono lungo il peduncolo ipofisario. Una volta
legati ai recettori posti sulla superficie dell’ipofisi anteriore, attivano la regolazione
ormonale nella circolazione generale.
INSERTO: Lo stress e il cervello.
Lo stress biologico è prodotto dal cervello in risposta a stimoli reali o immaginari. Lo stress
induce il rilascio dell’ormone steroideo cortisolo dalla corticale surrenale. Attraverso
l’attivazione dei recettori, viaggia verso il nucleo cellulare dove stimola la trascrizione genica e
la sintesi proteica. Una conseguenza dell’azione del cortisolo è l’aumento della quantità di Ca 2+
attraverso i canali voltaggio-dipendenti. A breve termine quindi il cortisolo ottimizza la capacità
del cervello di affrontare lo stress. Se però i neuroni diventano saturi di calcio, muoiono
(eccitotossicità). Gli effetti di stress cronico si notano principalmente sull’ippocampo che può
ridurre in modo irreversibile la propria conformazione (fino al 50%).
IL SISTEMA NERVOSO AUTONOMO.
Oltre alla composizione del fluido ormonale, la parte periventricolare deIl’ipotalamo controlla
anche il sistema nervoso autonomo (SNA) che, solitamente svolge funzioni altamente
coordinate, senza l’intervento del controllo cosciente e volontario.
Il SNA, opera in condizioni di tempo e spazio espanse creando un equilibrio tra eccitazione ed
inibizione sinaptica, a differenza del sistema motorio somatico che è in grado di eccitare solo i
suoi bersagli periferici. Il sistema motorio somatico e il SNA costituiscono insieme la totalità
delle efferenze neurali del SNC.
L’unica efferenza del sistema motorio somatico è costituita dai neuroni motori inferiori, i cui
corpi cellulari risiedono nel midollo spinale e nel tronco dell’encefalo (SNC), i quali innervano i
muscoli scheletrici (via monosinaptica). Il SNA, simpatico e parasimpatico, governa ogni altro
tessuto ed organo attraverso la comunicazione tra i neuroni inferiori (pregangliari) del midollo
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
spinale e del tronco dell’encefalo, e i neuroni superiori (postgangliari) i cui corpi cellulari
giaccioni all’esterno del SNC in gruppi di cellule detti gangli autonomi.
- Le divisioni simpatica e parasimpatica operano in parallelo. I loro effetti fisiologici
sono generalmente opposti, quando l’attività di una è alta, l’altra tende ad esser bassa
grazie all’inibizione da parte del SNC della parte non attiva. La divisione simpatica
tende ad essere più attiva durante una crisi reale o percepita, riassumibile in 4 parole:
attacco, fuga, paura, sesso. La divisione parasimpatica facilita vari processi non
riconducibili a questo schema.
Gli assoni pregangliari della divisione simpatica emergono dal terzo mediano del
midollo spinale (segmento toracico e lombare) e inviano i loro assoni attraverso le
radici ventrali in gangli collaterali (nella cavità toracica) o alla sinapsi del ganglio della
catena simpatica (in prossimità della colonna vertebrale). Gli assoni pregangliari della
divisione parasimpatica emergono dal tronco encefalico e dai segmenti inferiori
(sacrali) e i loro assoni viaggiano entro diversi nervi cranici e del midollo spinale.
Le afferenze pregangliari di entrambe le divisioni utilizzano come neurotrasmettitore
l’ACh. L’innervazione postgangliare simpatica utilizza NA, quella parasimpatica sempre
ACh.
- La divisione enterica del SNA è un unico sistema neurale inserito nel rivestimento
dell’esofago, dell’intestino, del pancreas e della cistifellea. È composta da nervi
sensitivi, interneuroni e motoneuroni divisi in due complesse reti, una esterna
chiamata plesso mioenterico (di Auerbach) e una interna chiamata plesso submucoso
(di Meissner). Essa opera con un certo grado di indipendenza in molti processi
fisiologici coinvolti nel trasporto e nella digestione del cibo, dall’orifizio orale a quello
anale.
- Il controllo centrale del SNA. L’ipotalamo integra le diverse informazioni che riceve
sulle condizioni del corpo, anticipa alcune necessità e provvede a un insieme di
efferenze sia neurali che ormonali. Essenziali al controllo autonomo sono le
connessioni periventricolari con il tronco encefalico e con i nuclei del midollo spinale
contenenti i neuroni pregangliari della divisione simpatica e parasimpatica. Il nucleo
del tratto solitario, situato nel bulbo e connesso con l’ipotalamo è un altro centro di
controllo autonomo (alcune funzioni autonome si espletano anche senza la
connessione con strutture sovrastanti, incluso l’ipotalamo).
I neurotrasmettitori pregangliari. Il principale trasmettitore dei neuroni autonomi periferici è
l’acetilcolina (ACh), utilizzato anche dalle giunzioni neuromuscolari scheletriche. Sia i neuroni
pregangliari della divisione simpatica, sia quelli della divisione parasimpatica rilasciano ACh, la
quale si lega ai recettori nicotinici AChRn (canali ACh-dipendenti) suscitando un potenziale
postsinaptico eccitatorio (PPSE) che genera un potenziale d’azione nella cellula postgangliare.
L’ACh gangliare è più potente di quello neuromuscolare, esso può attivare anche recettori
muscarinici per l’ACh (AChRm), recettori metabotropici accoppiati alla proteina G in grado di
indurre sia l’apertura che la chiusura dei canali ionici che conducono a PPSE e PPSI molto lenti.
Oltre ad ACh alcuni terminali pregangliari rilasciano piccoli peptidi neuroattivi (NPY, VIP) che
hanno effetti modulatori non portando i neuroni postsinaptici a livello di soglia, ma rendendoli
più reattivi ai potenziali nicotinici in arrivo.
I neurotrasmettitori postgangliari, motoneuroni autonomi che stimolano effettivamente gli
organi bersaglio, utilizzano neurotrasmetitori differenti: rilasciano NA nella divisione simpatica
(diffonde lontano, anche nel sangue) e ACh nella divisione parasimpatica (effetto locale sui
bersagli per mezzo di AChRm).
I farmaci che promuovono l’azione della NA o che inibiscono l’azione muscarinica dell’ACh
sono detti simpaticomimetici (es. l’atropina, agonista degli AChRm, dilata la pupilla). I farmaci
che inibiscono l’azione della NA o promuovono l’azione muscarinica di ACh sono detti
parasimpaticomimetici (es. il propanolo, un antagonista del recettore beta per la NA, rallenta
il battito cardiaco ed abbassa la pressione sanguigna.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
I SISTEMI MODULATORI DIFFUSI DEL CERVELLO.
Messaggi come “mi sto addormentando” o “mi sta venendo sonno”, devono pervenire a
regioni molto ampie del nostro cervello. La diffusione di queste informazioni richiede la
presenza di neuroni dotati di assoni molto estesi e ramificati. Gruppi di questi neuroni si
servono di uno specifico neurotrasmettitore non per portare informazioni dettagliate ma per
modulare vari assembramenti di neuroni postsinaptici così da renderli più o meno eccitabili,
attivi in maniera più o meno sincrona. Esistono diversi sistemi modulatori diffusi che, pur nelle
loro differenze, presentano dei punti comuni:
- Il nucleo dei sistemi è composto da migliaia di neuroni che originano dal SNC, per lo
più dal tronco dell’encefalo;
- ciascun neurone può influenzare fino a 100.000 neuroni postsinaptici diffusi in tutto il
cervello;
- le sinapsi create da questi sistemi sembrano progettate per liberare molecole di
trasmettitore nel fluido extracellulare e non solo nella fessura sinaptica, così da
diffondere su più neuroni.
Il locus coeruleus noradrenergico (sistema noradrenergico).
Oltre ad essere un neurotrasmettitore del SNA periferico, la NA viene utilizzata anche dai
neuroni del piccolo locus coeruleus del ponte. Gli assoni lasciano il locus coeruleus dando
origine a diversi tratti che si aprono a ventaglio per innervare la corteccia cerebrale, il talamo,
l’ipotalamo, il bulbo olfattivo, il cervelletto, il mesencefalo e il midollo spinale.
I neuroni del locus coeruleus sono massimamente attivati da stimoli sensoriali nuovi,
inaspettati e non dolorosi. Poichè la NA rende i neuroni della corteccia cerebrale più reattivi a
stimoli sensoriali salienti, la funzione del locus coeruleus può essere quella di incrementare la
reattività cerebrale e la rapidità di elaborazione delle informazioni delle vie sensoriali e
motorie rendendole più efficienti.
I nuclei del rafe serotoninergici (sistema serotoninergico).
I neuroni contenenti serotonina sono raggruppati nei 9 nuclei del rafe, posizionati su entrambe
i lati della linea mediana del tronco encefalico. I nuclei più caudali, nel bulbo, innervano il
midollo spinale dove modulano i segnali dolorosi, quelli più rostrali, nel ponte e nel
mesencefalo, innervano la maggior parte del cervello e del cervelletto similmente al locus
coeruleus. Anch’essi scaricano più rapidamente durante la veglia e sono implicati nel controllo
dei cicli sonno-veglia, dei diversi stadi del sonno, dell’umore e di alcuni comportamenti
emotivi.
Locus coeruleus e nuclei ndel rafe fanno parte del sistema reticolare ascendente.
La substantia nigra e l’area tegmentale ventrale (sistema dopaminergico).
Solo due gruppi di cellule dopaminergiche hanno le caratteristiche dei sistemi modulatori:
- la substatia nigra del mesencefalo che proietta i suoi assoni al nucleo striato (nucleo
caudato e putamen) dove facilitano l’inizio del movimento volontario. La
degenerazione di queste cellule produce il disturbo motorio progressivo del morbo di
Parkinson.
- l’area tegmentale ventrale del mesencefalo, i cui assoni innervano una parte
circoscritta del telencefalo (corteccia frontale e parte del sistema limbico). Questa
proiezione dopaminergica, detta sistema dopaminergico mesocorticolimbico, è
implicata nel sistema di ricompensa che da valore, o rinforza, determinati
comportamenti adattivi.
Il proencefalo basale colinergico e i complessi del tronco encefalico (sistema acetilcolinergico).
L’acetilcolina è presente nel cervello in due sistemi modulatori:
- il complesso del proencefalo basale, formato dal nucleo mediale settale che fornisce
l’innervazione all’ippocampo e dal nucleo basale di Meynart che fornisce
l’innervazione alla corteccia. La loro funzione non è definita ma sembra implicata
nell’apprendimento e nella formazione di ricordi; queste cellule inoltre, sono le prime
a morire nel decorso del morbo di Alzheimer.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
- il complesso pontomesencefalotegmentale (cellule del ponte e del tegmento), agisce
sul talamo dorsale dove, insieme ai sistemi noradrenergici e serotoninergici, regola
l’eccitabilità dei nuclei sensoriali di ritrasmissione.
INSERTO: Siamo quello che mangiamo.
L’influenza del regime dietetico sul cervello è più evidente a livello dei sistemi modulatori
diffusi. La velocità di sintesi della serotonina dipende dalla disponibilità di triptofano nel
cervello che a sua volta dipende dalla quantità di triptofano nel sangue e dall’efficienza del suo
trasporto attraverso la barriera ematoencefalica. Una dieta proteica innalza il contenuto di
triptofano ematico ma innesta una competizione con altri aminoacidi, i cui effetti sono la
riduzione di serotonina cerebrale. Una dieta ad alto contenuto di carboidrati (e proteine)
provoca il rilascio di insulina dal pancreas la quale riduce il livello degli altri aminoacidi rispetto
al triptofano, provocando un aumento di serotonina cerebrale.
Le droghe psicoattive, quei composti che producono “stati mentali alterati” agiscono tutte sul
SNC, la maggior partre di esse interferendo con la trasmissione sinaptica.
- Gli allucinogeni. La struttura chimica dell’acido lisergico dietilamide (LSD) essendo
simile alla serotonina, agisce come un potente agonista a livello dei recettori di
serotonina nelle terminazioni nervose dei nuclei del rafe inibendone la frequenza di
scarica. L’effetto è una riduzione del flusso del sistema modulatorio diffuso
serotoninergico del cervello (caratteristica della fase onirica del sonno).
- Gli stimolanti. I potenti stimolanti del SNC, la cocaina e l’anfetamina, esercitano i loro
effetti sulle sinapsi dei sistemi dopaminergici e noradrenergici. Conferiscono sensazioni
di vigilanza e sicurezza, senso di allegria ed euforia e una diminuzione dell’appetito.
Entrambe sono simpaticomimetiche: aumentano la frequenza cardiaca, la pressione
sanguigna, la dilatazione della pupilla e così via. Sia la cocaina che l’anfetamina
bloccano il riassorbimento delle catecolamine nella fessura sinaptica, prolungano e
intensificano gli effetti di DA e NA liberate. La cocaina agisce sul riassorbimento di DA
in maniera più selettiva rispetto a NA, l’anfetamina blocca il riassorbimento di DA e NA
e stimola la liberazione di DA. Entrambe condividono anche un insidioso aspetto
comportamentale: la forte dipendenza psicologica (assuefazione). Le sensazioni
piacevoli dovute all’uso di queste droghe attiva il sistema dopaminergico
mesocorticolimbico coinvolto nel rinforzo dei comportamenti adattivi.
18. I MECCANISMI CEREBRALI DELLE EMOZIONI.
CHE COS’E’ UN’EMOZIONE?
Sulla base dell’osservazione dell’espressione emotiva, vennero sviluppate teorie relative
all’espressione e all’esperienza emozionale:
- La teoria di James-Lange, sostiene che la sperimentazione di un’emozione avviene in
risposta a cambiamenti fisiologici del nostro corpo (ci sentiamo tristi perchè
piangiamo). I sistemi sensoriali reagiscono a cambiamenti evocati dal cervello, e questa
è la sensazione che costituisce un’emozione. I cambiamenti fisiologici sono l’emozione.
- La teoria di Cannon-Bard, sostiene che l’esperienza emotiva possa verificarsi
indipendentemente dall’espressione emotiva. I sistemi sensoriali evocano risposte del
cervello in funzione dello stimolo emotivo.
- Emozioni inconsce. Recenti studi suggeriscono che gli input sensoriali potrebbero
avere effetti emozionali sul cervello senza che vi sia consapevolezza dello stimolo. Gli
studi consistono nella presentazioni di stimoli aversivi associati ad un leggero shock
elettrico per frazioni di secondo. I soggetti presentavano quindi un’alterazione
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
dell’attività autonoma (aumento conduttanza cutanea). Quando venivano presentate
facce adirate i soggetti presentavano una risposta automatica (aumento della
conduttanza cutanea) pur se inconsapevoli dello stimolo.
Si osservò, da immagini PET, che vi era un’ampia attività localizzata: l’amigdala.
IL CONCETTO DI SISTEMA LIMBICO.
Paul Broca aveva osservato che nella superficie mediale del cervello vi erano alcune aree
diverse dalla corteccia circostante: quelle del giro cingolato e dell’area mediale del lobo
temporale compreso l’ippocampo che Broca chiamò lobo limbico.
James Papez ipotizzò che sulla parete mediale del cervello, esistesse un sistema emozionale
che collegasse la corteccia e l’ipotalamo mediante tratti di fibre più grossi. Nel circuito di
Papez, l’ipotalamo e la neocortecccia sono disposti in modo da potersi influenzare.
Circuito di Papez:
o ippocampo (e fornice)
o ipotalamo (espressione emozionale)
o nuclei anteriori del talamo
o corteccia cingolata (esperienza emozionale) neocorteccia
Per via della loro somoglianza (lobo limbico di Broca e circuito di Papez), il gruppo di strutture
che ipoteticamente governano la percezione e l’espressione delle emozioni prende il nome di
sistema limbico.
Oggi, data la diversità delle emozioni di cui facciamo esperienza di continuo, si pensa entri in
gioco più di un sistema e che alcune strutture implicate nelle emozioni siano anche coinvolte in
altre funzioni.
La sindrome di Kluver-Bucy si verifica in seguito a lobotomia temporale. I soggetti, pur avendo
una buona percezione visiva, non riconoscono gli oggetti se non portandoli alla bocca. Inoltre
esperienza, espressioni di paura e aggressività sono notevolmente ridotte. In aggiunta ai
problemi di riconoscimento visivo, alle tendenze orali e all’ipersessualità, le persone sembrano
avere emozioni “appiattite”.
INSERTO: Phineas Cage.
Un uomo cui una sbarra metallica trapassò il cranio entrando dall’occhio e fuoriuscendo dal
lobo frontale. Incredibilmente resto vivo (e cosciente) e in breve tempo venne dimesso. Anche
se apparentemente normale, la sua personalità era notevolmente mutata: da stimato ed
efficiente capocantiere, persona intelligente ed equilibrata divenne sregolato, irriverente,
intollerante, irrispettoso, volgare, ostinato e inconcludente. La sua mente era cambiata
radicalmente, molto probabilemente a causa dell’esplosione emozionale dovuta alle lesioni ai
lobi frontali.
L’AMIGDALA E I CIRCUITI CEREBRALI ASSOCIATI.
Elemento critico nei circuiti del cervello che elaborano la paura e l’aggressività, sembra essere
l’amigdala, situata nel lobo temporale, sotto la corteccia sul lato mediale. È un complesso di
nuclei divisi in tre gruppi: nuclei basolaterali, nuclei corticomediali e nucleo centrale.
L’amigdala riceve afferenze da una varietà di fonti, in particolare, le informazioni provenienti
dai sistemi sensoriali convergono sui nuclei basolaterali. Le vie principali che collegano
l’amigdala all’ipotalamo sono la via amigdalofuga ventrale e la stria terminale.
L’amigdala e la paura.
In molte specie, lesioni all’amigdala hanno come conseguenze l’appiattimento dell’emozione in
modo analogo alla sindrome di Kluver-Bucy. La rimozione bilaterale dell’amigdala riduce
notevolmente l’aggressività e la paura negli animali. Non c’è però ancora accordo su quali
emozioni possano essere coinvolte. Il sintomo più comunemente associato a lesioni
all’amigdala è una inabilità a riconoscere la paura nelle espressioni facciali.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
- Un circuito nervoso per le paure apprese . Attraverso l’esperienza dolorosa, impariamo
ad evitare certi comportamenti. I ricordi associati alla paura possono formarsi
rapidamente e persistere a lungo. L’amigdala è certamente coinvolta
nell’arricchimento di contenuti emozionali del ricordo probabilmente attraverso
cambiamenti sinaptici in corrispondenza dei nuclei basolaterali.
L’amigdala e l’aggressività.
Esistono diverse ragioni che spingono all’aggressività, ognuna regolata differentemnete dal SN.
Una distinzione può esser fatta tra aggressività predatoria, non associata ad alti livelli della
divisione simpatica e aggressività affettiva, caratterizzata da alti livelli di attività nella divisione
simpatica. L’amigdala risulta coinvolta nel comportamento aggressivo, la sua stimolazione
elettrica produce uno stato di agitazione o aggressività affettiva.
- Un intervento chirurgico per ridurre l’aggressività umana . In casi estremi è possibile
intervenire, attraverso operazione psicochirurgica, alla rimozione di tutta o parte
dell’amigdala (amigdalectomia). Viene incrementata la capacità di concentrazione e
ridotti il comportamento aggressivo, l’iperattività e gli attacchi epilettici.
Componenti neurali dell’aggressività oltre l’amigdala.
L’ipotalamo.
In seguito alla rimozione degli emisferi cerebrali, si notò una reazione di falsa rabbia, ovvero
manifestazioni tipiche dell’ira in situazioni che normalmente non avrebbero dovuto provocarla.
La falsa rabbia si osservava se l’ipotalamo anteriore veniva distrutto insieme alla corteccia ma
non se la lesione si estendeva sino alla metà posteriore dell’ipotalamo. Le deduzioni portarono
a pensare che l’ipotalamo posteriore fosse importante per l’espressione di rabbia o
aggressività e che, normalmente esso venisse inibito dal telencefalo.
L’aggressività affettiva (attacco di panico) veniva osservata stimolando l’ipotalmo mediale
mentre l’aggressività predatoria (attacco silente) stimolando l’ipotalamo laterale.
Il mesencefalo.
Due sono le vie attraverso le quali l’ipotalamo manda segnali che coinvolgono la funzione
autonoma del tronco encefalico (mesencefalo):
- il fascio proencefalico mediale comunica con l’area tegmentale ventrale. Stimolazioni
di quest’area possono suscitare comportamenti tipici dell’aggressività predatoria. La
stimolazione ipotalamica non produce invece aggressività se viene tagliato il fascio
proencefalico mediale anche se il comportamento aggressivo non viene eliminato
interamente. Ciò suggerisce che tale via sia importante quando l’ipotalamo è coinvolto
ma che non sempre viene chiamato in causa.
- il fascicolo longitudinale dorsale comunica con la sostanza grigia periacquedottale. La
stimolazione di quest’area può produrre aggressività affettiva e lesioni qui localizzate
possono sopprimere questo comportamento.
La serotonina e l’aggressività.
I neuroni contenenti serotonina sono localizzati nei nuclei del rafe del tronco encefalico, e
risalgono sino all’ipotalamo e le varie strutture limbiche interessate nelle emozioni.
Ci sono molti sottotipi di recettori per la serotonina, quelli più interessanti sono i recettori
5-HT1A e 5-HT1B presenti in alte concentrazioni proprio nei nuclei del rafe. Molti di questi sono
autorecettori. La loro attivazione inibisce globalmente il rilascio di serotonina, ovvero utilizzano
un sistema a feedback negativo (il rilascio di serotonina attiva i neuroni del rafe che riducono
un ulteriore rilascio).
Gli antagonisti della serotonina aumentano l’agressività, al contrario, gli agonisti dei recettori
5-HT1A e 5-HT1B diminuiscono l’ansia e l’aggressività (esperimento con topini knock-out).
L’assenza di recettori 5-HT1A e 5-HT1B porta invece ad una maggiore ansia ed aggressività. In
particolare, l’assenza dei recettori 5-HT1B, presenti anche nell’amigdala, nella sostanza grigia
periacquedottale e nei gangli della base, porta ad un aumento dell’aggressività solo in
condizioni stressanti.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
19. I RITMI DEL CERVELLO E IL SONNO.
L’ELETTROENCEFALOGRAMMA.
L’elettroencefalogramma (EEG), è una misura indicativa dell’attività generalizzata della
corteccia cerebrale. È utilizzato come ausilio nella diagnosi di particolari condizioni
neurologiche (crisi epilettiche) e scopi di ricerca (studi del sonno).
La registrazione delle onde cerebrali.
Attraverso l’uso di elettrodi accoppiati è possibile misurare, in regioni differenti del cervello,
piccole fluttuazioni di voltaggio della corrente che scorre nella corteccia durante l’eccitazione
sinaptica dei dendriti di molti neuroni piramidali. Sono necessari migliaia di neuroni attivati
contemporaneamente per generare un segnale EEG abbastanza grande da poter essere
rilevato. L’ampiezza del segnale dipende dalla sincronizzazione dell’attività neurale.
I ritmi EEG.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
I ritmi EEG variano e sono spesso correlati con particolari stati di comportamento (livelli di
attivazione, il sonno, la veglia) e di patologia (accessi o coma). I ritmi sono categorizzati sulla
base dell’intervallo di frequenza entro cui variano:
- ritmi beta (14 Hz), corteccia molto attivata;
- ritmi alfa (8-13 Hz), stati di veglia rilassata;
- ritmi teta (4-7Hz), stati di sonno;
- ritmi delta (1-3 Hz), stato di sonno profondo.
I ritmi ad alta frequenza e bassa ampiezza sono associati a stati di vigilanza e di veglia, i ritmi a
bassa frequenza e alta ampiezza sono associati con gli stati di sonno in cui non si sogna o a
coma.
20. IL LINGUAGGIO.
INTRODUZIONE.
L’elaborazione del cervello tra sistemi sensoriali e motori rappresenta l’essenza del linguaggio,
sistema di comunicazione esclusivo del genere umano.
LA SCOPERTA DELLE AREE CEREBRALI SPECIALIZZATE PER IL LINGUAGGIO.
Molto di quanto conosciamo sull’importanza di certe aree cerebrali deriva dagli studi
sull’afasia, la perdita parziale o completa delle capacità linguistiche conseguente a un danno
cerebrale, senza la perdita delle facoltà cognitive o delle capacità di muovere i muscoli
dell’eloquio.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
Broca si convinse che il linguaggio è controllato solo da un emisfero, quasi sempre il sinistro,
teoria avvalorata dalle indagini con la tecnica di Wada (anestesia di un emisfero). La regione
del lobo frontale sinistro dominante, che Broca ritenne fondamentale per l’articolazione del
linguaggio, prende il nome di area di Broca (parte inferiore area 9).
Un’altra area, situata sulla superficie superiore del lobo temporale, tra la corteccia uditiva e il
giro angolare, prende il nome di area di Wernicke (aree 41-42-22). Lesioni in questa regione
portano a disturbi del linguaggio parlato.
I TIPI DI AFASIA.
La necessità di distinguere diversi tipi di afasia suggerisce che il linguaqggio viene elaborato a
diversi livelli e in diverse aree cerebrali.
L’afasia di Broca (afasia motoria o nonfluente).
I pazienti hanno difficoltà nel parlarte e fanno spesso pause, come per cercare la parola giusta
(questa incapacità è chiamata anomia). È caratterizzata da uno stile telegrafico nel quale si
usano soprattutto parole di contenuto. Nonostante le difficoltà di articolazione del discorso, la
comprensione è in genere abbastanza buona.
L’afasia di Wernicke.
I pazienti presentano un linguaggio parlato scorrevole ma la comprensione è compromessa.
Non si riscontrano problemi nell’uso di parole di contenuto e funzionali, tuttavia il contenuto
non ha alcun senso. Risulta un miscuglio di cose senza senso e di stupidaggini con molti più
errori parafasici (tetti anzichè letti) rispetto all’afasia di Broca. I pazienti semplicemente non
capiscono sia quello che dicono, sia quello che viene detto loro. L’area di Wernicke potrebbe
avere un ruolo fondamentale nel mettere in correlazione i suoni in arrivo con il loro significato.
È quindi un’area di ordine superiore nel riconoscimento dei suoni.
L’afasia e il modello di Wernicke-Geschwind.
I punti chiave del modello sono l’area di Broca, l’area di Wernicke, il fascicolo arcuato (fascio di
assoni che collega queste due aree corticali) e il giro angolare oltre alle aree sensoriali e
motorie specializzate nel ricevere e produrre linguaggio.
Danni all’area di Broca interferiscono con la produzione di un discorso perchè la corteccia
motrice non riceve più segnali corretti e la comprensione è relativamente normale perchè
l’area di Wernicke non viene attivata.
Danni all’area di Wernicke creano grossi problemi di comprensione perchè in quest’area
avviene la trasformazione dei suoni in parole e non ci sono problemi di linguaggio perchè l’area
di Broca riesce ancora a comandare i muscoli preposti ad essa.
Questo modello presenta però errori e semplificazioni: il linguaggio scritto, ad esempio, non
deve essere tradotto in risposte pseudouditive e l’afasia è influenzata da danni alle strutture
subcorticali come il talamo e il nucleo caudato che non sono presenti nel modello.
Ripetizione del linguaggio parlato:
corteccia uditiva A. di Wernicke fascicolo arcuato A. di Broca corteccia motrice
Ripetizione del linguaggio scritto:
corteccia visiva giro angolare A. di Wernicke fascicolo arcuato A. di Broca corteccia motrice
Elaborazione del modello:
parole scritte: parole dette:
prima elaborazione visiva prima elaborazione uditiva
corteccia striata 17 corteccia uditiva primaria 41-42
riconoscimento visivo parole riconoscimento uditivo parole
corteccia extrastrita 18-19 giro angolare/giro temp.sup.ant 39-38
(associazione semantica)
corteccia frontale inferiore 10-45
codifica premotoria
area motoria supplementare 6
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
controllo motorio della parola
corteccia motrice primaria 4
produzione della parola
L’afasia di conduzione. Deriva da lesioni al fascicolo arcuato e ad aree della corteccia parietale
che lasciano intatte, ma disconnesse, le aree di Broca e Wernicke.
L’afasia negli individui bilingui e nella sordità . Alcuni studi hanno evidenziato come il
linguaggio appreso più fluentemente nel corso della vita tende a essere più conservato.
Lesioni all’emisfero sinistro negli individui che usano il linguaggio dei segni sembra causare
deficit linguistici simili a quelli dei pazienti afasici dal punto di vista verbale: pur rimanendo
intatta la capacità di muovere le mani, queste vengono usate in modo scorretto.
L’ELABORAZIONE ASIMMETRICA DEL LINGUAGGIO NEGLI EMISFERI CEREBRALI.
Il linguaggio non è di norma regolato allo stesso modo dai due emisferi. Su pazienti con
cervello diviso, cui sono stati separati chirurgicamente i due emisferi attraverso il taglio del
corpo calloso (la più importante commissura con 200 milioni di assoni) la gran parte della
comunicazione intercerebrale viene perduta.
L’elaborazione del linguaggio negli individui con cervello diviso . I due emisferi generano
conflitti comportamentali apparentemente perchè pensano in due modi differenti.
- Dominanza del linguaggio dell’emisfero sinistro . Anche se i pazienti con cervello diviso
sono normali sotto molti punti di vista c’è un’incredibile asimmetria nella loro capacità
di verbalizzare risposte a domande poste separatamente ai due emisferi. Stimoli che
coinvolgono l’emisfero destro (percezioni da occhio o mano sinistra) non vengono colti
e risultano impossibili da descrivere, come non esistessero.
- Funzioni linguistiche dell’emisfero destro . L’incapacità dell’emisfero destro di
elaborare il linguaggio, non significa che non conosca nulla del linguaggio. In molti casi
può saper scrivere senza riuscire a parlare, percepire figure complesse senza saperlo
comunicare. Percepisce meglio le sfumature del suono.
L’asimmetria anatomica e il linguaggio. Le maggiori differenze si riscontrano sulla superficie
superiore del lobo temporale (piano temporale), nel 65% dei casi più esteso sull’emisfero
sinistro (contro il 10% del destro). Questa asimmetria è riscontrabile anche nel feto non è
quindi imputabile all’esperienza. La prevalenza di destrimani sui mancini (90%), caratteristica
del genere umano, è un’altra asimmetria evidente della specializzazione dell’emisfero sinistro
per i movimenti fini.
GLI STUDI SUL LINGUAGGIO ATTRAVERSO LA STIMOLAZIONE CEREBRALE E LE
NEUROIMMAGINI.
La stimolazione di certe aree del cervello influenza il linguaggio. Questi effetti rientrano in tre
categorie (vocalizzazioni, arresto del discorso e disturbi del linguaggio simili all’afasia) e si
verificano in seguito alla stimolazione di aree dell’emisfero dominante. La prima corrisponde
all’’area di Broca, la seconda si trova in prossimità della scissura silviana sul lobo parietale
posteriore e la terza sul lobo temporale (medio). Gli effetti della stimolazione sono comunque
variabili tra siti corticali adiacenti e tra soggetti diversi. Suggeriscono la specializzazione di aree
come quelle di Broca e Wernicke ma anche il coinvolgimento di altre strutture come il talamo e
il nucleo striato.
22. LA MALATTIA MENTALE.
LA MALATTIA MENTALE E IL CERVELLO.
Salute e malattia rappresentano due punti lungo un continuum di funzioni corporee, e lo
stesso si può dire della salute mentale e della malattia mentale. Il momento in cui un individuo
è dichiarato “malato mentale” è quando ha un disturbo diagnosticato del pensiero, dell’umore
o del comportamento che causa angoscia e disfunzioni.
I DISTURBI D’ANSIA.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
La paura è espressa da una risposta automatica d’attacco e fuga mediata dalla divisione
simpatica del SNA. Molte paure sono innate e specie-specifiche. Una espressione non
appropriata di paura è ciò che caratterizza il disturbo d’ansia.
Gli attacchi di panico sono sentimenti improvvisi d’intenso terrore. Fanno parte dei sintomi
palpitazioni, sudorazione, dolore al torace, vertigini, sensazioni di prurito, gelo o rossore,
avvertendo la paura di impazzire o morire. La condizione psichiatrica di disturbo di panico è
caratterizzata da ricorrenti attacchi di panico senza causa apparente e da un timore persistente
d’avere altri attacchi.
L’agorafobia è caratterizzata da una grave ansia di trovarsi in situazioni nelle quali fuggire può
essere difficile o imbarazzante che conduce all’evitamento delle situazioni percepite come
minacciose.
Il disturbo ossessivo-compulsivo (DOC) è caratterizzato dalla presenza di pensieri e idee
ricorrenti e intrusivi o impulsi percepiti come non appropriati, grotteschi o proibiti (ossessioni).
Questi pensieri sono riconosciuti come estranei e provocano un’ansia considerevole. Le
compulsioni sono comportamenti ripetitivi o atti mentali stereotipati, messi in atto per ridurre
l’ansia associata con le ossessioni.
Le basi biologiche del disturbo d’ansia. La paura è normalmente evocata da uno stimolo
minaccioso e si manifesta in una risposta di stress. Ciò che contraddistingue il disturbo d’ansia
è la comparsa di una risposta inadeguata da stress sia quando lo stimolo non è presente, sia
quando non è immediatamente minaccioso. Risposta da stress:
- comportamento d’evitamento (sostanza grigia);
- aumento della vigilanza e dell’attivazione mentale (sistemi modulatori diffusi);
- attivazione della divisione simpatica del SNA (ipotalamo);
- rilascio di cortisolo dalle ghiandole surrenali (asse ipotalamo-ipofisi-surrenale).
L’ormone cortisolo è rilasciato dalla corteccia surrenale in risposta ad un aumento dei livelli
del’ormone adrenocorticotropo (ACHT) nel sangue. L’ACHT è rilasciato dall’ipofisi anteriore in
risposta all’ormone rilasciante corticotropina (CRH). La CHR è rilasciata nel sangue della
circolazione portale da neuroni parvocellulari (ipotalamo).
Asse ipotalamo-ipofisi-surrenale. I neuroni dell’ipotalamo contenenti CHR sono regolati da
due strutture: l’amigdala e l’ippocampo. L’informazione sensoriale proveniente dal talamo
(informazione sensoriale ascendente) e dalla neocorteccia (informazioni discendenti) giunge
all’amigdala basolaterale dove è analizzata e inviata ai neuroni del nucleo centrale. Quando il
nucleo centrale dell’amigdala diviene attivo da origine alla risposta da stress.
L’asse ipotalamo-ipofisi-surrenale è regolata anche dall’ippocampo. L’ippocampo contiene
numerosi recettori glucocorticoidei che rispondolo al cortisolo rilasciato dalle ghiandole
surrenali in risposta all’attivazione del sistema ipotalamo-ipofisi-surrenale inibendo il rilascio di
CHR, e il successivo rilascio di ACHT e di cortisolo quando il livello in circolo diviene troppo alto
(feedback).
L’esposizione continua a cortisolo (stress cronico) può causare il deperimento e la morte dei
neuroni ippocampali, producendo una risposta da stress sempre più pronunciata e portando
ad un rilascio di cortisolo maggiore e ad un danno ippocampale più vasto. I disturbi d’ansia
sono stati quindi correlati sia ad una iperattività dell’amigdala, che a una diminuita attività
dell’ippocampo oltre che ad una elevata attivazione della corteccia prefrontale.
Il trattamento dei disturbi d’ansia prevede la psicoterapia e la somministrazione di farmaci.
I farmaci che riducono l’ansia, detti ansiolitici, agiscono alterando la trasmissione sinaptica
chimica del cervello; i più importanti sono:
- le benzodiazepine (valium), agiscono sui recettori GABA A selettivi per il cloro. Questo
recettore contiene oltre a siti per il neurotrasmettitore inibitorio GABA anche siti dove
sostanze chimiche possono agire per modulare la funzione del canale. Le
benzodiazepine ( anche l’etanolo dell’alcol) si legano a questi siti e rendono il GABA
più efficace nell’aprire il canale e produrre inibizione. L’azione calmante delle
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
benzodiazepine è dovuta alla soppressione dell’attività dei circuiti cerebrali coinvolti
nella risposta allo stress.
- gli inibitori selettivi per il riassorbimento della serotonina (SSRI), sono ampiamente
utilizzati nel trattamento dei disturbi dell’umore (Prozac), tuttavia sono molto efficaci
anche nel trattamento dei disturbi d’ansia incluso il disturbo ossessivo-compulsivo. Le
azioni della serotonina sono mediate soprattutto da recettori accoppiati alla proteina G
e sono arrestate dal riassorbimento nel terminale assonico. Gli SSRI prolungano
l’azione della serotonina a livello dei recettori inibendone il riassorbimento. A
differenza delle benzodiazepine l’effetto ansiolitico degli SSRI non è immediata
(settimane) ma produce un aumento dei recettori glucocorticoidei nell’ippocampo e
innalzando la risposta di feedback dei neuroni CRH nell’ipotalamo. Un nuovo farmaco
molto promettente ha come bersaglio i recettori CRH, ormone utilizzato dai neuroni
ipotalamici per controllare il rilascio di ACHT da parte dell’ipofisi e come
neurotrasmettitore in alcuni circuiti centrali coinvolti nella risposta da stress.
I DISTURBI AFFETTIVI.
I disordini affettivi o disturbi dell’umore sono caratterizzati da disturbi della sfera emozionale.
La depressione maggiore è il più comune disturbo dell’umore; i sintomi tipici sono una
riduzione dell’umore e una diminuzione dell’interesse o del piacere nelle attività quotidiane
caratterizzati da: perdita o aumento dell’appetito, insonnia o ipersonnia, fatica, sentimento di
preoccupazione e colpa, diminuzione della concentrazione, pensieri ricorrenti di morte.
Il disturbo bipolare è una patologia ricorrente dell’umore e consiste in episodi ripetuti di
mania e depressione (disturbo maniaco-depressivo). Mania è un periodo limitato di umore
anormale, elevato, espansivo o irritabile caratterizzato da: eccessiva autostima o grandiosità,
ridotta necessità di sonno, aumento dell’eloquio, fuga delle idee, distraibilità, aumento
dell’attività diretta a un obiettivo, ridotta capacità di giudizio.
Le basi biologiche dei disturbi affettivi.
- l’ipotesi delle monoamine, indica la depressione come conseguenza di un deficit dei
sistemi modulatori diffusi noradrenergico e serotoninergico. Nasce dall’osservazione
dell’effetto di alcuni farmaci sui sistemi modulatori diffusi. La reserpina introdotta per
controllare la pressione sanguigna causava depressione in molti pazienti esaurendo le
catecolamine e la serotonina a livello centrale e interferendo con il loro
immagazzinamento nelle vescicole sinaptiche. Altri farmaci usati per il trattamento
della tubercolosi inibivano la monoaminossidasi (MAO), l’enzima che distrugge le
catecolamine e la serotonina. L’imipramina introdotto come antidepressivo, inibisce il
riassorbimento della serotonina e della noradrenalina rilasciate aumentandone
l’azione nella fessura sinaptica.
- l’ipotesi della diatesi da stress, indica l’ereditarietà e la predisposizione genetica alla
malattia (diatesi) come fattori determinanti i disturbi dell’umore. Nella depressione
maggiore, a causa della distruzione della funzionalità dell’ippocampo (inibizione
retroattiva), vi è una iperattività dell’asse ipotalamo-ipofisi-surrenale, i livelli di
cortisolo nel sangue sono elevati come la concentrazione di CRH nel fluido
cerebrospinale.
Il trattamento dei disturbi affettivi, prevede diverse terapie efficaci:
- la terapia elettroconvulsiva (ETC), utilizza la stimolazione elettrica localizzata del lobo
temporale, la quale scatena scariche epilettiche nel cervello nella regione
ippocampale. Viene utilizzata in forme gravi di depressione con alto rischio suicidario.
- la psicoterapia, efficace nei casi di depressione lieve o moderata.
- i farmaci antidepressivi, più popolari sono i triciclici come l’imipramina che blocca il
riassorbimento sia della noradrenalina che della serotonina da parte dei trasportatori,
gli SSRI come la fluoxetina che agisce sui terminali serotoninergici, gli inibitori del
riassorbimento della noradrenalina come la reboxetina, gli inibitori delle MAO come la
fenelzina che riduce il degrado enzimatico della serotonina e della noradrenalina. Tutti,
innalzano il livello dei neurotrasmettirori monoaminici nel cervello agendo
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
lentamente. È stato inoltre dimostrato che il trattamento prolungato con SSRI
incrementa la neurogenesi la proliferazione di nuovi neuroni nell’ippocampo.
- il litio, è altamente efficace nel ristabilire l’umore nei pazienti con disturbo bipolare,
perchè impedisce alle manie di ripresentarsi e di prevenire episodi di depressione. Il
litio influenza la risposta dei neuroni in molti modi: in soluzione passa liberamente
attraverso i canali del sodio. All’interno del neurone previene il normale ricambio di
fosfatidilinositolo (PIP2) un precursore della molecola di un secondo messaggero
accoppiato alla proteina G. Il litio interferisce anche con l’azione dell’adenilato-ciclasi
essenziale per la generazione del secondo messaggero AMPc, e la chinasi della sintesi
del glicogeno, importante per il metabolismo energetico della cellula. Come altri
antidepressivi il litio richiede un uso a lungo termine.
LA SCHIZOFRENIA.
La schizofrenia è caratterizzata da una perdita di contatto con la realtà e da una distruzione del
pensiero, della percezione, dell’umore e del movimento. Tipicamente il disturbo si manifesta
durante l’adolescenza o nella prima età adulta e abitualmente persiste per tutta la vita. I
sintomi si dividono in due categorie:
sintomi positivi (pensieri e comportamenti anormali):
- illusioni, allucinazioni, eloquio disorganizzato, comportamento disorganizzato e
caotico.
sintomi negativi (assenza di risposte normalmente presenti):
- espressione ridotta delle emozioni, povertà di linguaggio, difficoltà ad iniziare un
comportamento finalizzato, disturbo di memoria;
Le basi biologiche della schizofrenia.
La comprensione delle basi biologiche della schizofrenia rappresenta una sfida per le
neuroscienze in quanto coinvolge numerosi aspetti che ci contraddistinguono come esseri
umani: il pensiero, la percezione, l’autocontrollo.
- i geni e l’ambiente: alcuni dati sono fortemente a favore di una base genetica del
disturbo, la probabilità di diventare schizofrenici, infatti, diminuisce con il diminuire di
geni condivisi con un membro della famiglia con questo disturbo. Fattori ambientali,
infezioni virali durante lo sviluppo fetale e postnatale, malnutrizione, stress ambientali
nel corso della vota sono in grado di esacerbare il disturbo. Gli schizofrenici
presentano spesso ventricoli laterali allargati, difetti della guaina mielinica a livello
della corteccia cerebrale, raggruppamenti anomali di neuroni,
- l’ipotesi dopaminergica: l’associazione della dopamina alla schizofrenia avviene per
due ragioni. La prima: l’anfetamina aumenta la trasmissione a livello delle sinapsi che
utilizzano catecolamine e causano il rilascio di noradrenalina. L’assuefazione alle
anfetamine porta all’aumento del consumo (overdose) con conseguenti episodi
psicotici con sintomi positivi indistinguibili dalla schizofrenia. La seconda: farmaci
neurolettici (antipsicotici) come la clorpromazina, usata inizialmente come
antistaminico, prevengono i sintomi positivi della schizofrenia in quanto potenti
antagonisti dei recettori della dopamina, specialmente del recettore D 2.
- l’ipotesi del glutammato: un’indicazione che la spiegazione dopaminergica non possa
essere la sola deriva dagli effetti della feniciclidina (PCP), introdotta come anestetico e
conosciuta come “polvere degli angeli”, la quale procurava in casi di intossicazione
molti sintomi di schizofrenia sia positiva che negativa. La PCP influenza le sinapsi che
usano glutammato come neurotrasmettitore, agendo come inibitore dei recettori
NMDA diminuendone l’attivazione.
Il trattamento della schizofrenia.
Sfortunatamente i farmaci hanno anche molti effetti collaterali in particolare nell’azione
dell’input dopaminergico allo striato che arriva dalla substantia nigra. I sintomi del blocco dei
recettori della dopamina nello striato assomigliano a quelli della malattia di Parkinson. La
terapia cronica con neurolettici può far emergere una discinesia tardiva, caratterizzata da
movimenti involontari delle labbra e della mascella. Molti effetti collaterali possono essere
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
evitati con l’uso di neurolettici atipici come la clozapina e il risperidone perchè non agiscono
direttamente sui recettori della dopamina dello striato.
24. I SISTEMI DI MEMORIA.
INTRODUZIONE.
Dal nostro primo respiro, gli stimoli sensoriali di cui facciamo esperienza modificano il nostro
cervello ed influenzano il nostro comportamento. Impariamo cose semplici e cose astratte,
alcune facilmente esprimibili con un racconto altre che rappresentano pattern motori
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
profondi. Le lesioni cerebrali, colpiscono in modo diverso i differenti tipi di informazione
memorizzata, suggerendo l’esistenza di più sistemi di memoria.
I TIPI DI MEMORIA E L’AMNESIA.
L’apprendimento è l’acquisizione di nuove informazioni o conoscenze. La memoria è la
ritenzione delle informazioni apprese.
La memoria dichiarativa (esplicita) è la memoria di eventi o fatti, solitamente accessibile per il
recupero conscio, facile da formare e dimenticare.
La memoria non dichiarativa (implicita o procedurale) è la memoria per le abilità, le abitudini e
i comportamenti, non accessibile al ricordo cosciente, si forma attraverso la ripetizione e la
pratica per un periodo lungo ed è più difficile da dimenticare.
I ricordi sono immagazzinati nella memoria a breve termine e sono convertiti selettivamnete in
una forma permanente tramite un processo detto consolidazione mnemonica.
La memoria di lavoro è una forma temporanea di immagazzinamento di informazioni di
limitate capacità e che richiede un ripasso (span 7+/-2).
Determinate patologie e lesioni al cervello, come alcolismo cronico, encefaliti, tumori al
cervello ed ictus, provocano una grave perdita di memoria e/o della capacità di apprendere
che è chiamata amnesia. Se l’amnesia non è accompagnata da altri deficit cognitivi è detta
dissociata. Nell’amnesia retrograda, si ha la perdita della memoria per eventi precedenti al
trauma, nell’amnesia anterograda, si ha invece l’incapacità a formare nuovi ricordi in seguito
al trauma cerebrale. Nell’amnsesia globale transitoria si ha una perdita di memoria retrograda
per eventi precedenti il trauma ed una amnesia anterograda di qualche minuto o giorno (lieve
ischemia).
ALLA RICERCA DELL’ENGRAMMA.
La rappresentazione fisica o localizzazione di un ricordo è detta engramma (traccia mnestica).
Non tutte le aree corticali contribuiscono alla memoria in egual misura, tuttavia le memorie
sono distribuite (deduzioni successive agli studi di Lashley sull’apprendimento di un labirinto
nei ratti, in seguito a grandi dimensioni delle lesioni).
La rappresentazione interna di un oggetto è costituita da tutte le cellule corticali che sono
attivate dallo stimolo. Hebb chiamò questo gruppo di neuroni simultaneamente attivati,
assemblamento cellulare. Se l’attivazione di un assemblamento cellulare persisteva
abbastanza a lungo, vi sarebbe stato un consolidamento per mezzo di una crescita che
rendesse le connessioni reciproche più efficaci. Di conseguenza, se solo una frazione di cellule
dell’assemblamento fosse in seguito attivata da uno stimolo, le connessioni reciproche
potenziate causerebbero l’attivazione dell’intero assemblamento, richiamando l’intera
rappresentazione interna dello stimolo.
Secondo Hebb, se un engramma si basa sulle informazioni provenienti da una sola modalità
sensoriale, deve essere localizzabile nella regione della corteccia che serve a quella modalità.
Alcuni esperimenti dimostrarono che provocando una lesione nell’area IT del lobo temporale
inferiore, viene meno la capacità di eseguire un compito di discriminazione nonostante resti
inalterata la capacità visiva. L’area IT (es. riconoscimento di volti) è pertanto sia un’area visiva
che un’area di immagazzinamento della memoria. La specializzazione (bird watchers) consente
di riconoscere particolari per altri insignificanti. Queste specializzazioni si riflettono
nell’attivazione maggiore della corteccia alla presentazione di stimoli relativi alla
specializzazione. La stessa area corticale può quindi essere alla base di funzioni diverse.
INSERTO: Un modello di memoria distribuito.
Consideriamo un ipotetico SN consistente in tre neuroni sensoriali (input) e tre neuroni
postsinaptici (output). Gli input rappresentano le risposte visive a tre soggetti: Anna, Barbara e
Chiara in relazione a tre cellule output: A, B, C. In un sitema di memoria non distribuito, la
cellula A immagazzina l’immagine di Anna, la cellula B l’immagine di Barbara e la cellula C
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
l’immagine di Chiara con pesi equamente distribuiti. Una volta ripetuta l’esposizione alle
immagini, possiamo individuare quale immagine è stata presentata in base alla cellula output
attivata. In un sistema di memoria distribuita invece, ogni cellula immagazzina le tre immagini
con pesi differenti. La presentazione di un’immagine, attiva pertanto tutte le tre cellule; la
cellula A avrà una risposta maggiore per l’immagine di Anna e così per le altre cellule output.
Quanti più neuroni sono coinvolti in una memoria distribuita, tanto minori saranno le
conseguenze della perdita di una singola cellula.
I LOBI TEMPORALI E LA MEMORIA DICHIARATIVA.
Gli effetti della lobotomia temporale, come abbiamo visto con la sindrome di Kluver-Bucy,
porta ad una perdita del riconoscimento degli oggetti nonostante la prestazione visiva sia
inalterata. Questa problematica è probabilmente legata alla funzione mnemonica del lobo
temporale.
- Un caso di studio: H.M. La lobotomia temporale (lobo temporale mediale inclusa la
corteccia, amigdala sottostante e due terzi dell’ippocampo) in seguito a gravi crisi
epilettiche, ebbe piccoli effetti su percezione, intelligenza e personalità ma provocò
un’amnesia così profonda da impedirgli operazioni basilari. Nello specifico una parziale
amnesia retrograda per gli anni precedenti ed una grave amnesia anterograda con
estrema incapacità a formare nuove memorie dichiarative.
Nei lobi temporali mediali vi sono strutture importanti per il consolidamento della memoria:
l’ippocampo, le aree corticali adiacenti (corteccia entorinale, corteccia peririnale e corteccia
paraippocampale) e le vie che mettono in contatto queste strutture con il resto del cervello.
Una delle vie efferenti più importante dell’ippocampo è il fornice che gira intorno al talamo
prima di terminare nell’ipotalamo.
o aree associative corticali
o aree paraippocampali
o ippocampo fornice talamo/ipotalamo
Il diencefalo e l’elaborazione della memoria.
Lesioni al lobo temporale mediale, in particolare alla corteccia peririnale producono una
profonda amnesia. Al di fuori del lobo temporale una regione fortemente associata all’amnesia
è il diencefalo, in particolare i nuclei anteriore e dorsomediale del talamo e i corpi mammillari
dell’ipotalamo. La maggior parte degli assoni del fornice proietta ai corpi mammillari, questi
proiettano al nucleo anteriore del talamo (metà del circuito di Papez). Il nucleo dorsomediale
del talamo riceve afferenze da strutture del lobo temporale, tra cui l’amigdala e la neocorteccia
inferotemporale e proietta a tutta la corteccia frontale.
fornice corpi mammillari nucleo anteriore del talamo
amigdala/neocorteccia inf-temp nucleo dorsomediale corteccia frontale
- Un caso di studio: N.A. Colpito da un fioretto al talamo dorsomediale che gli procurò
un’amnesia retrograda di circa due anni ed un’amnesia anterograda simile ad H.M.
- La sindrome di Korsakoff si riscontra generalmente nell’alcolismo cronico ed è
caratterizzata da confusione, confabulazione, grave deterioramento della memoria
(amnesia anterograda e retrograda) ed apatia. La deficienza di tiamina porta numerosi
sintomi tra cui movimenti anormali degli occhi, perdita di coordinazione e tremori. Se
non viene trattata entro una certo tempo il deficit di tiamina diviene irreversibile con
ampi danni strutturali al cervello.
Le funzioni mnemoniche dell’ippocampo.
Un importante ruolo dei lobi temporali mediali consiste nell’elaborazione o nel
consolidamento della memoria dichiarativa. Uno stesso stimolo riceve una risposta più ampia
quando è familiare rispetto quando non lo è. L’attività ippocampale potrebbe riflettere il
riconoscimento.
- Gli effetti di lesioni ippocampali nel ratto . Sembra che i ratti apprendano il compito ma
non siano in grado di ricordare quali percorsi sono già stati fatti.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
- La memoria spaziale e le cellule di luogo . L’ippocampo è importante per la memoria
spaziale. I ratti non comprendono il compito e non ricordano la localizzazione della
piattaforma. Le cellule di luogo, in grado di codificare la localizzazione non funzionano.
Se l’ippocampo è particolarmente attivo nei compiti di navigazione spaziale, il nucleo
caudato sembra riflettere la pianificazione del movimento (taxi).
- La memoria spaziale, di lavoro e relazionale . Olton descrisse le conseguenze di lesioni
ippocampali come deficit della memoria di lavoro (spiegando le difficoltà dei ratti
nell’esperimento dei raggi).
L’idea di base della memoria relazionale è che le informazioni sensoriali altamente
elaborate giungono all’ippocampo e alla corteccia circostante e che le memorie sono
formate in un modo che lega tutte le cose che accadono in quel momento.
L’interconnessione è dunque la caratteristica chiave dell’immagazzinamento della
memoria dichiarativa.
LO STRIATO E LA MEMORIA PROCEDURALE.
Dei gangli della base fanno parte due nuclei, il nucleo caudato e il putamen che insieme
formano lo striato. Questo svolge un ruolo chiave nel circuito della risposta motoria ricevendo
informazioni in entrata dalla corteccia frontale e parietale e inviando informazioni ai nuclei
talamici e alle aree corticali coinvolte nel movimento. Lo striato è critico per la memoria
procedurale coinvolta nella formazione di abitudini comportamentali.
INTEGRAZIONE (Tipi di memoria).
memoria sensoriale: memoria iconica-visiva
memoria ecoica-acustica
tattile-propriocettiva
dolore
memoria a breve termine: fonologica uditiva-verbale
visuo-spaziale
memoria a lungo termine:
- consapevole esplicita-dichiarativa: memoria episodica
eventi
memoria semantica
parole lessico
simboli
algoritmi
conoscenza
enciclopedia
memoria emotiva
eventi avversi
eventi piacevoli
- inconsapevole implicita-non dichiarativa-procedurale: abilità
motorie
percettive
cognitive
memoria contestuale
memoria polimodale
condizionamento
memoria emotiva
eventi aversivi
traumatica (fobie)
25. I MECCANISMI MOLECOLARI DELL’APPRENDIMENTO E DELLA MEMORIA.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
LA PLASTICITA’ SINAPTICA NELL’IPPOCAMPO.
I meccanismi del PLT nel CA1.
Nell’ippocampo la trasmissione sinaptica eccitatoria viene mediata dai recettori per il
glutammato. Gli ioni Na+ che attraversano la sottoclasse di recettori AMPA per il glutammato
sono responsabili dei PPSE che si verificano nella sinapsi tra due sottocampi dell’ippocampo:
collaterale di Schaffer e cellula piramidale CA1 (sottocampo dell’ippocampo). I neuroni CA1
possiedono anche dei recettori NMDA postsinaptici. L’aumento di Ca 2+ nel neurone
postsinaptico è collegato con l’induzione di un potenziamento a lungo termine (PTL). Se i
recettori NMDA vengono inibiti farmacologicamente o se l’aumento di Ca 2+ viene impedito, il
PTL non si verifica. Si suppone che l’aumento di Ca 2+ attivi due tipi di protein-chinasi: la
protein-chinasi C e la protein-chinasi II calcio-calmodulina (CaMKII).
Il sentiero molecolare che porta ad un potenziamento della sinapsi si ramifica. Una via produce
un aumento dell’efficienza dei recettori AMPA postsinaptici esistenti: la fosforilazione del
recettore AMPA da parte delle protein-chinasi C e CaMKII porta a un cambiamento della
proteina che aumenta la conduttanza ionica del canale. L’altra via porta all’inserimento di un
nuovo recettore AMPA nella membrana.
Anche la struttura sinaptica cambia in conseguenza del PTL. Le spine dendritiche appaiono
germogliare e formare nuovi contatti sinaptici con gli assoni in modo che un singolo assone
possa poi formare sinapsi multiple sullo stesso neurone postsinaptico. Questo aumenta sia la
superficie per la risposta postsinaptica che la probabilità che il potenziale d’azione scateni il
rilascio di glutammato a livello presinaptico.
La depressione a lungo termine (DLT) nel CA1.
L’informazione può essere immagazzinata sia come diminuzione dell’efficacia sinaptica (DLT
cerebellare) che come aumento dell’efficacia sinaptica (PTL ippocampale). Le memorie sono
quindi codificate come specifici pattern di cambiamento sinaptico, con alcune sinapsi che
diventano più forti ed altre più deboli. Sia la DLT che il PLT sono scatenati dall’ingresso di Ca 2+
postsinaptico attraverso il recettore NMDA. La differenza sta nel livello di attivazione del
recettore NMDA. Se debolmente polarizzato, il blocco del Mg 2+ impedisce quasi
completamente l’ingresso di Ca2+, attivando le protein-fosfatasi, enzimi che strappano i gruppi
fosfato, se fortemente depolarizzato, il blocco viene interamente rimosso, attivando le protein-
chinasi.
PLT, DLT e il traffico dei recettori glutamminergici.
I recettori AMPA nella membrana postsinaptica vengono continuamente aggiunti e rimossi
anche in assenza di attività sinaptica. Lo stato di equilibrio viene interrotto dal PLT e dalla DLT,
incrementando o diminuendo la capacità della membrana sinaptica per i recettori AMPA.
PLT, DLT e memoria.
PLT e DLT sono meccanismi di plasticità sinaptica che contribuiscono alla memoria dichiarativa.
I tipi di plasticità sinaptica dipendenti dai recettori NMDA che caratterizzano l’ippocampo sono
presenti anche nella neocorteccia implicati nell’apprendimento e nella memoria.
INSERTO: La plasticità sinaptica.
Se un PPSE è seguito da un potenziale d’azione postsinaptico entro 50msec, la sinapsi si
potenzia. Non succede invece nulla in risposta a un impulso o a un PPSE che si presentano da
soli. Il PLT deriva specificatamente da una precisa temporalizzazione di PPSE ed impulso.
I recettori NMDA hanno un alta affinità per il glutammato così che il neurotrasmettitore
rimane legato al recettore per molte decine di msec. Questo non ha però effetto se la
membrana postsinaptica non viene depolarizzata in maniera molto forte in modo da liberare il
canale dal Mg2+. Quindi, in seguito al presentarsi del potenziale d’azione, il Ca2+ entrerà nella
cellula nella misura in cui il glutammato è ancora legato al recettore, dando via al processo di
PLT.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
LE BASI MOLECOLARI DELLA MEMORIA.
L’attività persistente delle protein-chinasi.
Normalmente l’attività delle chinasi è regolata rigidamente e queste molecole rimangono
“accese” solo in presenza di un secondo messaggero, a volte però, possono diventare
indipendenti. Consideriamo i cambiamenti che si verificano in una protein-chiansi durante un
PLT nell’ippocampo:
- CaMKII e PLT. L’ingresso di Ca2+ nella cellula postsinaptica e l’attivazione della CaMKII
sono essenziali per la formazione di PLT nel CA1. Ricerche hanno dimostrato che la
CaMKII rimane attiva anche dopo che il Ca 2+ è ritornato ad un basso livello. La CaMKII
è composta da due subunità, una regolatrice ed una catalitica (unite tra loro e chiuse
in assenza di un secondo messaggero) che mantengono l’enzima nella condizione
“spento”. La normale azione è quella di aprirsi in presenza del secondo messaggero
(Ca2+calmodulina) e di chiudersi una volta che il secondo messaggero viene tolto.
Tuttavia, dopo un PLT la subunità regolatrice non riesce a chiudersi completamente
per l’aggiunta di un gruppo fosfato lasciando la regione catalitica esposta a continua
fosforilazione. La CaMKII è quindi una protein-chinasi autofosforilante. Se l’attivazione
iniziale di CaMKII da parte della Ca 2+calmodulina è sufficientemente forte,
l’autofosforilazione avverrà più velocemente che la defosforilazione e la molecola sarà
“accesa”. L’attività persistente di CaMKII può contribuire al potenziamento sinaptico,
ad esempio, tenedo i recettori postsinaptici AMPA fosforilati.
La sintesi proteica.
Le protein-chinasi con attività persistente, contribuiscono al mantenimento della
modificazione sinaptica per minuti od ore, dopodichè per formare dei ricordi a lungo termine è
necessaria la sintesi di nuove proteine usate per assemblare nuove sinapsi nel periodo di
consolidamento della memoria.
- CREB e memoria. Il primo stadio nella sintesi proteica è la generazione di un mRNA
trascritto da un gene. Questo processo è regolato da fattori di trascrizione nel nucleo.
Uno di questi è una proteina che si lega agli elementi di risposta all’AMPc (CREB). Il
CREB è una proteina che si lega a specifici segmenti di DNA, chiamati elementi di
risposta all’AMPc (CRE) e regola l’espressione dei geni vicini. Ci sono due forme di
CREB: il CREB-2 che reprime l’espressione del gene quando si lega al CRE e il CREB-1
che attiva la trascrizione ma solo quando è fosforilato dalla protein-chinasi (sposta il
CREB-2 e avvia la trascrizione).
La modulazione dell’espressione del gene da parte di CREB offre un meccanismo
molecolare che può controllare la forza della memoria.
- Plasticità strutturale e memoria. Nel caso delle sinapsi che vengono rinforzate dopo
l’apprendimento, sembra che le proteine vengano utilizzate per costruire sinapsi
ex-novo. La sensibilizzazione a lungo termine, ma non quella a breve termine, provoca
un raddoppiamento del numero delle sinapsi formate dal neurone. Un ambiente
“arricchito” può generare un aumento del numero delle sinapsi per neurone nella
corteccia occipitale di circa il 25% (ratti in gabbia stimolante).
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
lOMoARcPSD|6322212
INTEGRAZIONE: definizioni.
- Neurofisiologia: settore delle neuroscienze che studia la fisiologia del SN a livello di
cellule (neuroni) e tessuti e indaga mediante tecniche elettrofisiologiche i circuiti
nervosi di collegamento tra le diverse strutture. Quando l’oggetto di studio è il
comportamento si sovrappone alla psicologia fisiologica.
- Neuropsicologia: settore delle neuroscienze che studia la base neurale delle funzioni
mentali correlando i deficit specifici dei pazienti con le corrispondenti lesioni cerebrali
(metodo anatomo-clinico). Utilizza tecniche non invasive (PET e fMRI) come la
psicofisiologia.
- Neuroscienze: sistema integrato di discipline che ha per oggetto lo studio del cervello e
del SN degli organismi viventi a livello molecolare, biochimico e genetico. Scopo delle
neuroscienze è quello di evidenziare la base biologica delle espressioni mentali e
comportamentali dell’animale e dell’uomo a partire dalle singole cellule nervose.
- Paradigma: modello o schema esplicativo della realtà e di alcuni suoi aspetti. In
psicologia sperimentale si intende un modello sperimentale.
- Psicobiologia (psicologia biologica o psicologia biologica): ampio settore delle scienze
che studia sia le basi biologiche del comportamento sia la relazione tra i processi
fisiologici e quelli psicologici. Le ricerche coinvolgono la sfera umana e animale.
- Psicofisiologia: disciplina che studia la relazione tra comportamento e risposte
fisiologiche. Oggetto di studio è l’essere umano analizzato con tecniche non invasive
che non alterino i processi analizzati. Si usano sensori di superficie oppure si inducono
modificazioni comportamentali tramite stimoli di varia natura.
- Psicologia fisiologica: settore delle neuroscienze che studia le relazioni tra fisiologia e
comportamento mediante tecniche invasive sugli animali. Induce alterazioni
fisiologiche per studiare i cambiamenti comportamentali che ne derivano.
Scaricato da Luca De Zuane (lucadezuane@gmail.com)
Potrebbero piacerti anche
- 129 RassegnaTest IntelligenzaEmotivaDocumento40 pagine129 RassegnaTest IntelligenzaEmotivaGiuseppe Chet MagistraleNessuna valutazione finora
- Appunti Di Storia Della PsicologiaDocumento109 pagineAppunti Di Storia Della PsicologiaMirko Mocavini100% (1)
- Manuale Psicologia DinamicaDocumento296 pagineManuale Psicologia DinamicaSzandorLaveyNessuna valutazione finora
- Psicobiologia e Psicologia FisiologicaDocumento42 paginePsicobiologia e Psicologia FisiologicaErika SpadettoNessuna valutazione finora
- Relazione TirocinioDocumento7 pagineRelazione TirocinioNoemi GaleanoNessuna valutazione finora
- Psicologia GeneraleDocumento40 paginePsicologia GeneraleAlessandra Enea100% (1)
- NeurologiaDocumento50 pagineNeurologiaSalvatore FerraroNessuna valutazione finora
- Psichiatria Storia BreveDocumento5 paginePsichiatria Storia BreveocoxodoNessuna valutazione finora
- Psicologia GeneraleDocumento33 paginePsicologia GeneraleRossella ZumbèNessuna valutazione finora
- Psicologia Delle Relazioni Interpersonali - Slides 1-118Documento118 paginePsicologia Delle Relazioni Interpersonali - Slides 1-118AlysiaNessuna valutazione finora
- La Nuova Psicologia ScientificaDocumento74 pagineLa Nuova Psicologia ScientificaFilippoMetalcøreSorianoNessuna valutazione finora
- Modelli Di Attaccamento Come Strategia Di Regolazione AffettivaDocumento7 pagineModelli Di Attaccamento Come Strategia Di Regolazione AffettivaNeuroscienze.netNessuna valutazione finora
- dsm5 Edizione 5Documento4 paginedsm5 Edizione 5netshidoNessuna valutazione finora
- Psichiatria UniversitàDocumento43 paginePsichiatria UniversitàTimoBollNessuna valutazione finora
- Fisiologia Del ComportamentoDocumento21 pagineFisiologia Del Comportamentoshine91lol0% (1)
- AnamnesiDocumento53 pagineAnamnesilulujolieNessuna valutazione finora
- Simboli MatematicaDocumento9 pagineSimboli MatematicamailkkNessuna valutazione finora
- Simboli MatematicaDocumento9 pagineSimboli MatematicamailkkNessuna valutazione finora
- Psicologia Delle DipendenzeDocumento35 paginePsicologia Delle DipendenzeAnnamaria Spinoglio100% (1)
- Psicopatologia e Ragionamento ClinicoDocumento5 paginePsicopatologia e Ragionamento Clinicobarra_marcoNessuna valutazione finora
- Appunti Psicologia GeneraleDocumento58 pagineAppunti Psicologia GeneraleStefano AlfonsoNessuna valutazione finora
- Psicologia Sociale Dei GruppiDocumento399 paginePsicologia Sociale Dei Gruppigigibigai100% (1)
- Tesina Corso OpiDocumento10 pagineTesina Corso OpiLuisa Di LorenzoNessuna valutazione finora
- PsicobiologiaDocumento141 paginePsicobiologiaFrancesca PalmaNessuna valutazione finora
- Neopsiche 5Documento72 pagineNeopsiche 5ilariaNessuna valutazione finora
- NEUROANATOMIADocumento172 pagineNEUROANATOMIAFrancesco LanzaNessuna valutazione finora
- Parte 4 L'Approccio Sistemico Relazionale La Psicologia Dei Gruppi e La Leadership Nelle Professioni Di AiutoDocumento19 pagineParte 4 L'Approccio Sistemico Relazionale La Psicologia Dei Gruppi e La Leadership Nelle Professioni Di Aiutolulujolie100% (2)
- Eric Berne - Ciao... e Poi?Documento5 pagineEric Berne - Ciao... e Poi?Metaforum0% (1)
- La dopamina nel nucleo accumbens: la cocaina, la motivazione e la sensazione di piacere: la cocaina, la motivazione e la sensazione di piacereDa EverandLa dopamina nel nucleo accumbens: la cocaina, la motivazione e la sensazione di piacere: la cocaina, la motivazione e la sensazione di piacereNessuna valutazione finora
- Fondamenti NeuroscienzeDocumento60 pagineFondamenti NeuroscienzeSimone MontuoriNessuna valutazione finora
- NeuroscienzeDocumento14 pagineNeuroscienzePaola GiannottiNessuna valutazione finora
- 8 CervellettoDocumento44 pagine8 CervellettoMoussa LandryNessuna valutazione finora
- Riassunto Neuropsicologia Dei Lobi FrontaliDocumento22 pagineRiassunto Neuropsicologia Dei Lobi FrontaliDavide SaggeseStyleNessuna valutazione finora
- Appunti Di PsicofarmacologiaDocumento211 pagineAppunti Di PsicofarmacologiaAndrea CianettiNessuna valutazione finora
- Libro PsicoterapiaDocumento183 pagineLibro PsicoterapiaNelida Puma RamosNessuna valutazione finora
- Elementi Di Psicologia GeneraleDocumento1 paginaElementi Di Psicologia GeneraleButnarasu Andreea-petronela0% (1)
- Chimica Del CervelloDocumento4 pagineChimica Del CervelloexploroNessuna valutazione finora
- Riassunto Manuale Di Psichiatria Gilberti, Rossi 2005Documento13 pagineRiassunto Manuale Di Psichiatria Gilberti, Rossi 2005Walter PolitoNessuna valutazione finora
- La Teoria Della Mente Secondo I Modelli Cognitivista e Cost Rut Ti VistaDocumento4 pagineLa Teoria Della Mente Secondo I Modelli Cognitivista e Cost Rut Ti VistaSILVIANessuna valutazione finora
- Tecnica Del ColloquioDocumento4 pagineTecnica Del ColloquioRosencranzNessuna valutazione finora
- Psicologia Dell'Handicap RiassuntiDocumento36 paginePsicologia Dell'Handicap RiassuntiRoberta RossiNessuna valutazione finora
- Gratificazione e Dipendenza Sostanze D'abusoDocumento35 pagineGratificazione e Dipendenza Sostanze D'abusoFrancesco PaleseNessuna valutazione finora
- LibroDocumento69 pagineLibroMarcoNessuna valutazione finora
- Tesina Psicologia Del LavoroDocumento25 pagineTesina Psicologia Del LavoroFrancesca PiazzaiNessuna valutazione finora
- LelliDocumento42 pagineLelliagilulfo123Nessuna valutazione finora
- La scuola al tempo del covid: Tra spazio di esperienza ed orizzonte d’attesaDa EverandLa scuola al tempo del covid: Tra spazio di esperienza ed orizzonte d’attesaNessuna valutazione finora
- Presentazione Istituto Psicologia AnalogicaDocumento19 paginePresentazione Istituto Psicologia AnalogicaRuth FoffNessuna valutazione finora
- (SCARICA) Il Secondo Cervello PDFDocumento1 pagina(SCARICA) Il Secondo Cervello PDFramziNessuna valutazione finora
- UmiltàDocumento6 pagineUmiltàCecix Masselli100% (1)
- Lezione Mente CorpoDocumento21 pagineLezione Mente CorpoNunzio Luca BufardeciNessuna valutazione finora
- Psicometria 2 - Psicologia - Lezioni CavalleroDocumento111 paginePsicometria 2 - Psicologia - Lezioni CavalleroEmanuele CasaleNessuna valutazione finora
- Riconoscere e curare l'ansia e il panico - Collana di Psichiatria Divulgativa Vol. IIIDa EverandRiconoscere e curare l'ansia e il panico - Collana di Psichiatria Divulgativa Vol. IIINessuna valutazione finora
- Training AutogenoDocumento10 pagineTraining AutogenoAcontresens IvreNessuna valutazione finora
- Il Linguaggio - Psicologia GeneraleDocumento92 pagineIl Linguaggio - Psicologia GeneraleAntonio Bonansinga0% (1)
- Lezioni Sbobinate BoveDocumento123 pagineLezioni Sbobinate BoveDan ValiumNessuna valutazione finora
- Le Emozioni & Paul EkmanDocumento3 pagineLe Emozioni & Paul EkmanMassimo DeplanoNessuna valutazione finora
- ManualeDocumento298 pagineManualeElo EloNessuna valutazione finora
- Appunti Psicologia SocialeDocumento11 pagineAppunti Psicologia SocialelulujolieNessuna valutazione finora
- Fisiologia UmanaDocumento254 pagineFisiologia UmanagigioNessuna valutazione finora
- Appunti Lezioni Aa 20192020Documento26 pagineAppunti Lezioni Aa 20192020gigioNessuna valutazione finora
- Fondamenti Anatomo Fisiologici Dellattivita PsichicaDocumento29 pagineFondamenti Anatomo Fisiologici Dellattivita PsichicagigioNessuna valutazione finora
- Listino Gla H247Documento48 pagineListino Gla H247gigioNessuna valutazione finora
- Gla 2020 IdealeDocumento20 pagineGla 2020 IdealegigioNessuna valutazione finora
- XceedDocumento5 pagineXceedgigioNessuna valutazione finora
- Cap2 PDFDocumento8 pagineCap2 PDFAlexNessuna valutazione finora
- Cap2 PDFDocumento8 pagineCap2 PDFAlexNessuna valutazione finora
- Scheda1 Esercizi AlessioDocumento15 pagineScheda1 Esercizi AlessiogigioNessuna valutazione finora
- LA SINTESI PROTEICA - Di Nicola, Mirra, Nobile, Strollo, TorluccioDocumento11 pagineLA SINTESI PROTEICA - Di Nicola, Mirra, Nobile, Strollo, TorluccioAlessandra NobileNessuna valutazione finora
- AgentiterapeuticiDocumento46 pagineAgentiterapeuticiapi-3863584Nessuna valutazione finora
- 3° Esercitazione PCRDocumento8 pagine3° Esercitazione PCRYo Yo BroNessuna valutazione finora
- Operone LacDocumento3 pagineOperone LacMaria Giulia CementiNessuna valutazione finora
- BohDocumento2 pagineBohEmanuele SerraNessuna valutazione finora
- Glutine Glutenine 1599Documento1 paginaGlutine Glutenine 1599Daniela AronaNessuna valutazione finora