Il 0% ha trovato utile questo documento (0 voti)
200 visualizzazioni7 pagineIpercapnia
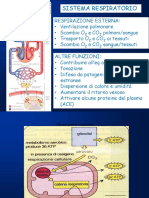
Questo documento tratta dei meccanismi fisiopatologici della ipercapnia in medicina intensiva. Descrive i tre principali meccanismi che possono portare ad ipercapnia: ipoventilazione alveolare, alterazioni nel rapporto ventilazione/perfusione polmonare e aumento della produzione di anidride carbonica. Approfondisce in particolare il primo meccanismo, l'ipoventilazione alveolare, e i metodi per valutarla.
Caricato da
Paride Di StasioCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Il 0% ha trovato utile questo documento (0 voti)
200 visualizzazioni7 pagineIpercapnia
Questo documento tratta dei meccanismi fisiopatologici della ipercapnia in medicina intensiva. Descrive i tre principali meccanismi che possono portare ad ipercapnia: ipoventilazione alveolare, alterazioni nel rapporto ventilazione/perfusione polmonare e aumento della produzione di anidride carbonica. Approfondisce in particolare il primo meccanismo, l'ipoventilazione alveolare, e i metodi per valutarla.
Caricato da
Paride Di StasioCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd