Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Quimica Resumen
Caricato da
Jz Lizandro0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
4 visualizzazioni3 paginesisisisisisi
Titolo originale
quimica_Resumen
Copyright
© © All Rights Reserved
Formati disponibili
PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentosisisisisisi
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
4 visualizzazioni3 pagineQuimica Resumen
Caricato da
Jz Lizandrosisisisisisi
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 3
Espectros
Lizandro Jimenez
Ingeniería Electronica
Tecnológico Nacional Campus Tuxtla Gutierrez Chis.
Química
Docente: MONTOYA MAGAÑA, JOSÉ MANUEL
Tuxtla Gutierrez Chiapas,Mexico 11/Sep/2023
Resumen:
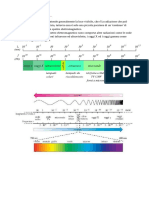
Un espectro es una representación gráfica de cómo la intensidad de la radiación
electromagnética varía con respecto a su frecuencia o longitud de onda. Los espectros
son fundamentales para el estudio de la luz y otros tipos de radiación, y se pueden
clasificar en dos tipos principales: espectro de absorción y espectro de emisión.
Espectro de Absorción:
• El espectro de absorción muestra las frecuencias o longitudes de onda
específicas en las que un material absorbe radiación electromagnética. Cuando
la luz pasa a través de una sustancia, algunos de sus componentes pueden ser
absorbidos por los átomos o moléculas del material.
• Estas absorciones se representan como líneas oscuras o bandas en un espectro
de absorción. Cada sustancia tiene un patrón único de líneas de absorción, lo
que permite la identificación de elementos químicos y compuestos.
• Un ejemplo común es el espectro de absorción de una sustancia gaseosa, como
el espectro de absorción del hidrógeno, que muestra líneas de absorción
características en el espectro visible.
Espectro de Emisión:
• El espectro de emisión muestra las frecuencias o longitudes de onda en las que
un material emite radiación electromagnética cuando se excita. Cuando los
átomos o moléculas de un material se excitan energéticamente, liberan esta
energía en forma de luz.
• Las emisiones se representan como líneas brillantes o bandas en un espectro de
emisión. Al igual que en el espectro de absorción, cada sustancia tiene un patrón
único de líneas de emisión.
• Un ejemplo destacado es el espectro de emisión del gas neón, que produce
líneas brillantes de colores característicos cuando se excita eléctricamente.
En resumen, los espectros de absorción y emisión son herramientas cruciales en la
investigación científica, permitiendo el estudio de la composición química y la
naturaleza de la luz emitida o absorbida por diversas sustancias. Estos espectros
desempeñan un papel fundamental en campos como la astronomía, la química
analítica y la física atómica.
Series Espectrales
Las series espectrales son patrones de líneas de emisión o absorción en un espectro
electromagnético que se producen debido a las transiciones electrónicas en átomos o
iones. Estas transiciones electrónicas ocurren cuando los electrones se mueven entre
niveles de energía discretos dentro de un átomo. Las series espectrales se observan
típicamente en el espectro de emisión de elementos químicos y se utilizan para
identificar elementos y comprender su estructura atómica. Hay tres series espectrales
fundamentales:
Serie de Balmer:
La serie de Balmer se encuentra en el espectro de emisión del hidrógeno y consiste en
líneas de emisión en la región visible del espectro electromagnético. Estas líneas son
resultado de las transiciones de electrones desde niveles de energía superiores a un
nivel de energía n=2.
Las líneas más prominentes de la serie de Balmer se encuentran en el espectro visible
y corresponden a transiciones a partir de n=3, n=4, n=5, etc. hacia n=2. Los colores
característicos de estas líneas son el rojo (n=3 a n=2), el verde (n=4 a n=2), el azul
(n=5 a n=2), y así sucesivamente.
Serie de Lyman:
La serie de Lyman se encuentra en el espectro de emisión del hidrógeno y comprende
líneas de emisión en la región ultravioleta del espectro electromagnético. Estas líneas
son el resultado de las transiciones de electrones desde niveles de energía superiores
a n=1, el nivel más cercano al núcleo.
Las líneas de la serie de Lyman son más energéticas y no son visibles para el ojo
humano, ya que están en el ultravioleta. Son importantes en astronomía para estudiar
objetos celestes como estrellas calientes.
Serie de Paschen:
La serie de Paschen se encuentra en el espectro de emisión del hidrógeno y consiste
en líneas de emisión en la región infrarroja del espectro electromagnético. Estas líneas
son el resultado de las transiciones de electrones desde niveles de energía superiores
a n=3 hacia n=2.
A diferencia de las series de Balmer y Lyman, las líneas de la serie de Paschen no son
visibles a simple vista, pero son importantes en la espectroscopia infrarroja para el
análisis de compuestos químicos.
Estas series espectrales en el hidrógeno son ejemplos destacados, pero otros
elementos también tienen sus propias series espectrales características, lo que permite
la identificación de elementos y el estudio de la estructura atómica. Estas series se
deben a las restricciones cuánticas en las transiciones de electrones entre niveles de
energía específicos dentro de los átomos.
Potrebbero piacerti anche
- Lezione1 - Spettroscopia UV VisDocumento51 pagineLezione1 - Spettroscopia UV VisventilabroNessuna valutazione finora
- MetodiDocumento7 pagineMetodiLuisaCurlacciNessuna valutazione finora
- La Natura Elettromagnetica Della LuceDocumento6 pagineLa Natura Elettromagnetica Della Luceamaru shakurNessuna valutazione finora
- Lezione 80321 Spettrofotometria UV-VIS pt.1Documento28 pagineLezione 80321 Spettrofotometria UV-VIS pt.1robertapittalissNessuna valutazione finora
- Disposizione Degli Elettroni Nell'AtomoDocumento3 pagineDisposizione Degli Elettroni Nell'AtomoAlessioContu100% (1)
- Lo Spettro ElettromagneticoDocumento4 pagineLo Spettro ElettromagneticoGabriele VisentinNessuna valutazione finora
- Spettroscopia: Radiazione ElettromagneticaDocumento9 pagineSpettroscopia: Radiazione ElettromagneticaFilomena LongobardiNessuna valutazione finora
- Dispensa Illuminotecnica 13 14Documento95 pagineDispensa Illuminotecnica 13 14Claudio CiavattaNessuna valutazione finora
- Lezione 3 SB22Documento71 pagineLezione 3 SB22Martina PorcuNessuna valutazione finora
- AEM Capitolo8 0708Documento21 pagineAEM Capitolo8 0708TrinchettoNessuna valutazione finora
- Colegio de Bachilleres Plantel 16 Tlahuac "Manuel Chavarria Chavarria"Documento14 pagineColegio de Bachilleres Plantel 16 Tlahuac "Manuel Chavarria Chavarria"Miriam JNNessuna valutazione finora
- Metodo RadiograficoDocumento59 pagineMetodo RadiograficodavidemolNessuna valutazione finora
- Spettroscopia AADocumento25 pagineSpettroscopia AAMatteo TreviNessuna valutazione finora
- 04 La Struttura AtomicaDocumento63 pagine04 La Struttura Atomicapb9kft9rwtNessuna valutazione finora
- Onde Elettromagnetiche PDFDocumento7 pagineOnde Elettromagnetiche PDFOsteofisioNessuna valutazione finora
- La Spettroscopia Di FotoemissioneDocumento5 pagineLa Spettroscopia Di FotoemissioneAlessandro Axl BellapiantaNessuna valutazione finora
- La Struttura Dell'AtomoDocumento58 pagineLa Struttura Dell'AtomoSabrina SabatoNessuna valutazione finora
- ANATOMIADocumento52 pagineANATOMIAliaNessuna valutazione finora
- AEM Capitolo10 0708Documento17 pagineAEM Capitolo10 0708TrinchettoNessuna valutazione finora
- Fenomeni OtticiDocumento11 pagineFenomeni OtticiLudovico IraNessuna valutazione finora
- Strumentazione BiomedicaDocumento15 pagineStrumentazione BiomedicaMarco AmatrudaNessuna valutazione finora
- Le Onde Elettromagnetiche PpsDocumento50 pagineLe Onde Elettromagnetiche Ppsyv5dktNessuna valutazione finora
- Lezione 8 LASERDocumento88 pagineLezione 8 LASERANessuna valutazione finora
- Powerpoint Fisica Corpo NeroDocumento13 paginePowerpoint Fisica Corpo Neroalfonso SchettinoNessuna valutazione finora
- Chimica - Capitolo 7 e 9Documento4 pagineChimica - Capitolo 7 e 9giovannidifonzo10Nessuna valutazione finora
- Analisi SpettroscopicaDocumento11 pagineAnalisi SpettroscopicaRobNessuna valutazione finora
- Manuale Patologico OPTONDocumento111 pagineManuale Patologico OPTONGerson De Oliveira0% (1)
- Diagnostica ArteDocumento22 pagineDiagnostica ArteLisa El AawarNessuna valutazione finora
- Metodi Chimico Fisici D'indagine Applicati Ai Sistemi Molecolari e NanostrutturatiDocumento12 pagineMetodi Chimico Fisici D'indagine Applicati Ai Sistemi Molecolari e NanostrutturatinazzaNessuna valutazione finora
- Lucidi RaggixDocumento62 pagineLucidi RaggixSalvatore IgnazziNessuna valutazione finora
- ChimicaDocumento7 pagineChimicaMaria TeresaNessuna valutazione finora
- CALLEGARIDocumento25 pagineCALLEGARIMarco AlfieriNessuna valutazione finora
- Tom Tat Hoa Dai Cuong 1Documento91 pagineTom Tat Hoa Dai Cuong 1Alex TrầnNessuna valutazione finora
- Ripasso FisicaDocumento8 pagineRipasso FisicasimoneNessuna valutazione finora
- Interpretare Gli Spettri IRDocumento23 pagineInterpretare Gli Spettri IRbobasa9655Nessuna valutazione finora
- Lezione 3 - Meccanica Quantistica - Prima ParteDocumento38 pagineLezione 3 - Meccanica Quantistica - Prima ParteRiccardo GroppoNessuna valutazione finora
- Dpi Top SecretDocumento177 pagineDpi Top SecretratsarcomaNessuna valutazione finora
- Materiali Tecnologie Innovativi 3Documento23 pagineMateriali Tecnologie Innovativi 3ChopinerNessuna valutazione finora
- Appunti Caratterizzazione 2014Documento90 pagineAppunti Caratterizzazione 2014LuigiBanaNessuna valutazione finora
- Laserterapia in Medicina 1 PDFDocumento19 pagineLaserterapia in Medicina 1 PDFOsteofisioNessuna valutazione finora
- SpettrosDocumento34 pagineSpettrosfuliggineNessuna valutazione finora
- Determinazione Strutturale Tramite Spettrometria Di MassaDocumento19 pagineDeterminazione Strutturale Tramite Spettrometria Di MassaFrank Burgay0% (1)
- MeccanicaQuantistica 01Documento23 pagineMeccanicaQuantistica 01complex77Nessuna valutazione finora
- ChimicaDocumento6 pagineChimicaLuigiFioreNessuna valutazione finora
- Fisica Delle RadiazioniDocumento14 pagineFisica Delle Radiazioniblablabla25Nessuna valutazione finora
- Tarea FisicaDocumento4 pagineTarea FisicaJuan PabloNessuna valutazione finora
- Onde Elettromagnetiche Ed EinsteinDocumento5 pagineOnde Elettromagnetiche Ed EinsteinGretaNessuna valutazione finora
- La Natura Della Luce e Il Modello Atomico Di BohrDocumento9 pagineLa Natura Della Luce e Il Modello Atomico Di BohrAlessandro Axl Bellapianta100% (1)
- L'atomo QuantisticoDocumento5 pagineL'atomo QuantisticoMartina LiverzaniNessuna valutazione finora
- Meccanica QuantisticaDocumento3 pagineMeccanica QuantisticaIkram LazarNessuna valutazione finora
- 14 - Lm65 - Spettroscopia Raman e FtirDocumento11 pagine14 - Lm65 - Spettroscopia Raman e FtirventilabroNessuna valutazione finora
- EPRDocumento11 pagineEPR88alexiaNessuna valutazione finora
- Brady PPT 22055 c07Documento55 pagineBrady PPT 22055 c07Sofia ArcuriNessuna valutazione finora
- Capitolo 1 - Lo Spettro ElettromagneticoDocumento12 pagineCapitolo 1 - Lo Spettro ElettromagneticoIvoGraziotinNessuna valutazione finora
- Meccanica Quantistica e La Chimica - Chimica InorganicaDocumento2 pagineMeccanica Quantistica e La Chimica - Chimica InorganicaGre VellaniNessuna valutazione finora
- PDF Ago-Dic 2023 Fundaml IRDocumento75 paginePDF Ago-Dic 2023 Fundaml IRDaniel Pascual NZNessuna valutazione finora
- Manuale Valvole E Amplificazione Del SuonoDocumento100 pagineManuale Valvole E Amplificazione Del SuonoGiorgio BattelliNessuna valutazione finora
- Spettroscopia Uv 2Documento13 pagineSpettroscopia Uv 2Ludovico IraNessuna valutazione finora