Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Relazione Fisica
Caricato da
giuvannpasqual0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
3 visualizzazioni4 pagineRelazione fisica 2°anno
Titolo originale
Relazione fisica
Copyright
© © All Rights Reserved
Formati disponibili
DOCX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoRelazione fisica 2°anno
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
3 visualizzazioni4 pagineRelazione Fisica
Caricato da
giuvannpasqualRelazione fisica 2°anno
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 4
Cetraro Edoardo IIE
Relazione di laboratorio di fisica Cap. 14
Il primo principio della termodinamica
Applicazioni del primo principio della termodinamica
Motori a combustione interna
Ciclo Otto
Ciclo Diesel
Il secondo principio della termodinamica
Il primo principio della termodinamica
Il primo principio della termodinamica rappresenta una formulazione del principio di
conservazione dell'energia e afferma che:«L'energia interna di un sistema
termodinamico isolato è costante.»
La sua formula è: ΔU=Q-W
In cui:
Q indica il calore assorbito(J)
W indica il lavoro compiuto(J)
Sottraendo questi valori possiamo ottenere la variazione di energia interna (ΔU) in
(J)
Per spiegare meglio il principio si può far un esempio: Ponendo del gas perfetto in
un cilindro a tenuta stagna, con uno stantuffo che esercita forza al di sopra di esso,
posizionando il cilindro su una fonte di calore, il volume del gas passera da uno stato
A ad uno stato B ed anche la sua energia interna da Ua a Ub e può essere calcolata
con questa formula: ΔU=Ub-Ua ,l’energia interna (U) è la somma delle energie
cinetiche di tutte le (N) molecole che formano un sistema e dall’energia potenziale
associata alle forze intermolecolari. Durante la trasformazione il gas guadagna
l’energia poiché assorbe il calore positivo del fornello e perde energia quando si
compie un lavoro sempre positivo quando si espande sollevando lo stantuffo. Poiché
l’energia si conserva,(ΔU) deve essere uguale al calore assorbito (Q) meno il lavoro
che è stato compiuto(W).ù
Applicazioni del primo principio della termodinamica
Esaminiamo alcune trasformazioni particolari che può subire il sistema
termodinamico più semplice: Una quantità di gas perfetto racchiusa in un cilindro
con pistone
1)Trasformazioni isocòre (volume costante)
Blocchiamo il pistone, in modo che il volume non cambi, e scaldiamo lentamente il
gas. Questa trasformazione nel piano-volume è rappresentata da un segmento
verticale Poiché il pistone è fisso, il gas non compie lavoro (W=0J) ed il primo
principio si semplifica in: ΔU=Q
2)Trasformazioni isoterme(temperatura costante)
Immergiamo il cilindro in una vasca con dell’acqua ad una temperatura voluta, se la
quantità dell’acqua è in sufficiente quantità, la sua capacità termica è così grande
che mantiene invariata la propria temperatura nonostante lo scambio di calore col
gas . mettendo della sabbia sul pistone e togliendola man mano, possiamo ridurre la
pressione del gas. Nel diagramma (p-V) questa trasformazione è rappresentata da
un arco di iperbole,che ha per estremi lo stato iniaziale A e lo stato finale B. Il
lavoro(W) del gas è positivo poiché da A a B il gas si espande. Poiché l’energia
interna (U) è proporzionale alla temperatura assoluta (T),quindi se la variazione di
temperatura è nulla, anche la variazione dell’energia interna(ΔU)è nulla ,ed il primo
principio diventa: 0=Q-W cioè Q=W.
3)Trasformazioni adiabatiche(senza scambi di calore tra il sistema e l’ambiente)
Utilizziamo un thermos che impedisca il passaggio di calore oltre ad un pistone che faccia lo stesso.
Mettiamo della sabbia sul pitone e diminuiamo lentamente la pressione del gas togliendone un po'
alla volta, ed il gas espande. In una trasformazione adiabatica la variazione dell’energia interna de
sistema è opposta al lavoro da esso compiuto, quindi: dato che si ha Q=0J il primo principio
diventa: ΔU=-W
Nel piano p-V un’espansione adiabatica del gas perfetto è rappresentata da una curva
decrescente: quando il volume occupato dal gas aumenta, la sua pressione diminuisce.
Motori a combustione interna
I motori delle automobili sono macchine termiche, che si procurano il calore
necessario al loro funzionamento bruciando il combustibile direttamente dentro i
cilindri. Per questa ragione sono chiamati motori a combustione interna. Esse usano
il calore come vettore energetico per la produzione di lavoro meccanico.
Molte automobili hanno il motore che fu inventato dall’ingegnere tedesco Nikolaus
Otto, e che conosciamo come motore a scoppio o motore a quattro tempi. Quattro,
infatti, sono le fasi di cui si compone il suo ciclo, qui illustrato:
1 Aspirazione: Il pistone si abbassa e aspira la miscela aria-benzina che proviene dal
carburatore.
2Compressione: Dopo che la valvola di aspirazione si è chiusa, il pistone si alza e
comprime la miscela.
3 Scoppio-Espansione: La candela genera la scintilla che fa scoppiare la miscela. Il
gas si espande e spinge il pistone verso il basso.
4 Scarico: La valvola di scarico si apre e la pressione diminuisce. Il pistone sale ed
espelle i gas di combustione.
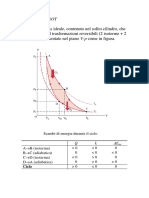
Il tratto AB corrisponde all’aspirazione, durante la
quale il gas si espande alla pressione
atmosferica(costante)
Il tratto BC, è un arco di curva adiabatica, e
rappresenta la compressione, aumentano sia la
pressione che la temperatura del gas.
Il segmento CD, a volume costante, rappresenta
lo scoppio.
La curva DE rappresenta l’espansione ( questa è
la fase utile poiché spinge il pistone e lo accelera.
La spezzata EBA rappresenta lo scarico, una riduzione di pressione a volume
costante(EB), seguita da una riduzione di volume a pressione costante(BA)
Il motore diesel
Inventato dall’ingegnere tedesco Rudolf Diesel, questo è un altro tipo di motore a
scoppio. Al posto del carburatore vi è un iniettore che nebulizza delle minuscole
goccioline di gasolio all’interno della camera di scoppio. Questo motore non
necessita di candele poiché l’accensione della miscela aria-gasolio è provocata dal
suo riscaldamento, che avviene a causa della rapida compressione nel secondo
tempo del cilindro, Il ciclo Diesel è simile a quello di Otto, con l’isocòra CD sostituita
da un’ isòbara.
Il secondo principio della termodinamica
Il secondo principio della termodinamica è uno solo, ovvero che “è impossibile che il
calore passi spontaneamente da un corpo freddo a uno più caldo” ma ci sono più
modi per esprimerlo.
Secondo Lord Kelvin
È impossibile realizzare una trasformazione il cui unico risultato è quello di assorbire
una certa quantità di calore da un’unica sorgente a temperatura uniforme e
trasformarla integralmente in lavoro.
La produzione di lavoro non è l’unico risultato della trasformazione assistiamo anche
all’aumento di volume occupato dal gas modificando così il sistema; per eliminare
questo evento indesiderato bisogna cedere calore a una sorgente fredda. Quindi
una sola sorgente non basta, se vogliamo trasformare il calore in lavoro.
Secondo Rudolf Clausius
È impossibile realizzare una trasformazione il cui unico risultato è quello di far
passare calore da un corpo più freddo a un corpo più caldo. Prendendo come
esempio il frigorifero, esso fa andare il calore al contrario cioè il calore viene spinto
da un corpo più freddo a uno più caldo, nonostante questo il pensiero di Clausius
non viene smentito visto che il frigorifero non produce solo il flusso spontaneo di
calore ma consuma anche energia elettrica.
Si può dimostrare che gli enunciati di Kelvin e di Clausius discendono l’uno dall’altro:
quindi sono equivalenti
Potrebbero piacerti anche
- Risposte Aperte Fisica Tecnica EnzoDocumento85 pagineRisposte Aperte Fisica Tecnica EnzoCorrado MazzottaNessuna valutazione finora
- Cicli CombinatiDocumento30 pagineCicli CombinatiNiccolò Giannotti100% (3)
- Ciclo RankineDocumento36 pagineCiclo RankineSara GioacchiniNessuna valutazione finora
- Il Ciclo FrigoriferoDocumento15 pagineIl Ciclo FrigoriferoscacchiNessuna valutazione finora
- Turbo Compressor IDocumento68 pagineTurbo Compressor IWilliam MoscaNessuna valutazione finora
- Capitolo 9 - CICLO FRIGOR PDFDocumento0 pagineCapitolo 9 - CICLO FRIGOR PDFBrandon BrooksNessuna valutazione finora
- Mulinello Di JouleDocumento5 pagineMulinello Di JouleVevveNessuna valutazione finora
- Composizione e Funzionamento Del Motore Quattro TempiDocumento8 pagineComposizione e Funzionamento Del Motore Quattro TempiCiaoCrossClub DocumentsNessuna valutazione finora
- Termodinamica SintesiDocumento9 pagineTermodinamica SintesiPaola CeresatoNessuna valutazione finora
- Term Odin A MicaDocumento2 pagineTerm Odin A MicaPaola BebaNessuna valutazione finora
- Ciclo Otto DieselDocumento39 pagineCiclo Otto Dieselbianca lavricNessuna valutazione finora
- 3 Evaporatori-ConcentratoriDocumento14 pagine3 Evaporatori-ConcentratoriEdLardo GaleanoNessuna valutazione finora
- Leggi Dei Gas e Princìpi Della TermodinamicaDocumento17 pagineLeggi Dei Gas e Princìpi Della TermodinamicaAmedeo De AmicisNessuna valutazione finora
- Fisica I 19Documento19 pagineFisica I 19AaNessuna valutazione finora
- Adiabatic ADocumento2 pagineAdiabatic AGiovanni PiepoliNessuna valutazione finora
- 07 Lezione 7 Di Motori 28-02-2013Documento19 pagine07 Lezione 7 Di Motori 28-02-2013Hernan MarianiNessuna valutazione finora
- Impianti Turbine A VaporeDocumento41 pagineImpianti Turbine A VaporeantoniomambroNessuna valutazione finora
- La Termodinamica - SlidesDocumento56 pagineLa Termodinamica - SlidesDaniele ColeraNessuna valutazione finora
- 6 Cilindro Oleodinamico PDFDocumento79 pagine6 Cilindro Oleodinamico PDFfabioNessuna valutazione finora
- Ariali 2Documento7 pagineAriali 2Teresa NunziataNessuna valutazione finora
- Capitolo 12Documento3 pagineCapitolo 12smataloneNessuna valutazione finora
- Note Macchina StirlingDocumento6 pagineNote Macchina StirlingMarioNessuna valutazione finora
- Termodinamica 8Documento16 pagineTermodinamica 8Daniel LongoNessuna valutazione finora
- Cicli TermodinamiciDocumento13 pagineCicli TermodinamiciApril SykesNessuna valutazione finora
- Todisco Fisica Terza ProvaDocumento14 pagineTodisco Fisica Terza ProvalucaspunkyNessuna valutazione finora
- C4 CTD 07Documento37 pagineC4 CTD 07Marco Narco TorreNessuna valutazione finora
- 1 TermodDocumento11 pagine1 TermodMarianna SantarcangeloNessuna valutazione finora
- Term Odin A MicaDocumento2 pagineTerm Odin A MicaRosita FarsaciNessuna valutazione finora
- 49815-Cap 9 - Impianti Turbogas PDFDocumento24 pagine49815-Cap 9 - Impianti Turbogas PDFLeonardo GirolamiNessuna valutazione finora
- Secondo Principio PDFDocumento18 pagineSecondo Principio PDFFilippo MulasNessuna valutazione finora
- Cicli Inversi Frigoriferi e Pompe Di CaloreDocumento30 pagineCicli Inversi Frigoriferi e Pompe Di CaloreRiccardo Agnorelli100% (1)
- Prove D'esame TermodinamicaDocumento4 pagineProve D'esame TermodinamicaPasquale S BonsNessuna valutazione finora
- Motori 4 Tempi A Ciclo OttoDocumento5 pagineMotori 4 Tempi A Ciclo OttoDavide LombardoNessuna valutazione finora
- Cilindro Oleodinamico - AmbrogioDocumento53 pagineCilindro Oleodinamico - AmbrogioSantino Di GangiNessuna valutazione finora
- Fis2 PDFDocumento3 pagineFis2 PDFPaolo BartesaghiNessuna valutazione finora
- CompressoriDocumento9 pagineCompressoriMauro VinciNessuna valutazione finora
- TrasFormaZioni TermOdinaMicheDocumento28 pagineTrasFormaZioni TermOdinaMicheMarcoLovatoNessuna valutazione finora
- Esercitazione Di TermodinamicaDocumento8 pagineEsercitazione Di TermodinamicaNicola PaganoNessuna valutazione finora
- App Tgas PDFDocumento34 pagineApp Tgas PDFElena FiermonteNessuna valutazione finora
- Leggi Dei GasDocumento20 pagineLeggi Dei GasAnonymous IaN3qcb8Nessuna valutazione finora
- Formula Rio Sistemi (Turbine A Gas e A Vapore)Documento7 pagineFormula Rio Sistemi (Turbine A Gas e A Vapore)Matteo GnomeoNessuna valutazione finora
- Macchine Ad Assorbimento.Documento8 pagineMacchine Ad Assorbimento.Francesco FNessuna valutazione finora
- Cap 8Documento32 pagineCap 8TrinchettoNessuna valutazione finora
- Secondo Principio Della TermodinamicaDocumento47 pagineSecondo Principio Della Termodinamicasabara1964Nessuna valutazione finora
- Teoria Fisica TecnicaDocumento8 pagineTeoria Fisica TecnicaLeonardo CaverzanNessuna valutazione finora
- Motore Macchina e FrigoriferoDocumento21 pagineMotore Macchina e FrigoriferoGabrieleNessuna valutazione finora
- Termodinamica Secondo PrincipioDocumento16 pagineTermodinamica Secondo PrincipioGiulia EbarcaNessuna valutazione finora
- Appunti Fisica TecnicaDocumento44 pagineAppunti Fisica TecnicaChristian CoppolaNessuna valutazione finora
- 8.cicli InversiDocumento8 pagine8.cicli InversimariaNessuna valutazione finora
- Fisica RiassuntiDocumento25 pagineFisica RiassuntiRaff DlsNessuna valutazione finora
- Term Odin A MicaDocumento24 pagineTerm Odin A Micaa.penna05Nessuna valutazione finora
- 4 - Concentratori o Evaporatori (Scambio Termico 2)Documento22 pagine4 - Concentratori o Evaporatori (Scambio Termico 2)teresaNessuna valutazione finora
- FormularioDocumento53 pagineFormularioalele88Nessuna valutazione finora
- Il Ciclo Diesel Ideale e Quello RealeDocumento4 pagineIl Ciclo Diesel Ideale e Quello RealecapamalataNessuna valutazione finora
- Formulario TermodinamicaDocumento14 pagineFormulario TermodinamicaFederico CupelliniNessuna valutazione finora
- Esercizi di fisica per licei: fluidodinamica e termodinamicaDa EverandEsercizi di fisica per licei: fluidodinamica e termodinamicaNessuna valutazione finora
- Esercizi di fisica: termodinamica e trasmissione del caloreDa EverandEsercizi di fisica: termodinamica e trasmissione del caloreNessuna valutazione finora
- Schema Modello Di RelazioneDocumento2 pagineSchema Modello Di RelazionegiuvannpasqualNessuna valutazione finora
- Lez 08-03-24Documento6 pagineLez 08-03-24giuvannpasqualNessuna valutazione finora
- Lez 08-03-24Documento6 pagineLez 08-03-24giuvannpasqualNessuna valutazione finora
- Modello Per Relazioni A.S. 2022-2023 1Documento6 pagineModello Per Relazioni A.S. 2022-2023 1giuvannpasqualNessuna valutazione finora
- Prove Di Durezza Tecnologie Meccaniche N2Documento7 pagineProve Di Durezza Tecnologie Meccaniche N2giuvannpasqualNessuna valutazione finora
- Cap8 Esercizi RisoltiDocumento32 pagineCap8 Esercizi Risoltiandrea_luca_51Nessuna valutazione finora
- Repeir Pomp Manual - m4pv34-65Documento48 pagineRepeir Pomp Manual - m4pv34-65Dmytro YaniukNessuna valutazione finora
- Esercizi Gas PDFDocumento3 pagineEsercizi Gas PDFdbNessuna valutazione finora
- Precorsi 2014. Fisica. Parte 1Documento107 paginePrecorsi 2014. Fisica. Parte 1alper bahaNessuna valutazione finora
- ViscoelasticitàDocumento30 pagineViscoelasticitàGiuseppe VignolaNessuna valutazione finora
- Scheda - Prodotto - Stone-C1 - It-2022 Innova EnergieDocumento8 pagineScheda - Prodotto - Stone-C1 - It-2022 Innova EnergieAlessandro Luigi AmadoriNessuna valutazione finora