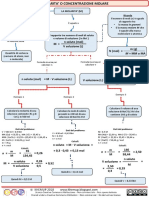
1) Calcolare quanti grammi di carbonato di sodio anidro, Na2CO3, occorrono per preparare 2 litri di una sua soluzione 0,85
N. Calcolare inoltre la sua molarit. Modalit di esecuzione e calcoli : Nei due litri di soluzione da preparare gli eq. di carbonato di sodio devono essere : neq = V x N ; neq = 2 x 0,85 ; neq = 1,70 che corrispondono a:
; g = ne x PM ; z Per questo sale z = 2 per cui i grammi da pesare risultano g = neq x P.E (Na2 CO3 ) g = 1,70 x 106 2 93,28
V = 2L
la soluzione viene preparata sciogliendo il sale in un matraccio da due litri a cui si aggiunge poi acqua sino a riempimento. Calcolo della molarit : ricordiamo che tra N e M esiste la relazione : N = z M , per cui si ha
M= N z ; M= 0,85 2 0,425 m/L
2) Calcolare i grammi di KCl che occorrono per preparare 700 ml di una soluzione 1,2 M.
Risoluzione :si calcolano prima le moli presenti nel volume di soluzione da preparare e poi si trasformano in grammi n(sale ) = 0,7 (L) x 1,2 0,84 moli; g(KCl) = 0,84 x 74,6 62,66 g
3) Calcolare Il volume di una soluzione di HNO3 al 25% in peso d=1,09 g/mL, necessario per preparare 2 litri di una soluzione 0,90 N
Risoluzione: si calcola molarit della soluzione concentrata, M =
% xd x10 PM
M = (25 x 1,09/63) x10 , M = 4,33 mol/L Occorre prelevare da questa soluzione un volume Vx che contenga un numero di moli di HNO3 pari a quelli che devono essere presenti nei 2 litri di soluzione 0,90 M. Le moli di HNO3 nel generico volume Vx sono : n = Vx x 4,33 ;
�le moli di acido nella soluzione da preparare sono : n = 2 x 0,90 uguagliando si ha: Vx x 4,33 = 2 x 0,90; Vx = ( 2 x 0,90)/4,33 0,415 L
4) Calcolare le moli di HCl presenti in 1,2 litri di una sua soluzione acquosa (d= 1,085 g/ml) in cui presente al 17,45% in peso.
Risoluzione: vengono preoposti due diverse procedure
Procedura 1 si ricava prima la massa della soluzione attraverso la densit e poi si calcola la massa del componente che poi si converte in moli
Massa di 1,2 L di soluzione = (1,2 x1000) x1,085) 1302 g % 17,45 Massa di HCl in essa contenuta = g ( solz ) x ; g(HCl)= 1302x 227,20 100 100 227,20 n(HCl) = 36,5 Procedura n 2 si ricava la molarit della soluzione (cio le moli in un litro e poi si ricavano le moli nel volume desiderato (V=1,2 L)
17,45 x1,085 % xd x10 ; M = x10 5,19 moli/litro PM 36,5 n , da cui si ricavano le moli ; Moli in 1,2 litri . Dalla definizione di molarit, M = V n = MxV ; n = 1,2 x5,19 6,23 moli
Molarit M =
B) Per diluizione Problema 1
Calcolare il volume di una soluzione di H2SO3 al 20% in peso d = 1,10 g/mL necessario per preparare 3,5 litri di una soluzione 0,60 M. Calcolare, inoltre, la Normalit della soluzione sapendo che entrambi i protoni vengono neutralizzati. Risoluzione: si calcola la molarit della soluzione concentrata.
M= % x d PM
10
; M=
20 x 1,10 82
10
2,68 m/L
Occorre prelevare da questa soluzione un volume Vx che contenga un numero di moli di H2SO3 uguali a quelli che devono essere presenti nei 3,5 litri di soluzione 0,60 M da preparare. Le moli di H2SO3 nel volume Vx sono : n = Vx 2,68
�le moli di acido nella soluzione da preparare sono : n = 3,5 x 0,60 uguagliando si ha: 3,5 x 0,60 0,738 L V x 2,68 = 3,5 x 0,60 ; V = 2,68 Modalit di esecuzione: si preleva con un cilindro graduato il volume richiesto, si trasferisce il tutto in un matraccio da 3,5 litri e si aggiunge acqua distillata sino a riempimento
Problema 2
Calcolare il volume di una soluzione di H2SO4 al 40% in peso d= 1,11 g/mL necessario per preparare 7 litri di una soluzione 0,90 M Risoluzione: si calcola molarit della soluzione concentrata M = (% x d / PM) x 10 M = (40 x 1,11/PM) x10 , M = 4,52 mol/L Occorre prelevare da questa soluzione un volume Vx che contenga un numero di moli di H2SO4 pari a quelli che devono essere presenti nei 1,5 litri di soluzione 0,90 M Le moli di H2SO4 nel generico volume Vx sono : n = Vx(L) 4,52 le moli di acido nella soluzione da preparare sono : n = 7 x 0,90 uguagliando si ha: Vx x 1,13 = 7 x 0,90; Vx =(7 x 0,90)/4,52 1,39 L