Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Calore Alluminio
Caricato da
Luigi PolitoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Calore Alluminio
Caricato da
Luigi PolitoCopyright:
Formati disponibili
Determinazione della capacità termica del calorimetro
e del calore specifico dell’alluminio.
Materiale in dotazione: calorimetro, un termometro con divisioni di 0.2 °C, contenitore di plastica,
cilindro di alluminio, cronometro.
Capacità termica del calorimetro
1. Nel calorimetro ci sono mc = 200 g di acqua calda.
2. Mettete nel recipiente di plastica mf = 200 g di acqua fredda e pesatela (ignorate
l’indicazione sui recipienti e abbiate cura di sottrarre il peso del recipiente vuoto).
3. Fate partire il cronometro (E NON FERMATELO FINO A FINE MISURA: punto 6).
4. Utilizzando il termometro una volta nel calorimetro e l'altra nel contenitore di plastica,
rilevate le temperature dell'acqua calda THc O e fredda THf O alternativamente ad intervalli
2 2
di un minuto (5 misure per ognuna per un totale di 10 minuti).
5. Cercate di eseguire le seguenti operazioni nel minor tempo possibile:
- sfilare il termometro
- aprire il calorimetro
- versare l'acqua fredda nel calorimetro
- chiudere il calorimetro e agitare
- reinserire il termometro nel calorimetro.
6. Attendete 5 minuti e rilevate 5 misure della temperatura TM nel calorimetro a intervalli di
un minuto.
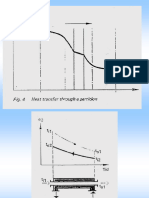
T(t) TC
HO
2 TC*H O
7. Riportate in un unico grafico le 2
temperature dell’acqua prima e dopo il
TM
mescolamento in funzione del tempo e T*M
tracciate per ogni andamento una retta TfH O
(vedere il grafico). 2
Tf*H O
2
8. Leggete le intersezioni delle tre rette con la
retta verticale corrispondente al tempo in
cui è avvenuto il mescolamento. t mescolamento
t
9. Ricavate la capacità termica Cc del calorimetro dalla relazione:
*
ca mf [ TM - THf * O ] = (ca mc + Cc) [ THc* O - TM
*
]
2 2
Laboratorio di Fisica – Ingegneria Elettronica – M. Migliorati A. A. 2005 - 2006
Calore specifico dell’alluminio
1. Prelevate col recipiente di plastica 250 g di acqua calda, misuratene la quantità mc,
mettetela nel calorimetro, chiudete e agitate.
2. Prelevate col recipiente di plastica 250 g di acqua fredda (non serve pesarla).
3. Pesate il cilindro di alluminio (mAl) e ponetelo nel contenitore con l'acqua fredda.
4. Fate partire il cronometro (E NON FERMATELO FINO A FINE MISURA: punto 7).
5. Utilizzando il termometro una volta nel calorimetro e l'altra nell’acqua con il cilindro,
rilevate le temperature dell'acqua calda TH O e fredda TC alternativamente ad intervalli
2
di un minuto (5 misure per ognuna).
6. Cercate di eseguire le seguenti operazioni nel minor tempo possibile:
sfilare il termometro - aprire il calorimetro - porre il cilindro nel calorimetro - chiudere
il calorimetro - agitare - reinserire il termometro del calorimetro.
7. Attendete 5 minuti e rilevate 5 misure della temperatura TM nel calorimetro a intervalli
di un minuto. T(t) T
HO
2 T*H O
2
8. Riportate in un unico grafico in
funzione del tempo le temperature delle TM
T*M
quantità di acqua calda e fredda prima
del mescolamento e quella dell’acqua TC
calda dopo averci messo dentro il T*C
cilindro di alluminio. Tracciate per ogni
andamento una retta (vedere il grafico).
t mescolamento t
9. Leggete le intersezioni delle tre rette
con la retta verticale corrispondente al tempo in cui è avvenuto il mescolamento.
* *
10. Ricavate cAl dalla relazione: cAl mAl [ TM - TC* ] = (ca mc + Cc) [ TH 2O
*
- TM ]
Confrontate la vostra misura con quella teorica cAl = 900 J / (kg K) tramite lo scarto
relativo.
Calcolate il calore molare dell’alluminio sapendo che MAl = 27 g/mol e confrontatelo con
quello di un solido ideale (legge empirica di Dulong e Petit).
Facoltativo:
Senza cambiare l’acqua calda, rimettete il cilindro di alluminio nel recipiente dell’acqua fredda
e ripetete nuovamente i passi 4 – 10.
Il valore del calore specifico dell’alluminio è in questo caso la media aritmetica delle due
misurazioni.
Laboratorio di Fisica – Ingegneria Elettronica – M. Migliorati A. A. 2005 - 2006
Potrebbero piacerti anche
- Misure Di TemperaturaDocumento10 pagineMisure Di Temperaturaf.cordella5397Nessuna valutazione finora
- Sensori e Trasduttori - PSPCDocumento56 pagineSensori e Trasduttori - PSPCgiuseppe baldassarreNessuna valutazione finora
- Esercitazioni 2016-17 Parte 4Documento6 pagineEsercitazioni 2016-17 Parte 4RafffdsghvNessuna valutazione finora
- Fisica Tecnica Vol 1 - Complementi Di Termodinamica e Trasmissione Del CaloreDocumento228 pagineFisica Tecnica Vol 1 - Complementi Di Termodinamica e Trasmissione Del CaloreFerruccio RossiNessuna valutazione finora
- 10 - Scambiatori Di Calore (Scambio Termico 1)Documento47 pagine10 - Scambiatori Di Calore (Scambio Termico 1)Luigi SantorelliNessuna valutazione finora
- Appunti Ed Esercizi Di Fisica Tecnica e Macchine TermicheDocumento25 pagineAppunti Ed Esercizi Di Fisica Tecnica e Macchine Termicheamjr1001Nessuna valutazione finora
- Calorimetro Delle MescolanzeDocumento16 pagineCalorimetro Delle Mescolanzegiulio141091Nessuna valutazione finora
- 03 Sensori Temperatura PDFDocumento30 pagine03 Sensori Temperatura PDFAlessandro MuragliaNessuna valutazione finora
- VIII Esperienza - Termometria - Calorimetria 2020 2021Documento16 pagineVIII Esperienza - Termometria - Calorimetria 2020 2021ForgeLionNessuna valutazione finora
- Term Odin A MicaDocumento2 pagineTerm Odin A MicaRosita FarsaciNessuna valutazione finora
- Esercizi Termodinamica-IIDocumento3 pagineEsercizi Termodinamica-IIboom shakalakaNessuna valutazione finora
- Calorimetro Delle MescolanzeDocumento16 pagineCalorimetro Delle Mescolanzegiulio141091Nessuna valutazione finora
- Equilibrio TermicoDocumento6 pagineEquilibrio Termicosandra citlali mendez torresNessuna valutazione finora
- TESI Scambio TermicoDocumento15 pagineTESI Scambio TermicoFilippo MorelliNessuna valutazione finora
- TRASDUTTORI Di TEMPERATURA PDFDocumento9 pagineTRASDUTTORI Di TEMPERATURA PDFGianlucaNessuna valutazione finora
- Analisi TermicaDocumento14 pagineAnalisi TermicabrutusNessuna valutazione finora
- C8 Mto 09Documento12 pagineC8 Mto 09euceetandaecefNessuna valutazione finora
- 1726 - Esercitazione 3 2014-15Documento2 pagine1726 - Esercitazione 3 2014-15Roberto MekhailNessuna valutazione finora
- Esercizi FT-Unità 16Documento16 pagineEsercizi FT-Unità 16ManuelLentiNessuna valutazione finora
- Curve TTT e CCTDocumento3 pagineCurve TTT e CCTDAVIDE LOPOPOLONessuna valutazione finora
- E13 Termodinamica CicliDocumento1 paginaE13 Termodinamica CicliCarlo CgnNessuna valutazione finora
- Termometria e CalorimetriaDocumento40 pagineTermometria e CalorimetriagioNessuna valutazione finora
- Scritto170717 2.1Documento3 pagineScritto170717 2.1Amal EssakhiNessuna valutazione finora
- Calore SpecificoDocumento5 pagineCalore Specificoomarhassab06Nessuna valutazione finora
- Cella Di PeltierDocumento8 pagineCella Di Peltiermaster69aNessuna valutazione finora
- Conduzione TermicaDocumento2 pagineConduzione Termicacandide999Nessuna valutazione finora
- Relazione CalorimetroDocumento3 pagineRelazione CalorimetroGiammi92Nessuna valutazione finora
- Effiecienza Di Uno Scambiatore Di Calore A Tubi e MantelloDocumento19 pagineEffiecienza Di Uno Scambiatore Di Calore A Tubi e MantelloDavide OccelloNessuna valutazione finora
- 22 Esercizio Raffreddamento MostoDocumento14 pagine22 Esercizio Raffreddamento MostoFrancesco MelchioniNessuna valutazione finora
- App Tgas PDFDocumento34 pagineApp Tgas PDFElena FiermonteNessuna valutazione finora
- Motor A JatoDocumento11 pagineMotor A JatoKelven pedroNessuna valutazione finora
- Slide 7 Blocco 6Documento4 pagineSlide 7 Blocco 6TerryNessuna valutazione finora
- 2022 MSI - Lez 13 - Introduzione Misure Di Temperatura e Scale - ALFDocumento34 pagine2022 MSI - Lez 13 - Introduzione Misure Di Temperatura e Scale - ALFLorenzo TripodinaNessuna valutazione finora
- Sistema Termico Del Primo OrdineDocumento22 pagineSistema Termico Del Primo Ordineclaudio cancelli100% (1)
- Relazioni Di LaboratorioDocumento20 pagineRelazioni Di LaboratorioMarco MorelliNessuna valutazione finora
- Lab CalorwDocumento7 pagineLab CalorwMatteo CozzolinoNessuna valutazione finora
- 10 Funzioni ResidueDocumento3 pagine10 Funzioni Residuepio344Nessuna valutazione finora
- Dispensa T T MeccDocumento15 pagineDispensa T T MeccLuca SpedicatiNessuna valutazione finora
- Fisica RiassuntiDocumento25 pagineFisica RiassuntiRaff DlsNessuna valutazione finora
- Lezione 9 Gas Perfetti BWDocumento30 pagineLezione 9 Gas Perfetti BWValentina CosentinoNessuna valutazione finora
- TermocoppieDocumento8 pagineTermocoppieLeon TrotskyNessuna valutazione finora
- Termodinamica 8Documento16 pagineTermodinamica 8Daniel LongoNessuna valutazione finora
- Teoria ScambiatoriDocumento14 pagineTeoria ScambiatoriMohammed SahibNessuna valutazione finora
- Fisica GeneraleDocumento43 pagineFisica GeneraleFrankyDonnarummaNessuna valutazione finora
- BainDocumento2 pagineBainLuca PasqualoneNessuna valutazione finora
- Domande Di Fisica TecnicaDocumento4 pagineDomande Di Fisica TecnicaFlavia BarigelliNessuna valutazione finora
- Regime Periodico Stabilizzato!Documento10 pagineRegime Periodico Stabilizzato!marcome87Nessuna valutazione finora
- Calorimetro Delle Mescolanze2 - 0Documento5 pagineCalorimetro Delle Mescolanze2 - 0Mattia BeniniNessuna valutazione finora
- Lorenzati Nodo Controterra Agli Elementi FinitiDocumento18 pagineLorenzati Nodo Controterra Agli Elementi FinitimarkNessuna valutazione finora
- Lab. 2 FisicoquìmicaDocumento14 pagineLab. 2 FisicoquìmicaAngela Lucenit Ore CuyubambaNessuna valutazione finora
- 04 01 16 TermodinamicaDocumento2 pagine04 01 16 TermodinamicaEmanueleNessuna valutazione finora
- Esercizi di fisica: termodinamica e trasmissione del caloreDa EverandEsercizi di fisica: termodinamica e trasmissione del caloreValutazione: 5 su 5 stelle5/5 (1)
- 020 Trasmissione Globale e ScambiatoriDocumento0 pagine020 Trasmissione Globale e ScambiatorilittlecheersNessuna valutazione finora
- 02 EsercitazioniDocumento2 pagine02 EsercitazioniDaniele PremariniNessuna valutazione finora
- T3 Temperatura TermocoppieDocumento20 pagineT3 Temperatura TermocoppieAndrea CozzolinoNessuna valutazione finora
- Errori-Tipici 1Documento17 pagineErrori-Tipici 1Lele KingNessuna valutazione finora
- 14txt WebiDocumento49 pagine14txt Webi96bestvideo96Nessuna valutazione finora
- 05 Pompe Di Calore Gruppi FrigoriferiDocumento81 pagine05 Pompe Di Calore Gruppi FrigoriferiFrancesco FNessuna valutazione finora
- Fisica: termodinamica e teoria cinetica dei gasDa EverandFisica: termodinamica e teoria cinetica dei gasValutazione: 3 su 5 stelle3/5 (2)
- Esercizi di fisica per licei: fluidodinamica e termodinamicaDa EverandEsercizi di fisica per licei: fluidodinamica e termodinamicaValutazione: 5 su 5 stelle5/5 (1)
- Modello Ricevuta Prestazione OccasionaleDocumento1 paginaModello Ricevuta Prestazione OccasionaleLuigi PolitoNessuna valutazione finora
- Procura Tribunale Minorenni - Segnalazione Degli Alunni InadempientiDocumento3 pagineProcura Tribunale Minorenni - Segnalazione Degli Alunni InadempientiLuigi PolitoNessuna valutazione finora
- GRIM Protocollo Valutazione MediumDocumento8 pagineGRIM Protocollo Valutazione MediumLuigi PolitoNessuna valutazione finora
- DS Canone TV Privato ISTRDocumento3 pagineDS Canone TV Privato ISTRLuigi PolitoNessuna valutazione finora
- FisicaDocumento1 paginaFisicaLuigi PolitoNessuna valutazione finora
- Procura Tribunale Minorenni - Segnalazione Degli Alunni InadempientiDocumento3 pagineProcura Tribunale Minorenni - Segnalazione Degli Alunni InadempientiLuigi PolitoNessuna valutazione finora
- Tecarcrv PDFDocumento36 pagineTecarcrv PDFLuigi PolitoNessuna valutazione finora
- Cds +73+calendario+scrutini+I+QUADRIMESTREDocumento2 pagineCds +73+calendario+scrutini+I+QUADRIMESTRELuigi PolitoNessuna valutazione finora
- NEXTdepl 6 PDFDocumento3 pagineNEXTdepl 6 PDFLuigi PolitoNessuna valutazione finora
- Cds +73+calendario+scrutini+I+QUADRIMESTREDocumento2 pagineCds +73+calendario+scrutini+I+QUADRIMESTRELuigi PolitoNessuna valutazione finora
- Cds +73+calendario+scrutini+I+QUADRIMESTREDocumento2 pagineCds +73+calendario+scrutini+I+QUADRIMESTRELuigi PolitoNessuna valutazione finora
- Cds +73+calendario+scrutini+I+QUADRIMESTREDocumento2 pagineCds +73+calendario+scrutini+I+QUADRIMESTRELuigi PolitoNessuna valutazione finora
- Cds +73+calendario+scrutini+I+QUADRIMESTREDocumento2 pagineCds +73+calendario+scrutini+I+QUADRIMESTRELuigi PolitoNessuna valutazione finora
- Modello PDP 2019-20Documento13 pagineModello PDP 2019-20Luigi PolitoNessuna valutazione finora
- Modello PDP 2019-20Documento13 pagineModello PDP 2019-20Luigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Cds 39 Comunicazione Di Servizio Per Motivi Di SicurezzaDocumento1 paginaCds 39 Comunicazione Di Servizio Per Motivi Di SicurezzaLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Programmafisica - 1a TecnDocumento3 pagineProgrammafisica - 1a TecnLuigi PolitoNessuna valutazione finora
- Citazioni Di Albert Einstein PDFDocumento18 pagineCitazioni Di Albert Einstein PDFMarino CrisNessuna valutazione finora
- Libretto Corsi ISICT 2010Documento100 pagineLibretto Corsi ISICT 2010Raffaello CamorianoNessuna valutazione finora
- VERIFICA Atmosfera-Venti-PrecipitazioniDocumento3 pagineVERIFICA Atmosfera-Venti-PrecipitazionimartaNessuna valutazione finora
- Il Metodo Dalcroze PDFDocumento4 pagineIl Metodo Dalcroze PDFgiuseppe vitaleNessuna valutazione finora
- 5.1 Principio Di Non Contraddizione. Parmenide e AristoteleDocumento7 pagine5.1 Principio Di Non Contraddizione. Parmenide e AristoteleAndrea VolonninoNessuna valutazione finora
- La Distillazione MurgeseDocumento5 pagineLa Distillazione Murgeseandrew wallenNessuna valutazione finora
- MappechimicaDocumento70 pagineMappechimicaElisa QuartieriNessuna valutazione finora
- ParadisoDocumento8 pagineParadisonadia cellNessuna valutazione finora