Il 0% ha trovato utile questo documento (0 voti)
312 visualizzazioni4 pagineNomenclatura
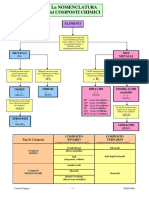
Il documento descrive la nomenclatura di vari composti chimici contenenti ossigeno, idrogeno e non metalli. Vengono illustrate le differenze tra la nomenclatura tradizionale e quella IUPAC per ossidi, idrossidi, ossiacidi e composti binari con l'idrogeno.
Caricato da
Anonymous Gp0K9p7vCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Il 0% ha trovato utile questo documento (0 voti)
312 visualizzazioni4 pagineNomenclatura
Il documento descrive la nomenclatura di vari composti chimici contenenti ossigeno, idrogeno e non metalli. Vengono illustrate le differenze tra la nomenclatura tradizionale e quella IUPAC per ossidi, idrossidi, ossiacidi e composti binari con l'idrogeno.
Caricato da
Anonymous Gp0K9p7vCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.