Il 0% ha trovato utile questo documento (0 voti)
212 visualizzazioni4 pagine5 - Gli Indicatori
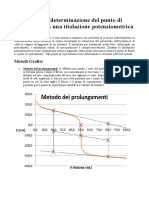
Il documento descrive i principi delle titolazioni acido-base e l'uso degli indicatori per determinare il punto di equivalenza. Vengono spiegati i tipi di reazioni di neutralizzazione che possono verificarsi e gli acidi e basi comunemente usati. Inoltre vengono descritti i fattori che influenzano il comportamento degli indicatori.
Caricato da
marco ghirardoCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
Il 0% ha trovato utile questo documento (0 voti)
212 visualizzazioni4 pagine5 - Gli Indicatori
Il documento descrive i principi delle titolazioni acido-base e l'uso degli indicatori per determinare il punto di equivalenza. Vengono spiegati i tipi di reazioni di neutralizzazione che possono verificarsi e gli acidi e basi comunemente usati. Inoltre vengono descritti i fattori che influenzano il comportamento degli indicatori.
Caricato da
marco ghirardoCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd