Il 0% ha trovato utile questo documento (0 voti)
244 visualizzazioni30 pagineNomenclatura
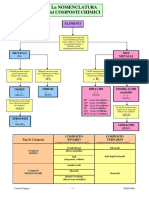
Il documento descrive le regole per assegnare i numeri di ossidazione agli elementi nei composti chimici e per nominare i composti in base alla loro struttura. Vengono forniti esempi dettagliati su come applicare queste regole per calcolare i numeri di ossidazione e nominare vari tipi di composti, tra cui ossidi, acidi, sali e altro.
Caricato da
Matteo Achille CampanelliCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
Il 0% ha trovato utile questo documento (0 voti)
244 visualizzazioni30 pagineNomenclatura
Il documento descrive le regole per assegnare i numeri di ossidazione agli elementi nei composti chimici e per nominare i composti in base alla loro struttura. Vengono forniti esempi dettagliati su come applicare queste regole per calcolare i numeri di ossidazione e nominare vari tipi di composti, tra cui ossidi, acidi, sali e altro.
Caricato da
Matteo Achille CampanelliCopyright
© © All Rights Reserved
Per noi i diritti sui contenuti sono una cosa seria. Se sospetti che questo contenuto sia tuo, rivendicalo qui.
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd