Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Forma Molecole
Forma Molecole
Caricato da
RivettiLucaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Forma Molecole
Forma Molecole
Caricato da
RivettiLucaCopyright:
Formati disponibili
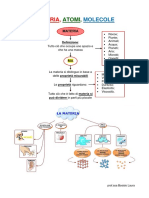
La teoria VSEPR Le proprietà delle sostanze
La teoria VSEPR Le proprietà delle sostanze
distinguere tra
distinguere tra definire
Le forze
stabilire
Miscibilità
Nella teoria VSEPR si precisa
definire stabilire che le coppie di elettroni
che formano doppi e tripli legami vanno conteggiate
prevedere
intermolecolari e solubilità
Struttura Struttura Struttura
lineare triangolare tetraedrica
distinguere tra rappresentare
dedurre Forze
di dispersione
di London
La dissociazione
ionica
come se fossero
Le forze prevedereuna sola coppia di elettroni.
Miscibilità
intermolecolari e solubilità
La forma rappresentare
della molecola
Forze Le reazioni
individuare dipolo-dipolo di ionizzazione
Struttura
Molecole polari
Struttura
riconoscere
triangolare tetraedrica
e apolari
distinguere tra
Legami Le forze
rappresentare
a idrogeno ione-dipolo
dedurre Forze La dissociazione
di dispersione ionica
di London
La forma rappresentare
della molecola
Forze Le reazioni
individuare dipolo-dipolo di ionizzazione
riconoscere
Molecole polari
e apolari
Legami Le forze
a idrogeno ione-dipolo
Entrambe le molecole Entrambe le molecole
sono lineari. sono planari.
Capitolo 7 Le forze intermolecolari e le proprietà delle sostanze
Lezione 1 La forma delle molecole 4
Chimica 2ed. F. Bagatti, E. Corradi, A. Desco, C. Ropa © Zanichelli, 2017
senti nel guscio di valenza
Le forze prevedere Miscibilità
intermolecolari e solubilità
Struttura Struttura
triangolare tetraedrica
Ledistinguere tra rappresentare
La teoria VSEPR Le proprietà delle sostanze
distinguere tra definire stabilire
molecole che, a causa di una distribuzione asimmetrica
della carica elettrica, presentano due distinte polarità sono
Le forze prevedere Miscibilità
intermolecolari e solubilità
Struttura Struttura Struttura
lineare triangolare tetraedrica
distinguere tra rappresentare
dedurre
dedurre Forze
di dispersione
di London
La dissociazione
ionica Forzechiamate molecole polari o dipoli.
La dissociazione
La forma rappresentare
di dispersione ionica
Le sostanze costituite da molecole polari sono chiamate
della molecola
individuare
Forze
dipolo-dipolo
Le reazioni
di ionizzazione di London
sostanze polari.
riconoscere
Molecole polari
rappresentare
e apolari
La forma
Legami Le forze
a idrogeno ione-dipolo
della molecola
individuare
Forze
dipolo-dipolo H2Una
O molecolaLe reazioni
d’acqua CO2è un dipolo.
di ionizzazione
mico e Molecole polari
e apolari
riconoscere
questo Legami
a idrogeno
Le forze
ione-dipolo
di una
he alla tf 0 °C −79 °C semplificata
Rappresentazione
+
iproca
+
–
e generica di una qualunque
++
teb 100 °C molecola−57 °C
+
–
++
polare.
––
+
–
+++
––
+
uite da Tabella 1 La diversa forma delle molecole
Una bacchetta di plastica, elettrizzata per strofinio,
delle due sostanze è èalla base della maggiore
no un intensità delle forze di
sufficiente
di attrazione
a determinare
traacqua.
attrarre il filo di
una forza elettrica capace
le molecole
Questa prova conferma che
di acqua rispetto a quelle l’acqua traè una
le molecole di
sostanza polare.
7anidride carbonica. A temperatura ambiente,
isconoCapitolo Le forze intermolecolari
Lezione 2l’acqua è liquida
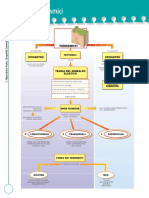
Sostanze polari e apolari
e le proprietà delle sostanze
perché le forze di attrazione tra Chimica 2ed. F. Bagatti, E. Corradi, A. Desco, C. Ropa © Zanichelli, 2017 5
Le forze prevedere Miscibilità
intermolecolari e solubilità
Struttura Struttura
triangolare tetraedrica
distinguere tra
caratterizzaterappresentare
La teoria VSEPR Le proprietà delle sostanze
distinguere tra definire stabilire
Le molecole da una
distribuzione simmetrica della carica elettrica
Le forze prevedere Miscibilità
intermolecolari e solubilità
Struttura Struttura Struttura
lineare triangolare tetraedrica
distinguere tra rappresentare
dedurre
dedurre Forze
di dispersione
di London
La dissociazione
ionica
non presentano distinte polarità
Forze
di dispersione
e si chiamano
La dissociazione
La forma rappresentare
ionica
molecole apolari.
della molecola
individuare
Forze
dipolo-dipolo
Le reazioni
di ionizzazione di London
Le sostanze costituite da rappresentare
molecole apolari
riconoscere
Molecole polari
e apolari
La forma
Legami Le forze
a idrogeno ione-dipolo
della molecola
sono chiamate sostanze apolari.
Forze Le reazioni
individuare dipolo-dipolo di ionizzazione
riconoscere
Molecole polari
e apolari
Legami Le forze
Tutte lea sostanze
idrogeno elementari, qualunque sia la forma delle loro
ione-dipolo
molecole, sono apolari: tra atomi uguali si stabiliscono sempre
legami covalenti puri e quindi si ha sempre una distribuzione
simmetrica delle cariche.
Il modellino rappresenta una molecola di tetracloruro
di carbonio. La differenza di elettronegatività tra carbonio
e cloro determina la polarizzazione dei legami. La molecola
risulta però apolare, a causa della disposizione simmetrica
degli atomi.
Il tetracloruro di carbonio è quindi un composto apolare.
Capitolo 7 Le forze intermolecolari e le proprietà delle sostanze
Lezione 2 Sostanze polari e apolari 6
Chimica 2ed. F. Bagatti, E. Corradi, A. Desco, C. Ropa © Zanichelli, 2017
Potrebbero piacerti anche
- CHIMICA ORGANICA (In ITALIAN)Documento102 pagineCHIMICA ORGANICA (In ITALIAN)DepeLilyNessuna valutazione finora
- FDC-lezione 15 (Solidi)Documento7 pagineFDC-lezione 15 (Solidi)Chiara Della feminaNessuna valutazione finora
- Chimica OrganicaDocumento8 pagineChimica OrganicaBeatrice MancaNessuna valutazione finora
- Geometria Delle MolecoleDocumento1 paginaGeometria Delle MolecoleDispense Biomedica UnicaNessuna valutazione finora
- Ideedellachimica - Mappa10 Lrgame ChmicoDocumento1 paginaIdeedellachimica - Mappa10 Lrgame ChmicoBtW EnderNessuna valutazione finora
- Chimica Generale E Inorganica Pt1Documento27 pagineChimica Generale E Inorganica Pt1matteoruzzaNessuna valutazione finora
- Chimica Seguilamappa Cap6Documento13 pagineChimica Seguilamappa Cap6Alice LizzolaNessuna valutazione finora
- La Struttura Dell'AtomoDocumento2 pagineLa Struttura Dell'AtomoAnna SassoneNessuna valutazione finora
- Isomerie 2Documento4 pagineIsomerie 2Marco NistorNessuna valutazione finora
- Isomeria 1Documento47 pagineIsomeria 1Giacomo BorgatoNessuna valutazione finora
- ChinnaDocumento11 pagineChinnaElena MonticchioNessuna valutazione finora
- ScienzeDocumento15 pagineScienzeedoardo correnteNessuna valutazione finora
- Fisica ModernaDocumento1 paginaFisica ModernaEreina FriasNessuna valutazione finora
- (Chimica) Forma Degli AtomiDocumento30 pagine(Chimica) Forma Degli AtomiAndrea SartorioNessuna valutazione finora
- Materia Atomi MolecoleDocumento9 pagineMateria Atomi Molecolerighini michelaNessuna valutazione finora
- Le Forze IntermolecolariDocumento17 pagineLe Forze IntermolecolariMOHAMED ELARAISHINessuna valutazione finora
- Lo Stato SolidoDocumento54 pagineLo Stato SolidoMartyna OsialNessuna valutazione finora
- Chimica InorganicaDocumento42 pagineChimica Inorganicar925tfw6xyNessuna valutazione finora
- FDC Lezione 16Documento4 pagineFDC Lezione 16Chiara Della feminaNessuna valutazione finora
- FDC Lezione 13Documento7 pagineFDC Lezione 13Chiara Della feminaNessuna valutazione finora
- I Legami Chimici: Capitolo 10Documento67 pagineI Legami Chimici: Capitolo 10sphereneroNessuna valutazione finora
- Sadava PPT 20160 CB1Documento34 pagineSadava PPT 20160 CB1Elisa MonacoNessuna valutazione finora
- DIFFERENZA ANALISI LOGICA E GRAMMTICALEmappeDocumento5 pagineDIFFERENZA ANALISI LOGICA E GRAMMTICALEmappegiuseppeNessuna valutazione finora
- 8 Interazioni IntermolecolariDocumento18 pagine8 Interazioni Intermolecolarisuada bicaNessuna valutazione finora
- Scienze TerrestriDocumento20 pagineScienze TerrestriAlessandro FrezzaNessuna valutazione finora
- Rippa 04Documento33 pagineRippa 04TOMMYNessuna valutazione finora
- Biologia ApplicataDocumento67 pagineBiologia ApplicataFederico MammarellaNessuna valutazione finora
- Chimica OrganicaDocumento18 pagineChimica OrganicaAsia ZaccariaNessuna valutazione finora
- UD5 Legami ChimiciDocumento27 pagineUD5 Legami ChimiciLucy FilettiNessuna valutazione finora
- I Legami e La Forma Delle MolecoleDocumento3 pagineI Legami e La Forma Delle Molecoleclasse 1 ANessuna valutazione finora
- BiologyDocumento35 pagineBiologyArianna DincaNessuna valutazione finora
- I Fenomeni SismiciDocumento1 paginaI Fenomeni SismiciFil Rouge MediaNessuna valutazione finora
- Diffusione Atomica Nei SolidiDocumento101 pagineDiffusione Atomica Nei Solidicoliko2960Nessuna valutazione finora
- Prove ChimicaDocumento47 pagineProve Chimicayannbouzan2005Nessuna valutazione finora
- aa.e.DA - LT Thomson: Greci NDocumento1 paginaaa.e.DA - LT Thomson: Greci Nz7kpbtsdpcNessuna valutazione finora
- Lezione 12Documento15 pagineLezione 12RivettiLucaNessuna valutazione finora
- Lezione 10 30-10 PT 1Documento6 pagineLezione 10 30-10 PT 1RivettiLucaNessuna valutazione finora
- 23-10 Interazioni Deboli Prima ParteDocumento4 pagine23-10 Interazioni Deboli Prima ParteRivettiLucaNessuna valutazione finora
- 23-10 Solo Slide Forza Di LondonDocumento2 pagine23-10 Solo Slide Forza Di LondonRivettiLucaNessuna valutazione finora
- Capitolo 16Documento27 pagineCapitolo 16Francesco PozielloNessuna valutazione finora
- 11 - Tamponi IdrolisiDocumento13 pagine11 - Tamponi IdrolisiMichele GrimaldiNessuna valutazione finora
- Il Sol GelDocumento20 pagineIl Sol GelCosimoEspositoNessuna valutazione finora
- Gruppi Funzionali, Polimeri e CarboidratiDocumento10 pagineGruppi Funzionali, Polimeri e CarboidratiLuca CanegratiNessuna valutazione finora
- Calore Specifico GasDocumento5 pagineCalore Specifico GasmarcopasottiNessuna valutazione finora
- 6 - Standardzzazione Di Una Soluzione Di HCL Con Carbonato Di SodioDocumento4 pagine6 - Standardzzazione Di Una Soluzione Di HCL Con Carbonato Di Sodiomarco ghirardoNessuna valutazione finora
- ClassificazionematerialiDocumento36 pagineClassificazionematerialiIl bis per favoreNessuna valutazione finora