Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
CaloreLatenteFusione MS Cap14 Amaldi
Caricato da
Michele GuerrisiCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
CaloreLatenteFusione MS Cap14 Amaldi
Caricato da
Michele GuerrisiCopyright:
Formati disponibili
CAPITOLO 14: Il calore
CALORE LATENTE DI FUSIONE DEL GHIACCIO
Determina sperimentalmente il calore latente di fusione del ghiaccio.
LA FISICA DELLESPERIMENTO
Il calore latente di una sostanza numericamente uguale alla quantit di energia necessaria per
fondere completamente 1 kg di quella data sostanza. Nel SI di unit di misura si esprime in J/kg.
Se in un calorimetro, che contiene una quantit nota m1 di acqua a una certa temperatura T1, si
aggiunge qualche cubetto di ghiaccio fondente di massa m2 , dopo un certo tempo il ghiaccio sar
fuso e la temperatura finale dellacqua sar minore di quella iniziale.
Lenergia necessaria per fondere il ghiaccio fornita dallacqua, che si raffredda fino a una
temperatura finale di equilibrio Te.
Lacqua cede lenergia E1 = cacqua m1 (T1 Te) che viene assorbita dal ghiaccio per fondere a 0C e
trasformarsi in acqua (E2 = Lf m2 ) e successivamente dallacqua proveniente dalla fusione per
scaldarsi fino alla temperatura di equilibrio: E3 = cacqua m2 ( Te 0C).
Trascurando eventuali scambi di calore con il calorimetro e lambiente circostante, dal bilancio
energetico E1 = E2 + E3 si ricava il valore del calore latente di fusione del ghiaccio:
E2 = E1 - E3 Lf =( E1 - E3) / m2
PER FARE LESPERIENZA
STRUMENTI E MATERIALE
Calorimetro, ghiaccio, acqua, becher, bilancia (al grammo), termometro 1 (al mezzo grado
Celsius), termometro 2 (al decimo di grado Celsius).
Strumento
Sensibilit
Portata
Bilancia
1g
1 kg
Termometro 1
0,5 C
100 C
Termometro 2
0,1 C
50 C
Predisponi un calorimetro, un becher e dell acqua.
Procurati alcuni cubetti di ghiaccio fondente, cio alla temperatura Tg di 0 C. Se il ghiaccio
conservato in un freezer, a una temperatura quindi inferiore, ponilo in un recipiente con acqua e,
quando il ghiaccio comincia a fondere, controlla che la temperatura del miscuglio sia pari a 0 C.
Copyright 2010 Zanichelli editore S.P.A., Bologna [6243]
Questo f ile unestensione online d el corso Amaldi, LAmaldi 2.0 Zanichelli 2010
PROCEDIMENTO
Misura con una bilancia la massa m1 di acqua che versi nel calorimetro; quando la temperatura
dell'acqua e del calorimetro si stabilizzata, misura la temperatura T1 con il termometro 1.
Prendi dal recipiente alcuni cubetti di ghiaccio, asciugali e velocemente misurane con la bilancia la
massa m2. Poi introducili nel calorimetro e richiudi il coperchio.
Mescola lentamente per mezzo dell'agitatore. Dopo alcuni minuti misura la temperatura di
equilibrio Te.
Ripeti le operazioni variando la quantit e la temperatura iniziale dell'acqua o la massa del ghiaccio.
DATI RACCOLTI
Ora registra i dati nella tabella.
Colonna 1: contiene il riferimento alla misura svolta.
Colonna 2: contiene il valore della massa m1 dellacqua usata nel calorimetro.
Colonna 3: contiene il valore della massa m2 dei cubetti di ghiaccio.
Colonna 4: contiene il valore della temperatura T1 dell'acqua nel calorimetro, misurata con il
termometro 1.
Colonna 5: contiene il valore della temperatura Tg del ghiaccio fondente.
Colonna 6: contiene il valore della temperatura di equilibrio Te dellacqua nel calorimetro, misurata
con il termometro 2.
Lincertezza sulle misure riportate nelle colonne 2, 3, 4, 6 data dalla sensibilit degli strumenti utilizzati.
1
12345caso
2
m1(g)
3
m2(g)
4
T1(C)
5
Tg(C)
6
Te(C)
E1 (J)
E3 (J)
Lf (J/g)
Copyright 2010 Zanichelli editore S.P.A., Bologna [6243]
Questo f ile unestensione online d el corso Amaldi, LAmaldi 2.0 Zanichelli 2010
5
Lf medio = (35439) J/g
ELABORAZIONE DEI DATI
-
Completa la tabella precedente con lelaborazione dei dati raccolti.
Colonna 7: calcola lenergia E1 = cacqua m1 (T1 Te) ceduta dallacqua (il calore specifico
dellacqua cacqua = 4,186 J/g C).
Colonna 8: calcola lenergia E3 = cacqua m2 ( Te 0C) assorbita dalla massa di ghiaccio fuso in
acqua, per raggiungere la temperatura di equilibrio.
Colonna 9: calcola il calore latente di fusione del ghiaccio Lf dalla formula del bilancio energetico:
Lf= (E1-E3 ) / m2.
Calcola il valore medio di Lf e la sua incertezza e trascrivili nelle ultime righe della tabella:
Lf medio =
Lf medio
( L f 1 + L f 2 + ...L f 5 )
5
=
L f max ! L f min
2
CONCLUSIONI
1. Il valore medio di Lf che hai ottenuto confrontabile, entro le incertezze di misura, con il valore standard
della stessa grandezza,
pari a 334 J/g ( 334 103 J/kg espresso in unit del Sistema Internazionale) ?
2. Quali misure svolte in questo esperimento influiscono maggiormente nellincertezza del risultato finale?
3. Cosa succederebbe se svolgessi lesperimento introducendo nel calorimetro ghiaccio a temperatura
molto inferiore a quella di fusione?
TEST
1. Per fondere una massa di ghiaccio occorrono N J di energia. Per fondere una quantit pari alla met
occorrono:
a)
b)
c)
d)
NJ
N/2 J
2NJ
pi o meno joule di energia a seconda del liquido in cui immerso il ghiaccio.
Copyright 2010 Zanichelli editore S.P.A., Bologna [6243]
Questo f ile unestensione online d el corso Amaldi, LAmaldi 2.0 Zanichelli 2010
2. Sono state misurate le temperature nel calorimetro con un termometro di sensibilit 0,2 C. Lincertezza
nel risultato del calcolo di (T1 Te) :
a)
b)
c)
d)
0,4 C
0,2 C
0,0 C
impossibili da determinare senza conoscere i valori di Te e di T1.
3) Al termine di un esperimento, aprendo il calorimetro si nota che parte del ghiaccio ancora solida. Si
pu ricavare ugualmente il valore del calore latente di fusione?
a) No, perch la formula usata richiede che tutto il ghiaccio sia fuso.
b) No, perch la temperatura raggiunta non quella di equilibrio.
c) S, se posso determinare m2 misurando con la bilancia la massa di acqua contenuta nel calorimetro dopo
aver buttato via il ghiaccio rimasto.
d) S, se posso determinare m2 misurando con la bilancia la massa di acqua contenuta nel calorimetro dopo
aver aspettato che tutto il ghiaccio rimasto sia fuso.
4) Per ridurre lincertezza nel risultato finale, preferibile che la differenza tra la temperatura iniziale T1
dellacqua e quella finale Te di equilibrio sia la pi grande possibile. Questo si pu ottenere:
a)
b)
c)
d)
evitando di rimescolare lacqua e il ghiaccio nel calorimetro.
utilizzando acqua a una temperatura iniziale pi bassa.
aumentando la quantit iniziale di ghiaccio e diminuendo quella dellacqua.
diminuendo la quantit iniziale del ghiaccio e aumentando quella dellacqua.
Copyright 2010 Zanichelli editore S.P.A., Bologna [6243]
Questo f ile unestensione online d el corso Amaldi, LAmaldi 2.0 Zanichelli 2010
Potrebbero piacerti anche
- Contratto Di Servizio e Tariffe OldDocumento35 pagineContratto Di Servizio e Tariffe OldMichele GuerrisiNessuna valutazione finora
- Brani CanzoniereDocumento2 pagineBrani CanzoniereMichele GuerrisiNessuna valutazione finora
- Made in ItalyDocumento2 pagineMade in ItalyMichele GuerrisiNessuna valutazione finora
- MobilitàDocumento6 pagineMobilitàMichele GuerrisiNessuna valutazione finora
- L'edificio Come Sistema: Progettazione Dei Sistemi Costruttivi (8CFU)Documento17 pagineL'edificio Come Sistema: Progettazione Dei Sistemi Costruttivi (8CFU)Michele GuerrisiNessuna valutazione finora
- Ho Visto Un ReDocumento2 pagineHo Visto Un ReMichele GuerrisiNessuna valutazione finora
- G Come GiunglaDocumento2 pagineG Come GiunglaMichele GuerrisiNessuna valutazione finora
- ANSA4Documento1 paginaANSA4Michele GuerrisiNessuna valutazione finora
- ANSA5Documento1 paginaANSA5Michele GuerrisiNessuna valutazione finora
- ANSA1Documento1 paginaANSA1Michele GuerrisiNessuna valutazione finora
- ANSA1Documento1 paginaANSA1Michele GuerrisiNessuna valutazione finora
- ANSA3Documento1 paginaANSA3Michele GuerrisiNessuna valutazione finora
- ANSA2Documento1 paginaANSA2Michele GuerrisiNessuna valutazione finora
- Donizetti Gaetano Sonata Per Flauto e Piano 28219Documento17 pagineDonizetti Gaetano Sonata Per Flauto e Piano 28219Andrea Libero CitoNessuna valutazione finora
- Piano Regolatore GeneraleDocumento42 paginePiano Regolatore GeneraleMichele GuerrisiNessuna valutazione finora
- Tema Giovani Sessantotto ItaliaDocumento2 pagineTema Giovani Sessantotto ItaliaMichele GuerrisiNessuna valutazione finora
- LM 4cu Ingegneria Edile ArchitetturaDocumento4 pagineLM 4cu Ingegneria Edile ArchitetturaMichele GuerrisiNessuna valutazione finora
- FJFHGHJMNBV CDocumento3 pagineFJFHGHJMNBV CMichele GuerrisiNessuna valutazione finora
- Legislazione UrbanisticaDocumento1 paginaLegislazione UrbanisticaMichele GuerrisiNessuna valutazione finora
- AsderftgyhujikjhDocumento5 pagineAsderftgyhujikjhMichele GuerrisiNessuna valutazione finora
- CVGHJK, NBVCXZXCVBNMNBVCDocumento1 paginaCVGHJK, NBVCXZXCVBNMNBVCMichele GuerrisiNessuna valutazione finora
- Le Conseguenze Della Prima Guerra MondialeDocumento2 pagineLe Conseguenze Della Prima Guerra MondialeMichele GuerrisiNessuna valutazione finora
- FreudDocumento12 pagineFreudMichele GuerrisiNessuna valutazione finora
- Il Fascismo, Gli Intellettuali e La Politica Della CulturaDocumento13 pagineIl Fascismo, Gli Intellettuali e La Politica Della Culturadebramorgan123Nessuna valutazione finora
- Societa Nell'Italia Del BoomDocumento1 paginaSocieta Nell'Italia Del BoomMichele GuerrisiNessuna valutazione finora
- Griglia Riassuntiva Su HegelDocumento16 pagineGriglia Riassuntiva Su HegelMichele GuerrisiNessuna valutazione finora
- ST103 017020 Antistaminici PDFDocumento4 pagineST103 017020 Antistaminici PDFMichele GuerrisiNessuna valutazione finora
- Classi Di LaureaDocumento1 paginaClassi Di LaureaMichele GuerrisiNessuna valutazione finora
- Gli IdrocarburiDocumento8 pagineGli IdrocarburiMichele Guerrisi100% (1)
- Scheda Malta Ripristino MultiporDocumento2 pagineScheda Malta Ripristino MultiporMichele GuerrisiNessuna valutazione finora
- Salvatore Abbruzzese - Sociologia Delle ReligioniDocumento63 pagineSalvatore Abbruzzese - Sociologia Delle ReligioniDaniel MoranNessuna valutazione finora
- Bruniana & Campanelliana Vol. 9, No. 2, 2003 PDFDocumento270 pagineBruniana & Campanelliana Vol. 9, No. 2, 2003 PDFVetusta MaiestasNessuna valutazione finora
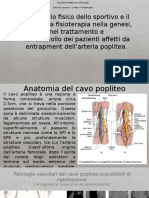
- Intrappolamento Dell'arteria Poplitea.Documento14 pagineIntrappolamento Dell'arteria Poplitea.AndreaGiustiNessuna valutazione finora
- Il Contratto Di Noleggio e La Clausola CancelloDocumento2 pagineIl Contratto Di Noleggio e La Clausola CancelloAnna Paola SannaNessuna valutazione finora
- Guida Insegnante VolentieriA2Documento49 pagineGuida Insegnante VolentieriA2Shreya ManojNessuna valutazione finora
- Edilizia in Legno-Linee Guida Toscana-Parte 1 Di 2Documento179 pagineEdilizia in Legno-Linee Guida Toscana-Parte 1 Di 2Mario Grimaudo100% (1)
- Da Muggia A TriesteDocumento47 pagineDa Muggia A TriesteRenzoMaggioreNessuna valutazione finora