Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Biologia 2
Caricato da
francescolapoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Biologia 2
Caricato da
francescolapoCopyright:
Formati disponibili
LORIGINE DELLA VITA 3,5 mld di anni fa, le ipotesi: -creazione divina -eternit della vita -origine dalle
condizioni primordiali della Terra Lesperimento di Miller Nel 1953 il chimico americano Stanley Miller costruisce un apparecchio capace di simulare le condizioni presenti sulla Terra delle origini. In una miscela di gas ( che riproduce l atmosfera primordiale del nostro pianeta ) egli immette un flusso di vapore acqueo ( proveniente da un recipiente contenente acqua in ebollizione ) dopodich espone la miscela ottenuta a scariche elettriche e ne attende la condensazione. Dopo qualche giorno analizza un campione del fluido ottenuto e rileva al suo interno la presenza di amminoacidi.
LA GENERAZIONE SPONTANEA Lesperienza di Pasteur Uno dei primi scienziati a confutare la teoria della generazione spontanea fu Luigi Pasteur: egli prese un brodo in cui erano sciolte proteine, zuccheri e altre sostanze nutritive adatte alla vita ( brodo di coltura ) e lo ripart in tre beute: la prima priva di alterazioni nella struttura, la seconda modificata in modo da presentare unansa , la terza chiusa ermeticamente.
I ESPERIMENTO
II
III
Dopo alcuni giorni: -nel I esperimento il brodo torbido ( colonie di microbi ) -nel II esperimento il brodo ancora limpido perch i batteri presentano difficolt a superare lansa -nel III esperimento il brodo perfettamente limpido
Gli esseri viventi autotrofi ed eterotrofi EVLUZIONE: cambiamento degli esseri viventi nel tempo In passato i biologi credevano che le variet si distinguessero poich erano state create diversamente ( teoria creazionistica ) Verso la fine dellOttocento,invece, si afferma la teoria evoluzionistica: gli esseri viventi godono della capacit di modificarsi in relazione ai fattori esterni. Gli organismi viventi bench godano delle stesse propriet ( riproduzione, movimento etc. )si dividono comunemente in autotrofi ed eterotrofi. -trofos in greco significa nutrimento -etero= altro -auto= se stesso Gli eterotrofi quindi si cibano di altri esseri viventi mentre gli autotrofi costruiscono il nutrimento autonomamente. La fotosintesi clorofilliana I raggi solari colpiscono un pigmento contenuto nelle foglie, la clorofilla, che funziona da tramite per sintetizzare gli zuccheri formati da anidride carbonica ed acqua; come elemento di rifiuto si ottiene ossigeno. Sintesi= collegamento, legame, unione di atomi per costruire molecole
6 CO2 + 6 H2O C6H12O6 + 6O2 Il bilancio tra lossigeno espulso attraverso la fotosintesi e la CO2 eliminata dai vegetali durante la respirazione ampiamente a favore allossigeno,per questo nel linguaggio comune si generalizza affermando che le piante espellono ossigeno. I coefficienti stechiometrici indicano il numero di molecole di un determinato elemento Dalla fotosintesi clorofilliana hanno origine anche sostanze diverse dal glucosio come le proteine ( leguminose: ceci; fagioli etc), vitamine, grassi (mais, ulivi, girasole, rosmarino ). I 5 REGNI DEGLI ESSERI VIVENTI >Regno dei funghi I funghi e le muffe sono formati da ife e il loro corpo cellulare il micelio; la parte del fungo che emerge dal terreno il corpo fruttifero destinato alla riproduzione. Sono esseri viventi che nascono dove ci sono sostanze organiche precostituite, eterotrofi e sessili. I funghi emettono enzimi al di fuori del loro corpo che degradano le sostanze presenti allesterno fino a ridurle a elementi semplici pronti per essere digeriti. >Regno delle monere Sono batteri e decompongono le sostanze inorganiche. Sono organismi procarioti( la membrana cellulare contiene pochi organuli al suo interno, il DNA non circondato dalla membrana nucleare ma sparso nello spazio intercellulare; contr. eucariota, es. i batteri necessari alla fermentazione del mosto ). >Regno dei protisti E formato da tutti quegli organismi difficilmente classificabili negli altri regni, siano essi oligocellulari o monocellulari.
SOLE
>Regno delle piante >Regno degli animali
Cellule e tessuti Pi cellule che svolgono una stessa funzione compongono un tessuto e analogamente pi tessuti costituiscono un organo. Si dice fisiologia lo studio delle funzioni, anatomia lo studio delle strutture, istologia quello dei tessuti e istologia quello della singola cellula. DARWIN E LAMARK Darwin il principale fautore della teoria evoluzionista e nel suo libroLorigine della specie sostiene che gli esseri viventi attuali si siano evoluti da un unico progenitore. Le sue teorie sono state universalmente accettate grazie ai ritrovamenti di resti fossili e hanno sconvolto la biologia affermando che ,in alcuni individui, al momento della nascita si potessero manifestare nuovi caratteri. Queste mutazioni nel 95% dei casi sono vere e proprie malformazioni ma, a volte, possono rivelarsi vantaggiose ed essere trasmesse in eredit alla prole. es. I delfini un tempo erano animali terrestri provvisti di zampe ma nel corso del tempo gli arti superiori hanno assunto una forma idrodinamica. Lamark e la teoria delluso che crea lorgano Il ricercatore francese elabora la tesi secondo cui le mutazioni avverrebbero in relazione allutilizzo che il genitore compie di un determinato organo.Tale teoria risulta per infondata, ad esempio,se pensiamo ai figli dei culturisti: essi non hanno alla nascita pi muscoli del figlio di un normale impiegato. Selezione naturale: la natura sopprime quegli individui con caratteristiche poco idonee a vivere in un determinato ambiente. Questo principio non vale per luomo e da ci si ha il conseguente indebolimento della specie. RIPRODUZIONE SESSUATA E ASESSUATA Riproduzione sessuata:per formare un nuovo individuo occorre la partecipazione di due individui e le caratteristiche dei genitori sono ereditate casualmente dalla prole ( variet dei discendenti ). Riproduzione asessuata: occorre la partecipazione di un unico essere. La violetta un organismo che in condizioni favorevoli si riproduce in maniera asessuata mentre quando lambiente diventa sfavorevole ricorre alla riproduzione sessuata affinch le nuove generazioni possano disporre di caratteristiche pi idonee alla vita in quel luogo.
Specie ( definizione di Carlo Linneo ): raggruppamento di esseri viventi che hanno caratteristiche simili, sono in grado di accoppiarsi, e dare origine a prole feconda.
LENERGIA Gli esseri viventi si procurano lenergia attraverso gli alimenti e la respirazione; lossigeno mediante reazioni chimiche produce lATP( lunica forma in cui un organismo vivente riesce a utilizzare lenergia ) che viene immagazzinato sotto forma di lipidi. Biologicamente la respirazione una combustione, ovvero lunione tra un combustibile e un comburente. ATP 6 CO2 + 6 H2O Il termine ATP significa adenosin trifosfato Le tre sostanze organiche che costituiscono la base degli alimenti degli animali sono proteine, lipidi e carboidrati. A pari peso questi ultimi hanno un valore energetico pari alla met dei secondi. Formula generale dei carboidrati Cn ( H2O )n ELEMENTO = sostanza chimica composta da atomi tutti uguali. ATOMO =la pi piccola particella in cui un elemento conserva le sue caratteristiche chimiche ( dal greco: non divisibile ). Alcuni elementi N = azoto H = idrogeno P = fosforo O = ossigeno F = fluoro Fe = ferro K = potassio C6H12O6 + 6 O2
Na = sodio Cl = cloro I = iodio S = zolfo Mg = magnesio Mn = manganese
Gli elementi scritti in corsivo sono dei sali. Postilla sulla distinzione tra organismi autotrofi ed eterotrofi Nelloceano primordiale le prime forme di vita si nutrivano di sostanze organiche gi sintetizzate, quindi erano eterotrofe. Solo quando queste sostanze vennero a mancare gli esseri viventi mutarono il modo di procurarsi il cibo e comparvero i primi organismi autotrofi, come le alghe verdi, ed inizi limmissione di ossigeno nellatmosfera. E necessario attendere ancora qualche millennio prima che tale ossigeno venga utilizzato da esseri autotrofi per produrre grandi quantit di energia.
ELEMENTI: sono sostanze costituite da atomi tutti uguali COMPOSTI: sono sostanze formate da atomi tutti uguali Gli atomi si differenziano gli uni dagli altri per il numero di particelle subatomiche che li compongono e conferiscono loro caratteristiche diverse. massa unitaria Protoni { carica positiva massa unitaria ATOMO Neutroni{ carica neutra privi di massa ( presentano un massa cos piccola che non si considera ) Elettroni { carica neutra Massa dellatomo: massa dei neutroni + massa dei protoni Latomo in natura ha carica neutra quindi il numero dei protoni uguale al numero degli elettroni. -1P 1E: atomo di idrogeno -2P 2N 2E: atomo di elio -6P 6N 6E: atomo di carbonio Il numero dei protoni il numero atomico e si indica con Z; A invece indica la massa atomica. Il nucleo composto da protoni e neutroni e costituisce una minuscola frazione dellatomo; la materia spazio vuoto dove circolano gli elettroni. I protoni non si respingono tra loro poich i neutroni leniscono le forze repulsive ( la forza nucleare la pi grande forza repulsiva che tende a far allontanare le particelle ). E=mc
E= Energia ( capacit di compiere un lavoro ) c= velocit della luce ( 800000 Km/s ) Se peso 10 nucleoni di un atomo essi pesano meno dei 10 nucleoni considerati singolarmente questa differenza viene definita difetto di massa. Lenergia ha sempre valori ben determinati ( quantizzazione dellenergia )
MASSA ATOMICA Lunit di misura della massa atomica lu.m.a. ( unit di misura della massa atomica ) ed stata oggetto di modificazioni nel corso del tempo: inizialmente coincideva con la massa atomica del carbonio , quindi con la sedicesima parte dellossigeno, infine con la dodicesima parte del C . Dato che, poi, in natura esistono atomi in cui il numero dei protoni differisce da quello dei neutroni ( isotopi ) allora la massa atomica di un atomo si ottiene operando la media percentuale degli isotopi. GLI ELETTRONI Gli elettroni circolano attorno al nucleo dellatomo perch risentono della forza attrattiva dei protoni che, secondo la legge di Coulomb, inversamente proporzionale alla distanza. Talvolta gli elettroni pi lontani dal nucleo dellatomo possono essere acquistati da un altro atomo che assume carica negativa e si dice anione; analogamente gli atomi che hanno ceduto un elettrone hanno carica positiva e vengono definiti cationi. In generale gli elettroni che hanno un numero atomico differente da quello degli elettroni sono detti ioni. Gli elettroni si muovono secondo una traiettoria ondulatoria in una struttura tridimensionale nella periferia dellatomo: si ottiene cos una sorta di densit elettronica che prende il nome di orbitale. Orbitale: la regione dellatomo in cui si ha la massima possibilit di trovare un elettrone. es. se paragoniamo latomo ad una sfera di vetro lorbitale lo spessore del vetro. Occorre per tenere presente che in realt non mai possibile conoscere con precisione la posizione e la velocit di un elettrone( principio di indeterminazione ). Ogni orbitale non pu ospitare pi di due elettroni, i quali si trovano sempre a distanze ben definite dal nucleo e la cui energia potenziale aumenta con lincrementare della distanza. I primi due orbitali hanno forma sferica senonch la densit elettronica si rapporta anche con altre forme: il terzo orbitale, ad esempio, comprende tre orbitali equidistanti dal nucleo simili ad altrettante clessidre che si dispongono secondo le tre direzioni dello spazio. LIVELLI DI ENERGIA I livelli energetici rappresentano la distanza degli elettroni dal nucleo dellatomo, essi si dividono poi in sottolivelli dove la differenza di energia molto contenuta. -Gli elettroni che occupano il primo sottolivello s danno origine ad un orbitale sferico. -Gli secondo sottolivello p danno origine a tre orbitali a forma di clessidra -Gli terzo sottolivello d danno origine a cinque orbitali a forma di quadrifoglio
-Gli orbitali che occupano il quarto sottolivello danno origine a sette orbitali. In ogni orbitale sono contenuti due elettroni. Per esprimere in maniera semplificata la disposizione degli elettroni allinterno dellatomo stata creata la cosiddetta configurazione elettronica. es.Li 1s2s A partire da terzo orbitale prima del sottolivello d trovo il sottolivello s dellorbitale successivo: questa peculiarit prende il nome di accavallamento. In natura esistono 92 elementi; i rimanenti sono stati sintetizzati in laboratorio. Quando un elemento completa lultimo livello energetico stabile; il neon ed altri gas in particolare si dicono gas nobili. Nella tavola di Mendeleev le righe orizzontali si dicono periodi e quelle verticali gruppi..
Legami ionici e covalenti Un composto ionico formato da due ioni che per differenza di carica si attraggono. La tendenza che ha un elemento ad acquistare elettroni si dice elettronegativit, al contrario la tendenza a perdere elettroni prende il nome di carattere metallico. Gli elementi che hanno una grande elettronegativit sono situati negli ultimi gruppi della tavola periodica, quelli a carattere metallico nei primi. Tra gli elementi che presentano grande differenza di elettronegativit si formano legami ionici; invece quando la differenza nulla o molto contenuta si creano legami covalenti. In questultimo caso gli elettroni vengono condivisi dagli atomi coinvolti ma comunque rispettata la regola dellottetto. -Nel frangente in cui un elettrone viene ceduto ad un altro elemento si parla di legame ionico . es. Il legame tra Na e Cl ionico Cl Formula di struttura: Ca Cl Il cloro in grado di formare un legame ionico. Il sodio in grado di formare due legami ionici. -Il legame covalente corrisponde ad una coppia di elettroni condivisi. Un legame in generale pu essere singolo, doppio o triplo. In un legame covalente non sempre la condivisione degli elettroni pari; in questo caso si dice che il legame covalente polare. Latomo pi elettronegativo prende il nome di polo negativo, lo ione meno elettronegativo costituisce il polo positivo. In generale possibile affermare che quando si ha una distribuzione di carica diseguale si forma un polo elettrico. indica un polo parzialmente positivo o negativo. La molecola dellacqua Nella molecola dellacqua sono presenti due + e due -. Gli orbitali s e p dellossigeno infatti si trasformano in quattro orbitali ibridi a forma di goccia che si dispongono nello spazio come i vertici di un tetraedro. Due di questi orbitali contengono un doppietto di elettroni e due un singoletto; questi ultimi condividono il singoletto con un atomo di idrogeno formando un legame covalente polare. Nella molecola dacqua cos ottenuta sia gli elettroni del doppietto e del singoletto sia quelli dellidrogeno tendono ad essere attratti dallossigeno e lasciano quindi isolato il protone dellidrogeno determinando un +. Dato che nella molecola dellacqua gli atomi di idrogeno sono due allora altrettanti sono i +. In corrispondenza di un + si posizioner un di carica opposta: il composto ottenuto il legame idrogeno. Esso un legame intermolecolare che si pu facilmente rompere portando lacqua in ebollizione. Al contrario il legame ionico un legame forte e intramolecolare.
CALORE E TEMPERATURA Gli isotopi si dicono pesanti quando il numero dei neutroni maggiore di quello dei protoni viceversa quando maggiore il numero dei protoni si parla di isotopi leggeri. Il legame idrogeno responsabile di molteplici propriet dellacqua e bench sia un legame debole in grado di riformarsi rapidamente. Se si ha da riscaldare un bicchiere di acqua ed uno di alcool in modo che raggiungano una stessa temperatura il tempo necessario ai due fluidi differente poich diverso anche il loro calore specifico. La caloria la quantit di calore che occorre per portare1 g di acqua da 14,5 gradi a 15,5 gradi. Se trasferisco calore aumenta lenergia cinetica. La quantit di calore dipende dalla massa ed la somma dellenergia cinetica delle molecole. La temperatura invece la media dellenergia cinetica delle molecole. Essendo luomo composto per il 60% da acqua non vi sono nel suo corpo grandi mutamenti di temperatura (dato che il calore specifico dellacqua molto elevato). Dal punto di vista energetico levaporazione sottrae energia allambiente pertanto in biologia il sudore che evapora raffredda un corpo.
IL pH In 18g dacqua ce un numero di molecole dacqua pari a 6,02*1023 1l dacqua pesa 1 Kg Su 1 l dacqua c una minima percentuale di molecole che si dissocia H20 H++OH idrogenione ossidrilione (ione ossidrile) (ione idrogeno) La minima percentuale [ H+ ]*[ OH- ]=10-14 costante di dissociazione dellacqua Il risultato esplicita che ci sono pochissime molecole dacqua che si dissociano. Per ogni particella dacqua che si dissocia si hanno un idrogenione ed un ossidrilione [ H+ ]*[OH-] =10-14 x*x= 10-14 x2=10-14 x2=10-14 logaritmo in base 10 -7 x=10 pH=7 il numero degli ioni idrogeno sempre uguale al numero degli ioni ossidrili idrogeno pH+pOH=14 [H+] =10-7 7+7=14
[OH-] =10-7 pH=3 [H+] =10-3 pH=7 [H+] =10-7 Se pH=3pOH=11 poich pH+pOH=14 Quando in una soluzione la concentrazione degli ioni idrogeno maggiore di quella degli ioni ossidrili, la soluzione si dice acida. Quando maggiore la concentrazione degli ioni ossidrili , la soluzione basica. In una soluzione acida il pH inferiore a 7. In una soluzione basica il pH maggiore di 7. Tanto pi il pH diminuisce, tanto pi la soluzione ricca di ioni idrogeno. HClH++Cl- acida poich il numero degli ioni idrogeno aumenta NaCl Na++ Cl- neutra poich non interferendo gli ioni idrogeno il pH rimane invariato NaOHNa++OH- basica poich il numero degli ioni idrogeno diminuisce quindi il pH aumenta. Il pH 5,5 neutro rispetto al pH della pelle. Il sudore acido perch una forma di difesa dai batteri. Il pH un elemento importante che gli esseri viventi tendono a mantenere nel loro interno prossimo al 7. La capacit di mantenere costante lambiente interno prende il nome di omeostasi. Ph temperatura per omeotermi. Dato che lacqua polare si lega con altre sostanze polari ; poich la maggioranza delle sostanze organiche sono polari si formano legami intermolecolari. Lacqua costituisce un ottimo solvente per le sostanze polari.Due sostanze polari si mescolano; una sostanza polare ed una apolare non si mescolano. Es. H2O e olio non si mescolano perch lolio apolare Lacqua gode pure delle seguenti caratteristiche: >mantiene costante lambiente grazie allelevato calore specifico dovuto al legame idrogeno; > disponibile per tutti gli esseri viventi; >si purifica facilmente mediante levaporazione (anche se lacqua piovana viene inquinata da sostanze presenti nellatmosfera).
Condensazione e idrolisi
Le reazioni chimiche sono volte a produrre energia e si dividono in condensazione e idrolisi. AH+BOH AB+HOH Lidrogeno va a sostituire la molecola B e B lidrogeno. Nella condensazione viene sempre eliminata dellacqua. AH+BOH AB+HOH Se si invertono i reagenti e i prodotti della prima formula viene consumata una molecola dacqua. lisi= rottura idro= (attraverso ) lacqua Le piogge acide hanno un pH minore di 7 e pertanto minacciano la flora. Lanidride carbonica , lanidride solforosa e altre sostanze inquinanti presenti nellatmosfera si legano con lacqua piovana contaminandola. Lunico rimedio sono le piante.
COMBUSTIBILI FOSSILI Il petrolio una miscela di idrocarburi ovvero di composti formati da carbonio e idrogeno. Lidrocarburo pi semplice il metano la cui formula bruta CH4 H Formula di struttura: HCH H H H HCCH H H H H H HCCCH H H H
Etano C2H6
Formula razionale:CH3CH3
Propano
Formula razionale: CH3CH2CH3
H H H H HCCCCH H H H H
Butano
Formula razionale: CH3CH2CH2CH3
A partire da C5H12 i nomi dei composti sono pentano, esano, ettano etc.
In certi idrocarburi non vi sono solo legami singoli ma anche doppi e tripli. Es. Butano H H H H HCC = CCH H H La molecola ottenuta dal legame doppio si dice insatura e la sostanza che si ricava il butene. Quando negli idrocarburi vi sono legami doppi si aggiunge il suffisso ene. Occorre inoltre specificare la posizione del legame 2 butene allinterno della molecola che si numera partendo da una sua estremit ( nel butene quindi le possibilit sono 1 o 2 butene ).
Lacetilene il gas usato dagli speleologi. Es. 2 butene H H H H H1C2C = 2C1CH H H
Analogamente esiste il legame triplo che, considerando ancora il butano come sostanza di partenza, da origine alla molecola del butino. Nei legami tripli tra gli atomi di carbonio il suffisso che si aggiunge al nome della sostanza quindi ino. Es. 2 butino H H H1C2C 2C1CH H H Pu accadere che il butano dia origine ad un composto ciclico: in questo caso si parla di ciclo butano (i legami sono singoli). Ciclo butano H H HCCH HCCH H H
Formula razionale:
H2CCH2 H2CCH2
Nella formula razionale si scrivono gli atomi di idrogeno allesterno poich il carbonio lelemento che ha quattro legami.
Il glucosio un aldeide ovvero appartiene ad una categoria particolare di composti organici che caratterizzano un gruppo funzionale. -Il gruppo OH il gruppo ossidrile e caratterizza gli alcoli. H HCOH H Se sostituiamo ad H un OH che ha una valenza, dal metano, otteniamo lalcool metilico o metanolo. - Dalletano ottengo invece, con uguale procedimento, lalcool etilico o etanolo che deriva da una fermentazione degli zuccheri presenti nelluva. H H HCCOH H H -Analogamente si opera con gli altri idrocarburi per ottenere i corrispettivi alcoli.
Chetoni e aldeidi
O RCH O RCR
gruppo aldeidico gruppo chetonico
-Il glucosio un aldeide: O CH C C
-Se il doppio legame tra O e C si ha che: H
HCH C=O C C
un chetone
I gruppi funzionali che caratterizzano le sostanze organiche sono: OH gruppo ossidrile
O RCH
gruppo aldeidico
O RCR
gruppo chetonico
O RCOH gruppo carbossilico RNH2
gruppo amminico
IL gruppo amminico contiene in R il C a differenza dellammoniaca che non un composto organico. LE SOSTANZE ORGANICHE Le quattro categorie fondamentali di sostanze organiche sono i carboidrati, le proteine, i lipidi e gli acidi nucleici. I carboidrati: Cn (H2O)n
Lamido una molecola organica formata da catene di molecole di glucosio Il lattosio invece formato da glucosio + galattosio ( monosaccaride + monosaccaride ) ed quindi un disaccaride come anche il saccarosio ( glucosio + fruttosio). MONOMERI: molecole semplici ovvero monosaccaridi POLIMERI: disaccaridi, polisaccaridi. In natura la produzione di carboidrati deriva dalla fotosintesi. I monosaccaridi ed i disaccaridi sono dolci. Il pane che costituito da amido che non dolce senonch lapparato digestivo in grado di produrre un enzima capace di rompere le sue catene mutare il sapore della mollica. La funzione biologica dei carboidrati fornire energia in tempi brevi.
Se si eccede nel loro utilizzo per questi attraverso il metabolismo dellindividuo tendono a trasformarsi in lipidi. H HCOH C=O RCOH Il fruttosio un chetone R indica il resto della molecola
O CH3CCH3
Lacetone un chetone, R in questo caso rappresentato da un idrocarburo
O HCOH
Lacido formico appartiene al gruppo carbossilico. In questo caso il resto della molecola H, se fosse stato CH3 avremmo ottenuto lalcool acetico.
I LIPIDI I lipidi dal punto di vista molecolare sono grandi molecole formate dal processo di esterificazione tra una molecola di glicerolo e tre acidi grassi.
Glicerolo
Acido grasso
H | HCOCCH2CH2. | HCOH | HCOH | H Gli acidi grassi hanno nel loro scheletro carbonioso un minimo di 10 atomi di carbonio. Quando in un acido grasso si trova un doppio legame tra due atomi di carbonio allora il grasso si dice insaturo ed meglio digeribile. Sono insaturi i grassi vegetali; quelli animali si dicono invece saturi. I lipidi sono poi molecole apolari e le loro principali funzioni biologiche sono riscaldare il corpo umano, aumentarne la resistenza ad urti meccanici e immagazzinare sostanze di riserva. Hanno un potere energetico doppio rispetto a quello dei carboidrati a parit di peso. I Fosfolipidi Particolare il caso dei fosfolipidi dove uno degli atomi di carbonio esterni del glicerolo si lega con con un gruppo fosforico rendendo la molecola parzialmente polare. Gli acidi nucleici si dicono qindi idrofobi ed il gruppo fosforico idrofilo. I fosfolipidi si trovano nelle celllule vegetali dove costituiscono la membrana cellulare: in questo frangente formano un doppio strato dove gli acidi grassi idrofobi si affacciano tra loro. Gli Ormoni Gli ormoni sono molecole complesse in che regolano determinate attivit prodotte da ghiandole endocrine ovvero che rilasciano il loro contenuto allinterno del sangue. Esempi di ghiandole endocrine sono il pancreas e la tiroide mentre sono ghiandole esocrine quelle che riversano il loro contenuto allesterno oppure in cavit in contatto con lesterno come le ghiandole sudoripare, salivari e digestive. Tra gli ormoni ricordiamo gli steroidi a cui appartengono il testosterone e gli ormoni estrogeni. Le Cere Le cere sono particolari grassi costituiti da un acido grasso legato ad un gruppo ossidrilico. Sono pi apolari dei comuni lipidi e pertanto sono presenti sulle ali degli uccelli, sulla patina di alcuni frutti (come le prugne; cere pruine) e sulle foglie di molti sempreverdi.
Il gruppo fosforico
O P OH OH OH LATP composto da tre atomi di fosforo e uno di adenosin. Gli atomi di fosforo sono uniti da legami covalenti che pur essendo forti si rompono abbastanza facilmente perch gli elettroni che vengono acquistati si respingono altamente. AP~P~P E ATPADP+P
LE PROTEINE Le proteine sono polimeri i cui mono meri sono 20 amminoacidi che si combinano tra loro mediante legame peptilico: una proteina formata quindi da due amminoacidi si dice bipeptide, una costituita da tre amminoacidi tripeptide etc. Gli amminoacidi hanno una loro struttura peculiare:
H H O | | NCCOH | | H R R il gruppo che caratterizza lamminoacido Un peptide linsieme di 15-30 amminoacidi; una proteina invece formata da 100-150 amminoacidi. E necessario un solo amminoacido anomalo percompromettere il funzionamento di tutta la proteina: il caso dellanemia falciforme in cui i globuli rossi assumono una caratteristica forma a falce e non riescono a trasportare lossigeno. Il risultato lagglutinazione.
Un amminoacido si dice nobile o essenziale quando deve essere assunto attraverso la dieta.
I ponti disolfuro si trovano nella struttura terziaria delle proteine e quando vengono rotti determinano la denaturazione delle proteine che perdono le loro peculiari caratteristiche organolettiche.
LA SRTRUTTURA DI UN NUCLEOTIDE I nucleotidi sono composti da uno zucchero ( il ribosio o il deossiribosio ), una base azotata (adenina, timina, citosina, guanina, uracile ) ed un gruppo fosfato che funziona da ponte tra due nucleotidi. Nucleotide:
BA D/R
( f.b.)
D/R= deossiribosio (DNA) o ribosio (RNA) BA= base azotata P= gruppo fosfato
IL DNA : IERI E OGGI
( immagine tratta da il Venerd di Repubblica n 779 )
LA DIFFUSIONE La diffusione consiste nello spostamento delle molecole da una zona in cui sono pi concentrate ad una in cui si trovano in quantit minore. Le particelle si espandono fino ad occupare tutto lo spazio disponibile a causa della forza gradiente. La diffusione alla base dellintroduzione e dellespulsione di gas nella cellula primi fra tutti lossigeno e lanidride carbonica. LOSMOSI Losmosi il passaggio di acqua attraverso una membrana biologica semipermeabile ed avviene sempre da una soluzione ipotonica ad una soluzione ipertonica. In una soluzione ipotonica troviamo una maggiore concentrazione del soluto rispetto ad una soluzione ipertonica. Quando la concentrazione tra due o pi soluzioni equamente ripartita allora si parla di soluzioni isotoniche. La concentrazione dellacqua prende il nome di potenziale idrico. Un esempio di membrana semipermeabile la pellicina bianca presente sotto il guscio calcareo delluovo. Per constatare losmosi di una cellula animale come luovo occorre sciogliere il guscio con sostanze acide (es. acido citrico, acetico, sostanze anticalcare etc.). Durante questa operazione si pone luovo entro un flacone che contiene dellacqua e quando sulla superficie del fluido appaiono delle bolle allora significa che lacido sta agendo sul guscio. Una volta sciolto il calcare si pulisce luovo sotto lacqua corrente di un normale lavello dopodich lo si inserisce in un recipiente dove precedentemente abbiamo versato una soluzione di sale ed acqua calda. Successivamente si prepara un secondo uovo che immergeremo nellacqua distillata.
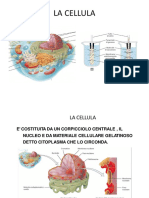
Dopo alcuni giorni si nota che luovo nella soluzione salina tende a diminuire le sue dimensioni mentre laltro si gonfia. La teoria cellulare Nel 1838 lo scienziato tedesco Schwann arriva alla conclusione che tutti gli animali sono formati da cellule; lanno seguente il conterraneo Schleider formula la stessa ipotesi per i vegetali. Cos nasce la teoria cellulare secondo cui tutti gli esseri viventi sono costituiti da cellule che hanno le stesse funzioni (si riproducono, respirano, si cibano etc.) e sono la pi piccola unit vivente a noi conosciuta. Lo studio delle cellule la citologia. Dimensioni delle cellule Allinterno di un organismo le cellule presentano determinate dimensioni in base al rapporto tra lArea superficiale (ovvero la membrana cellulare) e il Volume. Pertanto le cellule non devono essere n troppo grandi n troppo piccole, anche perch un esagerato volume renderebbe difficili i contatti tra il nucleo e la periferia della cellula. Il fatto che esistano molte cellule di dimensioni contenute comporta che queste si specializzino formando tessuti e organi, consentendoci di compiere azioni anche relativamente complesse.
Unit di misura metro (m) centimetro (cm): 10-2m millimetro (mm): 10-3m micrometro o micron (mm): 10-6m manometro (nm): 10-9m Le cellule hanno normalmente una dimensione compresa tra i 10 ed i 100 micron. Fanno eccezione ,tra le altre, le cellule nervose, quelle muscolari e le cellule uovo.
Potrebbero piacerti anche
- Esercitazione Ca 2 PDFDocumento11 pagineEsercitazione Ca 2 PDFfrancescolapoNessuna valutazione finora
- Dispensa Esercizi 01Documento45 pagineDispensa Esercizi 01xevni100% (1)
- Come Calcolare Le Pareti Di Un Silo RettangolareDocumento40 pagineCome Calcolare Le Pareti Di Un Silo Rettangolareantonioviton07vkNessuna valutazione finora
- Guida Operativa Docfa 4Documento120 pagineGuida Operativa Docfa 4matrokNessuna valutazione finora
- Sperimentazione Su Tavola VibranteDocumento12 pagineSperimentazione Su Tavola VibrantefrancescolapoNessuna valutazione finora
- Schemi StaticiDocumento1 paginaSchemi StaticifrancescolapoNessuna valutazione finora
- SagomarioDocumento3 pagineSagomariofrancescolapoNessuna valutazione finora
- De Matteis - Anatomia1 20-21 PDFDocumento94 pagineDe Matteis - Anatomia1 20-21 PDFStefano OuterGod CosentinoNessuna valutazione finora
- Biologia Capitolo 4Documento55 pagineBiologia Capitolo 4Arianna ManderioliNessuna valutazione finora
- Le SpezieDocumento4 pagineLe Spezieandrea valenzaNessuna valutazione finora
- Tesi 2Documento222 pagineTesi 2dirac80Nessuna valutazione finora
- Q91 MASTER DomandeDocumento8 pagineQ91 MASTER DomandeMariachiara AmbrogioNessuna valutazione finora
- Compito Veterinaria 2015Documento16 pagineCompito Veterinaria 2015Skuola.netNessuna valutazione finora
- Dimagrire PotasiuDocumento102 pagineDimagrire PotasiuLus AmelieNessuna valutazione finora
- Tecar-Terapia Nelle Tendinopatie Della Cuffia Dei RotatoriDocumento4 pagineTecar-Terapia Nelle Tendinopatie Della Cuffia Dei RotatoricarmineNessuna valutazione finora