Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
1-3-Propiededes Termodinamicas de Las Sustancias Puras
Caricato da
mi_am_ca5322Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
1-3-Propiededes Termodinamicas de Las Sustancias Puras
Caricato da
mi_am_ca5322Copyright:
Formati disponibili
1
UNIVERSIDAD DE CRDOBA
FACULTAD DE CIENCIAS AGRICOLAS
PROGRAMA DE INGENIERIA DE ALIMENTOS
CURSO DE FISICOQUIMICA DE ALIMENTOS
UNIDAD 3: PROPIEDADES TERMODINMICAS DE LAS
SUSTANCIAS PURAS
Ing. RAMIRO TORRES GALLO
IV SEMESTRE
MONTERA, COLOMBIA
Universidad de
Crdoba,
comprometida
con el
desarrollo
regional.
2
OBJETIVO
Establecer el concepto de fase y equilibrio entre
fases
Describir el comportamiento de las sustancias
puras frente a variaciones de presin y
temperatura.
Identificar las caractersticas de los estados de una
sustancia pura.
Analizar los diagramas de fase de sustancias puras
Identificar y determinar las condiciones de
aplicacin de las ecuaciones de estado.
3
CONTENIDO
3.1 INTRODUCCIN
3.2 SUSTANCIAS PURAS Y FASES
3.3 EQUILIBRIO LQUIDO VAPOR PARA UNA
SUSTANCIA PURA
3.4 VOLMENES ESPECFICOS Y DIAGRAMA Pv
3.5 DIAGRAMAS DE FASES PT
3.6 DIAGRAMAS Tv
3.7 DIAGRAMAS P-v-T
3.8 ECUACIONES DE ESTADO
3.9 ECUACIONES DE ESTADO PARA GASES REALES
3.10 APLICACIONES EN LA INDUSTRIA DE ALIMENTOS
4
3.1. INTRODUCCIN
En las operaciones de separacin que con
gran frecuencia se encuentran en la
industria qumica y en el procesamiento de
alimentos se presentan con equilibrios
entre fases los cuales dependen de
propiedades como la presin, la
temperatura y la composicin de las fases.
Con el conocimiento del comportamiento
de las sustancias puras y las leyes de la
termodinmica se resuelven muchos de los
problemas cotidianos que se presentan en
el campo de la ingeniera.
5
EL AGUA ?
Sustancia pura abundante en aplicaciones
industriales, por eso, se toma como
sustancia de referencia y se estudian sus
propiedades en diferentes fases y los
cambios que presenta cuando se somete a
procesos de calentamiento o enfriamiento,
compresin o expansin.
Es necesario conocer la forma de utilizar las
tablas de propiedades termodinmicas para
el agua y hacer extensiva esta aplicacin a
cualquier sustancia pura.
6
SUSTANCIA PURA
Es aquella que est constituida por una sola
clase de tomos o por una sola clase de
molculas, (un elemento o de un compuesto).
Bajo determinadas condiciones una mezcla
que tenga una composicin definida puede
ser considerada y manejada como si fuese
una sustancia pura. Un ejemplo de esta
situacin lo constituye el aire.
3.2 SUSTANCIAS PURAS Y FASES
7
FASES
Fase es una regin o porcin de materia
fsicamente distinta, la cual tiene una
composicin fija y unas propiedades
definidas en toda su extensin, por lo tanto
es homognea en todas sus partes.
El agua a presin atmosfrica y por debajo de
0 c forma una fase slida, entre 0 C y 100 C
es lquida y por encima de 100 C estar
como vapor. Cada una de estas fases es
distinta de las otras aunque la composicin
qumica es la misma.
8
En un recipiente apropiado que permite la
transferencia de calor se tiene hielo a -20 C y
1 atmsfera de presin (101,325 kPa) y
siguiendo un proceso isobrico se suministra
calor a este sistema Qu cree que va a
suceder?
9
Siempre que coexistan dos fases en
equilibrio a una determinada presin, la
temperatura debe ser constante.
10
3.3 EQUILIBRIO LQUIDO VAPOR PARA
UNA SUSTANCIA PURA
11
LQUIDO SUBENFRIADO
Si el lquido se encuentra por debajo de la
temperatura de saturacin
VAPOR SOBRECALENTADO
Si el vapor se encuentra a una temperatura
superior a la temperatura de saturacin
LQUIDO SATURADO O VAPOR SATURADO.
Si el lquido o el vapor se encuentran
precisamente a a la temperatura de
saturacin
12
VOLUMEN ESPECIFICO DEL LIQUIDO
SATURADO, Vf
3.4 VOLMENES ESPECFICOS Y
DIAGRAMA Pv
L
L
f
m
V
v =
VOLUMEN ESPECIFICO DEL VAPOR
SATURADO, V
g
.
En la presin critica el V
f
= Vg
v
v
g
m
V
v =
13
DIAGRAMA PV PARA EQUILIBRIO LQUIDO
VAPOR
14
CALIDAD, x
Propiedad para cuantificar la proporcin de
vapor presente en una mezcla vapor
El volumen especfico global de la mezcla de
lquido y vapor se puede determinar conociendo
los volmenes especficos de lquido saturado y
de vapor saturado,
m
m
x
v
=
v L
v
m m
m
x
+
=
g L
xv v x v + = ) 1 (
15
Como se determinan las propiedades de una
sustancia pura en equilibrio liquido vapor?
Experimentalmente donde para cada presin
se determina la temperatura de equilibrio.
Mediante ecuaciones o mtodos numricos
para temperaturas o presiones de saturacin,
densidades o volmenes especficos, energa
interna, la entalpa y la entropa.
Mediante tablas.
A travs de Internet, por programas de
computador que suministran esta informacin.
16
3.5 DIAGRAMA DE FASE PT
Diagrama de fase PT, para sustancia pura que se
contrae al congelarse
17
Diagrama de fase PT, para sustancia pura que se
expande al congelarse
18
3.6 DIAGRAMA Tv
Diagrama Tv, para el equilibrio liquido vapor
19
3.7 DIAGRAMAS P-v-T
Diagrama Tv, para el equilibrio liquido vapor
20
3.8 ECUACIONES DE ESTADO
El estado de una sustancia pura se describe
en funcin de propiedades intensivas como P,
v y T, las cuales se relacionan mediante
ecuaciones conocidas generalmente como
ecuaciones de estado.
La ms sencilla de ellas es la muy conocida
ecuacin de estado de gas ideal
La mayora de los gases reales a presiones
bajas, como la presin atmosfrica y
temperaturas iguales o superiores a las del
medio ambiente, tienen un comportamiento
ideal.
21
ECUACIONES DE ESTADO DEGAES
IDEALES
M RT Pv nRT V P nRT PV / ; ; = = =
22
3.9 ECUACIONES DE ESTADO PARA GASES
REALES
Los gases reales se apartan en mayor o
menor medida del comportamiento ideal
dependiendo de su naturaleza, de la cercana al
punto crtico.
A presiones elevadas o a temperaturas muy
bajas que se encuentren prximas a las de
condensacin y en estos casos no se puede
utilizar la ecuacin de gas ideal ya que el error
que se comete es muy grande.
El grado de desviacin de la idealidad se
determina por el factor de compresibilidad Z.
23
ECUACIN FACTOR DE COMPRESIBILIDAD Z
RT
V p
V
V
Z
id
=
El valor de Z se obtiene de las grficas o
correlaciones generalizadas de
compresibilidad para lo cual es necesario
conocer las presiones y temperaturas
reducidas definidas como
c
r
c
r
T
T
T
P
P
P = =
24
CALCULO DE Z
r
r
c
c
T
P
RT
BP
RT
BP
Z
|
|
.
|
\
|
+ = + = 1 1
Con coeficientes viriales generalizados
para Vr 2
1 0
B B
RT
BP
c
c
e + =
|
|
.
|
\
|
2 , 4
1
6 , 1
0
172 , 0
139 , 0
422 , 0
083 , 0
r r
T
B
T
B = =
7 , 0
) log( 1
=
r
T
sat
r
P e
25
CALCULO DE Z
1 0
Z Z Z e + =
Con factores de compresibilidad
generalizados para Vr 2
Los tres parmetros
disponibles con mejor
resultado son los de Lee y
Kesler. Consultar Tablas en
termodinmica
Z
0
y Z
1
son funcin de la T
r
y P
r
26
ECUACIN DE VAN DER WAALS
2
V
a
b V
RT
P
=
c
c
c
c
P
RT
b
P
T R
a
8 64
27
2 2
= =
ECUACIN DE REDLICH- KWONG
5 , 0
) ( T b V V
a
b V
RT
P
+
=
c
c
c
c
P
RT
b
P
T R
a
0866 , 0 427 , 0
5 , 2 2
= =
27
ECUACIN VIRIAL
...
...
3
3
2
2 1
0
3
3
2
2 1 0
+ + + + =
+ + + + =
V
B
V
B
V
B
B
RT
V P
P A P A P A A
RT
V P
Consultra otras ecuaciones
de estado
28
Los alimentos frescos o procesados son
mezclas coloidales de composicin compleja
Sin embargo el comprender estas relaciones
en sustancias puras ayuda en la formacin de
un criterio cientfico y tcnico frente al manejo
de estas variables
Ingeniero de Alimentos tendr que manejar
conceptos de evaporacin, cristalizacin,
extraccin, destilacin, humidificacin, secado
donde tienen aplicacin los conceptos
estudiados en este captulo.
3.10 APLICACIONES EN LA INDUSTRIA
DE ALIMENTOS
29
CONTESTAR EL CUSTIONARIO DE
CONCEPTUALIZACION Y ANALISIS
EN AULA VIRTUAL.
ACTIVIDADES DE APRENDIZAJE
Solucin de
Ejercicios
en clase
30
1. Determine los valores de la presin de
saturacin del agua a las temperaturas
de 50,100, 150, 200, 250, 300, 350 y
374,14 C. Con ellos realice un grfico
de Presin contrab temperatura. Qu
puede concluir de este grfico?
2. Determine la temperatura y las masas
de lquido y de vapor presentes en un
vapor hmedo cuya calidad es de 0,8 si
se encuentra en un tanque de 0,1 m3 a
una presin de 150 kPa.
EJERCICIOS
31
3. Determine la temperatura y la presin a
las cuales comienza la condensacin del
vapor de agua que se encuentra en un
tanque cerrado a 200 kPa y 250 C.
4. Determine el volumen, la masa, la
densidad y el volumen especfico del aire
contenido en un recinto que tiene 20 m de
largo, 10 m de ancho y 4 m de alto a 30 C
y 0,73 atmsferas.
EJERCICIOS
32
5. El etileno es un gas que se utiliza con
mucha frecuencia en la creacin de
atmsferas controladas para la
maduracin de frutas. Como parte un
trabajo de investigacin se necesita
determinar la presin que generaran 100
moles de etileno en un recipiente de50
litros a una temperatura de 27 C.
Determine este valor utilizando la
ecuacin de a) gas ideal, b) van der Waals
c) Redlich- Kwong Para el etileno Pc =
5,03 MPa Tc = 282 K. Qu concluye al
respecto?
EJERCICIOS
33
VAN NESS SMITH, Abbott. Introduccin a la termodinmica en la ingeniera
qumica. Mxico: Mc Graw Hill, 1997.
J. VAN WYLEN, Gordon y E. SONNTAG, Richard. Fundamento de
termodinmica. Mxico: Limusa, 1980.
CASTELLAN, Gilbert W. Fisicoqumica. Mxico: Fondo Educativo
Interamericano S.A., 1976.
MARON y PRUTTON. Fundamento de fisicoqumica. Limusa Wiley.
LEVINE, Ira N. Fisicoqumica. Espaa: Vol. I y II. Mc Graw Hill, 1996.
SERWAY, Raymond A. Fsica. Mxico: Tomo I y II. Mc Graw Hill, 1994.
LPEZ TASCON, Carlos. Mecnica newtoniana. Santaf de Bogot:
Universidad Nacional de Colombia, 1995.
BIBILOGRAFIA
Potrebbero piacerti anche
- Capacitacion Sobre EtasDocumento19 pagineCapacitacion Sobre Etasmi_am_ca5322100% (1)
- Lista de Chequeo para RestaurantesDocumento3 pagineLista de Chequeo para Restaurantesmi_am_ca532259% (39)
- BPM ServicioComida 2011Documento70 pagineBPM ServicioComida 2011Adonai SalaNessuna valutazione finora
- Manual Poes MelonDocumento81 pagineManual Poes Melonmi_am_ca5322Nessuna valutazione finora
- Manual Poes MelonDocumento81 pagineManual Poes Melonmi_am_ca5322Nessuna valutazione finora
- Listaa de Chequeo Cafeteria de La U San BuenaventuraDocumento21 pagineListaa de Chequeo Cafeteria de La U San Buenaventurami_am_ca5322Nessuna valutazione finora
- ArepaDocumento176 pagineArepami_am_ca532257% (7)
- Revision - Microencapsulacion de AlimentosDocumento17 pagineRevision - Microencapsulacion de Alimentosmi_am_ca5322Nessuna valutazione finora
- Perfil Sanitario ResueltoDocumento16 paginePerfil Sanitario Resueltomi_am_ca5322Nessuna valutazione finora
- Codex GoudaDocumento6 pagineCodex Goudami_am_ca5322Nessuna valutazione finora
- Diferencias Entre Clases de QuesosDocumento1 paginaDiferencias Entre Clases de Quesosmi_am_ca5322Nessuna valutazione finora
- Leches Concentrada OriginalDocumento16 pagineLeches Concentrada Originalmi_am_ca5322100% (1)
- Leche UhtDocumento7 pagineLeche Uhtmi_am_ca5322Nessuna valutazione finora
- Aspectos Del Diseño de PlantasDocumento28 pagineAspectos Del Diseño de Plantasmi_am_ca5322Nessuna valutazione finora
- 1 05 Pasteurizacin2012 130224094511 Phpapp02Documento37 pagine1 05 Pasteurizacin2012 130224094511 Phpapp02Josee LuissNessuna valutazione finora
- Sigale RastroDocumento5 pagineSigale Rastromi_am_ca5322Nessuna valutazione finora
- LOCALIZACIÓNDocumento21 pagineLOCALIZACIÓNmi_am_ca53220% (1)
- 1-5. - Memoria SancristobalDocumento50 pagine1-5. - Memoria SancristobalFrancisco Alfredo Macal Castillo100% (1)
- Plan de Comunicación Aguapen EP-SANTA ELENADocumento16 paginePlan de Comunicación Aguapen EP-SANTA ELENAsamborondonradioNessuna valutazione finora
- HS - Sika ViscoCrete SC-70Documento5 pagineHS - Sika ViscoCrete SC-70adderly menaNessuna valutazione finora
- Práctica - Sólidos Diseltos TotalesDocumento5 paginePráctica - Sólidos Diseltos TotalesLaura Barrera AmyaNessuna valutazione finora
- AbreviaturasDocumento36 pagineAbreviaturasCristian González RobleroNessuna valutazione finora
- Musa-Es-17-2 - Manual Del UsuarioDocumento44 pagineMusa-Es-17-2 - Manual Del UsuarioOmarValdezNessuna valutazione finora
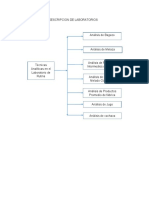
- Lab OratoriosDocumento27 pagineLab OratoriosJairo ZuñigaNessuna valutazione finora
- Elementos de Un DesarenadorDocumento13 pagineElementos de Un DesarenadorDaniel Alex Fernandez AlemanNessuna valutazione finora
- Es Realmente Costa Rica Líder en Conservación Del AmbienteDocumento2 pagineEs Realmente Costa Rica Líder en Conservación Del AmbienteAlonso CordobaNessuna valutazione finora
- Biodegradación de Colorante Azul Índigo Mediante CDocumento9 pagineBiodegradación de Colorante Azul Índigo Mediante CRP 1998Nessuna valutazione finora
- Formulas Ingeniería Sanitaria IiDocumento4 pagineFormulas Ingeniería Sanitaria IiDanielOrdoñezNessuna valutazione finora
- Práctica 3. Propiedades Físicas en ContextoDocumento3 paginePráctica 3. Propiedades Físicas en Contextonatalia gonzalezNessuna valutazione finora
- P COR SIB 05.04 Inspecciones Ambientales - V01Documento16 pagineP COR SIB 05.04 Inspecciones Ambientales - V01Juan CarlosNessuna valutazione finora
- Resumen para ExamenDocumento9 pagineResumen para ExamenCarlos Infante PerezNessuna valutazione finora
- Parcial 1 EcoDocumento22 pagineParcial 1 EcoYULIANA ANDREA CÁRDENAS MORENONessuna valutazione finora
- MiniReview Aprovechamiento Integral de Subproductos Avícolas (AVANCE)Documento16 pagineMiniReview Aprovechamiento Integral de Subproductos Avícolas (AVANCE)Mary Luz Suero ItoNessuna valutazione finora
- Wa0021.Documento14 pagineWa0021.Sukigarm MmkNessuna valutazione finora
- Ev6 Proceso de Elaboración de La Cátsup Con Chile MorrónDocumento48 pagineEv6 Proceso de Elaboración de La Cátsup Con Chile MorrónIrving Ochoa100% (1)
- Archivo Pesado de 21 MB EIA Provisur PDFDocumento953 pagineArchivo Pesado de 21 MB EIA Provisur PDFPiero DurandNessuna valutazione finora
- Hidrogeologia Lotes 8 y 1abDocumento10 pagineHidrogeologia Lotes 8 y 1abJezuz LhNessuna valutazione finora
- Hipoclorito de CalcioDocumento6 pagineHipoclorito de CalcioBoris Ivan VacaNessuna valutazione finora
- Construccion de Tubulones Con Aire Comprimido Dennys ArcienegaDocumento68 pagineConstruccion de Tubulones Con Aire Comprimido Dennys ArcienegaDennys Marcel Arcienega Flores100% (3)
- La Historia de La Costa Verde y de La Ciudad Que Conquistó Su Mar - Lima - Perú - Historias - El Comercio PerúDocumento12 pagineLa Historia de La Costa Verde y de La Ciudad Que Conquistó Su Mar - Lima - Perú - Historias - El Comercio PerúCesarNessuna valutazione finora
- Medidas de Cierre y Post CierreDocumento2 pagineMedidas de Cierre y Post Cierreyerlin tolentino duranNessuna valutazione finora
- El Rey Del Rio de OroDocumento52 pagineEl Rey Del Rio de OroPedro Jose Guzman PajaroNessuna valutazione finora
- Deshidratacion Por Refrigeracion ExpansivaDocumento4 pagineDeshidratacion Por Refrigeracion ExpansivaJohana JCNessuna valutazione finora
- Samsung Galaxy S7 Edge Manual SM-G935F, Marshmallow, SpanishDocumento179 pagineSamsung Galaxy S7 Edge Manual SM-G935F, Marshmallow, SpanishtrueIM471100% (1)
- Memoria Descriptiva - Barranca Bonito - ActDocumento57 pagineMemoria Descriptiva - Barranca Bonito - ActArturo ChinoNessuna valutazione finora
- Cuánto CO2 Absorbe Un ÁrbolDocumento5 pagineCuánto CO2 Absorbe Un ÁrbolAlexis Manchego Centty86% (7)
- Proyecto Final SanitariaDocumento13 pagineProyecto Final SanitariaMauricio Enrique Botello HannoverNessuna valutazione finora