Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Cartel 2.0
Caricato da
Jose Antonio MartinezCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Cartel 2.0
Caricato da
Jose Antonio MartinezCopyright:
Formati disponibili
Universidad Nacional Autónoma de México
Facultad de Química
Título: EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA
Integrantes: Ramos Consuelo Juan Carlos , Posadas Rodríguez David Mauricio,
Villafranca Martinez Jose Antonio
Laboratorio de Equilibrio y Cinética 108, Edificio B 1er Piso
Ciudad de México, 2 de Abril del 2019
Resumen: Esta práctica consistió en obtener distintas mediciones de volumen a partir de la variación de temperatura.
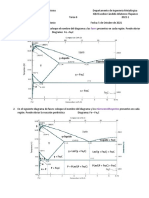
Objetivo general: Comprender e interpretar el significado de las variables Análisis de resultados:Comenzando el experimento sólo estaba presente
termodinámicas involucradas en la ecuación de Clausius-Clapeyron, para aire dentro de la probeta y conforme se fue calentando el sistema
aplicarlas en la determinación de la entalpía de vaporización de una comenzó a aparecer vapor de agua. Por el gráfico de presión contra
sustancia. temperatura se pudo notar que aunque no muestran un comportamiento
Introducción: El equilibrio físico es aquel en donde las fases se encuentran lineal evidente pero si muestran un comportamiento lógico. La presión
a la misma presión, temperatura, composición química, la energía libre de parcial del vapor de agua aumenta junto con la temperatura debido a que
gibbs es igual a cero así como el potencial químico. el agua en estado líquido empieza a evaporarse, dotando de más volumen
La entalpía de vaporización esta es la energía necesaria que hay que de vapor al sistema, y por ende, aumentando su presión, sin embargo la
suministrar a un sistema para que pase de líquido a vapor sus unidades son presión de nuestro sistema siempre es igual a la presión atmosférica, así
J/mol,cal/mol . que si la presión parcial del vapor aumenta necesariamente la presión del
La ecuación de Clausius-Clapeyron donde una fase es condensada y la aire tiene que disminuir para mantener la presión atmosférica como una
otra es un gas que se considera como ideal. Es conveniente para el constante.
equilibrio en la vaporización y en la sublimación: En cuanto a la gráfica de Ln(P) vs 1/T podemos notar que entre el 1/T
𝑃2 ߡvapH dt(𝑇1−𝑇2) aumenta el Ln(P) disminuye provocando así una tendencia lineal de
𝐿𝑛 = ,pero P1 normalmente se toma con un valor de 1
𝑃1 𝑅𝑇1 𝑇2 pendiente negativa, este comportamiento lo explica la siguiente ecuación:
−ߡvapHm 𝑇1 −𝑇2 −ߡvapHm 𝑇1−𝑇2
por lo que la ecuación queda finalmente como:𝐿𝑛 𝑃 = ( ) 𝐿𝑛 𝑃 = ( ) la cual vista para el método gráfico es la
𝑅 𝑇1 𝑇2 𝑅 𝑇1 𝑇2
Metodología: El experimento comenzó con la adición de 900 mL de agua al −ߡvapHm 1
vaso Berzelius, para después colocar una probeta de 50 mL boca abajo siguiente: 𝐿𝑛 𝑃 = + 𝑏
𝑅 𝑇
dentro del vaso Berzelius de manera que se generará una burbuja dentro −ߡvapH dLn(P)
donde: y=Ln(P) m= -= = 1 b= es la ordenada al origen
de ella enseguida se debe meter el vaso Berzelius en un baño de hielo para 𝑅 𝑑
𝑇
que con la modificación de la temperatura se pudieran observar las lo que nos permite el cálculo de la entalpía de vaporización, cuyo cálculo
variaciones de volumen dentro de la probeta. salió con un porcentaje de error mínimo debido a que los datos fueron
Resultados: Valor teórico de 40668.5 Jmol Cálculo del porcentaje de error proporcionados por el profesor ya que esta práctica no la pudimos realizar
40668.5 J/mol−40519.4 J/mol
ΔHVaporización %Error= 𝟏𝟎𝟎 correctamente por que no se logró bajar la temperatura del sistema.
40668.5 J/mol
Valor experimental 40519.4 Jmol %Error= 𝟎. 𝟑𝟕% Conclusiones:
de ΔHVaporización Se demostró experimentalmente que las leyes de Dalton y Charles se
cumplen para cualquier sistema termodinámico abierto, asi como
Transformación de las temperaturas : 0C+273.15=273.15 K tambien se puedo llegar a concluir que la ecuación de Clapeyron funciona
𝑉𝑎𝑖𝑟𝑒1(𝑇2) (8.97𝑚𝐿)(278.15𝑘)
Volumen de aire: Vaire 2= = =9.13mL para determinar ΔHVaporización.
𝑇1 273.15
Volumen de vapor: Vvapor = Vexperimental – Vaire También se pudo comprobar la relación proporcional entre volumen,
Vvapor = 9.27 mL – 9.13 mL = 0.14 mL temperatura y presión.
𝑉𝑎𝑖𝑟𝑒 8.97𝑚𝐿 Referencias:Chang R.(2008).Fisicoquímica.México:McGrawHill
Para el cálculo de Yaire: Yaire: = =1
𝑉𝑚𝑒𝑧𝑐𝑙𝑎 8.97𝑚𝐿
𝑉𝑣𝑎𝑝𝑜𝑟 0𝑚𝐿
Para el de la Yvapor de agua: ==0
𝑉𝑚𝑒𝑧𝑐𝑙𝑎 8.97𝑚𝐿
Pparcial de aire=(Yaire)(Patm)=(1)(585 mmHg)=585mmHg
Pparcial de vapor de agua =(Yvapor de agua)(Patm)=(0)(585 mmHg)=0 mmHg
1/T=1/273.15=3.66x10-3 K-1
Ln(P vapor)=Ln(8.57)=2.15
Hvap
Cálculo ΔHvap donde m=-
𝑅𝑇
ΔHvap = -RTm== -(8.314 Jmol K)(-4873.63 K)=40519.36 Jmol
Vvapor
Vaire Pparcialaire/ Pvapagua/ -1
Evento T (C) Vexp (mL) T (K) calculado/ Y (aire) Y (vapor) T /(K -1) ln Pvap
calculado/(mL) (mmHg) (mmHg)
(mL)
1 0 8.97 273.15 8.97 0 1 0.0000 585.00 0.00 0.00366
2 5 9.27 278.15 9.13 0.14 0.9854 0.0146 576.43 8.57 0.00360 2.148
3 10 9.5 283.15 9.30 0.20 0.9788 0.0212 572.59 12.41 0.00353 2.519
4 15 9.73 288.15 9.46 0.27 0.9725 0.0275 568.92 16.08 0.00347 2.777
5 20 10 293.15 9.63 0.37 0.9627 0.0373 563.17 21.83 0.00341 3.083
6 25 10.3 298.15 9.79 0.51 0.9506 0.0494 556.09 28.91 0.00335 3.364
7 30 10.64 303.15 9.96 0.68 0.9356 0.0644 547.35 37.65 0.00330 3.628
8 35 11.04 308.15 10.12 0.92 0.9166 0.0834 536.22 48.78 0.00325 3.887
9 40 11.52 313.15 10.28 1.24 0.8927 0.1073 522.21 62.79 0.00319 4.140
10 45 12.11 318.15 10.45 1.66 0.8627 0.1373 504.70 80.30 0.00314 4.386
11 50 12.85 323.15 10.61 2.24 0.8258 0.1742 483.11 101.89 0.00309 4.624
12 55 13.81 328.15 10.78 3.03 0.7803 0.2197 456.48 128.52 0.00305 4.856
13 60 15.08 333.15 10.94 4.14 0.7255 0.2745 424.41 160.59 0.00300 5.079
14 65 16.85 338.15 11.10 5.75 0.6590 0.3410 385.53 199.47 0.00296 5.296
15 70 19.45 343.15 11.27 8.18 0.5794 0.4206 338.93 246.07 0.00291 5.506
Potrebbero piacerti anche
- Produccion Punto 5Documento15 pagineProduccion Punto 5Orlando Munar Benitez75% (4)
- TRABAJO PRÁCTICO N°4 Quimica General Grupo 5Documento11 pagineTRABAJO PRÁCTICO N°4 Quimica General Grupo 5thiago100% (1)
- Calidad Del Ajuste en Regresión Lineal Simple 1Documento12 pagineCalidad Del Ajuste en Regresión Lineal Simple 1MAGDALENA50% (10)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDa EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSValutazione: 4.5 su 5 stelle4.5/5 (7)
- Modelos Matemáticos para Ciencias Experimentales by Horra Navarro, Julián deDocumento253 pagineModelos Matemáticos para Ciencias Experimentales by Horra Navarro, Julián deCristobal100% (1)
- PRACTICA 4. Influencia de La Presión Sobre El Punto de Ebullición.Documento13 paginePRACTICA 4. Influencia de La Presión Sobre El Punto de Ebullición.David VNessuna valutazione finora
- Practica 6 Quimica UPIICSADocumento7 paginePractica 6 Quimica UPIICSATann MetoxiNessuna valutazione finora
- Practica 7 Capacidad CalorificaDocumento6 paginePractica 7 Capacidad CalorificaRaúl FonsecaNessuna valutazione finora
- Practica 1 Quimica IndustrialDocumento20 paginePractica 1 Quimica IndustrialAreely Alvaarez100% (2)
- Villafranca Martinez Fundicion Tarea 1 (2022-1)Documento3 pagineVillafranca Martinez Fundicion Tarea 1 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Problemas de Ingeniería EconomicaDocumento4 pagineProblemas de Ingeniería EconomicaGisela Aneita60% (5)
- PRESIÓN DE VAPOR DE LÍQUIDO LabDocumento5 paginePRESIÓN DE VAPOR DE LÍQUIDO LabJuan Nicanor Marmolejos MartinezNessuna valutazione finora
- Informe - 3. Presion de VaporDocumento4 pagineInforme - 3. Presion de VaporLoreAl AbreoNessuna valutazione finora
- Informes de Fisicoquimica 1Documento166 pagineInformes de Fisicoquimica 1vannyaNessuna valutazione finora
- Presion de Vapor y Entalpia de Vaporizacion de AguaDocumento12 paginePresion de Vapor y Entalpia de Vaporizacion de AguaAlexia NajeraNessuna valutazione finora
- Presion de Vapor de Un Liquido PuroDocumento5 paginePresion de Vapor de Un Liquido PuroJohn Didier Cardenas Nieto100% (2)
- Informe Presion de VaporDocumento6 pagineInforme Presion de VaporElizabeth M. TuberquiaNessuna valutazione finora
- Guia 3 - Presión de VaporDocumento3 pagineGuia 3 - Presión de VaporCamiloNessuna valutazione finora
- YaDocumento7 pagineYaGISELLA SOFIA LEAL PERTUZNessuna valutazione finora
- Pract 2. Determinación de La Presión de Vapor y Entalpia de Vaporización Del AguaDocumento13 paginePract 2. Determinación de La Presión de Vapor y Entalpia de Vaporización Del AguaIsabel Francisco Rivera100% (1)
- Fisico Qui MicaDocumento9 pagineFisico Qui Micaal3j4ndr0escobar20Nessuna valutazione finora
- Laboratorio Entalpia de VaporizacionDocumento11 pagineLaboratorio Entalpia de VaporizacionIz RemyNessuna valutazione finora
- Informe de Presion de Vapor2Documento18 pagineInforme de Presion de Vapor2Lauriza Giraldo HuamanNessuna valutazione finora
- Informe 9 Calor de VaporizacionDocumento11 pagineInforme 9 Calor de VaporizacionDanny Paredes LayzaNessuna valutazione finora
- Informe #6 - Presión de VaporDocumento11 pagineInforme #6 - Presión de VaporCARLOS ALBERTO SANCHEZ RUIZNessuna valutazione finora
- Informe N°4 - Presión de VaporDocumento11 pagineInforme N°4 - Presión de VaporDevra GomezNessuna valutazione finora
- Practica Equilibrio Liquido Vapor de Un ComponenteDocumento10 paginePractica Equilibrio Liquido Vapor de Un ComponenteJose Antonio Chavez BiaisNessuna valutazione finora
- Reporte Peso AireDocumento3 pagineReporte Peso AireNoelia Jimenez FernandezNessuna valutazione finora
- Presión de Vapor - Laboratorio Fisicoquímica 1Documento43 paginePresión de Vapor - Laboratorio Fisicoquímica 1AyudaFIQ-SMNessuna valutazione finora
- Lab 1 FisicoquimicaDocumento11 pagineLab 1 FisicoquimicaBEATRIZ ROSARIO SULCA QUILCANessuna valutazione finora
- Informe P3 Presion de VaporDocumento6 pagineInforme P3 Presion de Vaporpoeta urbaNessuna valutazione finora
- Entalpía de EbulliciónDocumento4 pagineEntalpía de EbulliciónAbygail RHNessuna valutazione finora
- FQR Lab 1 Parte 1Documento23 pagineFQR Lab 1 Parte 1Efrain PerazaNessuna valutazione finora
- RESUMEN Presion VaporDocumento8 pagineRESUMEN Presion VapormiguelNessuna valutazione finora
- Práctica 3 - Presion de VaporDocumento8 paginePráctica 3 - Presion de VaporEduardo Sánchez MaldonadoNessuna valutazione finora
- Práctica Presión de VaporDocumento9 paginePráctica Presión de VaporyairpinelzNessuna valutazione finora
- Pre1 - Daniela Rodriguez324519 PDFDocumento5 paginePre1 - Daniela Rodriguez324519 PDFAlejandra RodriguezNessuna valutazione finora
- PRACTICA 1equilibrio Liquido-Vapor Presion de Vapor y Entalpia de Vaporizacion Del AguaDocumento7 paginePRACTICA 1equilibrio Liquido-Vapor Presion de Vapor y Entalpia de Vaporizacion Del AguaTeresa ChiNa R. Ornelas100% (1)
- Informe #4 Presión de Vapor - UNMSMDocumento13 pagineInforme #4 Presión de Vapor - UNMSMJheferson Alcocer100% (5)
- Practica de Laboratorio 1Documento8 paginePractica de Laboratorio 1ercilia pañao aguilarNessuna valutazione finora
- Influencia de La Temperatura en La Presión de VaporDocumento16 pagineInfluencia de La Temperatura en La Presión de VaporVanessa TrianaNessuna valutazione finora
- Cambios de FaseDocumento11 pagineCambios de FaseFercho GarciaNessuna valutazione finora
- Práctica 1 - Lab Integral II - Jesus Aguillon VillegasDocumento28 paginePráctica 1 - Lab Integral II - Jesus Aguillon VillegasJesus AguillonNessuna valutazione finora
- Cartel 5Documento2 pagineCartel 5Liliana SayagoNessuna valutazione finora
- Presion de Vapor LaboratorioDocumento15 paginePresion de Vapor LaboratorioJhojan MallquiNessuna valutazione finora
- Potencial TermodinamicoDocumento8 paginePotencial TermodinamicoFernanda MartinezNessuna valutazione finora
- Guía Laboratorio N°1 - Grupo 4 - Vaporización - Ing de Procesos 2023Documento10 pagineGuía Laboratorio N°1 - Grupo 4 - Vaporización - Ing de Procesos 2023Aaron FigueroaNessuna valutazione finora
- Laboratorio de Fisicoquímica 1, Reporte 3, Ley de Los GasesDocumento5 pagineLaboratorio de Fisicoquímica 1, Reporte 3, Ley de Los GasesPerez AvyNessuna valutazione finora
- Equilibrio Líquido VaporDocumento10 pagineEquilibrio Líquido VaporAlNessuna valutazione finora
- Presion de Vapor (Fisica)Documento18 paginePresion de Vapor (Fisica)Avs AlbertoNessuna valutazione finora
- Práctica 3 Presión de VaporDocumento9 paginePráctica 3 Presión de VaporLucero TrujilloNessuna valutazione finora
- Presion de VaporDocumento7 paginePresion de VaporManuel Alexander Huamán YánacNessuna valutazione finora
- Pre2 César Ramírez336145Documento4 paginePre2 César Ramírez336145Alvarez Mendez JoanaNessuna valutazione finora
- Practica 1 Quimica IndustrialDocumento20 paginePractica 1 Quimica IndustrialcecilioNessuna valutazione finora
- Practica 4 QUIMICA APLICADA ESIMEZDocumento11 paginePractica 4 QUIMICA APLICADA ESIMEZCamila Mendoza GaonaNessuna valutazione finora
- Practica 5 Lab QuimicaDocumento27 paginePractica 5 Lab QuimicaDante AgredaNessuna valutazione finora
- Informe Tema 2Documento13 pagineInforme Tema 2Daniel Vargas TrujilloNessuna valutazione finora
- PRACTICA N.1docx PDFDocumento3 paginePRACTICA N.1docx PDFBeymar ContrerasNessuna valutazione finora
- Practica 5 Determinación Experimental de La Presión de Vapor de Un LíquidoDocumento9 paginePractica 5 Determinación Experimental de La Presión de Vapor de Un LíquidoEvelin SánchezNessuna valutazione finora
- Analisis Experimental de Un Proceso Isocorico de Un Gas IdealDocumento30 pagineAnalisis Experimental de Un Proceso Isocorico de Un Gas IdealJheferson VillarNessuna valutazione finora
- UNMSM Informe Presión de Vapor - Grupo 1ADocumento15 pagineUNMSM Informe Presión de Vapor - Grupo 1AELVA JACQUELINE GAMARRA SANDOVALNessuna valutazione finora
- Entalpia de Un LiquidoDocumento8 pagineEntalpia de Un LiquidoSantiago Castro RengifoNessuna valutazione finora
- Practic 9Documento9 paginePractic 9nelsonelloNessuna valutazione finora
- Psicometría. Principios básicos y protocolos experimentales diversosDa EverandPsicometría. Principios básicos y protocolos experimentales diversosNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 8 (2022-1)Documento9 pagineVillafranca Martinez Fundicion Tarea 8 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 6 (2022-1)Documento4 pagineVillafranca Martinez Fundicion Tarea 6 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 3 (2022-1)Documento8 pagineVillafranca Martinez Fundicion Tarea 3 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 5 (2022-1)Documento12 pagineVillafranca Martinez Fundicion Tarea 5 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 4 (2022-1)Documento7 pagineVillafranca Martinez Fundicion Tarea 4 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 7 (2022-1)Documento7 pagineVillafranca Martinez Fundicion Tarea 7 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Serie 4 Tecnicas Selectas 2022-2Documento5 pagineSerie 4 Tecnicas Selectas 2022-2Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 3 (2022-1)Documento8 pagineVillafranca Martinez Fundicion Tarea 3 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Reporte Actividad 5Documento3 pagineReporte Actividad 5Jose Antonio MartinezNessuna valutazione finora
- Reporte Actividad 3Documento4 pagineReporte Actividad 3Jose Antonio MartinezNessuna valutazione finora
- Villafranca Martinez Fundicion Tarea 2 (2022-1)Documento4 pagineVillafranca Martinez Fundicion Tarea 2 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Reporte Actividad 4Documento3 pagineReporte Actividad 4Jose Antonio MartinezNessuna valutazione finora
- MF Cuestionario 01Documento3 pagineMF Cuestionario 01Jose Antonio MartinezNessuna valutazione finora
- Al P3 H Eléctricos Sem 22-2Documento12 pagineAl P3 H Eléctricos Sem 22-2Jose Antonio MartinezNessuna valutazione finora
- Reporte Actividad 2Documento3 pagineReporte Actividad 2Jose Antonio MartinezNessuna valutazione finora
- MF Cuestionario 02Documento5 pagineMF Cuestionario 02Jose Antonio MartinezNessuna valutazione finora
- IM 22-1 JAGH PRACTICA 1. Microscopía Metalográfica Óptica: Técnicas de ObservaciónDocumento11 pagineIM 22-1 JAGH PRACTICA 1. Microscopía Metalográfica Óptica: Técnicas de ObservaciónJose Antonio MartinezNessuna valutazione finora
- Al P1 Identificación de 22-1Documento16 pagineAl P1 Identificación de 22-1Jose Antonio MartinezNessuna valutazione finora
- IM P3 H Nodulares 2022-1Documento24 pagineIM P3 H Nodulares 2022-1Jose Antonio MartinezNessuna valutazione finora
- Cap IIIB Unid de Fus y TF 2022-1Documento57 pagineCap IIIB Unid de Fus y TF 2022-1Jose Antonio MartinezNessuna valutazione finora
- Cap II Nom y Clasif Al 2022-1Documento46 pagineCap II Nom y Clasif Al 2022-1Jose Antonio MartinezNessuna valutazione finora
- Cap IIIA Unid de Fus y TF 2022-1Documento69 pagineCap IIIA Unid de Fus y TF 2022-1Jose Antonio MartinezNessuna valutazione finora
- Cap I Introducción 2022-1Documento21 pagineCap I Introducción 2022-1Jose Antonio MartinezNessuna valutazione finora
- Al P5 Desgasificación 22-2Documento25 pagineAl P5 Desgasificación 22-2Jose Antonio MartinezNessuna valutazione finora
- Fundición Tarea 7 (2022-1)Documento7 pagineFundición Tarea 7 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Fundición Tarea 6 (2022-1)Documento4 pagineFundición Tarea 6 (2022-1)Jose Antonio MartinezNessuna valutazione finora
- Al P2 H Crisol Sem 22-1Documento18 pagineAl P2 H Crisol Sem 22-1Jose Antonio MartinezNessuna valutazione finora
- 1er Parc Al 2022-1 OKDocumento4 pagine1er Parc Al 2022-1 OKJose Antonio MartinezNessuna valutazione finora
- 1er Parc Al 2022-1 OKDocumento4 pagine1er Parc Al 2022-1 OKJose Antonio MartinezNessuna valutazione finora
- 02 Polinomios PDFDocumento4 pagine02 Polinomios PDFpedroNessuna valutazione finora
- Calculo de Acometida para Vivienda MultifamiliarDocumento9 pagineCalculo de Acometida para Vivienda MultifamiliarLuisSuaBallénNessuna valutazione finora
- Tema 13 Áreas de Figuras PlanasDocumento8 pagineTema 13 Áreas de Figuras PlanasKlaudiaMejiaValenciaNessuna valutazione finora
- Diagrama Del CirculoDocumento11 pagineDiagrama Del CirculoMiguel Ln100% (2)
- Recursamiento de Geometría Analítica - Abril 2023Documento2 pagineRecursamiento de Geometría Analítica - Abril 2023Cristian Francisco Nah AbanNessuna valutazione finora
- Matriz de Ponderacion PDFDocumento38 pagineMatriz de Ponderacion PDFCarol Hidalgo Lopez100% (2)
- Caja Negra (Psicología)Documento3 pagineCaja Negra (Psicología)Ozzyel CrowleyNessuna valutazione finora
- Modulo 5 Basico Perimetro Area PDFDocumento10 pagineModulo 5 Basico Perimetro Area PDFClaudia Arévalo AguayoNessuna valutazione finora
- Racionalización de Denominadores - 4toDocumento3 pagineRacionalización de Denominadores - 4tolucho 393Nessuna valutazione finora
- Ensayo de Topografía-3Documento2 pagineEnsayo de Topografía-3edwinNessuna valutazione finora
- Manual de Laboratorio de Análisis Instrumental 2Documento120 pagineManual de Laboratorio de Análisis Instrumental 2E Leonel Leonel Gonzales BarrionuevoNessuna valutazione finora
- Teoria de ProduccionDocumento43 pagineTeoria de ProduccionRosmeri Delinda QUISPE FLORESNessuna valutazione finora
- Aplicacion MatricesDocumento3 pagineAplicacion MatricesHenry Lois Davila Andrade100% (1)
- Actividad 1Documento7 pagineActividad 1maria lozano100% (1)
- Problema - Regla de ChvorinovDocumento3 pagineProblema - Regla de ChvorinovRaul AlcántaraNessuna valutazione finora
- Rivas 2009 PDFDocumento194 pagineRivas 2009 PDFCésarAugustoSantanaNessuna valutazione finora
- Tema 29 - Tronco de ConoDocumento2 pagineTema 29 - Tronco de ConoEdu YMNessuna valutazione finora
- Vazquez - Yamilet - Expresiones - RacionalesDocumento4 pagineVazquez - Yamilet - Expresiones - Racionalesyamilet VazquezNessuna valutazione finora
- Secuencia de Juego Reglado para Sala AmarillaDocumento3 pagineSecuencia de Juego Reglado para Sala AmarillaCecilia PereyraNessuna valutazione finora
- Ejercicios de Probabilidad y Estadística PDFDocumento121 pagineEjercicios de Probabilidad y Estadística PDFDanny Van DammeNessuna valutazione finora
- Muestreo - Diseño y ProcedimientosDocumento4 pagineMuestreo - Diseño y ProcedimientosElio TamaNessuna valutazione finora
- Esperanza MatemáticaDocumento3 pagineEsperanza MatemáticaDayan MonroyNessuna valutazione finora
- Boletin 4 - Geometría - Areas de Regiones SombreadasDocumento16 pagineBoletin 4 - Geometría - Areas de Regiones SombreadasAlejandro Arenas OreNessuna valutazione finora
- VPN (Vidas Iguales)Documento2 pagineVPN (Vidas Iguales)JesusNessuna valutazione finora
- Actividades Didácticas Que Potencian La Enseñanza de Las Matemáticas en La Orientación Del Aprend PDFDocumento110 pagineActividades Didácticas Que Potencian La Enseñanza de Las Matemáticas en La Orientación Del Aprend PDFSofiRuizNessuna valutazione finora
- Ingenieria Del Conocimiento ArticuloDocumento5 pagineIngenieria Del Conocimiento ArticuloCarlos SantanaNessuna valutazione finora