Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Sesion 03. Fqamb - Intr. Gaseos
Caricato da
juancalp810 valutazioniIl 0% ha trovato utile questo documento (0 voti)
21 visualizzazioni21 pagineEstado Gaseoso
Titolo originale
Sesion 03. Fqamb_intr. Gaseos
Copyright
© © All Rights Reserved
Formati disponibili
PPTX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoEstado Gaseoso
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PPTX, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
21 visualizzazioni21 pagineSesion 03. Fqamb - Intr. Gaseos
Caricato da
juancalp81Estado Gaseoso
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PPTX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 21
Universidad Nacional de San Agustín de
Arequipa
Facultad de Ingeniería de Procesos
Escuela Profesional de Ingeniería Ambiental
FISICOQUIMICA AMBIENTAL
SESION N° 04
LAS LEYES DE LOS
GASES
MSC. ING. JUAN CARLOS LICONA PANIAGUA
jlicona@unsa.edu.pe
1
CONTENIDO
1. COMPETENCIA
2. INTRODUCCIÓN
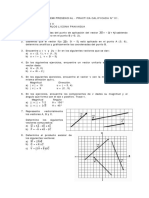
3. LEY DE BOYLE
4. LEY DE CHARLES
5. LEY COMBINADA DE LOS GASES
6. PRINCIPIO DE AVOGADRO
LAS LEYES DE LOS GASES
1.- COMPETENCIA
Comprende los conceptos básicos de las
leyes de los gases ideales que permita aplicar
cada una de ellas para comprender el
comportamiento del estado gaseoso
resolviendo problemas de manera objetiva y
actitud positiva.
LAS LEYES DE LOS GASES
2.- INTRODUCCION
Estados de agregación de la
materia
Sólido Líquido Gaseoso
LAS LEYES DE LOS GASES
2.- INTRODUCCION
Un Gas y Vapor son el mismo estado
de agregación (estado gaseoso).
• Gas: sustancia en estado gaseoso a
T° y P ambientales. Este gas para
licuarlo primero hay que comprimirlo
y luego enfriarlo o viceversa.
• Vapor: es la forma gaseosa
obtenida por calentamiento de
cualquier sustancia liquida o solida a
T° y P ambientales. Para licuar es
suficiente enfriarla o comprimirla.
LAS LEYES DE LOS GASES
2.- INTRODUCCION
• Gases Ideales: no hay interacción molecular. Su
volumen es despreciable en comparación con el del
recipiente que lo contiene.
• Gases Reales: existe colisión entre las moléculas. No
obedecen las leyes de los gases ideales.
Gases Ideales Gases Reales
LAS LEYES DE LOS GASES
3.- LEY DE BOYLE A temperatura constante el volumen (V)
ocupado por un una masa definida de un
gas es inversamente proporcional a la
presión aplicada.
Robert Boyle, (1627-1691)
Filósofo, químico, físico e
inventor Irlandes.
LAS LEYES DE LOS GASES
3.- LEY DE BOYLE PV = k ( n, T, constante)
LAS LEYES DE LOS GASES
3.- LEY DE BOYLE
LAS LEYES DE LOS GASES
3.- LEY DE BOYLE
EJEMPLO DE LA LEY DE BOYLE
Una muestra de oxigeno ocupa 10 L bajo una presión de
790 torr, ¿a qué presión debería ocupar éste en un
volumen de 13.4 L, si la temperatura no cambia?
LAS LEYES DE LOS GASES
4.- LEY DE CHARLES Jack Charles estudió por primera vez la
relación entre el volumen y la
temperatura de una muestra de gas a
presión constante.
1746 - 1823
Observó que cuando se
aumentaba la temperatura, el
volumen del gas también
aumentaba y que al enfriar el
volumen disminuía.
LAS LEYES DE LOS GASES
4.- LEY DE CHARLES
LAS LEYES DE LOS GASES
4.- LEY DE CHARLES
LAS LEYES DE LOS GASES
4.- LEY DE CHARLES
EJEMPLO DE LA LEY DE CHARLES
Una muestra de nitrógeno ocupa 117 mL a 100 °C . ¿A qué
temperatura debería el gas ocupar 234 mL si la presión no
cambia?
V1 = 117mL
T1 = 100 °C + 273 = 373 K
V2 = 234 mL
T2 =?
LAS LEYES DE LOS GASES
5.- LEY COMBINADA DE LOS GASES
LEY DE BOYLE LEY DE CHARLES
LAS LEYES DE LOS GASES
5.- LEY COMBINADA DE LOS GASES
EJEMPLO 1 DE LA LEY COMBINADA
Una muestra de neón ocupa 105 L a 27 °C bajo una presión
de 985 torr. ¿Cuál es el volumen que debería ocupar el gas a
temperatura y presión estándar (STP)?
V1 = 105 L P1 = 985 torr T1 = 27°C +273 =300 K
V2 = ? P2 = 760 torr T2 = 273 K
LAS LEYES DE LOS GASES
5.- LEY COMBINADA DE LOS GASES
EJEMPLO 2 DE LA LEY COMBINADA
Los neumáticos de un coche deben estar a una presión de
1.8 atm a 20ºC. Con el movimiento se calientan hasta
50ºC, pasando su volumen de 50 a 50.5 litros. ¿Cuál será la
presión del neumático tras la marcha?
V1 = 50 L P1 = 1.8 atm T1 = 20°C + 273 K = 293 K
V2 = 50.5 L P2 = ? T2 = 50°C + 273 K = 323K
LAS LEYES DE LOS GASES
6.- PRINCIPIO DE AVOGADRO
Cerca del año de 1811, Amadeo
Avogadro postuló que a la misma
temperatura y presión, a igual
volumen de todos los gases contienen
el mismo número de moléculas.
A T° y P constantes, el volumen V
ocupado por una muestra de gas, es
1776- 1856 directamente proporcional al número
de moles “n”, del gas.
LAS LEYES DE LOS GASES
6.- PRINCIPIO DE AVOGADRO
LAS LEYES DE LOS GASES
6.- PRINCIPIO DE AVOGADRO
LAS LEYES DE LOS GASES
ESO ES TODO
JOVENES
Potrebbero piacerti anche
- Manual MedlabqcDocumento16 pagineManual MedlabqcsaulmamaniNessuna valutazione finora
- Toma de Muestra de SangreDocumento12 pagineToma de Muestra de SangreJOSE DUBERLEE TAVARA VEGANessuna valutazione finora
- Sesion 03. Fqamb - Intr. GaseosDocumento16 pagineSesion 03. Fqamb - Intr. Gaseosjuancalp81Nessuna valutazione finora
- Tema 1 - Introduccion Al Estado GaseosoDocumento27 pagineTema 1 - Introduccion Al Estado Gaseosojuancalp8150% (2)
- Sesion 02 - 2018. Grs - Conceptos BasicosDocumento42 pagineSesion 02 - 2018. Grs - Conceptos Basicosjuancalp81Nessuna valutazione finora
- Sesion 02. Fqamb - Conceptos BasicosDocumento15 pagineSesion 02. Fqamb - Conceptos Basicosjuancalp81Nessuna valutazione finora
- Tema 3 - Mezcla de Gases - Gases RealesDocumento29 pagineTema 3 - Mezcla de Gases - Gases Realesjuancalp81Nessuna valutazione finora
- Sesion 03. Fqamb - Intr. GaseosDocumento16 pagineSesion 03. Fqamb - Intr. Gaseosjuancalp81Nessuna valutazione finora
- Practica 02 FQ 2018Documento3 paginePractica 02 FQ 2018juancalp81100% (1)
- Prac Calif 02 Precalc II 2018 00Documento2 paginePrac Calif 02 Precalc II 2018 00juancalp81Nessuna valutazione finora
- Cap4 - Impactos Ambientales en Mineria - LiconaDocumento33 pagineCap4 - Impactos Ambientales en Mineria - Liconajuancalp81Nessuna valutazione finora
- Proyeccion Social - Rosa Quispe MayhuaDocumento7 pagineProyeccion Social - Rosa Quispe Mayhuajuancalp81Nessuna valutazione finora
- Proyeccion Social - Carla PaloDocumento7 pagineProyeccion Social - Carla Palojuancalp81Nessuna valutazione finora
- Prac Calif 01 Precalc II 2018 00Documento3 paginePrac Calif 01 Precalc II 2018 00juancalp81Nessuna valutazione finora
- Cap1. Declaracion de Impacto AmbientalDocumento40 pagineCap1. Declaracion de Impacto Ambientaljuancalp81Nessuna valutazione finora
- Generalidades Proyectos MinerosDocumento21 pagineGeneralidades Proyectos Minerosjuancalp81Nessuna valutazione finora
- Cap1. Declaracion de Impacto AmbientalDocumento40 pagineCap1. Declaracion de Impacto Ambientaljuancalp81Nessuna valutazione finora
- Gran Fraude Vs Una Verdad IncomodaDocumento2 pagineGran Fraude Vs Una Verdad Incomodajuancalp81Nessuna valutazione finora
- Presentacion Matriz AADocumento10 paginePresentacion Matriz AAjuancalp81Nessuna valutazione finora
- Clase Modelo Ecuaciones Diferenciales ExactasDocumento10 pagineClase Modelo Ecuaciones Diferenciales Exactasjuancalp81Nessuna valutazione finora
- Silabo Aud Amb 2017Documento5 pagineSilabo Aud Amb 2017juancalp81Nessuna valutazione finora
- Cap1. Declaracion de Impacto AmbientalDocumento40 pagineCap1. Declaracion de Impacto Ambientaljuancalp81Nessuna valutazione finora
- Sesion 01. Grs. Presentacion Del CursoDocumento20 pagineSesion 01. Grs. Presentacion Del Cursojuancalp81Nessuna valutazione finora
- Prac 2 - Ceprunsa 2018 I FaseDocumento3 paginePrac 2 - Ceprunsa 2018 I Fasejuancalp81Nessuna valutazione finora
- Cap1 Ses1 Hidrologia Conceptos 2017 UltDocumento38 pagineCap1 Ses1 Hidrologia Conceptos 2017 Ultjuancalp81Nessuna valutazione finora
- 1er Examen Parcial Hidrol - LICONADocumento5 pagine1er Examen Parcial Hidrol - LICONAjuancalp81Nessuna valutazione finora
- Ejercicios de Practica 01 - FQ.Documento4 pagineEjercicios de Practica 01 - FQ.juancalp81Nessuna valutazione finora
- Practica 3Documento3 paginePractica 3juancalp81Nessuna valutazione finora
- Prac 1 - Ceprunsa 2018 I FaseDocumento2 paginePrac 1 - Ceprunsa 2018 I Fasejuancalp810% (1)
- Silabo Operaciones y Procesos Unitarios - 2017Documento5 pagineSilabo Operaciones y Procesos Unitarios - 2017juancalp81Nessuna valutazione finora
- Taller 1. Identificando Residuos SolidosDocumento4 pagineTaller 1. Identificando Residuos Solidosjuancalp81Nessuna valutazione finora
- Texto 3Documento20 pagineTexto 3EdDy BrahanNessuna valutazione finora
- Antología de QuímicaDocumento27 pagineAntología de QuímicaGustavo LeyvaNessuna valutazione finora
- 2.6 Técnicas de Administración Del Planificador.: La Planificación FIFODocumento7 pagine2.6 Técnicas de Administración Del Planificador.: La Planificación FIFOhasedrekjesk83Nessuna valutazione finora
- Terra Fusion Extractor ComerciallDocumento1 paginaTerra Fusion Extractor ComerciallJonathan Uriel Velarde MendezNessuna valutazione finora
- Andrea Mora-Elementos Básicos Del Diseño - TallerDocumento11 pagineAndrea Mora-Elementos Básicos Del Diseño - TallerAndrea MoraNessuna valutazione finora
- Examen de Tecnologia (Reparado)Documento3 pagineExamen de Tecnologia (Reparado)Ing. Oscar Rojas HernandezNessuna valutazione finora
- El Jardin Del Sol y La LunaDocumento40 pagineEl Jardin Del Sol y La LunaJesel Andrea Contreras EscobarNessuna valutazione finora
- Esquemas de LenguaDocumento45 pagineEsquemas de LenguaEVA_83Nessuna valutazione finora
- Diseño, Desarrollo y Construcción de Pirámide Regular y TruncadaDocumento2 pagineDiseño, Desarrollo y Construcción de Pirámide Regular y TruncadaLuis David Preciado MartinezNessuna valutazione finora
- Manual OJS AutorDocumento15 pagineManual OJS AutorDanaNessuna valutazione finora
- CALORDocumento39 pagineCALORGrace MartinezNessuna valutazione finora
- GUADAMUDDocumento12 pagineGUADAMUDyajairavera91Nessuna valutazione finora
- Ejemplos Arreglos Serie-ParaleloDocumento5 pagineEjemplos Arreglos Serie-ParaleloJUan de diosNessuna valutazione finora
- Marco ReferencialDocumento17 pagineMarco ReferencialElvis MariñoNessuna valutazione finora
- Resumen de Capitulo 11 y 12Documento21 pagineResumen de Capitulo 11 y 12Dario Ronald Poma LaimeNessuna valutazione finora
- Sumas 2Documento8 pagineSumas 2Celso JuàrezNessuna valutazione finora
- TEV2Documento3 pagineTEV2Federico BrunoNessuna valutazione finora
- Guia 2 Est. 10 ItidaDocumento11 pagineGuia 2 Est. 10 ItidaGiovanisAragónNessuna valutazione finora
- Sistema de Registro Académico y AdmisionesDocumento2 pagineSistema de Registro Académico y AdmisionesJulian QuimbayaNessuna valutazione finora
- Petzl - Acceso Por Cuerdas - Nivel 1Documento171 paginePetzl - Acceso Por Cuerdas - Nivel 1Joao Murrieta RattoNessuna valutazione finora
- Unidad C U A T R O: Vibraciones Libres AmortiguadasDocumento12 pagineUnidad C U A T R O: Vibraciones Libres AmortiguadasJonathan Valera VazquezNessuna valutazione finora
- El Consumidor PDFDocumento14 pagineEl Consumidor PDFDiego Rubiano GomezNessuna valutazione finora
- Mapas Mentales - Funciones y DerivadasDocumento5 pagineMapas Mentales - Funciones y DerivadasAldair100% (2)
- Determinación de La Densidad de Solidos y LíquidosDocumento15 pagineDeterminación de La Densidad de Solidos y LíquidosBrandon ThomasNessuna valutazione finora
- Instituto de Educacion Comfenalco "Consuelo Montoya Gil": Álvaro de Jesús Múnera QuiramaDocumento4 pagineInstituto de Educacion Comfenalco "Consuelo Montoya Gil": Álvaro de Jesús Múnera QuiramaRodolfo German Flores OyarceNessuna valutazione finora
- Vegetacion Tema 3Documento14 pagineVegetacion Tema 3ALEJANDRO AMARO MAGAÑANessuna valutazione finora
- Sismicidad Inducida Por El MinadoDocumento55 pagineSismicidad Inducida Por El MinadoKevin Márquez100% (4)
- Upgrade de Software UMTS, LTEDocumento16 pagineUpgrade de Software UMTS, LTEsantiago30101987Nessuna valutazione finora