Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Hiperplasia Da Supra Renal
Caricato da
Rafael Rodrigues de Castro Barboza0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
495 visualizzazioni41 pagineHiperplasia da supra-renal em pediatria
Copyright
© Attribution Non-Commercial (BY-NC)
Formati disponibili
PPT, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoHiperplasia da supra-renal em pediatria
Copyright:
Attribution Non-Commercial (BY-NC)
Formati disponibili
Scarica in formato PPT, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
495 visualizzazioni41 pagineHiperplasia Da Supra Renal
Caricato da
Rafael Rodrigues de Castro BarbozaHiperplasia da supra-renal em pediatria
Copyright:
Attribution Non-Commercial (BY-NC)
Formati disponibili
Scarica in formato PPT, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 41
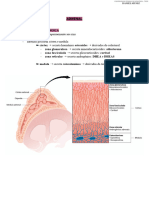
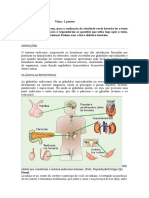
Supra-renal
• As glândulas supra-renais, que têm um
comprimento de cerca de 5 centímetros, estão
localizadas na cavidade abdominal,
anterosuperiormente aos rins. Encontram-se ao
nível da 12ª vértebra torácica, e são irrigadas
pelas artérias supra-renais.
• Cada glândula é composta por duas regiões
histologicamente distintas, que recebem
aferências moduladoras do sistema nervoso.
• É constituída de 2 sistemas endócrinos:
medular e cortical
• As células cromafins da medula são
derivadas do neuroectoderma, enquanto
as células do córtex originam-se do
mesoderma
• o córtex, de acordo com a organização
arquitetural das células que o compõem, é
dividido em :
– Zona glomerulosa: a mais externa, logo
abaixo da cápsula
– Zona fasciculada: a zona intermediária entre
a zona glomerulosa e a ...
– Zona reticula: a zona mais interna, em
contato com a medula
• As células da zona glomerulosa produzem
aldosterona, o mineralocorticóide natural mais
potente em seres humanos
• A zona fasciculada produz cortisol, o
glicocorticóide natural mais potente em seres
humanos
• E a zona fasciculada e reticulada produzem
os androgênios supra-renais
• Esteroidogênese:
tudo começa com a
conversão do
colesterol em
pregnenolona. Esta é
a primeira etapa da
esteróidogênese e
também a etapa
limitadora de
velocidade
•
• O colesterol pode ser sintetizado pelas
células produtoras de esteróides a partir
do acetato, porém a maioria do colesterol
para a esteroidogênese provém das
lipoproteínas plasmáticas circulantes
• Ele é incorporado às células através da
LDL, que se liga a um receptor de
superfície
• A secreção de glicocorticóides pela SR é
regulada pelo ACTH produzido na hipófise
• O ACTH é liberado em surtos de secreção
de amplitude variável durante o dia e a
noite
• Isso reflete diretamente nos surtos de
secreção de cortisol
• A secreção é mais alta ao despertar, baixa
ao fim da tarde e início da noite e tem seu
ponto mais baixo uma ou duas horas após
o início do sono
• Resumidamente o ACTH aumenta a
captação do colesterol-LDL e a produção
de hormônios esteróides
• O CRH é o hormônio estimulador da
secreção de ACTH
• O cortisol exerce efeito de feedback
negativo sobre a secreção de ACTH e o
próprio ACTH exerce feedback negativo
ao nível do hipotálamo
• Os principais reguladores da secreção de
aldosterona são o sistema renina-
angiotensina e o potássio
Aparelho justaglomerular > renina > renina
+ alfa2 globulina > angiotensina I
ECA – produzida nos pulmões
Angiotensina II e III
Estimulação da secreção de aldosterona e efeito
vasopressor
• Esse sistema é ativado por: privação de
sódio, redução do volume sanguíneo, da
pressão arterial e do fluxo sanguíneo renal
• Já o potássio aumenta diretamente a
secreção de aldosterona pelo córtex da
supra-renal
• Glicocorticóides: afetam o metabolismo da
maioria dos tecidos, entrando dentro das
células por difusão passiva e fixando-se a
receptores, regulando a síntese de RNA e
proteínas
• Tem efeito catabólico em: músculos, pele,
tecido conjuntivo, adiposo e linfóide.
• Tem efeito anabólico no fígado, onde
aumentam o conteúdo de proteínas e
glicogênio.
• Androgênios: são responsáveis pelos
caracteres sexuais secundários
masculinos ( pêlos axilares e púbicos)
• O DHEAS é o androgênio mais abundante
na circulação.
• A medula supra-renal produz
catecolaminas: dopamina, epinefrina e
noradrenalina.
• As catecolaminas também são produzidas
no cérebro, terminações nervosas
simpáticas e tecido cromafim fora da
medula da supra-renal
• Patologia:
• Hiperplasia supra-renal congênita:
• É um distúrbio autossômico recessivo da
esteroidogênese SR que resulta em
deficiência de cortisol
• Sua deficiência aumenta a produção de
ACTH, que por sua vez causa hiperplasia
da supra-renal, com acúmulo de
hormônios intermediários
• Deficiência de 21-hidroxilase:
• É responsável por 90% dos casos de
HSRC
• Forma identificadas três síndromes
distintas dessa deficiência:
– Androgenitalismo perdedor de sal
– Androgenitalismo virilizante simples
– Androgenitalismo não-clássico, que é
assintomática ou associada apenas a
sintomas de excesso de androgênios
• A síndrome perdedora de sal resulta da
incapacidade de converter a progesterona
em desoxicorticosterona, devido a
ausência total de 21 hidroxilase.
• não há produção de aldostenora e
também ocorre produção deficiente de
cortisol
• Esse padrão manifesta-se pouco depois
do nascimento, pois os eletrólitos ainda
são mantido normais in utero pelos rins
maternos
• Ocorrem perda de sal, hiponatremia e
hipercalemia, que induzem acidose,
hipotensão, colapso cardiovascular e
possivelmente morte.
• O bloqueio concomitante da síntese de
cortisol e produção excessiva de
androgênios levam à virilização, que é
facilmente reconhecida no sexo feminino
• É encontrado desde aumento discreto do
clítoris, até fusão lábio escrotal completa e
aumento acentuado do clítoris envolvendo
a uretra, produzindo assim, um ógão
falóide
• Em geral, recém nascidos do sexo
masculino com esse distúrbio não são
reconhecidos ao nascimento porém
chamam a atenção clínica 5 a 15 dias
após o nascimento, devido a alguma crise
de perda de sal
• A Síndrome androgenital virilizante
simples sem perda de sal, pode surgir
com defeito parcial da 21-hidroxilase
• O nível de mineralocorticóide, ainda que
reduzido, é suficiente para reabsorção de
sal.
• Os níveis diminuídos de glicocorticóides
não conseguem inibir por retroalimentação
os níveis de ACTH
• Os níveis de testosterona estão elevados,
assim como a hiperplasia da SR, devido a
grande concentração de ACTH
• O virilismo supra-renal não clássico, ou de
início tardio é muito mais comum do que
os padrões clássicos já descritos
• Esses pacientes podem ser praticamente
assintomáticos, ou exibir manifestações
leves, como o hirsutismo
• O diagnóstico só pode ser estabelecido
por um estudo bioquímico da
esteroidogênese
• Clínica:
• Em pacientes com a variante perdedora
de sal, os sintomas aparecem pouco
depois do nascimento, com:
– Incapacidade de recuperar o peso ao nascer
– Perda de peso progressiva
– Desidratação
– Vômitos proeminentes
– Anorexia
– Distúrbios da frequência e do ritmo cardíaco,
com cianose e dispnéia
• Nas meninas, a virilização dos órgãos
externos possibilita o diagnóstico correto
• Nos meninos, os órgãos parecem ser
normais e as manifestações podem ser
confundidas com:
– Estenose pilórica
– Obstrução intestinal
– Cardiopatia
– Intolerância ao leite
• Na HSRC sem perda de sal, o lactente
apresenta-se normal ao nascimento, e
sinais de precocidade sexual e somática
aparecem aos seis meses de idade ou se
desenvolvem de modo gradual e tornam-
se evidentes aos 4-5 anos de idade.
• Observa-se:
– Aumento do pênis, escroto e próstata
– Aparecimento de pêlos púbicos
– desenvolvimento de acne e voz grave
– Músculos bem desenvolvidos
– Idade óssea avançada para a idade
cronológica
• Embora pacientes com essa síndrome
sejam altos na infância, o fechamento
prematuro das epífises determina baixa
estatura na idade adulta
• Os testículos mantêm-se em seu tamanho
pré-puberal, em contraste com o pênis
aumentado
• O desenvolvimento mental é normal, mas
o desenvolvimento físico anormal pode
causar problemas de comportamento
• Na menina com HSRC, ocorre o pseudo-
hermafroditismo feminino, com variados
graus de masculinização ao nascer.
• Manifesta-se por aumento do clítoris e
variados graus de fusão dos lábios
• O óstio da vagina pode ter uma abertura
em comum com a uretra
• Os órgãos genitais internos são de uma
menina normal
• Após o nascimento, a masculinização
prossegue, com:
– Pêlos púbicos e axilares
– Acne
– Voz com timbre masculino
– Ausência de menstruação e telarca
– Meninas altas para a idade
• Nessa forma atenuada, observa-se:
– Órgãos genitais normais ao nascimento
– Pubarca precoce, desenvolvimento precoce
de pêlos púbicos e axilares
– Hirsutismo, acne, distúrbios menstruais e
infertilidade podem surgir em uma idade
posterior
• Diagnóstico laboratorial:
• Pacientes com a variante perdedora de
sal apresentam baixas concentrações
séricas de sódio e cloreto e níveis
elevados de uréia e potássio
• O nível da renina é alto e a aldosterona
sérica é baixa para o nível de renina
• Na deficiência clássica de 21-hidroxilase,
ocorre o acúmulo de 17-
hidroxiprogesterona
• Os níveis de cortisol estão baixos em
pacientes com a doença perdedora de sal
e também em relação ao nível de ACTH
• Os níveis urinários de 17-cetoesteróides e
pregnanetriol estão elevados
• As meninas afetadas com HSRC
apresentam cariótipo XX, os meninos ,
XY.
• A injeção de contraste no seio urogenital
de pseudo-hermafroditas femininos
geralmente revela vagina e útero
• A ultra-som também é útil para mostrar
órgãos sexuais femininos em PHF
• Com a administração de hidrocortisona,
ocorre um feedback negativo e inibição da
produção de ACTH na hipófise na HSRC
• Diagnóstico e tratamento pré-natal:
• As recomendações atuais para gestações
de alto risco consistem na administração
de dexametasona 20-25 microgramas/Kg
do peso materno antes da gravidez em
duas ou três doses fracionadas
• A seguir efetua-se uma biópsia das
vilosidades coriônicas no primeiro
trimestre para determinar o sexo e o
genótipo do feto
• A terapia só é mantida se o feto afetado
for do sexo feminino
Tratamento
• A administração de glicocorticóides inibe a
produção excessiva de androgênios e
previne a virilização
• Recomenda-se a hidrocortisona (10-
20mg/m²/24h) por V.O. em 2 ou 3 doses
fracionadas
• Em geral:
• Lactentes: 2,5-5 mg 2 ou 3 X ao dia
• Crianças: 5 -10 mg 2 ou 3 X ao dia
• Deve haver monitorização do crescimento
e níveis hormonais
• Os pacientes com a variante perdedora de
sal precisam de um mineralocorticóide
além de um glicocorticóide
• 9-alfa-fludrocortisona (0,05 – 0,3 mg ao
dia) e cloreto de sódio 1-3 g, costuma ser
suficiente para normalizar a atividade da
renina plasmática
• Para monitorização:
– Determinação de níveis urinários de 17-
cetoesteróides e pregnanetriol não são mais
necessárias
– Níveis séricos de 17-OHP, androstenediona,
testosterona e renina, determinados de
manhã ( 8-9 hrs) antes da medicação matinal,
oferecem bons índices de controle
• As crianças com a variante não perdedora
de sal, sobretudo os meninos, não
costumam ser diagnosticados até os 3-7
anos de idade, quando a maturação óssea
pode estar 5 anos ou mais à frente da
idade cronológica
• O tratamento pode reduzir a velocidade do
crescimento e a maturação óssea para
taxas quase normais
Potrebbero piacerti anche
- Relatório de Direção de TurmaDocumento6 pagineRelatório de Direção de TurmaFátima Pinho100% (1)
- PraticasCorporais4 LibreDocumento142 paginePraticasCorporais4 LibreJanaína Hallais100% (1)
- Sistema EndocrinoDocumento37 pagineSistema EndocrinoNicholas M. Bezerra100% (1)
- Atividade de ExtensaoDocumento5 pagineAtividade de ExtensaoGrasiele Alves100% (2)
- Treinamento para Mypro TouchDocumento25 pagineTreinamento para Mypro TouchEzsilvasilva Silva100% (2)
- Plano de Aula NataçãoDocumento4 paginePlano de Aula NataçãoJanaína Maia de Almeida100% (4)
- Hormonios ProteicosDocumento28 pagineHormonios ProteicosErick Johnny Franco QueirozNessuna valutazione finora
- Sistema ExcretorDocumento33 pagineSistema ExcretorRonnielle Cabral RolimNessuna valutazione finora
- Assistência de Enfermagem Nos Distúrbios HidroeletrolíticosDocumento52 pagineAssistência de Enfermagem Nos Distúrbios HidroeletrolíticosVanessa SuanaNessuna valutazione finora
- Análise Do Licor BrancoDocumento20 pagineAnálise Do Licor BrancoIvan Rabelo100% (1)
- Medula e Córtex Da AdrenalDocumento34 pagineMedula e Córtex Da AdrenalPaula Alves de MouraNessuna valutazione finora
- Teste Geografia 10 Ano PDFDocumento7 pagineTeste Geografia 10 Ano PDFEmília ReisNessuna valutazione finora
- Tecido EpietlialDocumento1 paginaTecido EpietlialMarcelo VeigaNessuna valutazione finora
- Aula 06 Sistema EndócrinoDocumento73 pagineAula 06 Sistema EndócrinoArkila PinheiroNessuna valutazione finora
- SEMINÁRIO SAÚDE DA CRIANÇA - HAC E HTD (Salvo Automaticamente)Documento20 pagineSEMINÁRIO SAÚDE DA CRIANÇA - HAC E HTD (Salvo Automaticamente)Victor GuilhermeNessuna valutazione finora
- Glândulas AdrenaisDocumento4 pagineGlândulas AdrenaisMirella JabbourNessuna valutazione finora
- Fisiologia EndócrinaDocumento5 pagineFisiologia EndócrinaperronebiancaNessuna valutazione finora
- Aula 03 - SÍNDROMES HIPERANDROGENICASDocumento12 pagineAula 03 - SÍNDROMES HIPERANDROGENICASAlisson MatheusNessuna valutazione finora
- Anatomia Do Sistema EndocrinoDocumento53 pagineAnatomia Do Sistema EndocrinoOlintoTomazoliNessuna valutazione finora
- Perfil PancreáticoDocumento27 paginePerfil PancreáticoCamila TorchiNessuna valutazione finora
- Ebook Intensivo Enem - Semana 14Documento218 pagineEbook Intensivo Enem - Semana 14eng civil Paulo Vitor MedeirosNessuna valutazione finora
- Aula SegundaDocumento16 pagineAula SegundaCarina NiloNessuna valutazione finora
- Fisiologia Da ReproducaoDocumento42 pagineFisiologia Da ReproducaoJaqueline ZwierzikowskiNessuna valutazione finora
- 10 - HormôniosDocumento15 pagine10 - HormôniosMarcilio GorvinoNessuna valutazione finora
- Sistema EndócrinoDocumento29 pagineSistema EndócrinoJuliany Marucci MirandaNessuna valutazione finora
- Aula 05 - ADRENALDocumento8 pagineAula 05 - ADRENALDaniel MunizNessuna valutazione finora
- Apg 1Documento3 pagineApg 1vitor ruasNessuna valutazione finora
- BIO An Fisiologia Humana Sistema EndócrinoDocumento1 paginaBIO An Fisiologia Humana Sistema EndócrinoMelissa DomingosNessuna valutazione finora
- AULA8Documento47 pagineAULA8Arthur PulçaNessuna valutazione finora
- O Eixo Hipotalamo - Hipofisário - AULA 08 - FISIOLOGIADocumento38 pagineO Eixo Hipotalamo - Hipofisário - AULA 08 - FISIOLOGIAJaqueline BastossNessuna valutazione finora
- Síndrome Dos Ovários Policísticos: UBS Jardim Dos Buritis Waleska Queiros Gurupi, 2021Documento19 pagineSíndrome Dos Ovários Policísticos: UBS Jardim Dos Buritis Waleska Queiros Gurupi, 2021Clara CunhaNessuna valutazione finora
- Trabalho Ciências Oitavo AnoDocumento6 pagineTrabalho Ciências Oitavo AnoPriscilla NetoNessuna valutazione finora
- Fisiologia EndócrinaDocumento39 pagineFisiologia Endócrinalaislopes93Nessuna valutazione finora
- Sistema Endócrino PDFDocumento56 pagineSistema Endócrino PDFInês Lapa100% (1)
- Aula AmenorréiaDocumento39 pagineAula AmenorréiaSâmela VianaNessuna valutazione finora
- Hipogonadismo Masculino DR Renato TorriniDocumento37 pagineHipogonadismo Masculino DR Renato Torrinicucucucu100% (1)
- Pediatria Problema 1 TutoriaDocumento13 paginePediatria Problema 1 TutoriaElizabeth DiasNessuna valutazione finora
- Sistema EndócrinoDocumento14 pagineSistema EndócrinoVinicius Eduardo Brito KochNessuna valutazione finora
- Introdução À Endocrinologia PediátricaDocumento74 pagineIntrodução À Endocrinologia PediátricaJunior SattoNessuna valutazione finora
- Sistema Endócrino - 220520 - 204710Documento38 pagineSistema Endócrino - 220520 - 204710karoldfpNessuna valutazione finora
- Endocrino 2019 EsteticaDocumento38 pagineEndocrino 2019 EsteticaDaniel VianaNessuna valutazione finora
- Aula Sistema RenalDocumento86 pagineAula Sistema RenalArnaldo CarvalhoNessuna valutazione finora
- Apresentação de Glandulas SuprarrenaisDocumento35 pagineApresentação de Glandulas SuprarrenaisAmabilly Dias AlvesNessuna valutazione finora
- Controle-Hormonal - Mariana AraujoDocumento42 pagineControle-Hormonal - Mariana AraujoIgorPinhoNessuna valutazione finora
- Sistema Urinario Completo 1Documento90 pagineSistema Urinario Completo 1Denise Gomes de MeloNessuna valutazione finora
- Endocrinologia 2024Documento27 pagineEndocrinologia 2024amandamaronez53Nessuna valutazione finora
- Ciclo Menstrual AttDocumento5 pagineCiclo Menstrual AttBianca Seixas CampeloNessuna valutazione finora
- Apresentação Caso Clinico DRCDocumento9 pagineApresentação Caso Clinico DRCIvete GonçalvesNessuna valutazione finora
- RCC 15 - CA de Bexiga e Disfunção ErétilDocumento7 pagineRCC 15 - CA de Bexiga e Disfunção ErétilMarcos AugustoNessuna valutazione finora
- Aula 7 NeuroendocrinologiaDocumento16 pagineAula 7 NeuroendocrinologiaBento CardosoNessuna valutazione finora
- Phpapp01Documento45 paginePhpapp01Kaline SantosNessuna valutazione finora
- Aula Supra Renal Adrenal 04-05-11Documento13 pagineAula Supra Renal Adrenal 04-05-11Alisson BuchiNessuna valutazione finora
- Síndrome de Klinefelter-2Documento17 pagineSíndrome de Klinefelter-2Jéssica BudelNessuna valutazione finora
- Sistema Endócrino: Giovanni Lopes EvangelistaDocumento44 pagineSistema Endócrino: Giovanni Lopes EvangelistaJanderson SousaNessuna valutazione finora
- Problema 06 11 1Documento18 pagineProblema 06 11 1Ricardo Vitor Mesquita BedettiNessuna valutazione finora
- Aula 11 Disturbios Hipertensivos Da GestaçãoDocumento31 pagineAula 11 Disturbios Hipertensivos Da GestaçãoIsabel CristinaNessuna valutazione finora
- Ciclo MenstrualDocumento33 pagineCiclo MenstrualSendhy QuirinoNessuna valutazione finora
- HipófiseDocumento82 pagineHipófiseViviane Alves dos SantosNessuna valutazione finora
- Problema 5Documento4 pagineProblema 5lucasmacedo392Nessuna valutazione finora
- Sistema Endocrino e SentidosDocumento30 pagineSistema Endocrino e SentidosJoão Victor LadislauNessuna valutazione finora
- Patologias Do Sistema EndócrinoDocumento6 paginePatologias Do Sistema EndócrinoMiguel SousaNessuna valutazione finora
- ClimatérioDocumento2 pagineClimatérioGabriella PachecoNessuna valutazione finora
- Modiicaã Ã Es Fã Sico-FuncionaisDocumento36 pagineModiicaã Ã Es Fã Sico-FuncionaisRoberta GeovanaNessuna valutazione finora
- Hormonas Sexuais, Anovulat1Documento61 pagineHormonas Sexuais, Anovulat1João Víctor HabibNessuna valutazione finora
- Anatomia Da Glandula Supra RenalDocumento33 pagineAnatomia Da Glandula Supra RenalAna Clara MoreiraNessuna valutazione finora
- Doenças Endócrinas em Pequenos AnimaisDocumento12 pagineDoenças Endócrinas em Pequenos AnimaisAna Karla de LimaNessuna valutazione finora
- TireoideDocumento3 pagineTireoideAmanda SilvaNessuna valutazione finora
- Aneurism As Cerebrais e Hemorragia SubaracnoideaDocumento46 pagineAneurism As Cerebrais e Hemorragia SubaracnoideaRafael Rodrigues de Castro BarbozaNessuna valutazione finora
- DislipidemiasDocumento89 pagineDislipidemiasRafael Rodrigues de Castro BarbozaNessuna valutazione finora
- Equilíbrio Ácido-BásicoDocumento48 pagineEquilíbrio Ácido-BásicoRafael Rodrigues de Castro Barboza100% (2)
- Abdome Agudo Na CriançaDocumento59 pagineAbdome Agudo Na CriançaRafael Rodrigues de Castro BarbozaNessuna valutazione finora
- Contrato de Trabalho - Cuidadora de CriançasDocumento2 pagineContrato de Trabalho - Cuidadora de CriançasFernando aparecido DevecchiNessuna valutazione finora
- TCC - Retificadores de Alta PotênciaDocumento26 pagineTCC - Retificadores de Alta PotênciaCaio CesarNessuna valutazione finora
- Resenha Do Texto: "A Epidemia de Doença Mental"Documento2 pagineResenha Do Texto: "A Epidemia de Doença Mental"Adnilson VazNessuna valutazione finora
- Caso Cesio 137 Qualificação Dos GestoresDocumento18 pagineCaso Cesio 137 Qualificação Dos GestoresmhdesetaNessuna valutazione finora
- 03 Estudo Comparativo Entre A Punctura e GalvanopunturaDocumento12 pagine03 Estudo Comparativo Entre A Punctura e GalvanopunturaSony-lou SenaNessuna valutazione finora
- PublicadDocumento67 paginePublicadBerdasfreitadaNessuna valutazione finora
- B1 Residencial - Residencial Conv. Monômia - Trifásico: Nome Do ClienteDocumento2 pagineB1 Residencial - Residencial Conv. Monômia - Trifásico: Nome Do ClienteClaudia GibsonNessuna valutazione finora
- Marketing Na LogisticaDocumento2 pagineMarketing Na LogisticaLetícia Débora SilveiraNessuna valutazione finora
- NR17 - Treinamento - Ergonomia - 2022Documento45 pagineNR17 - Treinamento - Ergonomia - 2022evanilNessuna valutazione finora
- Bai60a ManualDocumento20 pagineBai60a ManualnivalidzNessuna valutazione finora
- Instrução de Uso Portico Giratorio 360° em Caixa de ConcretoDocumento25 pagineInstrução de Uso Portico Giratorio 360° em Caixa de ConcretoERMES RIBEIRONessuna valutazione finora
- Bateson - Every Schoolboy KnowsDocumento22 pagineBateson - Every Schoolboy KnowsAnne AlencarNessuna valutazione finora
- T.C.C Triturador de PlasticoDocumento41 pagineT.C.C Triturador de PlasticoRodrigoRomero100% (2)
- Check List - Registro de Candidatura - CandidatosDocumento3 pagineCheck List - Registro de Candidatura - CandidatosKeimenson NascimentoNessuna valutazione finora
- Livro 2Documento14 pagineLivro 2c2fgpfcrv9Nessuna valutazione finora
- Uma Visão Sobre A Proteção de Terra Residual em Sistemas Elétricos IndustriaisDocumento11 pagineUma Visão Sobre A Proteção de Terra Residual em Sistemas Elétricos IndustriaisFilipe Barcelos ResendeNessuna valutazione finora
- Juventude Lazer Culturas JuvenisDocumento54 pagineJuventude Lazer Culturas JuvenisAmanda GonçalvesNessuna valutazione finora
- SegInfo-aula01 02Documento14 pagineSegInfo-aula01 02Felipe CavenaghiNessuna valutazione finora
- Samurai T20Documento7 pagineSamurai T20Quantica MultiversoNessuna valutazione finora
- Aet - NR17Documento14 pagineAet - NR17Alexandro CostaNessuna valutazione finora
- Aula 3 Alcanos Perfil de Rotação EnergiaDocumento47 pagineAula 3 Alcanos Perfil de Rotação EnergiajujulibrasNessuna valutazione finora
- Memorial DescritivoDocumento2 pagineMemorial DescritivoVega StrangeNessuna valutazione finora