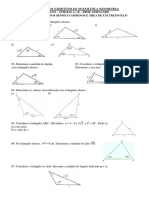
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
3 Cinética Química
Caricato da
Anonymous vJOOkQmTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
3 Cinética Química
Caricato da
Anonymous vJOOkQmCopyright:
Formati disponibili
CINTICA
QUMICA
Cintica Qumica
Parte da Qumica que estuda a velocidade das reaes e os
fatores que a influenciam.
Reaes Qumicas
Rpidas
Lentas
Moderadas
Cintica Qumica
Reao Rpida
6 NaN
3(l)
+ Fe
2
O
3(s)
3 Na
2
O
(s)
+ 2 Fe
(s)
+ 9 N
2(g)
fasca
Cintica Qumica
Reao Moderada
Reao Lenta
Decomposio dos
Alimentos
Formao do
Petrleo
Cintica Qumica
A B
t
[ ]
Cintica Qumica
Velocidade Mdia (Vm) de uma Reao em Funo
das Substncias
a razo entre a quantidade consumida ou produzida da
substncia e o intervalo de tempo (t) em que isso ocorrreu.
t
A de o concentra da iao var
Vm
t
B de o Concentra da Variao
Vm
Cintica Qumica
inicial final
t t
Inicial Final
t
Vm
t
reagentes
Vm
t
produtos
Vm
Velocidade Mdia (Vm) de uma Reao em Funo
das Substncias
Cintica Qumica
Como calcular a velocidade de uma reao quando a
proporo entre o nmero de mols diferente?
2 HI
(g)
H
2(g)
+ I
2(g)
A velocidade da variao de concentrao do HI
duas vezes maior que a velocidade da variao de
concentrao do H
2
Velocidade Mdia (Vm) de uma Reao
Cintica Qumica
C
2
H
2
+ 2 H
2
=> C
2
H
6
Tempo (min) Quantidade de
etano formada
0 0
4 12
6 15
10 20
Cintica Qumica
C
2
H
2
+ 2 H
2
=> C
2
H
6
Cintica Qumica
Condies para que ocorra uma Reao
Os reagentes devem estar em contato
Afinidade qumica entre os reagentes
Teoria da Coliso
As molculas dos reagentes devem colidir entre si
A coliso deve ocorrer com geometria favorvel
Cintica Qumica
Teoria da Coliso
Coliso
Desfavorvel
Coliso
Desfavorvel
Cintica Qumica
Teoria da Coliso
O
2
N
2
O-------N
O N
2 NO
Reagentes
Complexo
Ativado
Produtos
Cintica Qumica
Teoria da Coliso
Para que a coliso seja efetiva necessrio ainda
que os reagentes adquiram uma energia mnima
denominada energia de ativao.
Energia de Ativao a quantidade mnima de
energia necessria para que a coliso entre as
partculas dos reagentes, feita numa orientao
favorvel, seja efetiva.
Cintica Qumica
Complexo Ativado: estado intermedirio formado
entre reagentes e produtos, em cuja estrutura existem
ligaes enfraquecidas e formao de novas ligaes
O
2
N
2
O-------N
O N
2 NO
Reagentes
Complexo
Ativado
Produtos
I
2
+ H
2
HI + HI
I
2
H
2
TEORIA DAS COLISES:
Cintica Qumica
Quanto menor for a
energia de ativao
exigida, maior a velocidade
da reao.
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Superfcie de Contato
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Superfcie de Contato
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Temperatura
Um aumento de temperatura aumenta a
velocidade das reaes qumicas, pois h um
incremento na energia cintica das molculas
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Presena de Catalisador
uma substncia que aumenta a velocidade da
reao, diminuindo a energia de ativao para os
reagentes atingirem o complexo ativado. No entanto
eles no participam da formao do produto, sendo
completamente regenerados no final
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Presena de Catalisador
Sem catalisador
Com catalisador
Cintica Qumica
Fatores que Influenciam a Velocidade de uma
Reao
Concentrao dos Reagentes
Quanto maior a concentrao de partculas dos
reagentes, maior ser o nmero de colises efetivas
e consequentemente maior a velocidade da reao.
Cintica Qumica
Lei da Ao das Massas
(1833-1902), Cato Guldberg e Peter Waage
A cada temperatura, a velocidade de uma reao
diretamente proporcional ao produto das
concentraes dos reagentes, elevadas a
expoentes determinados experimentalmente
Cintica Qumica
Lei da Ao das Massas
A cada temperatura, a velocidade de uma reao
diretamente proporcional ao produto das
concentraes dos reagentes, elevadas a
expoentes determinados experimentalmente
aA + bB => cC + dD
V = k [A]
[B]
K uma constante da velocidade a uma dada temperatura
e so expoentes determinados experimentalmente
Cintica Qumica
Reao Elementar
aA + bB => cC + dD
V = k [A]
a
[B]
b
Quando a reao qumica se desenvolve em uma nica
etapa, dizemos que a reao elementar.
Numa reao elementar, os expoentes a que devem ser
elevadas as concentraes dos reagentes na expresso
da velocidade so os prprios coeficientes dos
reagentes na equao balanceada
Cintica Qumica
Reao Elementar
1 H
3
O
+
+ 1 OH
-
=> 2 H
2
O
V = k [H
3
O
+
] [OH
-
]
Numa reao elementar, os expoentes a que devem ser
elevadas as concentraes dos reagentes na expresso
da velocidade so os prprios coeficientes dos
reagentes na equao balanceada
Cintica Qumica
Reao No-Elementar
A etapa lenta a etapa determinante da velocidade da
reao
Quando a reao se desenvolve em duas ou mais etapas
distintas, a velocidade da reao depende apenas da
velocidade da etapa lenta.
Cintica Qumica
Reao No-Elementar
A etapa lenta a etapa determinante da velocidade da
reao
2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
Etapa I 1 H
2
+ 2 NO => 1 N
2
O + 1 H
2
O (lenta)
Etapa II 1 H
2
+ 1 N
2
O => 1 N
2
+ 1 H
2
O (rpida)
Reao Global 2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
Cintica Qumica
Reao No-Elementar
2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
Etapa I 1 H
2
+ 2 NO => 1 N
2
O + 1 H
2
O (lenta)
Etapa II 1 H
2
+ 1 N
2
O => 1 N
2
+ 1 H
2
O (rpida)
Reao Global 2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
A velocidade da reao global ser determinada pela
velocidade da etapa I
V = k [H
2
] [NO]
2
Cintica Qumica
Reao No-Elementar
2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
E
n
e
r
g
i
a
d
e
a
t
i
v
a
o
Caminho da reao
1 H
2
+ 2 NO => 1 N
2
O + 1 H
2
O
1 H
2
+ 1 N
2
O => 1 N
2
+ 1 H
2
O
Etapa I Etapa II
Cintica Qumica
Ordem de uma reao
Chamamos de ordem de uma reao a soma de todos
os expoentes que aparecem na expresso da
velocidade da reao
aA + bB + cC => dD + eE + fF
V = k [A]
a
[B]
b
[C]
Ordem da reao: + +
Cintica Qumica
Ordem de uma reao
Podemos expressar a ordem de uma reao em relao
a um determinado reagente:
Ordem da reao em relao a A =
Ordem da reao em relao a B =
Ordem da reao em relao a C =
A ordem da reao em relao a um reagente indica a
dependncia existente entre a concentrao desse
reagente e a velocidade da reao global.
Cintica Qumica
Ordem de uma reao
A ordem da reao em relao a um reagente indica a
dependncia existente entre a concentrao desse
reagente e a velocidade da reao global.
2 H
2
+ 2 NO => 1 N
2
+ 2 H
2
O
V = k [H
2
] [NO]
2
Ordem da reao: 1 +2 = 3 (3 ordem)
Ordem da reao em relao ao H
2
: 1 ordem, v = k [H
2
]
Ordem da reao em relao ao NO: 2 ordem, v = k [NO]
2
Cintica Qumica
Ordem de uma reao
V = k [H
2
] [NO]
2
Ordem da reao em relao ao H
2
: 1 ordem, v = k [H
2
]
Se dobrarmos a concentrao do H
2
e mantivermos a
concentrao do NO constante, a velocidade da reao
dobra.
2 V = k [2 H
2
] [NO]
2
Cintica Qumica
Ordem de uma reao
V = k [H
2
] [NO]
2
Ordem da reao em relao ao NO: 2 ordem, v = k [NO]
2
Se dobrarmos a concentrao do NO e mantivermos a
concentrao do H
2
constante, a velocidade da reao
quadruplica.
4 V = k [H
2
] [2 NO]
2
Cintica Qumica
Ordem de uma reao
aA + bB + cC => dD + eE + fF
Experincia [A] [B] [C] Velocidade/mol
(L.min
-1
)
1 2 mol/L 3 mol/L 1 mol/L V
1
= 0,5
2 4 mol/L 3 mol/L 1 mol/L V
2
= 2,0
3 4 mol/L 6 mol/L 1 mol/L V
3
= 2,0
4 4 mol/L 6 mol/L 2 mol/L V
4
= 16,0
Cintica Qumica
Ordem de uma reao
Experincia [A] [B] [C] Velocidade/mol
(L.min
-1
)
1 2 mol/L 3 mol/L 1 mol/L V
1
= 0,5
2 4 mol/L 3 mol/L 1 mol/L V
2
= 2,0
3 4 mol/L 6 mol/L 1 mol/L V
3
= 2,0
4 4 mol/L 6 mol/L 2 mol/L V
4
= 16,0
Comparando 1 e 2
v = k [A]
2
4 v = k [2 A]
2
Cintica Qumica
Ordem de uma reao
Experincia [A] [B] [C] Velocidade/mol
(L.min
-1
)
1 2 mol/L 3 mol/L 1 mol/L V
1
= 0,5
2 4 mol/L 3 mol/L 1 mol/L V
2
= 2,0
3 4 mol/L 6 mol/L 1 mol/L V
3
= 2,0
4 4 mol/L 6 mol/L 2 mol/L V
4
= 16,0
Comparando 2 e 3
v = k [B]
0
Cintica Qumica
Ordem de uma reao
Experincia [A] [B] [C] Velocidade/mol
(L.min
-1
)
1 2 mol/L 3 mol/L 1 mol/L V
1
= 0,5
2 4 mol/L 3 mol/L 1 mol/L V
2
= 2,0
3 4 mol/L 6 mol/L 1 mol/L V
3
= 2,0
4 4 mol/L 6 mol/L 2 mol/L V
4
= 16,0
Comparando 3 e 4
v = k [C]
3
8 v = k[2 C]
3
Potrebbero piacerti anche
- Trigonomtriret 2010Documento2 pagineTrigonomtriret 2010Anonymous vJOOkQmNessuna valutazione finora
- Apostila OficinaDocumento34 pagineApostila OficinaAnonymous vJOOkQmNessuna valutazione finora
- JurosDocumento11 pagineJurosAnonymous vJOOkQmNessuna valutazione finora
- Preparatório PROFMAT 2019Documento57 paginePreparatório PROFMAT 2019vrodrigues280889% (9)
- Aula 01 - M.M.C, M.D.C - Parte IIDocumento13 pagineAula 01 - M.M.C, M.D.C - Parte IIErica da Silva100% (1)
- RADICIAÇÃODocumento7 pagineRADICIAÇÃOIolanda CostaNessuna valutazione finora
- Manual Do Professor Matematica 8º Ano PDFDocumento59 pagineManual Do Professor Matematica 8º Ano PDFAnonymous vJOOkQm100% (3)
- LISTA - LEI DOS SENOS E COSSENOS - 9o. ANOS PDFDocumento2 pagineLISTA - LEI DOS SENOS E COSSENOS - 9o. ANOS PDFAnonymous vJOOkQmNessuna valutazione finora
- Mat 9ano 3tri Exercicios Marcelo PDFDocumento8 pagineMat 9ano 3tri Exercicios Marcelo PDFfelpson jamestownNessuna valutazione finora
- PneumáticaDocumento221 paginePneumáticaAnonymous vJOOkQmNessuna valutazione finora
- LISTA - LEI DOS SENOS E COSSENOS - 9o. ANOS PDFDocumento2 pagineLISTA - LEI DOS SENOS E COSSENOS - 9o. ANOS PDFAnonymous vJOOkQmNessuna valutazione finora
- Orientações Curriculares - EM - Ciências Da NaturezaDocumento140 pagineOrientações Curriculares - EM - Ciências Da NaturezaJosé Mauro SousaNessuna valutazione finora
- Mat 9ano 3tri Exercicios Marcelo PDFDocumento8 pagineMat 9ano 3tri Exercicios Marcelo PDFfelpson jamestownNessuna valutazione finora
- Apostila de Pneumática - ParkerDocumento168 pagineApostila de Pneumática - ParkerIzabela Almeida Mocelin100% (3)
- Tecnologia EletropneumaticaDocumento152 pagineTecnologia EletropneumaticaWil WiltmarNessuna valutazione finora
- Manual Correção Fator de Potência PotDocumento34 pagineManual Correção Fator de Potência PotLuiz UshijimaNessuna valutazione finora
- Apostila Protecao SEL354 2003Documento127 pagineApostila Protecao SEL354 2003eng_823664768Nessuna valutazione finora
- Apostila Protecao SEL354 2003Documento127 pagineApostila Protecao SEL354 2003eng_823664768Nessuna valutazione finora
- Dicionario Tecnico Ingles PortuguesDocumento9 pagineDicionario Tecnico Ingles PortuguesAnonymous vJOOkQmNessuna valutazione finora
- 01 PLDsDocumento40 pagine01 PLDsAnonymous vJOOkQm100% (1)
- Dicionário Técnico Inglês-PortuguêsDocumento242 pagineDicionário Técnico Inglês-Portuguêsdollarbr93% (14)
- Chapas Grossas - InovaçoesDocumento20 pagineChapas Grossas - InovaçoesAnonymous vJOOkQmNessuna valutazione finora
- Mate Matic ADocumento111 pagineMate Matic AAnonymous vJOOkQmNessuna valutazione finora
- Apostila Completa - Matemática Básica - 02 - IESDE Brasil PDFDocumento76 pagineApostila Completa - Matemática Básica - 02 - IESDE Brasil PDFmagnocunha100% (4)
- Kelly Regina CotosckfDocumento109 pagineKelly Regina Cotosckfjf6386Nessuna valutazione finora
- 5a8 Vol03 MatematicaDocumento152 pagine5a8 Vol03 Matematicaartur_reig100% (2)
- Dicas - Producao - Aulas Portal Do ProfessorDocumento10 pagineDicas - Producao - Aulas Portal Do Professoredilandio4656Nessuna valutazione finora
- Man 1997 Eletrificacao RuralDocumento114 pagineMan 1997 Eletrificacao RuralMarcelo MartinsNessuna valutazione finora
- Apostila de Práticas em InstalaçõesDocumento114 pagineApostila de Práticas em InstalaçõesMichell Vasconcelos SiqueiraNessuna valutazione finora
- Geracao Corrente AlternadaDocumento39 pagineGeracao Corrente AlternadaOsvaldo OliveiraNessuna valutazione finora
- A Retórica Da Alegria, Frei Bento Domingues, Público 200912Documento2 pagineA Retórica Da Alegria, Frei Bento Domingues, Público 200912josearmandopinhoNessuna valutazione finora
- Livro OncologiaDocumento112 pagineLivro OncologiaDanielNessuna valutazione finora
- Cópia de Ética e Novas TecnologiasDocumento24 pagineCópia de Ética e Novas Tecnologiasrayanni.freireNessuna valutazione finora
- Avaliação de Maquinas Modelo PDFDocumento11 pagineAvaliação de Maquinas Modelo PDFleandroNessuna valutazione finora
- BiopreenchedoresDocumento41 pagineBiopreenchedoresJaine Padilla100% (1)
- Dif Coord Topog UTM Seer 12230Documento5 pagineDif Coord Topog UTM Seer 12230Marcelo CaetanoNessuna valutazione finora
- 71 Regras Do Macho AlphaDocumento6 pagine71 Regras Do Macho AlphaCarlos Alesi KandimbaNessuna valutazione finora
- Lista - 1 de TermodinâmicaDocumento3 pagineLista - 1 de TermodinâmicaLeonardo BeckerNessuna valutazione finora
- Nu 677766922 01jun2023 30jun2023Documento7 pagineNu 677766922 01jun2023 30jun2023Raissa LopesNessuna valutazione finora
- Geometria Analítica e Álgebra VetorialDocumento212 pagineGeometria Analítica e Álgebra VetorialNadson Silva100% (2)
- 3ºano Eletrostática 1Documento27 pagine3ºano Eletrostática 1Maria ClaraNessuna valutazione finora
- Noções de CartografiaDocumento63 pagineNoções de CartografiaVanessa Gomes Pereira RoqueNessuna valutazione finora
- O Lendário Amazônico - Analisando o Fenomeno Religioso Nas Lendas e Mitos Da AmazôniaDocumento8 pagineO Lendário Amazônico - Analisando o Fenomeno Religioso Nas Lendas e Mitos Da AmazôniaEliete CristinaNessuna valutazione finora
- Cenário AudumblaDocumento31 pagineCenário Audumblapedro atilioNessuna valutazione finora
- Tunga - A Alquimia Como Arte - ISTOÉ Independente PDFDocumento4 pagineTunga - A Alquimia Como Arte - ISTOÉ Independente PDFNadam GuerraNessuna valutazione finora
- RESPOSTAS Exercícios para Fixação de Tempos e MétodosDocumento4 pagineRESPOSTAS Exercícios para Fixação de Tempos e MétodosJosé Eduardo OliveiraNessuna valutazione finora
- Catálogo de PeçasDocumento6 pagineCatálogo de PeçasMarcosNessuna valutazione finora
- Sistema Metrico2Documento5 pagineSistema Metrico2Benvindo Sebastiao Antonio100% (1)
- RELIGIÃODocumento300 pagineRELIGIÃONhynguyka AlmeidaNessuna valutazione finora
- Primeiros Passos Na Fé Cristã PDFDocumento66 paginePrimeiros Passos Na Fé Cristã PDFArlan SousaNessuna valutazione finora
- NívelC SimetriaDocumento10 pagineNívelC SimetriawashingtonNessuna valutazione finora
- Brugmansia Arborea, Datura StramoniumDocumento6 pagineBrugmansia Arborea, Datura StramoniumminhapicaNessuna valutazione finora
- Trabalho de FDDI - TCCDocumento26 pagineTrabalho de FDDI - TCCvitorino87100% (1)
- Encerramento Catequese 2012 2013Documento4 pagineEncerramento Catequese 2012 2013Catequese de Rendufinho67% (3)
- Psilocybin Mushroom Handbook - Easy Indoor and Outdoor Cultivation 223 P (090-190) en PT PDFDocumento101 paginePsilocybin Mushroom Handbook - Easy Indoor and Outdoor Cultivation 223 P (090-190) en PT PDFAndré Psilocybe CubensisNessuna valutazione finora
- 4 - Relatorio - Ensaio de CompressãoDocumento14 pagine4 - Relatorio - Ensaio de CompressãoNicollas AlvesNessuna valutazione finora
- GinásticaDocumento9 pagineGinásticaLuïdïnö Flävïo MätüssëNessuna valutazione finora
- A Inteligencia Coletiva Por Uma Antropologia Do Cyberespao Pierre LeviDocumento292 pagineA Inteligencia Coletiva Por Uma Antropologia Do Cyberespao Pierre LeviFabricio Eu100% (1)
- Caminhos SinuososDocumento198 pagineCaminhos SinuososMiguel JuniorNessuna valutazione finora
- Teste PeregrinaçãoDocumento2 pagineTeste PeregrinaçãoCristina MatiasNessuna valutazione finora