Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
BRUICE QuimicaOrganica PPT CAP07
Caricato da
Gabriel EspinozaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
BRUICE QuimicaOrganica PPT CAP07
Caricato da
Gabriel EspinozaCopyright:
Formati disponibili
Captulo 7
Aromaticidad:
reacciones del
benceno y de
bencenos
sustituidos
William Setzer, Bernhard Vogler, Mary Setzer
Universidad de Alabama - Huntsville
Compuestos representativos
HO
OH
CHCH
2
NHCH
3
OH
adrenalina
efedrina
CHCHNHCH
3
OH
CH
3
Compuestos representativos
anfetamina
CH
2
CHNH
2
CH
3
metanfetamina
CH
2
CHNHCH
3
CH
3
Psicoestimulante
Compuestos representativos
OH
O
O
O
Aspirina
Aromaticidad
Arreglo ininterrumpido de enlaces p
Molcula cclica
Todos los tomos deben tener un orbital p
La molcula debe ser plana
Debe tener un nmero impar de pares de
electrones p (1,3,5)
Molculas excepcionalmente estables
Aromaticidad
ciclobutadieno
Ciclobutadieno: planar, cclico, todos los tomos tienen
orbitales p, 2 pares de electrones p
ciclooctatetraeno
Ciclooctatetraeno: no planar, cclico, todos los tomos
tienen orbitales p, 4 pares de
electrones p
benceno
Benceno: planar, cclico, todos los tomos tienen
orbitales p, 3 pares de electrones p.
Aromaticidad
X
X
ciclobutadieno
benceno ciclooctatetraeno
Ciclobutadieno: planar, cclico, todos los tomos tienen
orbitales p, 2 pares de electrones p
Benceno: planar, cclico, todos los tomos tienen
orbitales p, 3 pares de electrones.
Ciclooctatetraeno: no planar, cclico, todos los tomos
tienen orbitales p, 4 pares de
electrones p
Benceno
Benceno: planar, anular, todos los tomos
tienen orbitales p, 3 pares de electrones p.
Benceno: determinacin de energa
de resonancia
La excepcional estabilidad de los compuestos
aromticos debida a la resonancia puede ser
estimada por medio de reacciones de hidrogenacin.
La hidrogenacin del ciclohexeno es una reaccin
exotrmica.
H
2
H = -28.6 kcal/Mol
La hidrogenacin del 1,4-ciclohexadieno tambin
es una reaccin exotrmica. La cantidad de calor
liberada se duplica porque tenemos dos enlaces
dobles.
H
2
H = -57.2 kcal/Mol
Benceno: determinacin de energa
de resonancia
Se espera que la hidrogenacin de un
ciclohexatrieno terico produzca 85.8 kcal/Mol.
Dado que aqu tenemos tres enlaces dobles, cada
uno podra contribuir con 28.6 kcal/Mol.
El valor real es 49.8 kcal/Mol. La diferencia es la
energa de resonancia
H
2
H = -49.8 kcal/Mol
Benceno: determinacin de energa
de resonancia
Aromaticidad
ciclopentadieno
catin ciclopentadienilo anin ciclopentadienilo
sp
3
4 electrones p 4 electrones p 6 electrones p
planar no planar planar
aromtico
Anin ciclopentadienilo
Contribuyentes de la resonancia.
En general todos los tomos C tienen la misma cantidad de carga
negativa
carga igualmente
distribuida
Catin cicloheptadienilo
- H
+
- H
-
6 electrones p 6 electrones p 8 electrones p
planar no planar planar
aromtico tomo sp
3
Catin cicloheptadienilo
Contribuyentes a la resonancia.
En general todos los tomos C tienen la misma cantidad de
carga positiva
carga igualmente
distribuida
Anillos aromticos policclicos
naftaleno,
planar, 5 pares
azuleno,
planar, 5 pares
Anillos aromticos policclicos
fenantreno
planar, 7 pares
antraceno
planar, 7 pares
criseno
planar, 9 pares
Anillos aromticos heterocclicos
N
N
H
O S
piridina
pirrol furano
tiofeno
Piridina
N
N
El par no compartido no es parte
del sistema del anillo aromtico.
Los electrones estn localizados
en el orbital hbrido sp
2
.
Pirrol, Furano
N H
N
H
El par no compartido es
parte del sistema p, el N y
y el O tienen hibridacin
sp
2
O
O
El segundo par no compartido
localizado en el orbital
tiene hibridacin sp
2
Pirrol
Contribuyentes por resonancia
N
H
N
H
N
H
N
H
N
H
carga positiva
Furano
O
O
O
O
O
Contribuyentes por resonancia
Heterociclos bicclicos aromticos
N
N
H
N
N
N
N
H
quinolina indol purina
Porfirina, clorofila, hem
N
HN
NH
N
El sistema anular de la porfirina, cuatro anillos pirrlicos
estn unidos por puentes mono-carbono.
Fe Mg
Importante en el Hem: Un Fe(II) toma la posicin del tomo central.
Importante en Clorofila: Un Mg(II) toma la posicin del tomo central.
Porfirina, clorofila, hem
Porfirina, clorofila, hem
Nomenclatura
Establezca el nombre del sustituyente y
agregue la palabra benceno
Br Cl NO
2
CH
2
CH
3
bromobenceno
clorobenceno nitrobenceno etillbenceno
OMe
CH
3
OH NH
2
metoxibenceno metilbenceno hidroxibenceno aminobenceno
Nomenclatura
Se usan muchos nombres triviales
OMe
CH
3
OH NH
2
anisol
tolueno fenol anilina
CHO COOH CN
estireno benzaldehido cido benzoico benzonitrilo
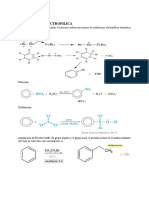
Sustitucin aromtica electroflica
Los sistemas de anillos aromticos reaccionan con
los electrfilos en forma diferente a los alquenos.
H
+ E
+
E
+ H
+
+ E
+
Nu
-
E
Nu
Obtenemos una sustitucin en lugar de un
producto de adicin.
Mecanismo
H
+ E
+
Primero, conseguimos un carbocatin intermediario.
En el carbono que aade el electrfilo, tiene lugar el
cambio de hibridacin (sp
2
sp
3
). La molcula
pierde su caracter aromtico.
H
EE
H
Mecanismo
El carbocatin tiene resonancia estable.
H
EE
H
H
EE
H
H
EE
H
Mecanismo
H
EE
H
+
Nu
-
E
Nu
H
H
E
+ HB
B
-
La parte rica en electrones del reactivo
puede actuar ya sea como nuclefilo en
una reaccin de adicin o como base
para eliminar un protn.
Mecanismo
Las dos reacciones resultarn en diferentes productos.
E
Nu
H
H
E
La excepcional estabilizacin de los compuestos
aromticos lleva slo al producto de sustitucin
(eliminacin de la adicin).
Perfil de energa
E
n
e
r
g
a
l
i
b
r
e
Progreso de la reaccin
Producto de sustitucin
Producto de adicin
Sustitucin electroflica
aromtica
Halogenacin:
El primer paso es generar un electrfilo:
Br Br
+ FeBr
3
FeBr
3
Br Br
FeBr
3
es un cido de Lewis que se coordina con Br
2
y
lo polariza, generando un Br
+
electroflico
Br
+
FeBr
3
Br
Br
+
HBr
+ FeBr
3
Sustitucin electroflica
aromtica
Nitracin:
El primer paso es generar un electrfilo, el in nitronio:
HO NO
2
+ H OSO
3
H
HSO
4
-
+
HO NO
2
H
NO
2
+
+ H
2
O
Sustitucin electroflica
aromtica
NO
2
+
H
NO
2
H
+
HSO
4
-
NO
2
El altamente electroflico in nitronio
ataca al anillo aromtico.
Sustitucin electroflica
aromtica
Sulfonacin: generar el electrfilo
HO S OH
O
O
HO S OH
O
O
HO S OH
2
O
O
O S OH
O
O
S
O
O
HO
+
+
+
H
2
O
Sustitucin electroflica
aromtica
+
S O
HO
O
H
SO
3
H
H
H
SO
3
H
H
+
HSO
4
-
SO
3
H
Sulfonacin: reaccin del electrfilo con el
anillo aromtico
Sustitucin electroflica
aromtica
+
S O
HO
O
H
SO
3
H
H
H
SO
3
H
H
+
HSO
4
-
SO
3
H
Sulfonacin: reaccin del electrfilo con el
anillo aromtico
Sustitucin electroflica
aromtica
Acilacin de FriedelCrafts
R
O
Cl
+
AlCl
3
R C O
R C O
-AlCl
4
R C O
+
R
O
-H
+
Sustitucin electroflica
aromtica
Alquilacin de FriedelCrafts
R
CH
2
Cl
+
AlCl
3
R CH
2
-AlCl
4
R CH
2 +
CH
2
R
-H
+
Bencenos disustituidos
Cl
Cl
1,2-diclorobenceno
orto-diclorobenceno
o-diclorobenceno
1,3-diclorobenceno
meta-diclorobenceno
m-diclorobenceno
1,4-diclorobenceno
para-diclorobenceno
p-diclorobenceno
Cl
Cl
Las posiciones relativas frecuentemente se indican
como orto, meta y para
Cl
Cl
Bencenos disustituidos
CH
3
Br
OH
NO
2
4-bromotolueno
para-bromotolueno
2-nitrofenol
orto-nitrofenol
Sustitucin electroflica aromtica
Los bencenos monosustituidos experimentan una
sustitucin electroflica aromtica.
Los sustituyentes influyen en la reactividad.
Los sustituyentes determinan la posicin en la
segunda sustitucin electroflica.
Los sustituyentes que incrementan la densidad de
electrones aumentan la reactividad.
Los sustituyentes que disminuyen la densidad de
electrones disminuyen la reactividad.
Clasificacin de los sustituyentes
Sustituyentes activadores
(direccin orto/para):
aminas primarias
aminas secundarias
aminas terciarias
OH fenlico
teres fenlicos
amidas
steres fenlicos
sustituyentes alquilo
halogenuros
Activadores
fuertes
Activadores
dbiles
Desactivantes
NH
2
NHR
NR
2
OH
OR
NH
CR'
O
O CR'
O
R
X
Clasificacin de sustituyentes
Sustituyentes desactivantes (direccin a meta):
aldehdos
steres
cido carboxlico
nitrilo
cido sulfnico
nitro
amonio
Desactivantes
dbiles
Desactivantes
fuertes
CH
O
+
COR
O
+
COH
O
+
C N
SO
3
H
N
O
O
NR
3
+
+
Resonancia y pK
a
OH
OCH
3
OH
CH
3
OH
H
OH
Cl
OH
NO
2
pK
a
= 10.2 10.19 9.95 9.38 7.14
La pK
a
disminuye con el aumento del poder receptor de
electrones del sustituyente.
Resonancia y pK
a
OH
NO
2
O
NO
2
+ H
+
El punto de partida es la reaccin cidobase que genera
un anin. Mientras mejor estabilizado est el anin,
menor ser la pK
a
y mejor ser el cido.
Resonancia y pK
a
O
NO
2
O
NO
2
O
N
O O
O
N
O O
O
NO
2
La capacidad de
aceptacin de electrones
del grupo nitro explica el
pequeo valor del pK
a
.
Clasifique las molculas segn el pK
a
OH
O
H
2
O
+
H
3
O
+
OH
O
2
N
O
O
2
N
H
2
O
+
H
3
O
+
OH
NO
2
O
NO
2
H
2
O
+
H
3
O
+
Clasifique las molculas segn el pK
a
El fenol tiene el mayor pK
a
, ninguna
resonancia especial.
meta-nitrobenceno: el sustituyente jala la
carga.
orto-nitro tiene un contribuyente de
resonancia adicional.
O
N
O
O
O H
O H
O
2
N
O H
N O
2
>
>
p K
a
Potrebbero piacerti anche
- FA-10 Silabo QuÍmica Orgánica 2022 II LUIS LUMBREDocumento6 pagineFA-10 Silabo QuÍmica Orgánica 2022 II LUIS LUMBRECarmenNessuna valutazione finora
- Hidrocarburos CiclicosDocumento47 pagineHidrocarburos CiclicosAlejandro Mont50% (6)
- Notas de AIDADocumento184 pagineNotas de AIDAluisfernandoacNessuna valutazione finora
- BencenoDocumento41 pagineBencenoMarcelo David GHNessuna valutazione finora
- Nitro Bence NoDocumento12 pagineNitro Bence NomishelNessuna valutazione finora
- TAREAS Tipo IDocumento5 pagineTAREAS Tipo IestefaniaNessuna valutazione finora
- Obtención Industrial Del BencenoDocumento9 pagineObtención Industrial Del BencenoOscar Ramon Palazuelos NavarroNessuna valutazione finora
- 3.3 Uso Del Benceno y Sus DerivadosDocumento17 pagine3.3 Uso Del Benceno y Sus DerivadosGustavo DíazNessuna valutazione finora
- Diseño Preliminar Del Proceso Sulfonato de Sodio DodecilbencenoDocumento35 pagineDiseño Preliminar Del Proceso Sulfonato de Sodio Dodecilbencenomacleod230286Nessuna valutazione finora
- Examen Aportaciones de Lavosier 17Documento7 pagineExamen Aportaciones de Lavosier 17Marcko MarPiNessuna valutazione finora
- Pre PARCIAL #1Documento21 paginePre PARCIAL #1Celii BordonNessuna valutazione finora
- Propiedades de Alquenos y AlquinosDocumento69 paginePropiedades de Alquenos y Alquinoslimahees1Nessuna valutazione finora
- Benceno 1 07 09 2021Documento24 pagineBenceno 1 07 09 2021Jonatan MarkaNessuna valutazione finora
- Usos Del BencenoDocumento2 pagineUsos Del BencenoSebastian Guayaquil100% (1)
- Guia Qca Organica 2014Documento122 pagineGuia Qca Organica 2014Alvaro ArancibiaNessuna valutazione finora
- Ejerc Hidrocarburos Aromaticos PDFDocumento4 pagineEjerc Hidrocarburos Aromaticos PDFDiana Urco Maco100% (1)
- Examenes de QuimicaDocumento40 pagineExamenes de QuimicaMary AndersonNessuna valutazione finora
- Prelaboratorio 05Documento23 paginePrelaboratorio 05Josselyn RamirezNessuna valutazione finora
- Diapositivas de QuimicaDocumento11 pagineDiapositivas de QuimicaYeison DaniesNessuna valutazione finora
- Sustitucion ElectrofilicaDocumento7 pagineSustitucion Electrofilicaela7cu-614774Nessuna valutazione finora
- Tesis de Ingria Electrónica e HidrocarburosDocumento119 pagineTesis de Ingria Electrónica e HidrocarburosOrlando D Jesus Herrera FloresNessuna valutazione finora
- Taller de QuimicaDocumento60 pagineTaller de Quimicaarbuitra150% (2)
- 6 Interpretación de Planos TuberiasDocumento12 pagine6 Interpretación de Planos TuberiasantonyNessuna valutazione finora
- Proceso de Deshidratacion Con Glicol Del Gas NaturalDocumento15 pagineProceso de Deshidratacion Con Glicol Del Gas Naturalgerson fitzgerald100% (1)
- Xerogeles de Carbono 2014Documento369 pagineXerogeles de Carbono 2014lilylove25Nessuna valutazione finora
- Simulación de Procesos Químicos BTXDocumento12 pagineSimulación de Procesos Químicos BTXalvaroing10Nessuna valutazione finora
- Problemas Unidad 1 Balance 1Documento32 pagineProblemas Unidad 1 Balance 1Arnoldo Piñon OrdazNessuna valutazione finora
- Presentacion - Quimica Hidrocarburos AromaticosDocumento5 paginePresentacion - Quimica Hidrocarburos AromaticosEsteban VillalobosNessuna valutazione finora