Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
So Luci Ones
Caricato da
jaclavijopCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
So Luci Ones
Caricato da
jaclavijopCopyright:
Formati disponibili
1
2
Es una mezcla homognea de dos o ms sustancias
en una sola fase. Cuando las sustancias se mezclan
pero al pasar el tiempo se separan formando varias
fases, la mezcla es heterognea, y se llama una
suspensin.
Una solucin puede involucrar cualquier componente,
No solamente sustancias disueltas en lquidos.
3
Solvente: componente
mayoritario en moles de
la disolucin, que
determina si sta es un
slido, un lquido o un
gas.
Solutos: Los dems
componentes de la
disolucin.
4
Ejemplos de soluciones
Tipo de
solucin
Solvente Solutos Ejemplo
Gas Gas Gas Aire
Lquido Lquido Gas Oxgeno en agua
Lquido Lquido Lquido Alcohol etlico en agua,
gasolina
Lquido Lquido Slido Sal de cocina en agua
Slido Slido Gas Hidrgeno en paladio
Slido Slido Lquido Mercurio en plata
Slido Slido Slido Plata en oro, plomo en
estao
5
Concentracin Nmero, casi siempre con unidades,
que expresa la cantidad de componente por cada
unidad de solvente o de solucin. Puede variar con la
temperatura.
SolubilidadMxima concentracin de componente
que se disolver en una cantidad dada de solvente a
temperatura fija para dar una solucin estable (una
sola fase). Una solucin as se le llama solucin
saturada.
Una solucin verdadera no muestra el Efecto Tyndall!
http://2012books.lardbucket.org/books/general-chemistry-principles-patterns-and-applications-
v1.0/section_17/305b670de14e70a25dd291ae4e4e78ab.jpg
Formas de expresar la
concentracin
Cuantitativas:
Usando moles y sin usar moles.
Molaridad (o concentracin molar)
Def.: Nmero de moles de componente disueltas en
un litro de solucin.
Unidades: mol/L; expresin: M; ejemplo: glucosa(ac) 0,25 M
Molalidad (o concentracin molal)
Def.: Nmero de moles de componente disueltas en
cada kg de solvente.
Unidades: mol/kg; expresin: m; ejemplo: glucosa(ac) 0,10 m
Fraccin molar
Def.: Moles de un componente por cada mol
de solucin.
Unidades: no tiene; expresin: X=...;
ejemplo: glucosa(ac) X=0.012
En una solucin acuosa de dos componentes (un
soluto y el solvente),
Porcentaje en masa, % en masa, % p/p
Def.: Masa de componente disuelta por cada 100
unidades de masa total.
Unidades: no tiene; expresin: %; ejemplo: glucosa(ac) 2,0 %
Porcentaje en volumen, % en volumen
Def.: Volumen de componente disuelto por cada
en 100 unidades de volumen total
Unidades: no tiene; expresin: % vol; ejemplo: etanol(ac) 0,5 % vol
Partes por milln ppm
Def.: Masa de componente disuelta por cada 10
6
unidades de masa total.
Unidades: no tiene; expresin: ppm; Ejemplo: 20 ppm de Cloruro en agua
Partes por billn ppb
Def.: Masa de componente disuelta por cada
10
12
unidades de masa total.
Unidades: no tiene; expresin: ppb; ejemplo: 20 ppb de As en agua
Ejemplos:
1.- Se disuelven 20 g de NaOH en 560 g de agua. Calcular
a) la concentracin de la solucin en % en masa y
b) su molalidad.
Masa molares, en g/mol: Na = 23 O = 16, H = 1.
2.- Se dispone de un cido ntrico comercial concentrado al
96,73 % en peso y densidad 1,5 g/ml. Cuntos ml del cido
concentrado sern necesarios para preparar 0,2 L de solucin
1,5 M de dicho cido? MM HNO
3
= 63 g/mol.
Ejemplos:
3.- Indicar cmo preparar L de solucin 0,1 M de HCl a
partir de un HCl concentrado del 36 % y densidad 1,19 g/mL.
4.- Se disuelven en agua 30,5 g de cloruro de amonio NH
4
Cl
hasta obtener 0,5 L de solucin. Sabiendo que la densidad de
la misma es 1027 kg/m
3
, calcular:
a) La concentracin de la misma en porcentaje en masa.
b) La molaridad.
c) La molalidad.
d) Las fracciones molares del soluto y del disolvente.
MM NH
4
Cl = 53,5 g/mol.
1
4
1. Una muestra de 2.5 g de agua subterrnea
contiene 5.4 g de iones Zn
2+
. Cul es la
concentracin de Zn
2+
en ppm?
2. Un blanqueador comercial presenta una
concentracin 3.62 % p/p de NaOCl en agua.
Calcular (a) la molalidad y (b) la fraccin molar
de NaOCl en la solucin.
2.2 ppm
(a) 0.505 m, (b) 9.00 10
3
Dilucin
Es tomar una parte (alcuota) de
una solucin de concentracin
dada y obtener otra solucin de
menor concentracin agregando
solvente.
En un proceso de dilucin se conserva el nmero de moles de soluto
moles de soluto en la disolucin inicial = moles de soluto en la disolucin final
inicial inicial final final
V M = V M
http://www.caes.uga.edu/applications/publications/files/html/C992/images/C992Fig2.gif
Ejemplo:
Qu volumen de HCl 0,10 M se necesita para preparar
100 ml de HCl 0,0025 M?
Inicial
=
100 0.0025
0.10
= 2.5
inicial inicial final final
V M = V M Despejando de ,
Por qu una sustancia se disuelve en otra?
Porque se atraen las molculas de soluto y
las de solvente.
1
9
La atraccin se llama
solvatacin.
Si el solvente es agua, se llama solvatacin.
2
0
Entalpa de solucin
2
1
Endotrmico
Exotrmico
FACTORES QUE AFECTAN LA SOLUBILIDAD:
DE QU DEPENDE QUE UNA SUSTANCIA SE
DISUELVA O NO EN OTRA?
2
2
Polaridad (Todos los casos)
Temperatura (No para lquidos disueltos
en lquidos)
Presin (solamente para gases disueltos
en lquidos)
2
3
El agua es un solvente muy polar.
http://www.columbia.edu/cu/biology/courses/c2005/images/ethanolh.gif
http://rpmedia.ask.com/ts?u=/wikipedia/commons/thumb/2/2e/Toluol.svg/220px-Toluol.svg.png
2
6
La gran mayora de hidrocarburos estn formados
por enlaces C-H, que tienen tan poca polaridad,
que en la prctica se les cataloga como molculas
apolares. Por ello, difcilmente se disuelven en
agua, que es muy polar.
Las molculas apolares, como los derivados del
petrleo, no se pueden asociar entre s por
interacciones dipolares, sino que lo hacen
mediante fuerzas de dispersin. OJO! ^_^
2
7
Sustancias polares se disuelven fcilmente en
solventes polares, y solutos apolares se disuelven
fcilmente en solventes apolares.
Cuando se trata de un soluto y un solvente de
tamao comparable, la polaridad es el factor
que ms influye en la solubilidad.
Al tratar con molculas grandes (protenas,
polmeros, derivados del petrleo, etc) una
sustancia, entre ms grupos polares haya y
menos simtrica sea, ms soluble ser en agua.
2
8
2
9
3
0
Cul vitamina (B6, E)
es soluble en agua y
cul en grasas?
Efecto de la temperatura en la
solubilidad:
Curvas de solubilidad
3
1
La solubilidad es la mayor concentracin de
una sustancia que se puede disolver en una
cantidad dada de disolvente a temperatura
dada.
3
2
Slidos
en
lquidos
Aumenta
Segn la concentracin de soluto, una
solucin puede ser
3
3
Insaturada
Saturada
Sobresaturada
3
4
Solucin Insaturada
Concentracin de soluto menor a la solubilidad.
Se ve todo homogneo, sin slido en el fondo del
recipiente.
3
5
Solucin Saturada
Contiene la mayor concentracin de soluto a T dada.
Se ve todo homogneo con slido en el fondo del
recipiente.
Solucin sobresaturada
Es una solucin que se ha preparado a
elevada T y luego se ha enfriado lentamente,
para que al enfriarse quede con mayor
concentracin de componente que lo que
indica la solubilidad.
3
6
3
7
Se obtiene una solucin inestable, que al agregarle un
cristal semilla o golpear el vaso, mostrar que cristaliza el
exceso de slido que se haba logrado disolver.
3
8
http://2012books.lardbucket.org/books/general-chemistry-principles-patterns-and-applications-
v1.0/section_17/1688d1d5941ac728ff289a871c57b432.jpg
Video!
Slidos en lquidos
3
9
Gases en
lquidos
http://2012books.lardbucket.org/books/general-chemistry-principles-patterns-and-
applications-v1.0/section_17/67558bdc4beb64e06b29db7b4c8d74bb.jpg
Disminuye
Si dos lquidos se mezclan, generalmente lo
harn en todas las proporciones o lo harn muy
poco. Si se mezclan, se les llama miscibles
(como el etanol y el agua), y si se mezclan muy
poco, se les llama inmiscibles (como las
gasolinas y el agua).
Lquidos en otros lquidos: La solubilidad
no se afecta apreciablemente por la
temperatura ni por la presin.
Efecto de la presin en la
solubilidad: Ley de Henry
La presin afecta de manera apreciable
solamente la solubilidad de gases en lquidos.
4
2
Al aumentar la presin del gas sobre la
solucin, el gas se disuelve ms.
es la molaridad del gas en la solucin,
es la constante de ley de Henry para
el gas en el solvente a T fija,
es la presin parcial del gas sobre la
solucin.
4
3
Ley de Henry
http://wattsupwiththat.files.wordpress.com/2008/04/co2_solubility_h2o.jpg
Cuntos gramos de CO
2
(g) estn disueltos en una gaseosa de 1
L si fue embotellada a presin de 2,4 atm sobre la bebida?
K
H
CO
2
en agua = ,
mol/L atm a 25 C.
El cucho ^_^.
La solubilidad del CO
2
(g) en agua es 0,161 g/mL a 20 C a
presin parcial de 1,00 atm. Cul es la presin parcial del gas
que se debe usar para lograr una solubilidad de 0,886 g/mL?
Hijitos.^_^.
3,5 g.
5,5 atm.
Propiedades coligativas
Propiedades coligativas de las
disoluciones
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
4
7
Propiedades coligativas
Aquellas propiedades de las disoluciones que no dependen de la
naturaleza del soluto (o solutos), sino solamente de la concentracin de
partculas en disolucin
Presin de vapor de una disolucin de disolvente voltil y solutos no voltiles
Presin osmtica
Aumento ebulloscpico y descenso crioscpico
Si un soluto se disocia al disolverse, la concentracin que determina las
propiedades coligativas es la de todas las especies presentes en la
disolucin
[Lectura: Petrucci 14.6-8]
Soluto AB(s)
disolvente
A(dis) + B(dis)
concentracin relevante = concentracin de A(dis) + concentracin de B(dis)
Presin de vapor (tendencia a evaporarse)
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
4
8
Presin de vapor de una sustancia a una T dada
Presin que tiene el vapor de dicha sustancia cuando est en equilibrio
con la misma sustancia lquida (o slida) a esa temperatura
Presin de vapor de una disolucin a una T dada
Presin que tiene el vapor formado por los componentes voltiles de dicha
disolucin cuando est en equilibrio con la disolucin a esa temperatura
[Lectura: Petrucci 14.6]
1
, P T
D(gas)
D(lq)
vapor:
lquido:
0
, 1 v D
P P =
Presin de vapor: de un disolvente
D puro
,disln 2 v
P P =
de una disolucin de D
y solutos no voltiles
2
, P T
D(gas)
D+soluto(lq)
Presin de vapor de una disolucin de disolvente voltil y
solutos no voltiles
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
4
9
[Lectura: Petrucci 14.6]
1
, P T
D(gas)
D(lq)
vapor:
lquido:
0
, 1 v D
P P =
Presin de vapor: de un disolvente
D puro
,disln 2 v
P P =
de una disolucin de D
y solutos no voltiles
2
, P T
D(gas)
D+soluto(lq)
0
,disln , v D v D
P x P =
(Ley de Raoult)
Disminuye proporcionalmente a
la fraccin molar del disolvente
D
x
1 0
,disln v
P
0
, v D
P
d
i
s
o
l
v
e
n
t
e
p
u
r
o
d
i
s
o
l
u
c
i
n
d
i
l
u
i
d
a
La tendencia a evaporarse de una disolucin
disminuye en la misma proporcin en que lo
haga la fraccin molar del disolvente
Presin de vapor de una disolucin de disolvente voltil y
solutos no voltiles
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
0
0
1 ,
;
v D
P P T =
2 ,disolucin
;
v
P P T =
Disolvente puro: Todas las molculas en la
superficie del lquido tienden a evaporarse.
Hacen falta una presin del gas relativamente
alta para que muchas molculas en el gas se
condensen y compensen esa tendencia,
alcanzndose el equilibrio.
Disolucin: Menos molculas en la superficie
del lquido tienden a evaporarse. Con una
presin de gas menor que la anterior ya
hay suficientes molculas en el gas para
compensar esa tendencia por condensacin y
alcanzar el equilibrio.
0
,disolucin ,D v v
P P <
2 1
P P <
Presin de vapor de una disolucin de disolvente voltil y
solutos no voltiles
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
1
Ejemplo:
A 20C, la presin de vapor del agua pura es 17,54 mm Hg (o Torr).
Qu presin de vapor se espera para una disolucin acuosa de glucosa formada
por 0,13 mol glucosa y 2,84 mol H
2
O?
1) Necesitamos la fraccin molar del agua:
2) Aplicamos la ley de Raoult:
2
2
Totales
H O
H O
n
x
n
= 229
2, 84 2, 84
0, 956
2,84 0,13 2, 97
= = =
+
,disln
2, 84
17, 54 16, 8
2, 97
v
P mm Hg mm Hg = =
resultado intermedio: no
redondeamos todava
Presin de vapor de una disolucin de disolvente voltil y
solutos no voltiles
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
2
Ejemplo:
1) Usamos la ley de Raoult para determinar la fraccin molar de agua en la
disolucin:
2) Despejamos los moles de glucosa:
2
2
2
;
H O
H O
H O gluc
n
x
n n
=
+
2
2
,disln
0
,
v
H O
v H O
P
x
P
=
A 20C, la presin de vapor del agua pura es 17,54 mm Hg (o Torr).
Cuntos moles de glucosa hay que aadir a 2,84 mol H
2
O para que la presin de
vapor de la disolucin sea 16,8 mm Hg?
811
16, 8
0, 957
17, 54
mm Hg
mm Hg
= =
2
2
2
1
1 0, 957811
2,84 0,125
0, 957811
H O
gluc H O
H O
x
n n mol mol
x
= = =
resultado intermedio: no
redondeamos todava
smosis: Presin osmtica de una
disolucin
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
3
[Lectura: Petrucci 14.7]
P
P
membrana
semipermeable
H
2
O
H
2
O+soluto
P t +
smosis: A igualdad de presin a ambos lados de la
membrana (que slo es permeable al agua), en la unidad
de tiempo chocan ms molculas de H
2
O por la parte del
disolvente que por la parte de la disolucin (porque la
concentracin de H
2
O es menor): no hay equilibro y
entran a la disolucin ms molculas que salen,
produciendo dilucin. La presin sobre la membrana en la
disolucin va aumentando y con ella la frecuencia de
choques, hasta que sta se iguala con la del lado del
disolvente. En esa situacin de equilibrio, la diferencia de
presiones se llama presin osmtica, t.
V n RT t =
moles de solutos disueltos
M RT t =
| |
solutos RT =
P
smosis: Presin osmtica de una
disolucin
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
4
Las mismas clulas al microscopio ...
en agua dulce en agua salada muy concentrada
Imgenes originales: http://podcast.nhart.org/groups/7thgradescience/weblog/42420/
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
5
smosis: Presin osmtica de una
disolucin
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
6
Ejemplo:
A 37C, cul es la presin osmtica (en atm) de una disolucin resultante de
disolver 0,10 mol de glucosa en agua hasta formar 250 ml de disolucin?
1) Necesitamos la molaridad de la glucosa:
2) Utilizamos la ley de la presin osmtica:
0,10 glucosa 1000
0, 40
250 disolucin 1
mol ml
M
ml l
=
0, 40 0, 08206 (273 37)
mol atml
M RT K
l K mol
t = = + = 10 atm
Las presiones osmticas de
las clulas pueden llegar a
ser muy grandes!
Aumento ebulloscpico y descenso
crioscpico
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
7
P
T
sl
gas
lq
disolvente D
disolucin
1atm
,D f
T
,disln f
T
f
T A
,D e
T
,disln e
T
e
T A
,dsln ,D ,D e e e e
T T T K m = A =
,dsln ,D ,D f f f f
T T T K m = A =
molalidad
constante
ebulloscpica
del disolvente
constante
crioscpica
del disolvente
aumento
ebulloscpico
descenso
crioscpico
| |
1 1
,
e f
K K C m K m
= =
grados (K o C) que sube/baja
el punto de ebullicin/fusin
por cada incremento de
concentracin de 1m
Aumento ebulloscpico y descenso
crioscpico
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
8
Ejemplo:
El punto de fusin (temperatura de fusin a la presin de 1 atm) del agua pura es
0C (exactos) y el de una disolucin acuosa de glucosa de concentracin
0,427 m es -0,794C.
a) Cunto vale la constante crioscpica del agua?
b) Qu punto de fusin se espera para una disolucin formada al disolver
0,143 mol glucosa en 500,00 g H
2
O?
a)
b) Necesitamos la molalidad:
2
,
( 0, 794 0)
1,86 /
0, 427
f
f H O
T
C
K C m
m m
A
= = =
2 2
0,143 glucosa 1000 0, 286 glucosa
0, 286
500, 00 1 1
mol g mol
m
g H O kg kg H O
= =
2
,
1, 86 / 0, 286 0, 532
f f H O
T K m C m m C A = = =
2
,
0 0, 532 0, 532
f f H O f
T T T C C C = + A = =
Aumento ebulloscpico y descenso
crioscpico
Qumica
(1S, Grado
Biologa)
UAM
2.
Disolucione
s
5
9
Ejemplo:
El punto de fusin del fenol es 43,0C y su constante crioscpica 7,27 C m
-1
.
Se disuelven 0,23 mol de una sustancia A en 800,00 g de fenol y se sabe que
las molculas de esa sustancia se disocian en dos (A2B) al disolverse en
fenol.
a) Qu punto de fusin se espera para dicha disolucin?
1) Necesitamos la molalidad de las especies presentes en la disolucin
2) Usamos la ley del descenso crioscpico:
5
5
0, 23 A 2 soluto 0, 57 soluto
0, 57
0, 80000 fenol 1 A 1 fenol
mol mol mol
m
kg mol kg
= =
,fenol
5 7, 27 / 0, 57 4, 2
f f
T K m C m m C A = = =
,fenol
43, 0 4, 2 38, 8
f f f
T T T C C C = + A = =
Brown et al; Chemistry, The Central Science, 11th edition.
Adaptado de
http://www.google.com.co/url?sa=t&rct=j&q=propiedades%20de%20las%
20soluciones%20ppt&source=web&cd=2&cad=rja&ved=0CDMQFjAB&url=
http%3A%2F%2Fwww.uam.es%2Fdepartamentos%2Fciencias%2Fquimica%2
Faimp%2Fluis%2FDocencia%2FQB%2FEste_curso%2FPresentaciones%2F2-
Disoluciones.ppt&ei=g8wHUcvdO4qY9QS-
koGoAw&usg=AFQjCNHRG5abLhwzfTCnKl0mCfkhS2p2IA
6
0
Literatura citada y fuentes tomadas adaptadas
6
1
6
2
El azufre se presenta en la naturaleza en muchas formas. Una
de ellas es la unin de ocho tomos juntos, S
8
, y es un slido
amarillo insoluble en agua.
1. Cuntos gramos de azufre es preciso disolver en 100.0 g
de naftaleno (C
10
H
8
) para tener una disolucin 0.12 m?
La masa molar del S
8
es 256.52 g/mol.
2. Cuntos gramos de azufre es preciso disolver en 100.0
mL de naftaleno (C
10
H
8
) para tener una disolucin 0.18
M? La masa molar del S
8
es 256.52 g/mol.
3. Cuntos gramos de azufre es preciso disolver en 100.0 g
de naftaleno (C
10
H
8
) para lograr una disolucin que
quede con
S
8
= 0.12 ? La masa molar del S
8
es 256.52
g/mol y la del naftaleno es 128 g/mol.
6
3
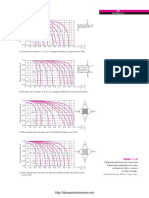
Con base en esta curva de
solubilidad, responda si
la siguiente solucin es
insaturada, saturada o
sobrestaurada:
1. 75 g de KCl en 150 g
de agua a 40 C
2. 110 g de CaCl
2
en 200
g de agua a 10 C
3. 90 g de KClO
3
en 300
g de agua a 70 C
6
4
Potrebbero piacerti anche
- A6 - Guia de Comunicacion de Peligros Segun El SGA 2017Documento115 pagineA6 - Guia de Comunicacion de Peligros Segun El SGA 2017Lilia Rosa Serrano Demares100% (1)
- 4 Equilibrio Ácido-Base (2) - Sistemas Reguladores Monopróticos ZoomDocumento12 pagine4 Equilibrio Ácido-Base (2) - Sistemas Reguladores Monopróticos ZoomjaclavijopNessuna valutazione finora
- Equilibrios químicos de iones en solución acuosaDocumento1 paginaEquilibrios químicos de iones en solución acuosajaclavijopNessuna valutazione finora
- 13 Aplicaciones Potenciométricas - ISE y PH PDFDocumento17 pagine13 Aplicaciones Potenciométricas - ISE y PH PDFjaclavijopNessuna valutazione finora
- Resumen 1 Soluciones (Para Llenar)Documento10 pagineResumen 1 Soluciones (Para Llenar)jaclavijopNessuna valutazione finora
- Balanceo Redox en Compuestos Orgánicos UNAMDocumento23 pagineBalanceo Redox en Compuestos Orgánicos UNAMjaclavijop100% (1)
- Resumen Titulaciones Ácido-Base (¡Excelente!)Documento23 pagineResumen Titulaciones Ácido-Base (¡Excelente!)jaclavijopNessuna valutazione finora
- Ensayo de Suelos - 03Documento5 pagineEnsayo de Suelos - 03Danny Glicerio Quispe Benito DaquibeNessuna valutazione finora
- Guía-Cálculo IntegralDocumento77 pagineGuía-Cálculo IntegralPieer Anderson OINessuna valutazione finora
- Tablas Termicas Intercambiadores de CalorDocumento4 pagineTablas Termicas Intercambiadores de CalorXavi Places100% (1)
- Contracción Intrínseca o EspontáneaDocumento2 pagineContracción Intrínseca o EspontáneaJair Arias100% (1)
- Movimiento de ProyectilDocumento13 pagineMovimiento de ProyectilRicardoNessuna valutazione finora
- Raspador poliuretano limpieza ductosDocumento2 pagineRaspador poliuretano limpieza ductosElinton De Jesus SarmientoNessuna valutazione finora
- Quiz 2 Semana 6 PDFDocumento5 pagineQuiz 2 Semana 6 PDFjuan gabriel diazNessuna valutazione finora
- Disrupcion CelularDocumento36 pagineDisrupcion CelularAnonymous bynfHwivFNessuna valutazione finora
- Determinacion de Cromo...Documento9 pagineDeterminacion de Cromo...Kmilo MoralesNessuna valutazione finora
- Orificios y vertederos: clasificación y coeficiente de gastoDocumento24 pagineOrificios y vertederos: clasificación y coeficiente de gastoCarlos Roberto Plata67% (3)
- Exposicion de SuelosDocumento54 pagineExposicion de SuelosMaria Alejandra Rivas HueteNessuna valutazione finora
- Revision 7 Michelle MogollonDocumento5 pagineRevision 7 Michelle MogollonAndrea mogollonNessuna valutazione finora
- Experimento de Difracción de Electrones en Polvo de Oro - Carlos David Gonzales LorenzoDocumento8 pagineExperimento de Difracción de Electrones en Polvo de Oro - Carlos David Gonzales LorenzoCarlos David Gonzales LorenzoNessuna valutazione finora
- Microsco PDFDocumento10 pagineMicrosco PDFLuisNessuna valutazione finora
- El Laboreo Sigue Siendo Objeto Permanente de Atención Por Parte de AgricultoresDocumento7 pagineEl Laboreo Sigue Siendo Objeto Permanente de Atención Por Parte de AgricultoresJazmin Reyes OteroNessuna valutazione finora
- Laboratorio Fisica ElectronicaDocumento35 pagineLaboratorio Fisica ElectronicaLopez KeilyNessuna valutazione finora
- Escuela de Ingeniería Civil-X - XiDocumento51 pagineEscuela de Ingeniería Civil-X - XiPatrick AntonyNessuna valutazione finora
- Obtención de anilina a partir de nitrobencenoDocumento8 pagineObtención de anilina a partir de nitrobencenoFCONessuna valutazione finora
- Peru Gem Brochure TecnicoDocumento14 paginePeru Gem Brochure TecnicoJunnior L. PalmaNessuna valutazione finora
- Paradox 1759EX ProgramacionDocumento56 pagineParadox 1759EX ProgramacionFélix Chaves Repullo100% (1)
- Apuntes - Procesos Químicos IndustrialesDocumento9 pagineApuntes - Procesos Químicos IndustrialesElder RoiserNessuna valutazione finora
- Proyecto de SolidosDocumento3 pagineProyecto de SolidosCristopher AguaizaNessuna valutazione finora
- Levantamiento Con TaquimetroDocumento3 pagineLevantamiento Con TaquimetroJhordan ValdiviaNessuna valutazione finora
- Matriz de Programacion Anual 2018Documento6 pagineMatriz de Programacion Anual 2018PaolaMejiaCcahuanaNessuna valutazione finora
- Estimulacion Acida Matricial en Arenas, RequerimientosDocumento36 pagineEstimulacion Acida Matricial en Arenas, RequerimientosOmar Catañed PeñaNessuna valutazione finora
- Establecimiento de calibres estándar de conductores para distribución eléctricaDocumento64 pagineEstablecimiento de calibres estándar de conductores para distribución eléctricalfcorralesNessuna valutazione finora
- CatalogoDocumento65 pagineCatalogoJavier EnriqueNessuna valutazione finora
- Biprisma de FresnelDocumento5 pagineBiprisma de FresnelsaikandreaNessuna valutazione finora