Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Fisiologia 2 - Comunicazione Metabolica
Caricato da
Anna De SimoneTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Fisiologia 2 - Comunicazione Metabolica
Caricato da
Anna De SimoneCopyright:
Formati disponibili
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
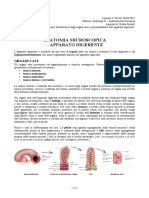
COMUNICAZIONE METABOLICA E NERVOSA: INTRODUZIONE E CONFRONTO Al ne di garantire il funzionamento dellintero organismo, le diverse cellule hanno la necessit di comunicare tra loro. Pi sar complesso lorganismo e pi il sistema di comunicazione sar evoluto. La comunicazione pu avvenire mediante messaggi elettrici o messaggi chimici. Negli organismi pi evoluti, la comunicazione elettrica trova la sua pi completa espressione nel sistema nervoso, mentre quella chimica la trova nel sistema endocrino. Con la comunicazione nervosa i protagonisti sono i neuroni, questi hanno la capacit di elaborare un segnale elettrico codicando un messaggio attraverso di esso. Una delle differenze cruciali dei due sistemi di comunicazione (oltre alla gi citata tipologia del messaggio) sta nella localizzazione della cellula che riceve il segnale: la cellula bersaglio. Nella comunicazione nervosa la cellula bersaglio si trova in contiguit con il neurone emittente: negli organismi meno evoluti il segnale esclusivamente elettrico ed trasmesso attraverso giunzioni perch la cellula che emette il segnale dista solo 2 nM da quella bersaglio. Negli organismi superiori, come luomo, la distanza tra le due cellule aumenta, anche se le cellule sono contigue queste distano 20 nM luna dallaltra e il messaggio elettrico, per giungere alla cellula contigua, deve necessariamente essere convertito in un segnale chimico. In questo caso il segnale sar detto neurotrasmettitore chimico. La comunicazione nervosa si avvale sia di segnali elettrici che chimici ed avviene tra cellule contigue o mediante giunzioni. Nella comunicazione ormonale, tipica del sistema endocrino, il segnale chimico ha una destino diverso: esso dovr raggiungere cellule ben distanti dal sito di origine. La destinazione del segnale raggiunta mediante il sistema circolatorio, per questo motivo la comunicazione metabolica molto pi lenta -ha tempi pi umani: secondi, minuti...- di quella nervosa -temi rapidissimi: millesimi di secondo-, anche la durata della risposta pi lunga, tanto da raggiungere ore. Per quanto riguarda lintensit dello stimolo, nella comunicazione endocrina, essa direttamente proporzionale alla quantit di ormone rilasciato; nella comunicazione nervosa lentit della risposta non proporzionale alla quantit del neurotrasmettitore ma strettamente dipendente allintensit del segnale elettrico. Per la comunicazione ormonale, le cellule bersaglio sono discriminate dalla presenza di una proteina recettore che si trova nella cellula (a livello della membrana, nel citoplasma o nel nucleo) in stato inattivo e solo a seguito della sua interazione con la molecola segnale si attiver fornendo lopportuna risposta ormonale. In teoria, la comunicazione nervosa non necessita di recettori: stesso la contiguit a denire il ruolo della cellula bersaglio; tuttavia, anche le cellule bersaglio del segnale nervoso sono munite di recettori, questi per, hanno un ruolo ben diverso. In questo caso i recettori non danno una specicit alla risposta cellulare ma operano la trasduzione del segnale. Nella comunicazione nervosa, i recettori sono molecole proteiche capaci di trasdurre il segnale cos da consentirne lingresso: il segnale di natura lipofobica, per questo motivo non riuscir a diffondersi in forma libera attraverso il doppio strato fosfolipidico, lazione del recettore consentir lingresso del neurotrasmettitore e di conseguenza, la sua azione specica.
PG. 1
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
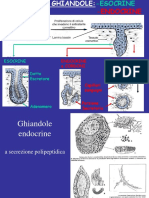
La comunicazione metabolica e quella nervosa non sono gli unici due meccanismi di interazione cellulare conosciuti, vi sono altre tipologie che posseggono caratteri intermedi tra le due forme; a tal proposito, la comunicazione metabolica, oltre alla classica ormonale, pu essere anche autocrina o paracrina. In ogni caso il segnale sar prodotto da una ghiandola endocrina. -Comunicazione autocrina: qui il segnale agisce direttamente sulla cellula emittente e prender il nome di fattore autocrino. -Comunicazione paracrina: in questo caso la molecola segnale sar detta fattore paracrino e agir sulle cellule contigue. Un altro compromesso tra le due tipologie di interazione cellulare dato da una forte modicazione della comunicazione nervosa: -Comunicazione neuroendocrina: il neurotrasmettitore emesso dal neurone, non agisce direttamente sulle cellule contigue ma si immette nel circolo sanguigno e diviene un neuro-ormone. COMUNICAZIONE ENDOCRINA: GLI ORMONI Il segnale chimico trasmesso mediante ormoni. Questi possono essere lipoli (idrofobici) o lipofobici (idroli). Ormoni lipoli: possono penetrare in forma libera attraverso il doppio strato fosfolipidico della membrana o mediante diffusione semplice se sono ad alto pm, in ogni caso solo se la cellula presenter al suo interno la molecola proteica capace di interagire con lormone (recettore) si avr una risposta specica. Sar proprio il complesso ormone-recettore ad innescare la trascrizione di un gene per la sintesi (o inibizione) di una proteina che far variare la funzione della cellula. I recettori sono fattori di trascrizione in stato inattivo ed entrano in funzione solo a seguito dellinterazione con la molecola segnale. In questo caso il recettore pu trovarsi sia nel citoplasma (citosolico) che nel nucleo, solo in rari casi di recente scoperta, questo pu essere situato a livello della membrana cellulare. Ormoni lipofobi: trattandosi di molecole lipofobiche, queste non riusciranno ad attraversare il plasmalemma in forma libera pertanto sar necessario lintervento di una proteina trasportatrice. In questo caso il recettore svolger un duplice compito e dovr essere situato necessariamente a livello della membrana plasmatica. Gli ormoni sono prodotti dalle ghiandole endocrine e possono essere di diversa natura: - Pepetidici: sono i pi diffusi, sono costituiti da proteina e sono di natura lipofobica. (es.: insulina prodotto dal pancreas, TSH...). - Steroidei: sono prodotti dalle ghiandole sessuali (androgeni ed esogeni) e dalla ghiandola corticale del surrene (ormoni mineral-attivi, ormoni gluco-attivi come il cortisolo). Sono lipoli e provengono dal colesterolo. - Amine: a questa classe appartengono gli ormoni tiroidei (secreti dalla ghiandola tiroidea) e le catecolamine (sintetizzati dalla ghiandola midollare del surrene). Gli ormoni tiroidei sono lipoli, dunque attuano una diffusione in forma libera mentre le catecolamine hanno bisogno di un recettore a livello del plasmalemma perch sono lipofobici. Le catecolamine sono lAdrenalina (80%) e la Noradrenalina (20%) e la dopamina, mentre i tiroidei sono la Triiodotirosina e la Tetraiodotirosina, anche dette Tiroxina T3 e T4. La sintesi degli ormoni delle Amine attivata dallamminoacido polare Tirosina. La tirosina, grazie al suo anello fenolico, pu attuare le due idrossilazioni necessarie alla sintesi delle catecolamine. Mentre nella ghiandola corticale del surrene, la tirosina alogenata reagisce
PG. 2
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
per dare un residuo di T3 e T4, rilasciati mediante proteolisi. La iodurazione dellanello della tirosina pu essere ostacolata da una carenza di iodio che causa un patologico ingrossamento della ghiandola tiroide. La quantit degli ormoni dipende dalla funzionalit della ghiandola che li secerne, una sua iper- o ipo-funzionalit potrebbe causare diverse patologie. Lesempio pi classico dato da un ipofunzionalit delle -cellule che causa il diabete di tipo 2, ma se i livelli di insulina nel sangue sono nella norma, e il soggetto presenta ugualmente un comportamento diabetico, questo sar causato da un malfunzionamento del recettore; Da questo esempio si evince che, in ambito ormonale, le patologie possono essere legate sia ad una disfunzione delle ghiandole che al malfunzionamento dei recettori che provocano la resistenza della cellula bersaglio. La cellula bersaglio pu essere resistente al segnale, oltre che per un danno al recettore, anche per la risposta che esso innesca. Lemovita degli ormoni idroli (lipofobici) breve perch si dissipano nel sangue, gli ormoni entrano in circolo mediante delle proteine trasportatrici prodotte dal fegato: globuline e albumine. Tutti gli ormoni sono secreti da particolari cellule che costituiscono le ghiandole endocrine, dopo la secrezione, gli ormoni sono riversati nel sistema sanguigno per poi giungere, mediante i capillari, a livello delle cellule bersaglio. Teoricamente, dal circolo sanguigno, gli ormoni potrebbero agire su qualsiasi cellula, a discriminare lazione di un ormone uno speciale proteina, detta recettore che caratterizza la cellula bersaglio. Il recettore da specicit alla risposta. INTERAZIONE TRA RECETTORE E ORMONE La concentrazione ormonale nel sangue dipende strettamente dalla funzionalit delle ghiandole endocrine, una iper- o ipo-funzionalit di queste pu essere, per quanto possibile, tamponata dalle cellule bersaglio con due differenti meccanismi che prevedono la regolazione del numero di recettori (con lup e down regulation) e lafnit dei siti attivi di questi ultimi. - down regulation: in caso di una iperfunzionalit delle ghiandole endocrine, le cellule bersaglio produrranno una regolazione verso il basso del numero di recettori, o meglio, si avr un abbassamento del numero di recettori a livello della cellula bersaglio, in moda da rendere la risposta adeguata. - up regulation: attuata dalle cellule bersaglio in caso di ipofunzionalit delle ghiandole endocrine e al contrario della down regulation, qui previsto una regolazione verso lalto, quindi un aumento dei recettori a livello della cellula. Le cellule bersaglio possono contrastare eventuali disfunzioni delle ghiandole anche modicando lafnit del sito attivo: aumentando o diminuendo il grado di fosforilazione del sito di legame. Quando la concentrazione di ormone nel sangue troppo bassa (ipofunzionalit), lafnit del sito attivo recettoriale sar aumentata, viceversa nel caso in cui si dovesse vericare una iperfunzionalit. Queste regolazioni sono indispensabili per mantenere invariata la risposta ormonale delle cellule bersaglio. La concentrazione ormonale nel sangue pu essere stimata mediante appositi dosaggi, in condizioni normali non supera i 10-12 M. Nonostante le bassissime concentrazioni, lormone lega al sito attivo della proteina recettore grazie allaltissima afnit e specicit di
PG. 3
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
questo ultimo. Il numero di proteine recettori a livello della cellula limitato, ma tutti dispongono di un sito di legame ad alta specicit e afnit. Ogni recettore pu avere un diverso numero di siti di legame; I recettori con un unico sito attivo seguono la stessa cinetica dei Glu-T (entrambi sono soggetti a saturazione); I Glu-T sono trasportatori con stechiometria pari a 1 e la cinetica di tipo MichaelisMenten che con rappresentazione graca su assi cartesiani ha un andamento di crescita lineare, ci signica che per bassi livelli ormonali, allaumentare della concentrazione aumenter il numero di recettori attivati e quindi anche la risposta ormonale a livello cellulare, laumento sar proporzionale no al raggiungimento della Vmax. Con laumento dei siti di legame sul recettore la cinetica non pi di Michaelis-Mentene, perch non si manifesta una risposta ormonale n quando il recettore non avr legato tutti i suoi siti attivi. In casi limite (con un alta stechiometria, es.: 16), la risposta ormonale avr luogo solo al raggiungimento della cosiddetta concentrazione critica, dove lormone abbastanza concentrato da dar vita direttamente alla risposta massima, anche in questo caso, aumentando ulteriormente il livello ormonale non si avr un aumento della risposta cellulare: allaumentare della stechiometria si passa da una cinetica ad andamento iperbolico ad un andamento sigmoidale. Le risposte della cellula allormone sono variabili perch dipendono dalla stechiometria del recettore. COMUNICAZIONE ENDOCRINA: I LEGAMI Il recettore, per innescare la traduzione deve legarsi allormone. I legami sono generalmente inuenzati dalla concentrazione e dalla specicit del sito attivo, ma nel sangue, la concentrazione ormonale bassissima (da 10-8 a 10-12 M), per questo tutto dipende dallaltissima afnit del sito di legame del recettore, infatti, esso ha una costante di dissociazione molto bassa. Lalta afnit del sito attivo rende la dissociazione tra lormone e il recettore piuttosto ardua e questo potrebbe essere uno svantaggio perch il segnale deve agire per un tempo limitato (la risposta ormonale non deve essere troppo lunga), per questo motivo la cellula attua dei meccanismi per interrompere lazione dellormone nonostante il recettore sia ancora attivato. Per quanto riguarda i recettori a livello della membrana, qui la proteina non si limiter a dare specicit alla risposta ma opera anche un ruolo di trasduzione del segnale. A questo proposito, la cellula bloccher il sistema trasduzionale, questo bloccher il segnale ma non dissocer il legame ormone recettore; Per rigenerare un nuovo recettore a livello della membrana, la cellula dar vita ad un fenomeno di internalizzazione: per endocitosi il complesso recettore ormone condotto -mediante delle vescicole- no ai lisosomi, dove la variazione di PH (basso) far diminuire lafnit del sito attivo cos da favorire la dissociazione del legame. A questo punto, la cellula sar in grado di generare un nuovo recettore a livello del plasmalemma. Quando il recettore allinterno della cellula, pu essere facilmente diminuita lafnit del sito attivo cos da consentire il distacco dellormone che viene metabolizzato dalla cellula cosicch il recettore libero potr interagire con un altro ormone.
PG. 4
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
I RECETTORI I recettori possono essere raggruppati in 4 categorie principali: recettori intracellulari, proteine solubili che mediano gli effetti di molecole segnale in grado di poter entrare nella cellula, quindi di natura lipola (in caso degli ormoni, saranno gli steroidei e tiroidei). Unaltra classe costituita da recettori presenti a livello della membrana plasmatica che mediano gli effetti delle molecole che per loro natura chimica non possono entrare nella cellula per diffusione libera (idroliche). Queste sono proteine integrali di membrana sono costituite da domini extracellulari che interagiscono con lormone, da segmenti transmembrana e domini intracellulari (effettori) che si attivano quando i domini extracellulari interagiscono con la molecola segnale. A differenza dei trasportatori e delle proteine canale che hanno entrambe le estremit allinterno del citosol, i recettori membranali sono caratterizzati dallestremit amminica allesterno e quella carbossilica allinterno. In base al numero dei segmenti transmembrana si hanno diverse categorie: Recettori Enzima: il dominio intracellulare un enzima, di solito una tirosinchinasi, una chinasi in grado di fosforilare una proteina su residui di tirosina, utilizzando lATP. La tirosinchinasi si attiva solo quando lormone si lega al dominio extracellulare. I recettori enzima possono mediare gli effetti di ormoni proteici come linsulina, di fattori autocrini e paracrini ma anche di fattori di accrescimento, sono specici per molecole di natura peptidica. Questo tipo di recettore ha un solo segmento transmembrana e per questo viene anche detto Recettore a singolo lamento transmembrana. Recettori metabotropi: sono molto duttili in quanto mediano gli effetti di numerose molecole segnale: ormoni di natura proteica e catecolamine, di neurotrasmettitori o segnali non molecolari come la luce, i sapori e gli odori. Sono caratterizzati da sette lamenti transmembrana e per funzionare devono essere accoppiati ad una proteina G (una proteina intrinseca di membrana, solo agganciata al doppio strato lipidico perch sporge nel citosol). Recettori canale: come i recettori enzimi, anche questi sono molto specici in quanto mediano il segnale solo di alcuni neurotrasmettitori e presentano un canale ionico nella loro struttura. Si trovano esclusivamente in ambito della comunicazione nervosa. I recettori intracellulari danno vita a risposte a lungo termine perch il segnale induce, quasi esclusivamente, lattivazione di un lungo processo di trascrizione. Questi recettori sono delle proteine solubili situate nel citosol o nel nucleo. Questi sono fattori di trascrizione inattivi che entrano in funzione solo quando il recettore interagisce con la molecola segnale. Un fattore di trascrizione una proteine capace di interagire con il sito promotore del DNA, con una specica sequenza detta HRE (elemento di risposta allormone, anche detto sito accettore), questa interazione dar vita alla trascrizione con la formazione di un RNA messaggero capace di emigrare nel citosol dove avverr la traduzione con la formazione della proteina specica. In rari casi potrebbe vericarsi il meccanismo opposto: il recettore un fattore di trascrizione attivo e viene inibito mediante linterazione con lormone che ne interrompe la trascrizione. Negli organismi esiste unintera famiglia di recettori intermembranali con un pm che oscilla tra 70.000 e 90.000. Sebbene ogni isoforma codicata da differenti geni, le strutture dei recettori intracellulari possono essere ricondotte ad un unico modello descrittivo: sono
PG. 5
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
costituiti da una zona centrale altamente conservata -con una sequenza amminoacidica ripetuta- in cui si trova il DBD (dominio che lega il DNA), capace di interagire con lHRE (sito accettore). Le due estremit sono molto variabili tra le varie isoforme, quella carbossilica rappresenta il sito recettoriale che lega lormone mentre quella amminica un fattore regolatore. Il DBD costituito da una catena lineare di circa 80 amminoacidi. La catena presenta due ripiegamenti causati dallinterazione tra un atomo di zinco e 4 cisteine, queste curvature sono dette zinger-nger e possono interagire con lHRE solo quando il fattore di trascrizione attivo. I recettori Intracellulari, reagiscono solo con molecole lipole (ormoni steroidei -cortisolo, estrogeni, progesterone- e tiroidei, molecole segnali non ormonali come la vitamina D e vitamina A) e possono essere divisi in due classi principali: - Recettori intracellulari di primo tipo/recettori steroidei: di norma si trovano nel citosol e sono specici per gli ormoni steroidei. In assenza del segnale si trovano sotto forma di monomeri perch associati ad un complesso proteico inibitore. Quando un ormone steroideo giunge nel citosol (mediante trasporto in forma libera o diffusione facilitata se si tratta di steroidi ad alto PM) e interagisce con il sito attivo (ad altissima afnit) del recettore, questo subisce una variazione della conformazione che porta libera il recettore dalla molecola inibitrice. In questo modo il recettore potr migrare nel nucleo e legarsi ad un altro monomero cos da formare un dimero capace di interagire con lHRE e innescare il meccanismo di trascrizione con la formazione di una determinata proteina. La struttura omodimerica un fattore di trascrizione attivato. Lestremit carbossilica e il DBD interagiscono con linibitore proteico: il distacco dallinibitore avverr quando la molecola lipola si legher al sito recettoriale presente proprio sullestremit carbossilica. Lestremit amminica importante nel determinare il processo di dimerizzazione al momento della dissociazione del complesso recettore+inibitore. - Recettori intracellulari di secondo tipo/recettori tiroidei: questi recettori si trovano esclusivamente a livello del nucleo e sono specici per gli ormoni tiroidei. Non sono associati a nessuna proteina inibitrice, pertanto si trovano gi in forma omo- o etero-dimerica. Il recettore eterodimerico pu avere due differenti siti attivi (uno per la molecola segnale, lacido retinoico -un derivato della vitamina A- e uno per lormone tiroideo), ma a differenza del sito di legame dei recettori intracellulari di primo tipo, questi siti attivi sono a bassa afnit, pertanto incapaci di reagire con lHRE. Sar proprio linterazione con un ormone tiroideo a causare un cambiamento della struttura conformazionale del recettore cos da causare un aumento di afnit. Questa diminuzione della Kd sar indotta dalla fosforilazione dellestremit amminica e render possibile linterazione con il sito accettore per innescare la trascrizione. In forma inattiva c bassa afnit tra DBD e HRE. Per bloccare lazione dellormone bisogna scomporre il complesso recettore ormone, cos da disattivare nuovamente il fattore di trascrizione: proprio questa lazione che svolge il sito di regolazione. Sullestremit amminica vi un sito di fosforilazione, le chinasi idrolizzano ATP per fosforilare residui di treonina e serina, in tal modo si avr una netta diminuzione dellafnit del sito attivo.
PG. 6
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
I recettori membranali sono proteine integrali di membrana e possono essere classicati in base al num. di lamenti transmembrana: - Recettori a singolo lamento/recettori enzima/Tirosina-chinasi: sono rappresentati da unampia famiglia tanto che il pm oscilla tra 80.000 e 100.000. Questi recettori sono glicoproteine*1 integrali di membrana caratterizzate dalla presenza di un enzima nella struttura. I recettori membranali sono specici per le molecole proteiche (es. insulina, fattori di accrescimento, e citochine come fattori paracrini e autocrini). Pur presentando una certa specicit per le molecole proteiche, i recettori a singolo lamento non trasducono il segnale di neurotrasmettitori, pertanto si trovano solo in ambito della comunicazione metabolica. Dato che questi recettori mediano i segnali delle molecole di natura lipofoba, svolgono anche un ruolo di trasduzione (legano il segnale e lo trasportano allinterno della cellula bersaglio). Il recettore Tirosina-chinasi costituito da un dominio esterno dato dallestremit amminica, di norma, un solo segmento transmembrana che fa da tramite tra i domini intra- ed extra- cellulare e inne, lestremit carbossilica con il dominio intracellulare: al contrario dellestremit amminica che varia molto tra le diverse isoforme, il dominio interno altamente conservato e presenta la componente enzimatica. I recettori Tirosina-chinasici inattivi, si trovano in forma monomerica, in questa forma, lenzima situato sulla coda carbossilica presente ma non svolge nessuna funzione; il ligando che costituisce la proteina segnale un omodimero, per questo capace di interagire con due siti attivi di due differenti domini esterni*2, con questa interazione si avr la dimerizzazione del recettore. Con la formazione del dimero, i due domini interni si attivano perch lenzima inizier a svolgere la sua funzione: la chinasi idrolizza lATP e rilasciando lADP nel citosol utilizza il fosfato per fosforilare un residuo di tirosina dellaltro dominio intracellulare che costituisce il dimero. Mediante questo fenomeno di trans-autofosforilazione, i due domini intracellulari si fosforilano vicendevolmente. La formazione del dimero necessario sia per lattivazione delle due chinasi, che per la fosforilazione: ogni enzima non potr fosforilare il proprio residuo di tirosina per questo la fosforilazione dovr essere trans, il presso auto segnala che le chinasi fosforilano la stessa molecola alla quale appartengono. Leffetto della fosforilazione: un recettore che ha subito linuenza dellormone presenta le tirosine fosforilate cosicch i domini interni saranno capaci di interagire con particolari proteine citosoliche, queste si fosforileranno a loro volta dando vita alla risposta ormonale. Le proteine citosoliche cos fosforilate potranno essere sia enzimi che inducono lattivazione o linibizione di un enzima gi presente nel citosol oppure dar vita ad una catena di fosforilazione; anche la catena di fosforilazione potr terminare con lattivazione o linibizione di un enzima (risposta breve) oppure con lattivazione di un fattore di trascrizione (risposta a lungo termine).
_______________ *1 Sono glicosilate nei domini extracellulari, proprio come la pompa sodio potassio *2 Il dominio extracellulare dato dalla coda amminica e presenta il sito attivo specico per le varie molecole segnale di natura proteica.
PG. 7
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
- Recettori per linsulina: pur essendo dei recettori enzima, questi presentano due segmenti transmembrana, quindi si trovano gi in forma di dimero; questo costituito da una subunit di 135 kD, e una di 95 kD legate tra loro da ponti disolfuro -non dai classici legami deboli-. Linterazione con una o due molecole di insulina indurr un mutamento della conformazione che attiver le chinasi interne cos da avere la trans-autofosforilazione su residui di tirosina e la conseguente trasduzione del segnale: il dominio interno potr interagire con proteine citosoliche che riconoscono le tirosine fosforilate. Nel caso dellinsulina, sar la IRS -substrato di risposta allinsulina- a legarsi al recettore. La IRS si fosforila a sua volta sempre su residui di tirosina. La IRS pu essere: un enzima, una proteina modulatoria. Pertanto pu dare sia risposte lunghe (trascrizione di una proteina) che brevi (attivazione di un enzima). Un classico esempio di risposta breve dato dallattivazione della glicogenosintetasi. Linsulina lormone della fase postprandiale: la cellula non pu contenere troppo glucosio per non far aumentare la pressione osmotica, per questo dopo lassorbimento, il glucosio deve essere degradato con la glicolisi, oppure, grazie ad enzimi attivati dallinsulina, trasformato in glicogeno. La glicogeno sintetasi presente solo a livello delle cellule muscolari ed epatiche in forma fosforilata, cio inattiva. Linsulina, interagendo con i suoi recettori a livello della membrana, indurr il primo cambio conformazionale con lattivazione delle chinasi dei domini interni e della conseguente trans-autofosforilazione, in tal modo si potr legare e fosforilare lIRS e dare una risposta enzimatica. Con lattivazione di una fosfatasi si attiver la glicogeno sintetasi; questa sar defosforilata su residui di serina. La glicogeno sintasi garantir una riserva di glucosio nella fase di digiuno. Quando la IRS non un enzima, questa detta trasduttore: A livello descrittivo, la trasduzione del segnale pu essere divisa in due fasi, la prima trasduzione avviene con la fosforilazione delle code carbossiliche, quando lIRS non un enzima, questa detta trasduttore perch attua la seconda fase del trasporto del segnale a livello citoplasmatico. - Recettori non enzima: pur trattandosi di recettori a singolo lamento, questi costituiscono una eccezione e non presentano nessun enzima a livello della coda carbossilica, pertanto, quando sar attivato un recettore a singolo lamento non enzima, la risposta ormonale sar esclusivamente lunga (trascrizione di una proteina). Lassenza della tirosina chinasi a livello del dominio intracellulare sopperita dalla presenza di enzimi tirosinchinasici solubili nel citosol. Quando una molecola segnale omodimerica interagisce con il recettore non enzima, questo dimerizza. Con la dimerizzazione, i domini interni potranno reagire con la tirosina chinasi citosolica JAK, questa fosforila i due domini e se stessa. A questo punto, lenzima STAT (trasduttore del segnale e attivatore della trascrizione) si legher al complesso e sar a sua volta fosforilato. La forma fosforilata di STAT potr dimerizzare con un altro STAT fosforilato. La forma dimerica sar trasporta al nucleo dove determineranno la fosforilazione di fondamentali fattori di trascrizione. Le molecole segnale per i recettori non enzima comprendono lormone della crescita e la prolattina. Il GH non un omodimero, per induce comunque la formazione di un dimero. Questa scoperta sconvolse anche i ricercatori: n ad allora si pensava che per far dimerizzare due catene polipeptidiche era necessario un omodimero, con il GH si vede che anche un ligando monomerico pu dimerizzare il recettore. Questo meccanismo stato spiegato assumendo che linterazione con i due siti attivi avviene mediante due differenti domini della proteina rappresentata dal GH. << questa pu essere considerata una doppia eccezione>>.
PG. 8
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
Il sistema di blocco della risposta ormonale, nel caso di recettori presenti a livello della membrana, cio di recettori che oltre a fornire una risposta specica dovranno anche trasportare il segnale allinterno della cellula, il blocco avviene fermando il meccanismo di trasduzione del segnale. La trasduzione attuata mediante la cascata di fosforilazione indotta dallinterazione tra ormone e il sito attivo ad altissima afnit del recettore. Per bloccare la cascata di fosforilazioni su residui di tirosina, la cellula attiva delle chinasi citosoliche speciche per fosforilare su residui di treonina e serina cosicch la proteina subir un variazione di conformazione che impedir lazione delle tirosina chinasi. A questo punto, le fosfatasi presenti nel citosol andranno a tagliare il fosfato dei residui di tirosina cosicch, nonostante la mancata dissociazione tra molecola segnale e recettore, la risposta ormonale avr ne. Il meccanismo di blocco della trasduzione del segnale, pu esprimersi a livello delle code carbossiliche oppure sulle molecole trasduttore come lIRS (il substrato di risposta allinsulina). In seguito al meccanismo di blocco si attuer il fenomeno di internalizzazione. I recettori metabotropi sono stati i primi ad essere studiati. Sono anche essi recettori transmembrana, quindi costituiti da una molecola intregrale di membrana ma al contrario dei recettori enzima, questi saranno a 7 lamenti. Da un punto di vista strutturale, analogamente ai recettori a singolo lamento, anche questi presentano lestremit amminica allesterno e la carbossilica allinterno, mentre la principale differenza data dal fatto che la risposta ormonale indotta dai recettori metabotropi vincolata alla presenza di una proteina estrinseca di membrana*3 la proteina G (si tratta di una famiglia di proteine capaci di attuare la GTPasi*4). Il complesso Recettore+Proteina G non lunico elemento essenziale afnch avvenga la trasduzione, questo dovr essere necessariamente associato ad un Effettore: una proteina integrale di membrana ad azione enzimatica che operer la trasformazione del substrato in un secondo messaggero. Al contrario della grande quantit di ormoni, le tipologie di Secondo Messaggero sono molto limitate. Tra i pi diffusi vi lAMP-ciclico Con i recettori metabotropi, il meccanismo di trasduzione sar tale da indurre la formazione di un secondo messaggero a partire dallinterazione tra substrato (primo messaggero) e dominio esterno. Il secondo messaggero dar vita ad effetti brevi: che regolano il trafco cellulare, cio i meccanismi di endo- ed eso-citosi, oppure con lazione sui canali ionici ( proprio per questo che i recettori metabotropi sono capaci di mediare i segnali dei neurotrasmettitori); ed effetti lunghi, che coinvolgono sempre la trascrizione di un gene e la sintesi proteica. Quando si parla di recettori metabotropi si fa riferimento ad unampia famiglia di recettori, questi possono essere ricondotti -a scopo descrittivo- ad ununica struttura che vede 7 lamenti transmembrana e 3 anse intra- ed extracellulari. Il sito recettoriale pu essere localizzato in differenti regioni; generalizzando si pu affermare che il sito attivo per i neurotrasmettitori sar localizzato livello della coda amminica, per i recettori come il -adrenergico, che interagiscono con speciche amine, il sito attivo formato da una tasca costituita dai lamenti 2, 3, 4, 5, 6 e 7, disposti in una struttura circolare; Per i segnali di natura proteica, il sito recettoriale sar dato sempre dalla tasca ma saranno coinvolte anche le tre anse extracellulari. Se somministrate nellorganismo umano, alcune sostanze sono capaci di inibire la risposta ormonale anche in presenza di esso (antagonisti) oppure
PG. 9
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
indurre una risposta ormonale anche in assenza della molecola segnale (agonisti). Queste sostanze, non solo hanno aiutato a determinare la posizione del sito attivo, ma trovano unampia applicazione in medicina per correggere unipo- o iper- funzionalit ghiandolare. La struttura dei domini interni, al contrario del sito attivo, altamente conservata a causa della presenza del G. Protein Coupling, cio la porzione che interagisce con la proteina G. Questa formata dalla seconda e terza ansa citosolica e dellestremit carbossilica. E proprio questo il sito che cambier di conformazione con linterazione della molecola segnale alla sacca recettoriale. Il mutamento di conformazione, a scopo descrittivo, pu essere considerato la prima fase della trasduzione del segnale perch attiver la proteina G che bstimoler lazione delleffettore con la formazione del secondo messaggero. Questa fase della trasduzione pu essere bloccata mediante delle chinasi citosoliche (PKA, proteina chinasi A) che fosforilano su residui di serina e treonina presenti sulla terza ansa citosolica e sulla coda carbossilica. - Recettori - e - adrenergico: anche detti BAR. Sono recettori metabotropi capaci di interagire con le catecolamine. La nomenclatura - e - dipende dal tipo di proteina G associata al recettore. Per i - adrenergico si avr una proteina di tipo Gs cio Stimolante. Per gli - adrenergico si tratter di proteine Gi, inibitrici. I recettori -adrenergici che si trovano a livello della membrana delle cellule epatiche. Quando nel sangue aumentano i livelli di adrenalina, questa agisce sui recettori degli epatociti cos da attivare la proteina G stimolante. La proteina attiver a sua volta leffettore che in questo caso rappresentato dallenzima Adenilato-ciclasi*5 (subunit ) che catalizza la trasformazione di ATP in AMP-ciclo.
PG. 10
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
Il ruolo delleffettore o secondo messaggero Ladenilato-ciclasi rompe il legame di natura eterea che lega il fosfato in a quello in posizione ; in questo modo si former il pirofosfato che sar rilasciato nel citosol. Contemporaneamente al rilascio di pirofosfato, lenzima induce la formazione di un altro legame tra il fosfato in posizione e il gruppo ossidrile del carbonio in posizione 3 del ribosio, cos si forma lAMP-ciclo. Nella cellula sono presenti fosfodiesterasi capaci di rompere il legame del ciclo cos da formare lAMP ma essendo lattivit delleffettore maggiore di quella delle fosfodiesterasi, la a produzione di c-AMP (secondo messaggero) sar tale che potr agire come ormone. Quattro molecole di AMP-ciclico sono in grado di attivare una proteina chinasi A (PKA) che consentir la degradazione del glicogeno per avere le singole unit di glucosio cos da innalzare la glicemia nel sangue. Strutturalmente, la PKA presente nella cellula, senza svolgere alcun ruolo, sotto forma di un eterotetramero formato da due subunit regolatorie adese a due subunit catalitiche. Due molecole di AMP-ciclico interagiscono con ogni subunit regolatoria; questa interazione indurr la separazione tra le subunit catalitiche e quelle regolatorie; In tal modo le subunit catalitiche si attivano cos da poter fosforilare su residui di serina e treonina di particolari proteine bersaglio: attiva la glicogenofosforilasi chinasi che a sua volta fosforiler sempre su residui di treonina e serina, la glicogenofosforilasi che attivandosi potr catalizzare la degradazione del glicogeno in glucosio. Con lattivazione della glicogenofosforilasi, bisogner inibire la glicogenosintetasi, un enzima che si presenta inattivo nella sua forma fosforilata, pertanto la PKA fosforila la glicogenosintetasi inattivandola.*6 LAMP-ciclico sar presente nella cellula n quando il segnala sar trasdotto, quando la trasduzione sar bloccata, le fosfodiasterasi potranno spezzare; Lazione delle fosfodiasterasi potr essere inibita ad opera delle Metilxantine, ne un esempio la caffeina: essendo di natura lipola, la caffeina pu penetrare facilmente attraverso il doppio strato fosfolipidico e inibendo le fosfodiesterasi a livello neuronale, prolungare leffetto della serotonina, per questo motivo la caffeina denita una sostanza eccitante. Funzioni della PKA in risposta allAMP-ciclico La PKA la proteina bersaglio dellc-AMP. La PKA pu attivare enzimi -come nella degradazione del glicogeno-, pu indurre fenomeni di trafco cellulare -come lesocitosi-, pu attivare o disattivare canali ionici -quindi sar coinvolta nella mediazione di neurotrasmettitori come la serotonina-; pu essere coinvolta nel meccanismo di blocco della trasduzione andando a fosforilare il recettore BAR sulle anse interne. (effetti a breve termine, che hanno luogo nel citosol). La PKA pu avere un effetto anche a lungo termine, quindi pu agire sulla trascrizione genica: la pka A, attivata, pu entrare nel nucleo mediante i pori nucleari. I fattori di trascrizione qui presenti -CREB (proteine di legame con elementi di risposta allAMP-ciclico)- possono essere attiva/fosforilati dalla PKA. Le CREB, per poter attuare la trascrizione deve dimerizzarsi legando con la proteina CDP (proteina legante CREB). Formando leterodimero, la CREB sar in grado di interagire con alcune sequenze del DNA presenti nel sito accettore, (CRE -elementi di risposta del c-AMP-)
PG. 11
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
La proteina G: struttura e attivazione delleffettore o secondo messaggero. Esistono varie isoforme della proteina G, e con la specicit di questa proteina possibile che la medesima molecola segnale potrebbe dar vita a risposte differenti. Strutturalmente, la proteina G inattiva un trimero, le subunit e sono ancorate al doppio strato lipidico e insieme alla subunit , la proteina si svolge interamente nel citosol. Le diverse subunit, anche in forma attiva, aderiranno alla membrana mediante una molecola idrofobica. Per quanto riguarda il peso molecolare, effettuando una media tra le varie isoforme si ha: Subunit , oscillante tra 40.000 e 50.000; Subunit , tra 30.000 e 35.000; Subunit , tra i 5.000 e i 10.000. Le interazioni tra le subunit e , pur essendo di tipo debole, garantiscono un legame molto forte tra le due subunit proteiche cos da impedirne la rottura. Al contrario, il legame con la subunit di natura pi debole, pertanto, la subunit si potr dissociare dando vita ai frammenti G() e la G(), sar questa la forma attivata: la subunit a svolgere lazione di GTPasi (nota che la subunit presenta un PM maggiore). Se il recettore non attivato dalla molecola segnale, la proteina G sar sotto forma di trimero e al sito attivo della subunit legata una molecola di GDP, dunque la sua attivit di idrolisi non potr avvenire. Quando lormone (o lagonista) interagisce con il recettore, la seconda e terza ansa citosolica cambiano di conformazione cos da poter interagire con la subunit della proteina G. Leffetto dellaccoppiamento tra recettore attivato e proteina G sar il cambio conformazionale della stessa subunit che, in presenza del cofattore (Mg2+), liberer il GDP nel citosol cos da legare al suo sito attivo il GTP che a livello citoplasmatico ha una concentrazione di 10 volte maggiore della sua forma defosforilata (GDP). Con la formazione del legame tra sito attivo e GTP, le interazioni deboli che legavano la subunit alla non sono abbastanza forti da tenere insieme il trimero cosicch si andranno a formare un monomero G() e il dimero G(). La G() dotata di un meccanismo a tempo non ancora noto, infatti lidrolisi del GTP non avviene subito, ma dopo qualche secondo. Nellintervallo di tempo che passa tra la formazione del legame sito attivo+GTP e lidrolisi della molecola a base guaninica, si attiveranno gli effettori. Con lattivazione degli effettori, la GTPasi liberer il P nel citosol e torner nella sua forma inattiva perch al substrato rester ancorato il GDP: la proteina G torner alla sua forma trimerica e sar pronta ad effettuare un nuovo ciclo. Generalmente, sia il monomero G() che il dimero G() potranno ad agire su effettori a livelli cellulari che concluderanno il meccanismo della trasduzione. Nel caso specico delleffettore dei recettori -adrenergici, sar il monomero G() della proteina Gs ad attivare il cAMP. Ma sia la proteina G() che G() agiranno sulleffettore quando al recettore sar associata una proteina G inibitrice. _______________ *3 proteina che non presenta segmenti transmembrana ma solo domini citosolici. *4 opera la scissione del GTP (guanosintrifosfato), una molecola simile allATP ma con base guaninica. *5 Proteina integrale di membrana che presenta lattivit enzimatica a livello dei domini citosolici *6 La fosforilazione attiva i processi catabolici e inattiva gli enzimi anabolici.
PG. 12
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
Il meccanismo di blocco dei recettori metabotropi Teoricamente, ogni qual volta la proteina G ricostituisce il trimero tornando alla sua forma inattiva, avviene il blocco della trasduzione del segnale; questo blocco per solo apparente perch la molecola segnale continua ad interagire con il recettore cos da avere un processo trasduzionale continuo. Per un buon funzionamento cellulare necessario che il segnale giunga al recettore attivandolo, ma ugualmente importante che avvenga il meccanismo di blocco per avere la risposta opportuna: il meccanismo di blocco dei recettori metabotropi avviene con linibizione della formazione del secondo messaggero che pu essere indotta bloccando una delle fasi della trasduzione, la prima a livello del recettore e la seconda agendo direttamente sulla proteina: Inibizione del recettore: Il meccanismo di blocco operato mediante la fosforilazione su residui di serina e treonina della coda carbossilica o della terza ansa citoplasmatica delleffettore, quando ci avviene, si perde laccoppiamento con la proteina G cosicch questa non potr essere nuovamente attivata. Inibizione della proteina G: In alternativa, la cellula potr bloccare il meccanismo di trasduzione agendo direttamente sulla proteina G. Nelle cellule sono presenti proteine RGS (Regolatorie del Segnale indotto dalle proteine G) che quando sono attive agiscono sulla subunit G() GTP: fanno avvenire un cambio conformazionale che attiva immediatamente lattivit GTPasica delle proteine: con lassenza del meccanismo a tempo non saranno attivati effettori. Agenti Patogeni Per quanto riguarda gli ormoni vi sono due gruppi di patologie, il primo legato a disfunzioni a livello recettoriale o ghiandolare, il secondo legato ad agenti patogeni. Lorganismo umano ha la necessit di aprirsi allesterno e per questo, organismi inferiori come agenti patogeni possono introdursi allinterno del nostro organismo -in genere attraverso lapparato respiratorio-. Alcuni batteri producono tossine capaci di interferire sul sistema trasduzionale, in particolar modo, agiscono sulla subunit G(). Le tossine in questione sono: - Tossina Colerica, un esotossina dal Vibrione. Agisce sulla subunit della proteina Gs con il trasferimento dellADP-ribosio del NAD presente nella cellula, ad un residuo aminoacidico della G. In tal modo la proteina G() stimolante, perde la sua attivit GTPasica e si blocca nella forma attiva (G+GTP) cos da indurre una stimolazione persistente del suo effettore che continuer la produzione di cAMP. LAMP ciclico il responsabile dellenorme perdita di elettroliti ed acqua dalle cellule intestinali, tipica del colera. - Tossine della Pertosse, un esotossina della Bordetella. Lattivit enzimatica di queste tossine, si concentra sulla subunit G() delle proteine G inibitorie, cosicch la Gi non potr pi accoppiarsi con il proprio recettore con una conseguente produzione abnorme di AMP-ciclico. Labbondanza di c-AMP avr ripercussioni deleterie con una produzione sopraelevata di muco che ostruir le vie respiratorie.
PG. 13
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
La Proteina G: altre isoforme Esistono circa 20 isoforme, generalmente queste sono classicate sulla base del tipo di subunit e del sistema effettore modulato. La struttura pu essere ricondotta ad un unico modello, il trimero precedentemente illustrato. Le isoforme maggiormente studiate ne sono 5, La Go e la Gt sono esclusive della comunicazione nervosa. La Go associata a recettori per neuromodulatori e neurotrasmettitori, mentre la Gt non prende parte alla trasduzione di molecole ma di altri tipi di segnali come fotoni (rodopsina) e odoranti. Nella comunicazione metabolica, di rilevante importanza sono le proteine Gs, le varie isoforme della Gi e la Gq. Queste operano attraverso la subunit . - Proteina Gs: associata a numerosi recettori (Noradrenalina, 5-HT, dopamina, adrenalina, glucagone...), stimola leffettore per ladenilatociclasi (es.: -adrenergico). Quando associata ad un recettore per un neurotrasmettitore, oltre la stimolazione di un effettore, potrebbe attivare direttamente un canale ionico. - Proteina Gi: associata a molti recettori (noradrenalina, serotonina oppioidi, dopamina...), come per la Gs anche in questo caso leffettore sar ladenilatociclasi ma lazione della subunit G() sar linattivazione (es.: -adrenergico). La G() inibitoria agisce esclusivamente quando i livelli di adenilatociclasi sono elevati: cronologicamente si avr prima lattivazione del complesso Recettore + G stimolante e solo in secondo momento si attiver il recettore associato alla G inibitoria per modulare i livelli di c-AMP. La Gi dispone di un duplice meccanismo inibitorio, il primo si avvale della subunit G()i che interferisce con i domini citosolici delladenilatociclasi attiva, cos da inibirla. Nonostante la G()s sia attiva, lazione delladenilatociclasi inibita. Il secondo meccanismo si avvale del dimero G()i: E stato osservato che tra il monomero G() stimolatorio e il dimero G() inibitorio vi unaltissima afnit, nonostante la G()s si trovi in forma attiva, cio con il sito di legame occupato dal GTP, dunque la G()s attiva sar inibita con la formazione di un trimero interagendo con la G()i. - Proteina Gq: si trova associata a recettori metabotropi (vasopressina, 5HT, noradrenalina...); in questo caso leffettore non sar lAMC ciclico ma un altro enzima di membrana: la Fosfolipasi C, isoforma . Con la variazione di effettore, cambieranno anche i secondi messaggeri. Nella trasduzione con recettori associati alla Gq sar coinvolto lo ione calcio come molecola segnale. Con linterazione ormone-recettore, il recettore attivato interagisce con la proteina G, qui la G()q stimolata, attiver leffettore Fosfolipasi C , come lAMC ciclico si tratta di un enzima di membrana. Il substrato della Fosfolipasi C , rappresentato da un fosfolipide membranoso, il Fosfatidilinositolo-4,5-difosfato (PIP2). La fosfolipasi C agisce rompendo il legame estereo tra linositolo e il glicerolo, in tal modo si formeranno due secondi messaggeri, linositolotrifosfato (IP3 i gruppi fosfato sono in posizione del carbonio 1,4,5) e il diacilglicerolo che essendo idrofobico rimarr a livello della membrana. Il messaggero, per attivare le chinasi ha bisogno della mediazione dello ione calcio che nel citosol in concentrazione di 10-7 M. Ad aumentare le concentrazioni del Ca2+ provveder linositolotrifosfato che essendo solubile nel citosol potr interagire con una proteina integrale di membrana presente nel reticolo sarcoendoplasmatico. Questa proteina attivata dallinositolotrifosfato si
PG. 14
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
trasformer in un canale per il Ca2+, la forza spingente data dal gradiente di concentrazione provveder a trasportare il calcio nel citosol dove medier la reazione dei secondi messaggeri. Essendo il Ca2+ necessario, esso pu essere considerato come un terzo secondo messaggero e pu agire in due differenti modi: Mediante lattivazione della calmodulina: Ad elevati livelli di calcio nel citoplasma 4 ioni interagiscono con i 4 siti attivi della calmodulina, questa stimola le chinasi calcio, calmodulina-dipendenti che avendo unazione enzimatica concludono la trasduzione. Mediante lattivazione della Proteina chinasi C, isoforma : la proteina chinasi C, isoforma comunemente presente nel citosol ma in forma inattiva; questa proteina entra in funzione in presenza di DAG (diacilglicerolo), ione calcio e fosfatidilserina (presente comunemente nella membrana), condizioni che si verica quando un ormone interagisce con il recettore associato ad una Gq. La Proteina chinasi C, in primo momento lega il calcio e cos potr interagire con il DAG e la fosfatidilserina attivandosi. Trattandosi di una chinasi, questa andr a fosforilare le proteine di membrana: enzimi, recettori, trasportatori o canali; nella struttura proteica, i residui di serina e treonina sono localizzati in posizioni difcili da raggiungere, quindi una volta fosforilati dalla protein kinasi C, non subiranno facilmente lazione delle fosfatasi attive nel citosol. Lazione della Proteina chinasi C isoforma quasi irreversibile. & Esempio: il recettore enzima dellinsulina inattivato quando la cosa carbossilica presenta residui di serina e treonina fosforilati. & Se a livello delle cellule epatiche, muscolari o adipose -dove presente il recettore per linsulina-, si dovesse attivare la proteina % chinasi C, questa proteina potrebbe inibire il recettore causando una resistenza allinsulina (diabete di tipo 2): lormone interagisce & con il recettore inutilmente; il segnale presente ma non vi lopportuna risposta cellulare. & Il recettore con linsulina viene internalizzato e se non sostituito potrebbe vericarsi una situazione di down regulation con la & presenza di pochi recettori. Quando il segnale ormonale cessa, i livelli di calcio devono diminuire nel giro di pochi secondi mediante trasporto attivo primario operato dalle pompe del calcio: SERCA e PMCA. Trasporto attivo secondario: antiporto di Ca2+. La proteina Gq pu essere bloccata -oltre con linibizione del recettore e la G()- con la degradazione del secondo messaggero diacilglicerolo e inositolo 1,4,5-trifosfato. La degradazione avviene ad opera di unenzima che va a tagliare i 3 fosfati (prima in posizione 4, poi in 5 e inne in 1) dellinositolotrifosfato, se la fosfolipasi ancora attiva Il diacilglicerolo trasformato in acido fosfatilico che reagendo con linositolo dar vita ad un nuovo fosfatidilinositolo: il pi semplice fosfolipide membranoso. Vi saranno delle chinasi che fosforilando il carbonio in posizione 4 e 5 riformeranno il PIP2 cosicch la cellula sar di nuovo pronta a rispondere a segnali. Le forme maniaco depressive sono caratterizzate da un aumento di norepinefrina, livelli ridotti di 5-HT e riduzione del numero dei recettori adrenergici. Molti farmaci per la cura di queste malattie sono a base di litio. Questo riduce il rilascio di noradrenalina e la sintesi del secondo messaggero, provvedendo perci ad una up-regulation dei recettori. Tuttavia, il principale meccanismo dazione sembra
PG. 15
COMUNICAZIONE METABOLICA - FISIOLOGIA ! !
De Simone Anna
essere rappresentato dalla capacit che ha il litio di diminuire la formazione del PIP2: il Litio blocca il passaggio dellinositolo monofosfato ad inositolo, in questo modo blocca indirettamente la formazione del PIP2. Anche se i livelli di ormoni sono elevati, non vi sar risposta. Amplicazione del segnale I recettori a livello della membrana (a singolo e a sette lamenti transmembrana), quando trasducono un segnale devono attuare anche un fenomeno di amplicazione: un fenomeno che vede lattivazione di pi effettori a partire da una sola molecola segnale. Nel caso del recettore a singolo lamento leffettore lenzima, la tirosinchinasi che si trova nel recettore. Una molecola di ormone attiva un solo effettore, quindi non si ha amplicazione: il substrato sar moltiplicato ad opera di altri enzimi contenuti nella cellula. Nel caso dei recettori a 7 lamenti, leffettore differente dal recettore: qui lormone non attiva direttamente leffettore, ma questo viene attivato da una molecola intermediaria rappresentata dalla proteina G. Il recettore, mediante la proteina G, pu attivare differenti effettori, quindi si ha lamplicazione: una molecola di ormone pu attivare differenti effettori.
PG. 16
Potrebbero piacerti anche
- Sistema EndocrinoDocumento34 pagineSistema EndocrinoDiego LorussoNessuna valutazione finora
- Messaggeri ChimiciDocumento30 pagineMessaggeri ChimiciMarynaNessuna valutazione finora
- Scienze - Il Sistema NervosoDocumento27 pagineScienze - Il Sistema NervosoRiccardo PengoNessuna valutazione finora
- 9 Ormoni - 2021 2022Documento45 pagine9 Ormoni - 2021 2022Martina MozzaniNessuna valutazione finora
- Fisiologia GeneraleDocumento158 pagineFisiologia GeneraleSusannaNessuna valutazione finora
- La Sindrome del Colon Irritabile: Guida alla fisiopatologia, alimentazione ed integrazioneDa EverandLa Sindrome del Colon Irritabile: Guida alla fisiopatologia, alimentazione ed integrazioneNessuna valutazione finora
- Citometria a flusso:principi generali e applicazione allo studio di alcune malattie ematologicheDa EverandCitometria a flusso:principi generali e applicazione allo studio di alcune malattie ematologicheNessuna valutazione finora
- 120 Domande FisiologiaDocumento6 pagine120 Domande FisiologiagoyshorvalNessuna valutazione finora
- Le Ghiandole IIDocumento20 pagineLe Ghiandole IIEleonora Di MarcoNessuna valutazione finora
- TesiDocumento62 pagineTesiSimonaNessuna valutazione finora
- Lo Stress - Tesi Di BarbaraDocumento46 pagineLo Stress - Tesi Di BarbaraSalvatore BonaffinoNessuna valutazione finora
- Fisiologia Del Muscolo ScheletricoDocumento20 pagineFisiologia Del Muscolo ScheletricoCarlo BritoNessuna valutazione finora
- 30 Anatomia II 02.03.2016 Laringe e MediastinoDocumento7 pagine30 Anatomia II 02.03.2016 Laringe e MediastinoSandroNessuna valutazione finora
- Apparato DigerenteDocumento47 pagineApparato Digerentelullaby02Nessuna valutazione finora
- Cap Mammella X27592allp1Documento10 pagineCap Mammella X27592allp1Raluca BordeianuNessuna valutazione finora
- Biologia Applicata - Biologia Dello SviluppoDocumento59 pagineBiologia Applicata - Biologia Dello Sviluppoapi-3826003100% (4)
- Iperuricemia e Gotta CorrettaDocumento7 pagineIperuricemia e Gotta CorrettaDavideNessuna valutazione finora
- Endocrinologia 2019 - IV D Catania 2019/20Documento209 pagineEndocrinologia 2019 - IV D Catania 2019/20Tre FiNessuna valutazione finora
- 30 - Anatomia II - 26-04-2017 - RDocumento11 pagine30 - Anatomia II - 26-04-2017 - RSandroNessuna valutazione finora
- Il Sistema RespiratorioDocumento12 pagineIl Sistema RespiratorioFabiana FonsinoNessuna valutazione finora
- 26 - Anatomia II - 30-03-2017 (R)Documento10 pagine26 - Anatomia II - 30-03-2017 (R)SandroNessuna valutazione finora
- Sinapsi e NeurotrasmettitoriDocumento45 pagineSinapsi e NeurotrasmettitoriNicola Laurora0% (1)
- L'Asse Ipotalamo - Ipofisario e L'epifisiDocumento12 pagineL'Asse Ipotalamo - Ipofisario e L'epifisiGabriele Di SienaNessuna valutazione finora
- Respirazione Addominale AppuntiDocumento4 pagineRespirazione Addominale AppuntiLaerteNessuna valutazione finora
- UntitledDocumento14 pagineUntitledMartina ZuccariniNessuna valutazione finora
- DIARREEDocumento29 pagineDIARREEapi-3733154Nessuna valutazione finora
- La Circolazione SanguignaDocumento4 pagineLa Circolazione SanguignaManuela MarraNessuna valutazione finora
- La Persona in Psicologia Sociale - Burr PDFDocumento58 pagineLa Persona in Psicologia Sociale - Burr PDFIgnacio VenturiniNessuna valutazione finora
- Risposte Domande Esame Orale Fisiologia.Documento24 pagineRisposte Domande Esame Orale Fisiologia.Paolo Berghella100% (1)
- Patologie Dell'Esofago - Patologia Chirurgica (Università Di Siena)Documento37 paginePatologie Dell'Esofago - Patologia Chirurgica (Università Di Siena)CARLOTTA IADANZANessuna valutazione finora
- Tessuto AdiposoDocumento15 pagineTessuto AdiposoAnna De Simone100% (3)
- Conigli & ConigliDocumento84 pagineConigli & ConigliPierlucaGioiaNessuna valutazione finora
- Protocollo Riabilitativo Anca (DA FARE)Documento6 pagineProtocollo Riabilitativo Anca (DA FARE)Flavia IovinoNessuna valutazione finora
- Lesioni MuscolariDocumento12 pagineLesioni MuscolariFrancoNessuna valutazione finora
- 2015 Ghiandole Endocrine PDFDocumento59 pagine2015 Ghiandole Endocrine PDFLaura RossiNessuna valutazione finora
- Speciale! Accademia Micoterapia.Documento4 pagineSpeciale! Accademia Micoterapia.NADIA MONDINessuna valutazione finora
- Istologia - ConnettivoDocumento46 pagineIstologia - ConnettivoRosario GrassoNessuna valutazione finora
- 5-Stenosi MitralicaDocumento8 pagine5-Stenosi MitralicaScribdNixNessuna valutazione finora
- Lezione II-10 Endocrino 04-04-11Documento91 pagineLezione II-10 Endocrino 04-04-11Roberta RossiNessuna valutazione finora
- La Fisiopatologia Muscolare - DefDocumento28 pagineLa Fisiopatologia Muscolare - Defgiuliacagnina1Nessuna valutazione finora
- Appunti NefrologiaDocumento46 pagineAppunti NefrologiaPasquale CacciatoreNessuna valutazione finora
- 4 Lezione - La Cute e I Suoi AnnessiDocumento24 pagine4 Lezione - La Cute e I Suoi AnnessiAlbert stefan PaulencoNessuna valutazione finora
- Panoramica Sulle Distorsioni e Altre Lesioni Dei Tessuti Molli - Lesioni e Avvelenamento - Manuale MSD, Versione Per I PazientiDocumento13 paginePanoramica Sulle Distorsioni e Altre Lesioni Dei Tessuti Molli - Lesioni e Avvelenamento - Manuale MSD, Versione Per I PazientiBeppe FranchinoNessuna valutazione finora
- Patologie Specifiche Del TennisDocumento1 paginaPatologie Specifiche Del TennisTurrix 1sNessuna valutazione finora
- 4 Anatomia 05-03-14Documento7 pagine4 Anatomia 05-03-14SandroNessuna valutazione finora
- Mappa Concettuale Sull'Apparato RespiratorioDocumento1 paginaMappa Concettuale Sull'Apparato RespiratorioBOLFRA100% (1)
- Aceto Dei 4 LadroniDocumento2 pagineAceto Dei 4 LadroniCris TinaNessuna valutazione finora
- Paratiroidi 2006Documento49 pagineParatiroidi 2006api-3733154100% (1)
- PDF News 239-SciatDocumento23 paginePDF News 239-SciatHati UlfNessuna valutazione finora
- 16 Anatomia 02-04-14Documento8 pagine16 Anatomia 02-04-14SandroNessuna valutazione finora
- Muscolo e LocomozioneDocumento21 pagineMuscolo e Locomozioneapi-3704348100% (1)
- Farmacologia ApplicataDocumento151 pagineFarmacologia ApplicataMukkamilkNessuna valutazione finora
- Sistema Linfatico e ImmunitarioDocumento23 pagineSistema Linfatico e ImmunitarioFedericaNessuna valutazione finora
- Malattie Del Sistema Endocrino e MetabolismoDocumento55 pagineMalattie Del Sistema Endocrino e MetabolismoOr MillerNessuna valutazione finora
- 4b.fisiologia Apparato DigerenteDocumento9 pagine4b.fisiologia Apparato DigerenteFedericoPppzPippoNessuna valutazione finora
- Ricerche Sulle Nuove Applicazioni Delle Piante Officinali in FitocosmesiDocumento4 pagineRicerche Sulle Nuove Applicazioni Delle Piante Officinali in FitocosmesiRenato BruniNessuna valutazione finora
- Zoologia Sistematica 2014-2015Documento47 pagineZoologia Sistematica 2014-2015Federica100% (1)
- Anatomia - Apparato DigerenteDocumento6 pagineAnatomia - Apparato DigerenteMario RossiNessuna valutazione finora
- Curare I Dolori Con La Riflessologia PlantareDocumento16 pagineCurare I Dolori Con La Riflessologia PlantareclekupreNessuna valutazione finora
- Spettroscopia Nir - Applicazioni SpectraalyzerDocumento31 pagineSpettroscopia Nir - Applicazioni SpectraalyzerclaudiaNessuna valutazione finora
- Pompe Di CaloreDocumento11 paginePompe Di CaloreAnna De Simone100% (1)
- Notti Per TeDocumento20 pagineNotti Per TeAnna De SimoneNessuna valutazione finora
- Modulo PassaportoDocumento2 pagineModulo PassaportoAnna De SimoneNessuna valutazione finora
- Vaso Dipinto 2Documento3 pagineVaso Dipinto 2Anna De SimoneNessuna valutazione finora
- Vaso Lanterna 2Documento3 pagineVaso Lanterna 2Anna De SimoneNessuna valutazione finora
- Vaso Lavanda 2Documento3 pagineVaso Lavanda 2Anna De SimoneNessuna valutazione finora
- Come Fare L'henneDocumento50 pagineCome Fare L'henneGiulia Scalzo100% (1)
- Vaso Country 2Documento3 pagineVaso Country 2Anna De SimoneNessuna valutazione finora
- 8 - Vaso LaternaDocumento2 pagine8 - Vaso LaternaAnna De SimoneNessuna valutazione finora
- 10 - Vaso Con Bottiglie RiciclateDocumento2 pagine10 - Vaso Con Bottiglie RiciclateAnna De SimoneNessuna valutazione finora
- 1 - Vaso MarmorizzatoDocumento2 pagine1 - Vaso MarmorizzatoAnna De SimoneNessuna valutazione finora
- 9 - Vaso Con Foglia D'oroDocumento2 pagine9 - Vaso Con Foglia D'oroAnna De SimoneNessuna valutazione finora
- 11 - Vasi Decorati A TemaDocumento2 pagine11 - Vasi Decorati A TemaAnna De SimoneNessuna valutazione finora
- Vaso Sassolini 2Documento3 pagineVaso Sassolini 2Anna De SimoneNessuna valutazione finora
- 7 - Vaso Con Inserti Di VetroDocumento2 pagine7 - Vaso Con Inserti Di VetroAnna De SimoneNessuna valutazione finora
- 6 - Vaso LavandaDocumento2 pagine6 - Vaso LavandaAnna De SimoneNessuna valutazione finora
- Come Rodare Un Motore NuovoDocumento28 pagineCome Rodare Un Motore NuovoAnna De SimoneNessuna valutazione finora
- Gioco Raccolta DifferenziataDocumento2 pagineGioco Raccolta DifferenziataAnna De Simone75% (8)
- 4 - Vaso Con SassoliniDocumento2 pagine4 - Vaso Con SassoliniAnna De SimoneNessuna valutazione finora
- 3 - Vaso DipintoDocumento2 pagine3 - Vaso DipintoAnna De SimoneNessuna valutazione finora
- Decorazione VasiDocumento2 pagineDecorazione VasiAnna De SimoneNessuna valutazione finora
- 1 - Vaso MarmorizzatoDocumento2 pagine1 - Vaso MarmorizzatoAnna De SimoneNessuna valutazione finora
- Insulina e DiabeteDocumento6 pagineInsulina e DiabeteAnna De SimoneNessuna valutazione finora
- 5 - Vaso CountryDocumento2 pagine5 - Vaso CountryAnna De SimoneNessuna valutazione finora
- Vaso Dolce AutunnoDocumento2 pagineVaso Dolce AutunnoAnna De SimoneNessuna valutazione finora
- Costruire Pale Eoliche in LegnoDocumento8 pagineCostruire Pale Eoliche in LegnoAnna De SimoneNessuna valutazione finora
- La Guida Ufficiale Dell'Agenzia Delle EntrateDocumento29 pagineLa Guida Ufficiale Dell'Agenzia Delle EntrateAnna De SimoneNessuna valutazione finora
- (Gardening) Vita in Campagna 2008-11 (26-29) - Come Realizzare Una Piccola Coltivazione Di Asparago Selvatico Partendo Dal SemeDocumento4 pagine(Gardening) Vita in Campagna 2008-11 (26-29) - Come Realizzare Una Piccola Coltivazione Di Asparago Selvatico Partendo Dal SemeFelice SinibaldiNessuna valutazione finora
- Codici Per Rifiuti PericolosiDocumento12 pagineCodici Per Rifiuti PericolosiAnna De SimoneNessuna valutazione finora
- Dati Tecnici PowerTabDocumento12 pagineDati Tecnici PowerTabAnna De SimoneNessuna valutazione finora