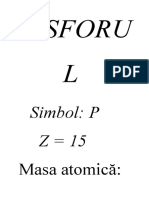Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Fosforul
Caricato da
Roxana AxinteTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Fosforul
Caricato da
Roxana AxinteCopyright:
Formati disponibili
Fosforul
Stare natural Fosforul se gsete in natura numai sub forma de ioni de fosfat, PO4,cea mai stabil combinaie a acestui element. Principalul mineral coninnd fosfor, format la solidificarea scoarei pmntului, este apatita, care poate fi considerat ca o soluie solid de fosfat de calciu, dar este n realitate un compus cristalizat, format din ioni de Ca2+, PO43- i F-, corespunznd formulei brute: Ca5[(PO4)3F].
Prin aciunea lent a agenilor atmosferici (CO2 i H2O) apatita se transform n fosforite. Acestea sunt mult mai rspndite, n concentraii mici, n solul cultivabil al pdurilor i au o mare importan pentru viaa plantelor. Se gsesc n puine locuri pe glob i zcminte mari, exploatabile, de fosforite. Fosforitele (considerate nainte, n mod eronat, ca fosfat tricalcic) sunt n realitate amestecuri neomogene de hidroxil-apatit, Ca5[(PO4)3OH] i carbonat-apatit, Ca10[(PO4)6CO3](H2O). Partea anorganic a oaselor vertebratelor este un amestec de mult hidroxil-apatit cu puin carbonat-apatit. Forme alotropice. Obinere i proprieti fizice. Se cunosc dou forme alotropice extreme ale fosforului: fosforul alb i fosforul negru i, ntre acestea, formele intermediare fosforul violet, fosforul rou i fosforul rou deschis. Forma cea mai srac n energie, deci cea mai stabil, este fosforul negru. ntre diferitele forme alotropice ale fosforului nu exist puncte de transformare reversibil (ca la sulf) ; raportul dintre ele este deci cel al monotropiei.
1.Fosforul alb. Fosforul alb se obine prin calcinarea fosfatului de calciu (apatite sau fosforite) cu crbune. n procedeul industrial se adaug ns dioxid de siliciu (nisip) , al crui rol este de a pune n libertate din ionul de fosfat, pentaoxidul de fosfor mai reactiv. Reacia necesit o temperatur ridicat (peste 2000C) i se efectueaz de aceea n cuptorul electric, cu electrozi de crbune. Vaporii de fosfor formai sunt condui n ap (spre a evita aprinderea lor n contact cu aerul) i se condenseaz astfel, sub form de fosfor alb, P4. Fosforul alb se prezint ca o mas cristalin, transparent, de consistena cerii. El poate fi tiat cu cuitul (sub apa, din cauza pericolului de aprindere). Expus la lumin, fosforul alb se acoper cu o pojghi de fosfor rou, care l face s apar galben; de aici numele de fosfor galben care i se d adesea. Fosforul alb se topete la 44C, formnd un lichid incolor ce arat o deosebit tendin spre suprarcire, putnd fi pstrat mai mult vreme la temperatura camerei fr s se solidifice. Punctul de fierbere este 287oC. Chiar la temperatura camerei formeaz vapori (miros caracteristic de usturoi), iar la 100oC poate fi distilat uor ntr-un curent de vapori de ap, proprietate care se poate folosi i pentru purificarea sa. Fosforul alb se dizolv uor n sulfur de carbon, n triclorur i tribromur de fosfor i n grsimi; este ns insolubil n ap i n alcool. Prin evaporarea soluiei n sulfur de carbon se obin cristale lucioase, transparente, aparinnd sistemului cubic. Acestea sunt compuse din reele de molecule P4, unite printre ele prin fore Van der Waals. Soluiile fosforului alb conin de asemenea molecule P4. Prin metoda difraciei electronilor s-a stabilit c moleculele P4 au forma unor tetraedre regulate, cu cte un atom de fosfor la fiecare col. Fiecare atom de fosfor este legat, prin trei covalene, de ceilali trei atomi ai moleculei. Cele trei valene ale fosforului au deci o aezare piramidal. Distana dintre doi atomi de fosfor (latura tetraedrului) este 2,21 A. Unghiurile dintre valene sunt deci de numai 60.
structura fosforului alb, P4. Este probabil c legturile din molecula P4 iau natere ntre orbitali p ai fosforului, al crui unghi de valen este astfel deformat de la 90o la 60o. Electronii neparticipani ocup deci orbitali s . S-a luat n considerare i o hibridizare pd2, care este mai favorabil geometric (unghi de valen 66,5o), dar mai nefavorabil energetic.
2.Fosforul molecular P2 Peste 800 oC moleculele P4 disociaz n molecule P2. La 1200o disocierea este de cca. 50%. Distana interatomic n P2 este 1,895 A. La condensarea vaporilor de fosfor se obine fosfor alb, P4 (alturi de o form, mai puin bine definit, numit fosfor brun). 3.Fosforul negru Fosforul negru se obine din fosforul alb prin nclzire, la 200oC, sub presiunea de 12 000 atm. Fosforul alb poate fi transformat n fosfor negru i fr aplicarea unei presiuni nalte, sub aciunea catalitic a mercurului. Prin metoda razelor X s-a stabilit c i n razele fosforului negru, fiecare atom de fosfor este legat prin trei covalene de ali trei atomi, ns n aa mod nct rezult straturi duble infinite compuse din cte dou planuri paralele de atomi, care pot fi considerate ca nite macromolecule uriae ntinzndu-se pe tot cristalul. Distanele interatomice sunt 2,28 A. Fosforul negru are proprieti semiconductoare. 4. 4.Fosforul rou Fosforul rou se obine prin nclzirea fosforului alb, n absena aerului la 269-300oC. n industrie operaia aceasta se realizeaz n vase de oel. Transformarea fosforului alb n fosfor rou are loc cu degajare de 3,7 kcal/atom-g. Se confirm astfel stabilitatea mai mare a formelor colorate mai nchis. Fosforul rou se topete, sub presiune, neunitar, pe la 600o; la presiunea atmosferic sublimeaz cam la aceeai temperatur, formnd vapori compui din molecule P4. Prin condensarea acestora se formeaz fosfor alb. Formele alotropice ale fosforului exist deci numai n faza solid. Presiunea de vapori a fosforului rou este incomparabil mai mic dect a fosforului alb, apropiindu-se de zero la temperatura camerei. De aceea fosforul rou nu are miros. Fosforul rou este practic insolubil n toi solvenii (la fel i cel negru). Din cauza aceasta nu se poate determina masa sa molecular. Celelalte modificaii ale fosforului au o structur macromolecular asemntoare cu cea a fosforului negru, dar mai puin regulat, straturile de atomi nu se ntind n mod uniform prin tot cristalul ci numai prin mici poriuni, schimbndu-i adesea direcia. Din cauza aceasta fosforul rou nu are aspect cristalin, numindu-se i fosfor amorf. Starea mai mult sau mai puin condensat a diferitelor forme se constat i din marile deosebiri dintre densitile lor: Fosfor: Densitate: alb 1,82 rou deschis 1,88 rou 2,20 violet 2,32 negru 2,70 Fosforul rou
Dup cum se vede, modificaiile compacte au culoare mai nchis.
5.Fosforul violet Fosforul violet este asemntor cu cel rou, ns este mai unitar. Se obine prin dizolvarea fosforului alb n plumb topit i ndeprtarea acestuia dup rcire prin dizolvare n acid azotic sau prin electroliz. Se obin astfel cristale hexagonale, cu forma unor foie. Fosforul rou deschis se depune dintr-o soluie de fosfor alb n sulfur de carbon, cnd aceasta este expus la lumin (cea mai activ fiind lumina violet). Produsul astfel obinut nglobeaz mult solvent. Proprieti chimice A. Arderea vie a fosforului. Formele alotropice ale fosforului se deosebesc mult de activitatea lor chimic. Caracteristic este comportarea fa de oxigenul molecular, respectiv de aer: fosforul alb n buci compacte se aprinde in aer pe la 60; punctul de aprindere al fosforului rou industrial este de cca. 260, iar al fosforului violet 430-440, n timp ce fosforul negru nu se aprinde n aer. Dup cum se vede, fosforul alb este una dintre substanele cele mai inflamabile cunoscute ( din care cauz trebuie conservat sub ap), n timp ce formele cele mai condensate sunt inerte fa de oxigen. Dac ntr-o eprubet larg se acoper puin fosfor alb cu ap cald i se trimite printr-un tub de sticl un curent de oxigen n fosforul topit, acesta arde sub ap. n arderea vie a fosforului se formeaz pentoxid de fosfor: P4 + 5O2 P4 O10 La arderea fosforului n aer ia natere un fum alb abundent, datorit combinrii pentoxidului de fosfor cu vaporii de ap din atmosfer i formrii de acid metafosforic, nevolatil. B. Arderea lent a fosforului. Spre deosebire de celelalte forme alotropice, care sunt stabile fa de oxigenul molecular la temperaturi mai joase dect punctul lor de aprindere, fosforul alb are proprietatea de a se oxida ncet la temperatura joas (autooxidare). Totodat el emite o lumin slab vizibil la ntuneric (chimio-luminescen). De aici se trage numele acestui element: pherein = a purta. Se observ chimio-luminescen la oxidarea anumitor substane organice. Unei asemenea oxidri, catalizate de o enzim, i se datoreaz lumina emis de licurici i de alte animale. Experiment: Dac ntr-un vas de sticl se introduc cteva bastoane de fosfor alb, nmuiate numai parial n ap spre a evita o aprindere, se observ, la ntuneric, c luminescena se datoreaz de fapt vaporilor de fosfor care nconjoar bastoanele ca un vl i se desprind de pe suprafaa lor, sub forma unor mici vrtejuri, cnd se sufl aer n vas. phos = lumin;
Scriind cu o bucat de fosfor ( inut cu un clete sau cu o crp ud, nu cu mna liber!) cteva litere pe un perete, acestea apar luminoasele la ntuneric, n special cnd se trece uor peste ele cu o crp uscat, care ndeprteaz oxizii formai. Un curent de dioxid de carbon saturat cu vapori de fosfor, prin trecere peste fosfor nclzit la 100, se prinde n contact cu aerul, arznd cu o flacr verde. Flacra este rece, se poate ine mna n ea. Prin oxidarea lent a fosforului se formeaz nti trioxid de fosfor, P4O6, care apoi trece n pentoxid de fosfor, P4O10. n aceast a doua parte a reaciei este emis lumina. Oxidarea lent a fosforului este nsoit de o formare de ozon, i anume pentru fiecare atom de fosfor care se oxideaz, apar 0,6 moli de ozon. Formarea ozonului se datoreaz apariiei de atomi liberi de oxigen. Acetia i ozonul format produc unele reacii chimice neateptate, care nsoesc oxidarea fosforului. Experiment. Dac ntr-un balon mare se introduc cteva grame de fosfor alb i puin ap i se nclzete pn la topirea fosforului, agitnd, se simte mirosul caracteristic de ozon. Dac se adaug o soluie de indigo (acid indigo-sulfonic) aceasta se decoloreaz imediat. Arderea lent este o reacie nlnuit. Luminescena fosforului nceteaz complet cnd se nlocuiete aerul prin oxigen curat (Fourcroy 1788), dar ea reapare dac se micoreaz presiunea oxigenului. Luminescena i oxidarea nceteaz i n aer atunci cnd se mrete presiunea, adic atunci cnd presiunea parial a oxigenului depete o anumit limit ( cca. 700 torr). Fenomenele acestea, care contrazic legea maselor, constituie cele mai vechi observaii privitoare la limita superioar de presiune a unei explozii. Ele au fost nelese cnd s-a recunoscut c oxidarea lent a fosforului este o reacie nlnuit (Semionov 1927). Ca n multe reacii nlnuite, nu se cunosc toi atomii i radicalii liberi care apar ca produi intermediari n reaciile lanului, este ns probabil ca printre acetia s se afle i atomi liberi de oxigen, care dau natere, secundar, ozonului observat. C. Combinri directe cu alte elemente. Fosforul alb se combin violent cu halogenii, aprinzndu-se, de exemplu, spontan ntr-o atmosfer de clor. Fosforul rou reacioneaz mai puin energic. De asemenea fosforul se combin cu sulful i cu multe metale. Fosforul are proprieti reductoare. El precipit unele metale cum sunt: aurul, argintul, plumbul i cuprul din soluiile srurilor lor. Cu cuprul se combin formnd fosfura de cupru. D. Fosforul alb este foarte toxic. El are o afinitate foarte mare pentru oxigen i determin dispariia acestuia din snge. Doza mortal pentru omul adult este de aproximativ 0,1 grame. Celelalte forme alotropice ale fosforului nu produc, din cauza insolubilitii, nici un efect asupra organismului. Ca antidot n otrvirea cu fosfor se folosete CuSO4, cu care fosforul
formeaz un compus netoxic (fosfura de cupru). E. ntrebuinri. Fosforul se utilizeaz la fabricarea chibriturilor, a cror introducere, ctre mijlocul secolului trecut, a reprezentat un mare progres fa de metodele mai vechi de aprins focul. Primele chibrituri conineau n gmlia lor fosfor alb i se aprindeau prin frecare pe orice suprafa aspr. Acestea au fost prsite din cauza toxicitii lor i nlocuite cu aa- numitele chibrituri suedeze. Gmlia acestora, coninnd clorat de potasiu i sulfur de antimoniu, uor inflamabile, se aprinde numai prin frecare pe o past coninnd fosfor rou. Pentru asigurarea creterii i dezvoltrii plantelor n bune condiii, acestea au nevoie de anumite elemente nutritive, dintre care cele mai importante sunt: fosforul, azotul i potasiul. Fosforul are un rol foarte important n procesul de cretere a plantelor, influennd favorabil procesul de fructificare a cerealelor, legumelor, pomilor fructiferi, viei- de -vie, precum i depunerea zaharurilor n fructe, sfecl i cartofi. mpreun cu potasiul i calciul fosforul mrete rezistena plantelor la boli i intemperii, grbete coacerea fructelor. n cazul unei cantiti insuficiente de fosfor, plantele se opresc din cretere, frunzele rmn mici i se rsucesc, iar seminele nu se mai formeaz. n fiecare an, odat cu recoltele de legume cereale i fructe, se scot din sol cantiti nsemnate de azot, fosfor i potasiu. Aceste cantiti le depesc pe cele care revin n sol pe cale natural. Bilanul nefavorabil impune deci utilizarea ngrmintelor chimice. ngrmintele chimice pe baz de fosfor sunt minerale simple i compuse. ngrminte minerale simple: superfosfatul simplu i concentrat (pulbere roiatic), fina lui Thomas (pulbere cenuie); i minerale compuse: fosfaii acizi de potasiu KH2PO4 i K2HPO4, fosfaii acizi de amoniu NH4H2PO4 i (NH4)2HPO4. Biochimia fosforului Fosforul alb, hidrogenul fosforat i compuii incomplet oxidai sunt otrvuri puternice pentru organismul animal. Dimpotriv acidul fosforic sub forma ionilor si sau a derivailor organici (esteri), nu este numai netoxic, dar este indispensabil vieii, fiind o component nelipsit a oricrei celule vii, vegetale i animale. n organismul animal se gsesc att derivai anorganici ct i organici ai acidului fosforic. Printre cei dinti se menioneaz, n primul rnd fosfaii din oase i dini, intim nglobai ntr-o substan organic (colagen n snge). Sngele conine un sistem tampon, compus din fosfat monosodic i disodic, care alturi de bicarbonai contribuie la meninerea unei concentraii constante a ionilor de hidrogen (pH). Prin urin se elimin necontenit fosfai care se pot depune, atunci cnd reacia este bazic, sub form de fosfat de calciu sau de fosfat dublu de magneziu i amoniu, ambii insolubili. Fosfaii de calciu se mai gsesc n scoici i n
carapacele crustaceelor. Legat organic, acidul fosforic apare n numeroase substane, din corpul animalelor i din plante i anume tocmai n acelea care, prin transformrile lor biologice intense, sunt hotrtoare pentru nsui fenomenul vieii. Menionez aici numai fosfatidele (derivai ai grsimilor), fosfoproteidele (printre care cazeina din lapte i vitelina din glbenuul de ou sunt cele mai importante), acizii nucleici (componente ale nucleelor celulare i suportul material al caracterelor ereditare), unele enzime, derivnd de la vitaminele B1 i B2 i unele substane jucnd un rol important n oxidrile din celule, n fermentaia alcoolic, n contracia muscular. Joac un rol important n mecanismul vitaminei D i controleaz echilibrul calcic al mediului intern. Particip la formarea osoas i sanguin i joac un rol important la reglementarea funciilor paratiroidiene. Este un element capital al energiei nervoase, intelectuale i sexuale. Fosforul se gsete n numeroase vegetale: cereale, germeni de gru, usturoi, elin, morcov, ceap, praz, roii, migdale, nuc, struguri i, de asemenea, n polen. Indicaiile lui sunt multiple: astenie fizic i intelectual, oboseal muscular (ncordri de muchi, crampe), demineralizare, afeciuni osoase, tuberculoz, anumite sindroame nervoase, tulburri paratiroidiene, spasmofilie, anumite astmuri, deficien cardiac. Nevoile zilnice ar fi de circa 800 mg.
Ursule Claudia Otilia clasa a X-a C Bibliografie: Adenosine triphosphate- Microsoft Encarta Manual de biologie pentru facultate
Potrebbero piacerti anche
- FosforulDocumento2 pagineFosforulNicholas Owens67% (3)
- Fosforul PDocumento12 pagineFosforul Pnicucazacu0% (1)
- Pile ElectrochimiceDocumento3 paginePile ElectrochimiceChirtibus SasaNessuna valutazione finora
- Importanța Fosforului În OrganismDocumento13 pagineImportanța Fosforului În OrganismCiprian CristuțiuNessuna valutazione finora
- Derivati Al Metabolismului Aminoacizilor: Curs 1 FarmacognozieDocumento397 pagineDerivati Al Metabolismului Aminoacizilor: Curs 1 FarmacognozieAlexandre NicoletteNessuna valutazione finora
- Chimie Analitic A Partea A DouaDocumento9 pagineChimie Analitic A Partea A DouaGrigoras Laura IoanaNessuna valutazione finora
- Chimie 7 8Documento2 pagineChimie 7 8Anonymous RkzuPewvydNessuna valutazione finora
- CocainaDocumento3 pagineCocainaBanzea Andreea IoanaNessuna valutazione finora
- Determinarea Căldurii Integrale de DizolvareDocumento12 pagineDeterminarea Căldurii Integrale de DizolvareElena KuhaskNessuna valutazione finora
- Peroxidul de HidrogenDocumento9 paginePeroxidul de HidrogenCosmina DudasNessuna valutazione finora
- Fotosinteza La PlanteDocumento4 pagineFotosinteza La PlanteSilviu-Anton Lupu100% (3)
- Spectrometria Atomică Şi Fluorescenţa AtomicăDocumento22 pagineSpectrometria Atomică Şi Fluorescenţa AtomicăIrina MelenciucNessuna valutazione finora
- (CaCl) Clorura de Calciu-ReferatDocumento1 pagina(CaCl) Clorura de Calciu-ReferatCalin GruiaNessuna valutazione finora
- Catabolismul GlucidelorDocumento2 pagineCatabolismul Glucideloririna_gimpireaNessuna valutazione finora
- Reactii Cu Formare de Combinatii ComplexeDocumento6 pagineReactii Cu Formare de Combinatii ComplexeIulianNessuna valutazione finora
- MercurDocumento12 pagineMercurIbanescu StefanNessuna valutazione finora
- Proiect ChimieDocumento8 pagineProiect ChimieV VasileNessuna valutazione finora
- Solutii - Suport TeoreticDocumento4 pagineSolutii - Suport TeoreticEmilia CiocanNessuna valutazione finora
- BromulDocumento5 pagineBromulIulik BrumaNessuna valutazione finora
- 06 Nucleul InterfazicDocumento48 pagine06 Nucleul InterfazicANCA OANCEANessuna valutazione finora
- Determinarea Punctului de Topire Al Substanțelor Amorfe - Supozitoare - PrezentareDocumento7 pagineDeterminarea Punctului de Topire Al Substanțelor Amorfe - Supozitoare - PrezentareGeaninaOanca100% (1)
- Acizi FenoliDocumento21 pagineAcizi FenoliIulia DarabusNessuna valutazione finora
- Modele AtomiceDocumento12 pagineModele AtomiceCecoi ElenaNessuna valutazione finora
- Anionii, Chimie AnorganicaDocumento26 pagineAnionii, Chimie AnorganicaAndraBuzNessuna valutazione finora
- Comp HalogenatiDocumento42 pagineComp HalogenatiIoana CrînganuNessuna valutazione finora
- Teste Chimie FizicaDocumento31 pagineTeste Chimie FizicaIvanescu PetrutaNessuna valutazione finora
- Utilizarea AlchenelorDocumento4 pagineUtilizarea AlchenelorMirela MangirNessuna valutazione finora
- REZULTATE - Edeleanu Municipiu (1) - CopieDocumento20 pagineREZULTATE - Edeleanu Municipiu (1) - CopieandreivladNessuna valutazione finora
- SulfanilamideDocumento15 pagineSulfanilamidejalbucristinaNessuna valutazione finora
- NaftalinaDocumento9 pagineNaftalinaRoxana Pg0% (2)
- CAPITOLUL 2-Structura SubstantelorDocumento51 pagineCAPITOLUL 2-Structura SubstantelorMatei SilviuNessuna valutazione finora
- ALCHENEDocumento8 pagineALCHENEAndrei SirbuNessuna valutazione finora
- Curs Membrane StructuraDocumento10 pagineCurs Membrane StructuraTeoFefe100% (1)
- AspirinaDocumento15 pagineAspirinaAnia Ania100% (1)
- IDENTIFICAREA IONULUI Fe3+Documento14 pagineIDENTIFICAREA IONULUI Fe3+RobertLărgeanuNessuna valutazione finora
- Indicatori PH 2Documento12 pagineIndicatori PH 2anon_9626641Nessuna valutazione finora
- LP10 2016Documento15 pagineLP10 2016Daniela SoareNessuna valutazione finora
- Analiza Structurala Anorganica-C1Documento51 pagineAnaliza Structurala Anorganica-C1Micu LucicaNessuna valutazione finora
- HalogeniiDocumento7 pagineHalogeniiAndrada Roxana LucaNessuna valutazione finora
- Plan de Citire Candela 2024Documento6 paginePlan de Citire Candela 2024Rahela NegruNessuna valutazione finora
- IMPORTANTA Ph-Ului ȘI A SOLUTIILOR TAMPONDocumento7 pagineIMPORTANTA Ph-Ului ȘI A SOLUTIILOR TAMPONCarmen BojoagaNessuna valutazione finora
- Regnul MoneraDocumento13 pagineRegnul MoneraBklDragosMklNessuna valutazione finora
- Clorul Si Compusii LuiDocumento14 pagineClorul Si Compusii LuiCristian MihaiNessuna valutazione finora
- Ferocianura de PotasiuDocumento3 pagineFerocianura de Potasiuporumb ionNessuna valutazione finora
- Proiect Chimie Apa RegalaDocumento3 pagineProiect Chimie Apa RegalaRadutu RebejaNessuna valutazione finora
- AnilinaDocumento4 pagineAnilinaCosmin BraisNessuna valutazione finora
- C6 IndicatoriDocumento15 pagineC6 IndicatoriTudor FloreaNessuna valutazione finora
- CupruDocumento2 pagineCupruvbadina100% (1)
- FosforulDocumento6 pagineFosforultobi92100% (3)
- Oxizii Şi Oxiacizii FosforuluiDocumento6 pagineOxizii Şi Oxiacizii FosforuluiIoanaToader100% (1)
- Fosforul FinalDocumento4 pagineFosforul Finalpetreionutz87Nessuna valutazione finora
- FosfOr (76543464567)Documento9 pagineFosfOr (76543464567)Dumitru BuzduganNessuna valutazione finora
- Acidul FosforicDocumento9 pagineAcidul Fosforicdiana fenichiuNessuna valutazione finora
- FOSFORULDocumento6 pagineFOSFORULvioletabadanNessuna valutazione finora
- Pentaoxid de FosforDocumento7 paginePentaoxid de FosforAna-Maria TurcuNessuna valutazione finora
- FosforDocumento15 pagineFosforAlexandra CismasNessuna valutazione finora
- Fosforul PDocumento19 pagineFosforul PEne Violeta Alina100% (1)
- Chimie Grupa 5Documento11 pagineChimie Grupa 5just meNessuna valutazione finora
- FluorulDocumento5 pagineFluorulSorina M. TeiusanuNessuna valutazione finora
- Ozonul ReferatDocumento5 pagineOzonul ReferatMariiaa Mariaa100% (1)