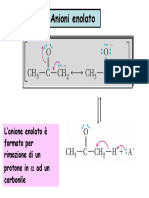
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Appunti Di Chimica Organica II
Caricato da
Federica MoroCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Appunti Di Chimica Organica II
Caricato da
Federica MoroCopyright:
Formati disponibili
CORSO DI CHIMICA ORGANICA II
APPUNTI DELLE LEZIONI
PROF. LESMA GIORDANO VENEGONI FABIO Ossidazione di catene laterali:
CH3
OH
OH
MnO2
Cr2 O6
H3C
Idrogenolisi Benzilica:
H3C
OH
H3C
Pd/C H2
Ove X = qualsiasi eteroatomo, ovvero O, N, Alg, S Sintesi delle Ammine:
NO 2
Cat
NH2
Ove Cat = H2 /Ni, Fe/HCl, SnCl2 , NaSH/EtOH.
NH 2OH
N OH
LiAlH4
NH2
Degradazione di Hoffman:
O R NH2
Cl2 OH R
R N O
H2 O
R NH
- CO2
H2N
OH
Degradazione di Curtius:
O R Cl
NaN3
O R N3
- N2
O R N
(Vedi Hoffman)
Degradazione di Schmidt:
O R OH
HN3
O R N3
(Vedi Curtius)
Reazioni di Alogenometilazione:
CCl4 AlCl3
CCl 3
+ HCl
H2 O
OH
+ 3 HCl
Sintesi di N Ossidi (da ammine terziarie) e Idrossilammine (da ammine secondarie):
H3C
CH3
H3C
H 2O 2 o RCOOOH
CH3
H3C
NH
H3C
OH N
H 2O 2 o RCOOOH
Riarrangiamento di Cope:
O N
CH3
CH2
+
H3C N HO CH3
CH3
Riarrangiamento di Polonovsky:
H N
CH3
(CF3 CO)2 O
H O N
+
CF 3 CH3
- CF3COOH
CH3
CH3
CH3
CH3
In seguito possibile ridurre il prodotto ad ammina. I cromofori sono sostanze in grado di assorbire nel visibile.
N
OH
Base
N OH
SO 3H
H3C
CH3
CH3 N CH3
+
+
N N
Metilarancio
N N
O3 S
Benzino:
NH2
Diaz.
N2
COOH
COO
-N2 - CO2
Il Benzino altamente instabile e, in assenza di altro, reagisce con se stesso a dare il Bifenilene:
Litiocuprati:
Li
CuBr 0 C
CuLi 2
Sintesi di Heck:
O2
Br
O H 2C OMe
O OMe
Pd(AcO) 2 Ph3P
Si viene a generare un nuovo legame C C tra il carbonio che regge lalogeno e il carbonio in al gruppo carbossilico. Nomenclatura tradizionale di Fenoli di uso comune:
OH
OH
OH OCH 3
COOH OH
OH CH3
OH
OH
OH
Resorcinolo Idrochinone Guajacolo Acido Salicilico o Cresolo
CH3
p Cresolo
Nelle reazioni degli Eteri Fenolici, lattacco procede maggiormente in para al gruppo etereo, a causa di una minore tensione sterica. Sintesi di composti policiclici:
OH
OH
O
OH
Zn(Hg)
BF3 HF
HO
AlCl3
HOOC O
HCl
HOOC
Lutilizzo di BF3 in miscela con HF come Acido di Lewis da preferirsi, in quanto risulta maggiormente compatibile con gli Acidi Carbossilici. Al termine della reazione possibile introdurre due doppi legami (riduzione ad alcol e riduzione successiva con Pd(C) e calore) oppure portare avanti reazioni proprie del carbonile.
O CH2
CH2
Chinometile o Chinometile
Reazione di Idrossimetilazione (produzione della Bachelite, polimero costituito da Formaldeide e Fenolo):
OH
H2 C=O
CH2O
OH
CH2
In presenza di ulteriore Formaldeide, la reazione prosegue con un nuovo attacco, dando vita ad una reazione di polimerizzazione. Tutti i composti chinonici sono vivacemente colorati.
OH OH
OH
O COOH
O
Alizarina (color rosso) I Chinoni sono ottenuti per ossidazione dei difenoli:
O
Juglone
OH
O
Reina
OH
OH
Ox
OH
Dove Ox = K2 Cr2 O7 , MnO2 , N2 O2 , ecc O OH
Cl2
Cl
Cl
HCl conc. HNO 3 Cl 80 C
Cl O Cloranile
I Chinoni, insieme ai corrispondenti difenoli, formano un sistema redox, in grado di trasportare elettroni. Meccanismo concertato: formazione e rottura di legami in maniera sincrona. Le reazioni pericicliche si dividono in: - Reazioni elettrocicliche: si ha lo shift di legami di tipo p, con la formazione di un nuovo legame s .
CH2 CH2
- Cicloaddizione: attacco da parte di un dienofilo ad un doppio legame, con shift di legami p e formazione di nuovi legami s .
H2C
CH2
H2C
CH2
Il dienofilo pu attaccare anche un chinone. La previsione della stereochimica avviene mediante la teoria degli orbitali molecolari. Semplificando, i due sostituenti (sullene e sul dienofilo) tendono a stare il pi vicino possibile. Laddizione pu avvenire con approccio eso (prodotto termodinamico) oppure endo (prodotto cinetico). Scaldando si forma principalmente prodotto eso (pi stabile).
HOC
+
CH2
COH H Approccio eso
H COH Approccio endo
H COH H2C
HOC H H 2C
Potrebbero piacerti anche
- Nomenclatura Chimica: Schema RiassuntivoDocumento1 paginaNomenclatura Chimica: Schema RiassuntivoAlessandro ColleoniNessuna valutazione finora
- Reazioni Di Chimica OrganicaDocumento4 pagineReazioni Di Chimica OrganicamarcellozampollaNessuna valutazione finora
- Domande Esame Biologia MolecolareDocumento2 pagineDomande Esame Biologia MolecolareMassimilianoMalerba0% (1)
- 02 Nomenclatura Con Le SoluzioniDocumento74 pagine02 Nomenclatura Con Le SoluzioniAnna Pavluk0% (1)
- Chimica Organica - Principali ReazioniDocumento7 pagineChimica Organica - Principali ReazioniStefanoNessuna valutazione finora
- Chimica OrganicaDocumento50 pagineChimica Organicamarco50% (2)
- Riassunto SaggiDocumento5 pagineRiassunto SaggiDeaMusicaNessuna valutazione finora
- Esercizi Chimica OrganicaDocumento108 pagineEsercizi Chimica OrganicaminchiazzurraNessuna valutazione finora
- Tabella Proprietà Composti OrganiciDocumento8 pagineTabella Proprietà Composti OrganiciLovelyJadeNessuna valutazione finora
- Benzene (Reazioni) - Chimica OrganicaDocumento18 pagineBenzene (Reazioni) - Chimica OrganicaGiorgio MattaNessuna valutazione finora
- Chimica Organica EserciziDocumento4 pagineChimica Organica EserciziAniello LangellaNessuna valutazione finora
- 29911-Esercizi Di Chimica OrganicaDocumento2 pagine29911-Esercizi Di Chimica Organicachicli133% (3)
- Reazione Di Maillard 1Documento15 pagineReazione Di Maillard 1lorellaNessuna valutazione finora
- Dispensa Acidi e BasiDocumento15 pagineDispensa Acidi e Basiluca9ceccottiNessuna valutazione finora
- Atkins Risposte EserciziDocumento46 pagineAtkins Risposte EserciziMimi MartineseNessuna valutazione finora
- Esercizi Di Chimica - 0Documento3 pagineEsercizi Di Chimica - 0Luca Corallo100% (1)
- Schemi BiochimicaDocumento52 pagineSchemi BiochimicachefeelingbroNessuna valutazione finora
- Chimica OrganicaDocumento22 pagineChimica OrganicaAlessandra MartinelliNessuna valutazione finora
- Svolti 3Documento91 pagineSvolti 3DeejayLupinNessuna valutazione finora
- 01 - Chimica e Propedeutica BiochimicaDocumento4 pagine01 - Chimica e Propedeutica BiochimicaAnnamariaBrattoliNessuna valutazione finora
- Chimica Organica BreveDocumento32 pagineChimica Organica Brevecho100% (1)
- Sistemi TamponeDocumento53 pagineSistemi TamponeYann89Nessuna valutazione finora
- Lab Chimica OrganicaDocumento73 pagineLab Chimica OrganicaNanduccNessuna valutazione finora
- SpettrosDocumento34 pagineSpettrosfuliggineNessuna valutazione finora
- Chimica - Redox e BiochimicaDocumento12 pagineChimica - Redox e BiochimicaPaolo D'AlessandroNessuna valutazione finora
- Appunti Di Chimica GeneraleDocumento34 pagineAppunti Di Chimica GeneraleDarla Romero100% (1)
- Appunti Di Chimica OrganicaDocumento167 pagineAppunti Di Chimica OrganicaMaria Giulia CementiNessuna valutazione finora
- 4) COMPOSTI INORGANICI EserciziDocumento4 pagine4) COMPOSTI INORGANICI Esercizicorrado corradiNessuna valutazione finora
- Svolti 2Documento64 pagineSvolti 2DeejayLupinNessuna valutazione finora
- Esercizi Di Chimica OrganicaDocumento16 pagineEsercizi Di Chimica OrganicaMoony Clipped Wings100% (1)
- Appunti Chimica AnaliticaDocumento3 pagineAppunti Chimica AnaliticafabiothekingjamesNessuna valutazione finora
- Bilanciamento ReazioniDocumento3 pagineBilanciamento ReazioniAlessandro Luigi AmadoriNessuna valutazione finora
- Spettrofotometria Uv VisibileDocumento9 pagineSpettrofotometria Uv VisibileDomenico Paralelo100% (1)
- Chimica OrganicaDocumento6 pagineChimica OrganicaSaraNessuna valutazione finora
- Lezione1 Stechiometria Nomenclatura ChimicaDocumento21 pagineLezione1 Stechiometria Nomenclatura ChimicaLeo Bursese100% (1)
- Acido BaseDocumento44 pagineAcido Basedoinita7Nessuna valutazione finora
- Eserciziario - Compito 2a ParteDocumento2 pagineEserciziario - Compito 2a ParteVincenzoABrunoNessuna valutazione finora
- Chimica OrganicaDocumento41 pagineChimica OrganicaSimone CiucciNessuna valutazione finora
- Reazioni RedoxDocumento10 pagineReazioni RedoxStefano GuiducciNessuna valutazione finora
- Esercizi RedoxDocumento2 pagineEsercizi RedoxevaNessuna valutazione finora
- Esercizi Di Chimica GeneraleDocumento24 pagineEsercizi Di Chimica GeneraleFrancesco CeramiNessuna valutazione finora
- Esercizi Di ChimicaDocumento31 pagineEsercizi Di ChimicaAlessandro Ingrosso100% (2)
- Chimica OrganicaDocumento32 pagineChimica OrganicaVito PaladiniNessuna valutazione finora
- Esercizi ChimicaDocumento7 pagineEsercizi ChimicagattullomNessuna valutazione finora
- Esercizi Di Esame ChimicaDocumento17 pagineEsercizi Di Esame ChimicaMarco Raneo PezzanoNessuna valutazione finora
- Acidi e BasiDocumento29 pagineAcidi e BasicicciobellosNessuna valutazione finora
- Lezioni Di Chimica AnaliticaDocumento37 pagineLezioni Di Chimica AnaliticaThomas CrudiNessuna valutazione finora
- Esercizi RisoltiDocumento7 pagineEsercizi RisoltiCronos100% (1)
- 1 Elementi Chimica OrganicaDocumento68 pagine1 Elementi Chimica OrganicaMarynaNessuna valutazione finora
- Riassunto Di ChimicaDocumento67 pagineRiassunto Di ChimicaMarioNessuna valutazione finora
- Fondamenti Di Chimica OrganicaDocumento36 pagineFondamenti Di Chimica OrganicaDamianoScrasciaNessuna valutazione finora
- Esercizi KpsDocumento5 pagineEsercizi KpsMaurizio SessaNessuna valutazione finora
- Esercizi Di Chimica Organica PDFDocumento59 pagineEsercizi Di Chimica Organica PDFBiagio CastronovoNessuna valutazione finora
- Tanti Esercizi Di ElettrochimicaDocumento2 pagineTanti Esercizi Di Elettrochimicamarcocorrao100% (1)
- Nomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaDa EverandNomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaNessuna valutazione finora
- ChemicalsDocumento31 pagineChemicalsLinkSkyword94Nessuna valutazione finora
- 8 - Competizione Tra E e SNDocumento40 pagine8 - Competizione Tra E e SNDouglas MaloneNessuna valutazione finora
- Ioni EnolatoDocumento15 pagineIoni EnolatoWolframio74Nessuna valutazione finora
- 1.presentazione ORDINE TP - GDRDocumento73 pagine1.presentazione ORDINE TP - GDRjavier contrerasNessuna valutazione finora
- Esercizi - I ParteDocumento27 pagineEsercizi - I Parteapi-3706692100% (5)
- Saponificazione EtAcDocumento5 pagineSaponificazione EtAcFabioNessuna valutazione finora
- Piano Studi Ottica e Optometria Federico 2Documento25 paginePiano Studi Ottica e Optometria Federico 2Andrea AnnunziataNessuna valutazione finora
- Dispensa Di Idraulica - QuerzoliDocumento97 pagineDispensa Di Idraulica - QuerzoliMarcello CoppolaNessuna valutazione finora
- Valitutti ChimicaNatura 5907 Calore Specifico PDFDocumento2 pagineValitutti ChimicaNatura 5907 Calore Specifico PDFGabriele1883Nessuna valutazione finora