Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Equilibrio Quimico 2
Caricato da
Elita Urrutia CarrilloTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Equilibrio Quimico 2
Caricato da
Elita Urrutia CarrilloCopyright:
Formati disponibili
21/06/2010
EQUILIBRIO QUMICO
Cuando se produce una reaccin, se generan dos procesos, uno en la direccin en que est escrita la reaccin y otro en el sentido inverso. El equilibrio se establece cuando ambos procesos ocurren a velocidades iguales. En este punto las concentraciones de los reactantes y productos son constantes y corresponden a las concentraciones en el punto de equilibrio
EQUILIBRIO QUMICO
EQUILIBRIO QUMICO
kf [A] = kr[B] En general:
EQUILIBRIO QUMICO
B k A k
aA bB cC dD
K
V1 = k1[A]a [B]b
c
V2 = = k2[C]c [D]d k1[A]a [B]b = k2[C]c [D]d , en el equilibrio las dos velocidades son iguales, luego:
Kc corresponde a la constante de equilibrio de la reaccin La reaccin se puede escribir:
A B
K
c
k C D A B k
c 2 a 1
Caractersticas del estado de equilibrio
Dinmico Un
sistema se mueve de manera espontnea hacia un estado de equilibrio
Equilibrio qumico
Proceso a T cte. (445 [C])
H2 + I2 2HI
0 1,58
(g)
(g)
(g)
1,00 0,212
1,00 0,212
Qi = 0 Q eq =55,3
H2
(g)
+ I2
(g)
2HI
(g)
Su naturaleza y propiedades no dependen
de cmo se haya alcanzado
0,100 0,127
0,100 0,127
1,00 0,945
Q i = 100 Q eq = 55,4
21/06/2010
Equilibrio qumico
Proceso a T cte. (445 [C])
H 2 (g) + I 2 (g)
0,700 0,410 0,400 0,110
Constante de equilibrio, K
Para una reaccin reversible, en que todas las sustancias (A, B, C y D) son gaseosas o estn disueltas en solucin acuosa
aA + b B cC + dD
2HI
(g)
1,00 1,58
Q i = 3,6 Q eq = 55,4
H2
(g)
+ I2
(g)
2HI
(g)
Q = cuociente de reaccin
Q i = 0,33 Q eq = 55,2
0,300 0,0117
1,00 0,712
0,100 0,678
Cc Dd A a Bb
K = constante de Equilibrio Qeq =
Cc Dd eq eq A a Bb eq eq
EQUILIBRIO QUMICO
Ejemplo: N2 + 3H2 2NH3 proceso de Haber
Kc EXPRESADA EN FUNCIN DE LAS PRESIONES PARCIALES
Si Kp es la cte de equilibrio en funcin de las presiones parciales, se tiene para el proceso de Haber:
N2O4(g) 2NO2
Usando la ecuacin para gases ideales:
C = n/V , P =CRT
Reemplazando las presiones parciales en Kp, se tiene
Kc EXPRESADA EN FUNCIN DE LAS PRESIONES PARCIALES
Para el proceso Haber
PREDICCIN DEL DESPLAZAMIENTO DEL EQUILIBRIO
Para seguir el progreso de una reaccin reversible en bsqueda del equilibrio, se define un parmetro el cuociente de reaccin Qt , el cual tiene la misma expresin algebraica de la constante de equilibrio . El cuociente Qt es la razn de las concentraciones molares de los productos respecto a las concentraciones molares de los reactantes en cualquier tiempo t, que tambin se puede expresar como Qi. Cuando se llega al equilibrio Qt se transforma en Qe = K Si Qi < Kc la reaccin neta se desplaza hacia la derecha Si Qi > Kc la reaccin se desplaza hacia la izquierda Si Qi = Kc la reaccin llega al equilibrio
11 12
Se tiene la relacin entre Kp y Kc
Kp = Kc(RT)-2 En general: Kp = Kc(RT)n
n = diferencia de coeficientes estequiomtricos entre productos gaseosos y reactivos gaseosos. Para el proceso Haber 2-4 = -2
21/06/2010
CLCULO DE Kc
Ejemplo:
Para el clculo de la constante de equilibrio se debe conocer las concentraciones en el equilibrio. Si no se conoce alguna de las concentraciones , sta se puede conocer aplicando la estequiometra de la reaccin para ese fin Pasos para resolver un problema de este tipo: 1. Tabular las concentraciones iniciales conocidas. 2. Calcular el cambio de las concentraciones que se produce cuando el sistema tiende a un nuevo equilibrio. 3. Use la estequiometra de la reaccin para calcular el cambio de concentracin de todas las especies en equilibrio. 4. De los valores conocidos de las concentraciones en el equilibrio calcular la constante de equilibrio.
CLCULO DE Kc
Se colocan 0,1Moles de N2O4 (tetrxido de dinitrgeno) en un recipiente
de 2 L , llegando al equilibrio a 110C. En el equilibrio la concentracin de NO2 es M(molar) . Calcular el valor de Kc para la reaccin a 110C. Solucin:
N2O4 2NO2
Tabla de concentraciones Estado del sistema lnicial cambio Equilibrio N2O4 0.050 M -0,036 0,014 NO2 0M +0.072 M 0.072 M
14
CLCULO DE Kc
EQUILIBRIO DE REACCIONES HETEROGNEAS
En las reacciones homogneas todas las sustancias participantes estn en la misma fase. En las reacciones heterogneas los reactantes y productos estn en diferentes fases. El equilibrio que involucra fases diferentes se llama Equilibrio Heterogneo. La expresin del equilibrio en este caso no incluye la concentracin de slidos o lquidos(puros) ya que su concentracin en trminos de moles por litro, permanece constante. Las concentraciones de slidos y lquidos se incluyen en el valor de la constante de equilibrio.
SnO2(s) + 2CO(g) Sn(s) + 2CO2(g)
Kp
P P
CO 2 CO
Kc
CO CO
2
15
16
PRINCIPIO DE LE CHATELIER
Cuando un sistema est en equilibrio no se advierte ningn cambio, mientras la condiciones externas permanezcan inalteradas, pero si la condiciones externas se alteran el equilibrio es perturbado y el sistema tiende a un nuevo estado de equilibrio. Esto se puede expresar en el principio de Le Chatelier: Cuando una accin externa perturba un sistema en equilibrio, el sistema reacciona desplazndose en la direccin que minimiza el efecto de la perturbacin, hasta alcanzar un nuevo estado de equilibrio Las alteraciones o cambios que influyen en el equilibrio: 1. Cambio de reactivo o reactantes 2. Cambio del volumen(presin) 3. Cambio de la temperatura En base al principio de le Chatelier es posible predecir la direccin en que se desplazar el equilibrio
Aumenta la concentracin de reactivos Reactivos Productos
Disminuye la concentraci n de reactivos
17 18
Reactivos
Productos
21/06/2010
Aumenta la
concentracin Reactivos Productos de productos
Efectos de la temperatura
Reaccin Endotrmica (DE > 0) K aumenta cuando la T aumenta Reactivos Productos
Disminuye la concentracin Reactivos Productos de productos
Reaccin Exotrmica (DE < 0) K disminuye cuando la T aumenta Reactivos Productos
20
19
Efectos de la temperatura
2NO2 (g)
Caf
K
Ejemplo 1
Una mezcla de NO(g) y Br2(g) reaccionan en un frasco de 1,0 [L] y a una cierta temperatura constante T, hasta que llega al equilibrio segn: 2 NO(g) + Br2(g) 2 NOBr(g) En equilibrio la muestra contiene 2,0 [mol] de NO(g) , 1,5 [mol] de Br2(g) y 0,40 [mol] de NOBr (i) Calcular la constante de equilibrio K de la reaccin a esa temperatura T (ii) Calcular los [mol] presentes de NO(g) y Br2(g) en la mezcla original
21 22
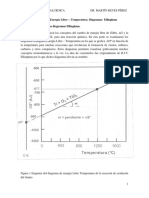
N2O4 (g) + DE
K = 170 (25 [C]) (izquierda) K = 1300 (0 [C]) (derecha)
N O 2 4 e NO2 e 2
Incoloro
Se aprecia que al bajar la T, el equilibrio se desplaza hacia la derecha
Ejemplo 1
EQUILIBRIO INICIAL
NO=? Br2= ?
Ejemplo 1
NO=2 [mol] Br2=1,5 [mol] NOBr=0,4 [mol]
(ii) Distintas mezclas originales generarn distintas mezclas en el equilibrio para esta reaccin, pero todas ellas estn caracterizadas por la misma K a la temperatura T
Solucin
(i) Para calcular K basta conocer la concentracin de todas las especies presentes en el equilibrio (no es necesario conocer la composicin de la mezcla inicial) K
2 NO(g)
ni
Br2(g)
y 1,5
2 NOBr(g)
0 0,4
neq
23
x 2,0
este valor es vlido slo a temperatura T
24
21/06/2010
Ejemplo 1
Sea z la cantidad de [mol] de NO que reaccionaron hasta que se lleg al equilibrio Necesariamente tienen que haber reaccionado z/2 [mol] de Br2 y se deben haber formado z [mol] de NOBr en toda circunstancia en una reaccin qumica Notar que las relaciones estequiomtricas se cumplen
Ejemplo 1
Solucin
EQUILIBRIO
INICIAL
K = 0,0027
NO=2 [mol] Br2=1,5 [mol]
NO=2,4 [mol]
Luego,
xz = 2,0 y - z/2 = 1,5 z = 0,4
Br2=1,7 [mol] NOBr=0,4 [mol]
x = nmero inicial de [mol] de NO = 2,4 y = nmero inicial de [mol] de Br2 = 1,7
25 26
Ejemplo 2 (i)
Hidrgeno, yodo y yoduro de Hidrgeno establecen el siguiente equilibrio H2(g) + I2(g) 2 HI(g) Con K1 = 0,16 a cierta temperatura T1 y K2 = 4,0 a otra temperatura T2 (i) Se introducen 1,0 [mol] de H2(g) y I2(g) en un frasco de 1 [L] y temperatura de la mezcla a T. composicin de la mezcla una vez al equilibrio 1,0 [mol] de se lleva la Calcular la que se llega
Ejemplo 2 (i)
As se obtiene
K
x = 0,167
Solucin
EQUILIBRIO INICIALH =1 M
2
K1 = 0,16
H2=0,8 M I2=0,83 M
I2=1 M
HI=0,3 M
Ejemplo 2 (ii)
(ii) Si la mezcla original se lleva a T 2. Calcular la composicin de la mezcla en el equilibrio
EQUILIBRIO INICIALH =1 M
2
Ejemplo 2 (ii)
Antes de calcular, debiera estar claro que en el nuevo equilibrio a T2, la concentracin de HI ser mayor y las de H 2 e I2 menores que en el caso anterior a T1
Formalmente, el planteo del problema es el mismo K2(T2) = 4,0 H2(g) + I2(g) 2 HI(g)
[ ]i 1,0 1,0 lo que reacciona x x [ ]eq 1,0 - x 1,0 - x
K2 = 4,0
H2=? I2=?
I2=1 M
HI=?
0 2x
21/06/2010
Ejemplo 2 (ii)
K
Solucin
EQUILIBRIO INICIAL
H2=1 M I2=1 M
Ejemplo 2 (iii)
; X = 0,5
(iii) Se prepara una nueva mezcla que contiene 1,0 [mol] de cada una de las especies H2, I2 y HI, en 1[L] Calcular la composicin de la muestra en equilibrio a T
EQUILIBRIO INICIAL H2=1 M
I2=1 M HI=1 M HI= ? K1 = 0,16 H2= ? I2= ?
K2 = 4,0
H2=0,5 M I2=0,5 M HI=1,0 M
Ejemplo 2 (iii)
Establecer cules son los reactivos y cules son los productos Se escoge por convencin, escribir el sistema como: H2(g) + I2(g) 2 HI(g) Entonces se dice que las especies de la izquierda son reactivos y los de la derecha son productos. As Q (o K) queda unvocamente definida por
Ejemplo 2 (iii)
Habr cambio en las concentraciones iniciales slo si este sistema inicial no est en equilibrio
K
El sistema no est en equilibrio y espontneamente evolucionar a partir de estas condiciones iniciales hasta llegar a l ( Q K ) Luego, a partir de las condiciones iniciales deben aumentar los reactivos y disminuir los productos, i.e., el sistema se desplaza en trminos netos de derecha a izquierda
Ejemplo 2 (iii)
Para pensar: Qu se quiere decir con desplaza en trminos netos?
Ejemplo 2 (iii)
Solucin
EQUILIBRIO INICIAL
K1 = 0,16 H2=1 M H2=1,25 M I2=1,25 M I2=1 M HI=1 M HI=0,5 M
K1(T1) = 0,16 H2(g) + [ ]i 1,0 lo que reacciona [ ]eq 1,0+x I2(g) 1,0 1,0+x 2 HI(g) 1,0 2x 1,0-2x
; X = 0,25
21/06/2010
Ejemplo 2 (iv)
(iv) Si la muestra original se lleva a T2, calcular la composicin en equilibrio
EQUILIBRIO INICIALH2=1 M
I2=1 M HI= 1 M
Ejemplo 2 (iv)
K
K2(T2) = 4,0
[ ]i
H2(g) + I2(g)
1,0 x 1,0 - x
2 HI(g)
1,0 1,0+2x
K = 4,0
H2=? I2=? HI=?
1,0 lo que reacciona x [ ]eq 1,0 - x
Ejemplo 2 (iv)
K
; X = 0,25
El mismo valor numrico de x, que en el caso anterior pero con otro significado Solucin
EQUILIBRIO INICIALH2=1 M
I2=1 M HI= 1 M
K = 4,0
H2= 0,75 M I2= 0,75 M HI= 1,5 M
Potrebbero piacerti anche
- Guia Discusion 02 FQR115 2022Documento3 pagineGuia Discusion 02 FQR115 2022Gabriela Maria Crespín LopezNessuna valutazione finora
- Ivan - Leyes de Los Gases - I - 8 - BioDocumento4 pagineIvan - Leyes de Los Gases - I - 8 - BioIvan Dario Mendez GoyesNessuna valutazione finora
- Guia Nom 014Documento17 pagineGuia Nom 014Carlos GuevaraNessuna valutazione finora
- Taller Estado GaseosoDocumento14 pagineTaller Estado GaseosoMelissa PinedaNessuna valutazione finora
- Ley de Henry y RaoultDocumento5 pagineLey de Henry y RaoultAlexxaNessuna valutazione finora
- Equilibrio Líquido-Vapor PDFDocumento21 pagineEquilibrio Líquido-Vapor PDFdaniel grNessuna valutazione finora
- Ficha 2 - Qca Gral 2021-22Documento14 pagineFicha 2 - Qca Gral 2021-22Benito Eyene Engono oyeNessuna valutazione finora
- TEORIA Diagramas de Energía Libre TOTAL PDFDocumento33 pagineTEORIA Diagramas de Energía Libre TOTAL PDFDiego RamirezNessuna valutazione finora
- Ejercicios de GasesDocumento3 pagineEjercicios de GasesEnrique MadridNessuna valutazione finora
- Guía de Problemas #8Documento3 pagineGuía de Problemas #8Aurora A León LainesNessuna valutazione finora
- Antologia Ejercicios Fisica Febrero 2023Documento15 pagineAntologia Ejercicios Fisica Febrero 2023Marcos SantiagoNessuna valutazione finora
- Guia 1Documento4 pagineGuia 1tutidqq DuranNessuna valutazione finora
- 1 Aa-1 Curso de Vapor-2Documento106 pagine1 Aa-1 Curso de Vapor-2Eyner GonzalesNessuna valutazione finora
- Resumen Cap 39Documento7 pagineResumen Cap 39jonasgs_92100% (2)
- Problemas GasesDocumento5 pagineProblemas GasesDamariasjaelNessuna valutazione finora
- Contenido de Agua en El Gas NaturalDocumento8 pagineContenido de Agua en El Gas Natural19895100% (1)
- Apuntes Hidraulica Resumen Completo Temas 1 8 PDFDocumento172 pagineApuntes Hidraulica Resumen Completo Temas 1 8 PDFCarla BarrioNessuna valutazione finora
- Absorcion Columna de RellenoDocumento21 pagineAbsorcion Columna de RellenojesiNessuna valutazione finora
- Presentación 4ta Clase PSPCCyH-3IV89 - 11feb22Documento6 paginePresentación 4ta Clase PSPCCyH-3IV89 - 11feb22Dulce MarielNessuna valutazione finora
- Hoja CuadriculadaDocumento7 pagineHoja CuadriculadaloqueseaNessuna valutazione finora
- Serie de Gases Ideales Ia 20-IiDocumento2 pagineSerie de Gases Ideales Ia 20-IiJulio Garibo VargasNessuna valutazione finora
- Aeromedico PCDocumento3 pagineAeromedico PCPablo RosasNessuna valutazione finora
- Física de La Difusión Gaseosa y Presiones ParcialesDocumento27 pagineFísica de La Difusión Gaseosa y Presiones ParcialesKevin Velazquez MartinezNessuna valutazione finora
- Quimica Semana 9Documento6 pagineQuimica Semana 9Daniel Agramonte RondoyNessuna valutazione finora
- Soluciones Ideales - Ley de Raoult CorregidoDocumento3 pagineSoluciones Ideales - Ley de Raoult CorregidoJoan HoyosNessuna valutazione finora
- Estequio 2Documento72 pagineEstequio 2Camilo Duran0% (1)
- Gases Ideales (Ley de Boyle)Documento8 pagineGases Ideales (Ley de Boyle)Roberto Silva100% (1)
- 083 EquilibrioDocumento4 pagine083 EquilibrioCarlos RubinaNessuna valutazione finora
- Taller 1 Fisicoquimica Gases Ideales PDFDocumento2 pagineTaller 1 Fisicoquimica Gases Ideales PDFJuan CamiloNessuna valutazione finora
- Tarea Preparatoria No.3Documento11 pagineTarea Preparatoria No.3ChristopherSoto0% (1)