Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Guía IV Medio Segunda Parte Ácidos Bases Química. Lab
Caricato da
Liceo Andrés Bello-ComunicacionesDescrizione originale:
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Guía IV Medio Segunda Parte Ácidos Bases Química. Lab
Caricato da
Liceo Andrés Bello-ComunicacionesCopyright:
Formati disponibili
Liceo Andrs Bello A-94 Coordinacin Tcnica Pedaggica Departamento de Ciencias Sr. Carlos Contreras G.
Curso: IV Medio Gua de Estudio Qumica Cuarto Medio cidos y Bases Segunda Parte Nombre Curso Fecha Objetivos: Conocer las distintas definiciones de cido base.. Habilidades: Conocer Identificar Reconocer Determinar Calcular Puntaje Calificacin Ortografa /100
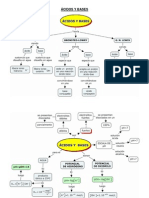
Fuerzas de los cidos y las bases
Los cidos fuertes son electrlitos fuertes que, para fines prcticos, se supone que se ionizan completamente en el agua. La mayora de los cidos fuertes son cidos inorgnicos como el cido Clorhdrico (HCl), cido Ntrico (HNO3), cido Perclrico (HClO4) y cido Sulfrico (H2SO4):
Observe que H2SO4 es un cido diprtico; aqu slo se muestra el primer estado de ionizacin. En el equilibrio, las disoluciones de los cidos carecen de molculas sin ionizar. La mayora de los cidos son cidos dbiles, los cuales si ionizan, solo en forma limitada, en el agua. En el equilibrio, las disoluciones acuosas de los cidos dbiles contienen una mezcla de molculas del cido sin ionizar, iones hidronios y la base conjugada. Como ejemplos de cidos dbiles estn el cido fluorhdrico (HF), el cido actico (CH3COOH) y el in amonio (NH4+). La ionizacin limitada de los cidos dbiles est relacionada con su constante de equilibrio de ionizacin. Las bases dbiles, al igual que los cidos dbiles, son electrolitos dbiles. El amoniaco es una base dbil. En el agua se ioniza en forma limitada. Observe que el NH3 no se ioniza como un cido porque no se desdobla para formar iones de manera semejante a como lo hace el HCl.
cidos dbiles y su constante de ionizacin cida
Como se ha visto, existen relativamente pocos cidos fuertes. La gran mayora de los cidos son dbiles. Considere un cido monoprtico dbil, HA. Su ionizacin en agua se representa como O simplemente La expresin de equilibrio para esta ionizacin es: Aunque la mayora de los cidos son dbiles, hay una gran variacin de fuerzas. Por ejemplo, la Ka para HF (7,1 * 10-4) es casi 1.5 millones de veces mayor que HCN (4,9*10-10). Por lo general, es posible calcular la
concentracin de iones hidrgeno o de pH de una disolucin cida en equilibrio a partir de la concentracin inicial del cido y del valor de Ka. De manera alternativa, se conoce el pH as como concentracin inicial es posible determinar Ka. Ej.
Identificar especies presentes en la disolucin. La ionizacin de los cidos dbiles es pequea, las principales especies son HF sin ionizar y algunos H+ y F-. Otra especie es H2O, pero como su valor es pequeo Kw (1.0*10-14) se desprecia La concentracin de HF, H+ y F en el equilibrio, expresadas en funcin de la incgnita x, se sustituyen en la expresin de la constante de ionizacin para obtener. Al reordenar esta expresin se tiene. Si el x es menor a un 5 % de la concentracin inicial, se puede hacer una aproximacin, de lo contrario hay que resolver la ecuacin de segundo orden. Al reordenar
As se obtiene el valor de x (fraccin disociada) sin necesidad de utilizar la ecuacin de segundo grado. Y el pH. Qu tan buena es la aproximacin?
Bases dbiles y su constante de ionizacin cida
La ionizacin de las bases dbiles se analiza de la misma manera que la ionizacin de los cidos dbiles.
Porcentaje de ionizacin
Como se ha visto, la magnitud Ka indica la fuerza de un cido. Otra forma de medir la fuerza de un cido es mediante su porcentaje de ionizacin, que se define como. Cuanto ms fuerte es un cido, mayor ser su porcentaje de ionizacin.
Relacin entre la constante de ionizacin de los cidos y sus bases conjugadas
La base conjugada, CH3COO-, suministrada por una disolucin de acetato de sodio (CH3COONa), reacciona con el agua de acuerdo con la ecuacin.
Y la constante de ionizacin bsica se escribe como Kb = [CH3COOH][OH-] El producto de estas dos constantes de ionizacin est dado por. [CH3COO-] Ka Kb = [H+][CH3COO-] * [CH3COOH][OH-] [CH3COOH] [CH3COO-] Ka Kb = [H+][OH-] Ka Kb = Kw Tal vez esto parezca extrao a primera vista, pero si sumamos ambas ecuaciones:
1. 2. 3.
H2O(l) H+(ac) + OH-(ac)
Kb Ka _____________________________________________________ Kw
cidos Diprtico y Poliprticos
El tratamiento de los cidos diprticos y poliprtico es ms complicado, dado que estas sustancias pueden ceder ms de un Protn por molcula. Estos cidos se ionizan por etapas, es decir, pierden un protn cada vez. Se puede escribir una expresin de la constante de ionizacin para cada etapa de ionizacin. H2CO3 (ac) HCO3-(ac) H+ (ac) + HCO3-(ac) H+ (ac) + CO3-2 (ac) ka1 = [H+][HCO3-]/ [H2CO3] ka2 = [H+][CO3-2]/ [HCO3-]
Observe que la base conjugada de la primera etapa de ionizacin se convierte en el cido de la segunda etapa de ionizacin. La primera constante siempre es mucho mayor qua la segunda y as sucesivamente. Esta tendencia resulta lgica ya que es ms sencillo quitar un protn de una molcula neutra que de un in cargado negativamente. La determinacin de las constantes de equilibrio, concentraciones y pH, tienen el mismo procedimiento, solo que se realizan por parte, es decir para cada disociacin.
Disoluciones Amortiguadoras
Esta debe contener 1) un cido dbil o una base dbil y 2) su sal; ambos componentes deben de estar presentes. La disolucin tienen la capacidad de resistir las cambios de pH en la adicin de pequea cantidades tanto de cidos como de bases. Los amortiguadores son muy importantes en los sistemas qumicos y biolgicos. El pH en el cuerpo humano vara mucho de un fluido a otro; por ejemplo el pH de la sangre es de 7,4, mientras que el jugo gstrico de ms o menos 1,5. Estos valores son cruciales para el funcionamiento adecuado de enzimas y del balance de la presin osmtica, se mantiene como amortiguadores en la mayora de los casos. Una disolucin amortiguadora debe contener un cido para reaccionar con los iones OH- que puedan agregarse, y una base para reaccionar con los H+. Adems los cidos y bsicos del amortiguador no deben consumirse entre s en una reaccin de neutralizacin. Esto se satisface con un cido dbil y su base conjugada o una base dbil y su cido conjugado en las mismas cantidades. Si se agrega un cido: CH3COOH (ac) + OH- (ac) Si se agrega una base: CH3COO-(ac) + H+ (ac) CH3COOH (ac) CH3COO-(ac) + H2O(l)
Aqu, los iones acetato son proporcionados por la disociacin del acetato de sodio. CH3COONa(s) CH3COO-(ac) + Na+ (ac)
Con el diagrama de distribucin podemos apreciar que a valores pequeos de pH la concentracin del CH3COOH es mucho mayor que de CH3COO-, porque la presencia del in H+ desplaza el equilibrio hacia la izquierda (Principio de Le Chatelier). El efecto opuesto ocurre a pH grande por la presencia de OH-. Para escoger un buen tampn, deberemos escoger de acuerdo al Ka o Kb que ms nos convenga. Ejemplo: Determinar el pH de un sistema amortiguador que contiene CH3COOH 1,0 M y CH3COONa 1,0 M. Respuesta: El pH del sistema amortiguador anterior a la adicin de un cido como el HCl puede calcularse suponiendo que la ionizacin del cido actico es despreciable, al igual que la hidrlisis de los iones acetato, se tiene, al equilibrio. [CH3COOH] = 0,1 M y
-5
[CH3COO-] = 0,1 M M
-5
Ka = [H+][CH3COO-] = 1,8 * 10 [CH3COOH]
[H+]= Ka [CH3COOH] = (1,8 * 10-5 M)(1,0 M) = 1,8 * 10 [CH3COO-] (1, 0 M) pH = - log (1,8 * 10 pH = 4,66
-5
Actividades
Resolver los siguientes ejercicios: Instrucciones: El desarrollo se realizar en hojas tamao oficio matemtica y deber contener preguntas, desarrollo y respuestas. Deber entregar dicho desarrollo con portada formal. No se aceptaran hojas sueltas o en mal estado. Se castigar con un descuento de 10 decimas sobre la nota obtenida, por borrones, corrector, desorden en el desarrollo, nmeros ilegibles, manchas o ausencia de portada formal. Y solo se podr optar a la nota 4,0 en caso de atrasos injustificados.
1.
Prediga la direccin de la siguiente reaccin en disolucin acuosa. (10 puntos)
2.
El pH de una disolucin de cido frmico (HCOOH) 0,10 M es de 2,39. cul es la Ka del cido? (30 puntos)
3.
Cul es el pH de una disolucin de amonaco 0,400 M? (30 puntos)
4.
El cido oxlico (C2H2O4) es una sustancia venenosa que se utiliza, sobre todo, como agente blanqueador y limpiador (por ejemplo, para eliminar el sarro en las tinas de bao). Calcule las concentraciones de todas las especies presentes en el equilibrio de una disolucin 0,10 M. (Ka= 6,5 * 10-2) (30 puntos)
Potrebbero piacerti anche
- Quimica I Clase 1 y LaboratorioDocumento42 pagineQuimica I Clase 1 y Laboratorioannthony sebastianNessuna valutazione finora
- Ácidos y Bases. Concepto de PH. Métodos de Determinación Electrodos Selectivos de IonesDocumento9 pagineÁcidos y Bases. Concepto de PH. Métodos de Determinación Electrodos Selectivos de IonesCELIA MALLADA RIVERANessuna valutazione finora
- Conceptos QuimicaDocumento9 pagineConceptos Quimicavaleria martinezNessuna valutazione finora
- Tema 5. Acido Base PDFDocumento23 pagineTema 5. Acido Base PDFciudadanousuarioNessuna valutazione finora
- Acidos y Bases BronstedDocumento4 pagineAcidos y Bases BronstedmorenomNessuna valutazione finora
- Quimica I Clase 14-02-2022Documento13 pagineQuimica I Clase 14-02-2022annthony sebastianNessuna valutazione finora
- HidrólisisDocumento29 pagineHidrólisisAlejandro RodriguezNessuna valutazione finora
- Acidos y Bases Poliproticos Final Ahora SiDocumento18 pagineAcidos y Bases Poliproticos Final Ahora SiIvan Cuauhtemoc Nuñez RamirezNessuna valutazione finora
- Equilibrio IonicoDocumento49 pagineEquilibrio IonicoCarol Celeste Villegas GomezNessuna valutazione finora
- Equilibrio IonicoDocumento48 pagineEquilibrio Ionicoperu210% (1)
- 4.-Introduccion Al Equilibrio Acido-BaseDocumento25 pagine4.-Introduccion Al Equilibrio Acido-Basemehow94461Nessuna valutazione finora
- Trabajo Listo. Curvas de PHDocumento29 pagineTrabajo Listo. Curvas de PHAlba MenesesNessuna valutazione finora
- Guia Calculo de PH en Disoluciones AcuosasDocumento9 pagineGuia Calculo de PH en Disoluciones AcuosaspaokaNessuna valutazione finora
- Guia de Problemas Nº10Documento7 pagineGuia de Problemas Nº10Nahuel YurquinaNessuna valutazione finora
- Equilibrio Homogéneo Parte 1Documento11 pagineEquilibrio Homogéneo Parte 1Dino P MoralesNessuna valutazione finora
- Práctica 11. Disoluciones Amortiguadoras. Química General IIDocumento5 paginePráctica 11. Disoluciones Amortiguadoras. Química General IIFrancisco Alejandro K. EstradaNessuna valutazione finora
- Acidos y BasesDocumento28 pagineAcidos y Baseseduardohk18Nessuna valutazione finora
- Unidad 10 Uba XxiDocumento6 pagineUnidad 10 Uba XxiPaulaNessuna valutazione finora
- U 10 Ácidos y BasesDocumento6 pagineU 10 Ácidos y BasesAgusBovedaNessuna valutazione finora
- Equilibrio Iónico de Ácidos PolipróticosDocumento11 pagineEquilibrio Iónico de Ácidos PolipróticosAlexa Garciamayork100% (1)
- Practica Nº4, PH, Sol ReguladorasDocumento23 paginePractica Nº4, PH, Sol ReguladorasDam_TNessuna valutazione finora
- Amortiguadores Ac PoliDocumento11 pagineAmortiguadores Ac PoliBRenyaz PanIbaNessuna valutazione finora
- GUIA 2016-Ácidos y BasesDocumento63 pagineGUIA 2016-Ácidos y BasesDianaNessuna valutazione finora
- QUI 222acidobaseDocumento85 pagineQUI 222acidobaseFernando Perez Carrasco0% (1)
- Ácidos y Bases - Química - 2022.dotxDocumento7 pagineÁcidos y Bases - Química - 2022.dotxMax ChazzNessuna valutazione finora
- 05 Fuerza Ácidos y BasesDocumento7 pagine05 Fuerza Ácidos y Basesromina rodriguezNessuna valutazione finora
- Cap 10 - TEMA 25 ACIDOS BASESDocumento34 pagineCap 10 - TEMA 25 ACIDOS BASESRetter Darwin ColqueNessuna valutazione finora
- Equilibrio Ionico AcidoDocumento8 pagineEquilibrio Ionico AcidoJean Danniel Montanares UlloaNessuna valutazione finora
- Acido y BaseDocumento15 pagineAcido y BaseMarco VazquezNessuna valutazione finora
- Bioquimica #1Documento18 pagineBioquimica #1Maria Jose MurciaNessuna valutazione finora
- Reacciones Acido BaseDocumento31 pagineReacciones Acido BaselhistaNessuna valutazione finora
- Taller de Quimica InorganicaDocumento6 pagineTaller de Quimica InorganicaAna RamirezNessuna valutazione finora
- Acido-Base - Problemas ResueltosDocumento76 pagineAcido-Base - Problemas ResueltosDlcm Born To WinNessuna valutazione finora
- Acido-Base - Problemas ResueltosDocumento76 pagineAcido-Base - Problemas ResueltosStefany Condor75% (4)
- Equilibrio IónicoDocumento30 pagineEquilibrio IónicoJorge Esteban Rojas GonzalezNessuna valutazione finora
- Acidez y BasicidadDocumento39 pagineAcidez y BasicidadGise VacarezzaNessuna valutazione finora
- Soluciones ReguladorasDocumento5 pagineSoluciones ReguladorasLuismor3333Nessuna valutazione finora
- Capítulo 16-Equilibrio Acido-BaseDocumento75 pagineCapítulo 16-Equilibrio Acido-BaseMariela VargasNessuna valutazione finora
- Ácidos y BasesDocumento24 pagineÁcidos y BasesomarguerrawarNessuna valutazione finora
- Colegio Liceo Femenino Mercedes Nariño 2Documento25 pagineColegio Liceo Femenino Mercedes Nariño 2Rocio BurgozNessuna valutazione finora
- Lab7 - Guía Preparación de BufferDocumento11 pagineLab7 - Guía Preparación de BufferSantiago Ahumada TobarNessuna valutazione finora
- Equilibrio Ionico Cap ViiDocumento43 pagineEquilibrio Ionico Cap ViiPedro Leon CamposNessuna valutazione finora
- Reconocimiento de Acidos, Esteres y AnhidridosDocumento32 pagineReconocimiento de Acidos, Esteres y AnhidridosJherson Guillermo Bonifacio Espinoza73% (15)
- Tema 13 - Equilibrio IónicoDocumento37 pagineTema 13 - Equilibrio IónicoEduardoNessuna valutazione finora
- Acido Bases09Documento63 pagineAcido Bases09Jerí CésarNessuna valutazione finora
- 2 Acido Base 2017Documento6 pagine2 Acido Base 2017Ornella BrogliaNessuna valutazione finora
- Acidos y Bases, PH AmortiguadoresDocumento4 pagineAcidos y Bases, PH AmortiguadoresCésarÑañez100% (1)
- Tema 06bDocumento26 pagineTema 06bManuel ArufeNessuna valutazione finora
- MedicinaDocumento6 pagineMedicinaMariaXimenaBlancoNessuna valutazione finora
- Buffers Marco TeoricoDocumento4 pagineBuffers Marco TeoricoShirley Lopez Escobar0% (1)
- Actividades Previas #9quimica de SolucionesDocumento6 pagineActividades Previas #9quimica de SolucionesJose Armando MartinezNessuna valutazione finora
- Ácidos y BasesDocumento12 pagineÁcidos y BasesCarlos Alfonso Jara Benites100% (2)
- 5.exposicion Equilibrio Ionico e Hidrolisis de SalesDocumento48 pagine5.exposicion Equilibrio Ionico e Hidrolisis de SalesRenso Ramos LopezNessuna valutazione finora
- Equilibrio y PHDocumento31 pagineEquilibrio y PHMiguel Angel Diaz MendezNessuna valutazione finora
- Sistemas Ácido BaseDocumento65 pagineSistemas Ácido BaseAna HernándezNessuna valutazione finora
- Quimica BiologicaDocumento24 pagineQuimica Biologicamatias961100% (1)
- Ácidos y Bases DébilesDocumento10 pagineÁcidos y Bases DébilesDaniela Esther SiñaniNessuna valutazione finora
- Introducción a la química de los metales de transiciónDa EverandIntroducción a la química de los metales de transiciónNessuna valutazione finora
- Proceso de Admisión 2021 (Actualizado)Documento4 pagineProceso de Admisión 2021 (Actualizado)Liceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Preguntas Frecuentes SAE 2021Documento12 paginePreguntas Frecuentes SAE 2021Liceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Proceso de Admisión 2021 (Actualizado)Documento4 pagineProceso de Admisión 2021 (Actualizado)Liceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Circular Informativa SAE 2020 - 2021Documento2 pagineCircular Informativa SAE 2020 - 2021Liceo Andrés Bello-Comunicaciones100% (1)
- Pausas ActivasDocumento2 paginePausas ActivasLiceo Andrés Bello-Comunicaciones100% (1)
- Nomina Admitidos Sorteo Alumnos 1 MedioDocumento1 paginaNomina Admitidos Sorteo Alumnos 1 MedioLiceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Nómina de Alumnos 1° Medio Admitidos Por SorteoDocumento1 paginaNómina de Alumnos 1° Medio Admitidos Por SorteoLiceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Nomina Admisión 7° 2019 - AdmitidosDocumento2 pagineNomina Admisión 7° 2019 - AdmitidosLiceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Nomina Admisión 1° 2019 - SorteoDocumento3 pagineNomina Admisión 1° 2019 - SorteoLiceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Nomina Admisión 1° 2019 Sorteo Prioritarios (Actualizado)Documento1 paginaNomina Admisión 1° 2019 Sorteo Prioritarios (Actualizado)Liceo Andrés Bello-ComunicacionesNessuna valutazione finora
- Reporte Planificacion AnualDocumento27 pagineReporte Planificacion AnualLiceo Andrés Bello-Comunicaciones67% (3)
- Practica Optativa 1Documento7 paginePractica Optativa 1Itzel SimonNessuna valutazione finora
- Práctica 1. Ejemplos de Mezcla Homogénea y Heterogénea.Documento3 paginePráctica 1. Ejemplos de Mezcla Homogénea y Heterogénea.Ángel ArriagaNessuna valutazione finora
- Taller Not BioDocumento7 pagineTaller Not BioLaila DomínguezNessuna valutazione finora
- HDS EstirenoDocumento8 pagineHDS Estirenopaloma aspeNessuna valutazione finora
- Manipulación GenéticaDocumento6 pagineManipulación GenéticaMagaly Castillo OrtizNessuna valutazione finora
- Regla de La Palanca 2Documento3 pagineRegla de La Palanca 2josSAN.6262Nessuna valutazione finora
- Equipo 2. Practica 1. Soluciones OralesDocumento9 pagineEquipo 2. Practica 1. Soluciones OralesAlejandra DelgadoNessuna valutazione finora
- Apunte TD1 P2014Documento71 pagineApunte TD1 P2014Rodrigo A Cáceres FuentesNessuna valutazione finora
- Práctica Calor Específico SólidoDocumento6 paginePráctica Calor Específico SólidoAna CorsiniNessuna valutazione finora
- Cobre BlistersDocumento3 pagineCobre BlistersAlexsandro Rodriguez FuentesNessuna valutazione finora
- Informe de Temperatura AbsolutaDocumento5 pagineInforme de Temperatura Absolutaleidy cardenasNessuna valutazione finora
- El Efecto FotoelectricoDocumento23 pagineEl Efecto FotoelectricoDavidSuarezNessuna valutazione finora
- TESIS AG1309 - HueDocumento64 pagineTESIS AG1309 - HueBryam Venegas Castro100% (1)
- Fertilizacion Foliar - Febrero 2010 - Libro de 100 Pp.Documento101 pagineFertilizacion Foliar - Febrero 2010 - Libro de 100 Pp.Harry Ortiz Prada100% (2)
- EstomagoDocumento1 paginaEstomagoMildret Genezaret Hernández HernándezNessuna valutazione finora
- Material 1 y 2 Cepreunac 2014-IIDocumento7 pagineMaterial 1 y 2 Cepreunac 2014-IIniltones2cesar2v2eNessuna valutazione finora
- Quimica 6Documento8 pagineQuimica 6Andres Castro FuentesNessuna valutazione finora
- Obtención de Biodiesel A Partir de Aceite de JatrophaDocumento21 pagineObtención de Biodiesel A Partir de Aceite de JatrophaChristian Pinedo ReateguiNessuna valutazione finora
- Diagramas de Fase Trabajo de InvestigacionDocumento15 pagineDiagramas de Fase Trabajo de InvestigacionWiliams CHNessuna valutazione finora
- Estudio Químico de La Reacción de Geopolimerización en Medio AlcalinoDocumento56 pagineEstudio Químico de La Reacción de Geopolimerización en Medio Alcalinofivecrrayci avalosNessuna valutazione finora
- Informe de La Obtención de Dibenzalacetona ReporteDocumento4 pagineInforme de La Obtención de Dibenzalacetona ReporteAdrian Bermudez LoeraNessuna valutazione finora
- ChupeteDocumento5 pagineChupeteJosue Marcelo Sucso ZavalagaNessuna valutazione finora
- GeofisicaPozosEF1 PDFDocumento197 pagineGeofisicaPozosEF1 PDFLuis Fernando Quiroz IbañezNessuna valutazione finora
- BF Respiraciòn - GeneralidadesDocumento15 pagineBF Respiraciòn - GeneralidadesDayanna CoralNessuna valutazione finora
- Práctica 13 Equilibrio QuímicoDocumento4 paginePráctica 13 Equilibrio QuímicoCarlos “Charly” Gómez LópezNessuna valutazione finora
- S01 S2-EjerciciosDocumento4 pagineS01 S2-EjerciciosLuisW.NoriegaNessuna valutazione finora
- Informe Esterificación de FischerDocumento7 pagineInforme Esterificación de FischerLuisafcaNessuna valutazione finora
- Laboratorio Virtual No 3Documento7 pagineLaboratorio Virtual No 3Edwin Andres Villamil DiazNessuna valutazione finora
- 1 Gases ComprimidosDocumento19 pagine1 Gases ComprimidosNacho FreireNessuna valutazione finora
- Aportaciones de La Bioquímica - 50 BiografiasDocumento42 pagineAportaciones de La Bioquímica - 50 BiografiasHugo E. Hernández61% (23)