Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Clase 7 - Reacciones de Sustitución de Alcanos
Caricato da
DIEGO FABIAN DIAZ VERA0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
98 visualizzazioni34 paginequimica
Titolo originale
CLASE 7_REACCIONES DE SUSTITUCIÓN DE ALCANOS
Copyright
© © All Rights Reserved
Formati disponibili
PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoquimica
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
98 visualizzazioni34 pagineClase 7 - Reacciones de Sustitución de Alcanos
Caricato da
DIEGO FABIAN DIAZ VERAquimica
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 34
QUEDATE EN CASA
ING. Esther Chavez Alfaro
jchavez9@unsa.edu.pe
Google homenajea a Robert Bunsen con motivo del año
internacional de la Química
GRUPOS FUNCIONALES
■ Se conocen como grupos funcionales a las características
estructurales que hacen posible la clasificación de los
compuestos en familias. Un grupo funcional es un grupo de
átomos que tienen un comportamiento químico característico
dentro de una molécula.
■ Químicamente, un grupo funcional se comporta casi de la
misma manera en todas las moléculas en las que aparece.
Por ejemplo, comparemos el etileno, una hormona de las
plantas que causa la madurez de las frutas, con el menteno,
una molécula mucho más complicada que se encuentra en el
aceite de menta. Ambas sustancias contienen un grupo
funcional con enlace doble carbono-carbono y por tanto
ambas reaccionan de la misma manera con el Br2 para dar
productos en los cuales se añade un átomo de Br a cada uno
de los dos carbonos doblemente enlazados. Este ejemplo es
típico: la química de todas las moléculas orgánicas,
independientemente de su tamaño y complejidad, está
determinada por los grupos funcionales que contiene.
GRUPOS FUNCIONALES
GRUPOS FUNCIONALES
■ El etileno es una hormona vegetal. Las plantas lo desprenden
y el etileno las estimula a madurar. El mundo de la
maduración de las plantas es complicado, hay plantas
climatéricas, que desprenden etileno y son sensibles al
mismo, y plantas no climatéricas, que no desprenden etileno
de forma sensible. De estas últimas, algunas pueden ser
sensibles al etileno producido por otras plantas o al etileno
presente en la atmósfera donde esté la planta. Esto es lo que
les pasa a muchas verduras.
■ Una manzana madura o podrida desprende más etileno que
cuando es verde, y de aquí que la manzana podrida acelere
la maduración y la putrefacción de las otras manzanas. Y de
aquí que se recomiende que determinadas frutas verdes
aguacates, peras- se envuelvan con papel para ayudar a su
maduración: se retiene el etileno que desprenden y así no se
pierde por el ambiente.
GRUPOS FUNCIONALES
Desde hace muchos años que ciertas frutas se recogen verdes y se
almacenan en cámaras frías y con ambiente bajo en oxígeno y alto
en nitrógeno y dióxido de carbono. Se evita así la maduración. Y
cuando se quiere que la fruta madure, se modifica la atmósfera de
la cámara y se ponen cantidades controladas de etileno. Las
concentraciones usadas son muy bajas, de partes por millón, que es
suficiente para favorecer la maduración en un tiempo de algunos
días.
Productores de etileno (e+)
Aguacate, albaricoque, ciruela, higo, kiwi, mango, manzana,
melocotón, nectarina, papaya, pera, plátanos madurando, tomate
Sensibles al etileno (e-)
Berenjena, brécol, col, col de Bruselas, coliflor, endibia, espinacas,
guisante, judía tierna, lechuga, melón, patata, pepino, pimiento,
plátano verde, sandía, zanahoria.
GRUPOS FUNCIONALES
GRUPOS FUNCIONALES
Principales grupos funcionales
REACCIONES DE SUTITUCION DE LOS
ALCANOS
Nomenclatura de grupos alquilo: el prefijo sec- (para secundario)
y ter- (para terciario) utilizado para los grupos alquilo C4 se
refieren al numero de otros átomos de carbono unidos al átomo
de carbono ramificado.
■ Hay cuatro posibilidades: primario (1°), secundario (2°),
terciario (3°) y cuaternario (4º)
REACCIONES DE SUSTITUCION ALCANOS
■ El grupo R puede ser metilo, etilo, propilo o cualquiera de una
multitud de otros; podría pensar en R como la representación del
Resto de la molécula, que no se interesa en especificar.
■ Los términos primario, secundario, terciario y cuaternario son
utilizados rutinariamente en química orgánica y sus significados
vienen de una segunda naturaleza; por ejemplo, si dijéramos, “el
acido cítrico es un alcohol terciario”, nos deberíamos referir a que
tiene un grupo funcional alcohol (-OH), unido a un átomo de
carbono que está a su vez unido a otros tres carbonos. (Estos otros
tres carbonos pueden también conectar con otros grupos
funcionales.)
TIPOS DE REACCIONES ORGÁNICAS
Las reacciones de la química orgánica pueden organizarse en
dos maneras generales: por los tipos de reacciones y por cómo
ocurren estas reacciones. Veamos primero los tipos de
reacciones que se llevan a cabo; hay cuatro tipos generales de
reacciones orgánicas: adiciones, eliminaciones, sustituciones y
transposición.
Las reacciones de adición tienen lugar cuando dos reactivos se
adicionan uno al otro para formar un solo producto sin átomos
“sobrantes”. Un ejemplo que estudiaremos pronto es la reacción
de un alqueno, como el etileno, con HBr para producir un
bromuro de alquilo.
TIPOS DE REACCIONES ORGÁNICAS
Las reacciones de eliminación son, de cierta forma, el opuesto
de las reacciones de adición y ocurren cuando un reactivo único
se separa en dos productos, a menudo con la formación de una
molécula pequeña como el agua o el HBr. Un ejemplo es la
reacción catalizada con ácido de un alcohol para producir agua y
un alqueno.
TIPOS DE REACCIONES ORGÁNICAS
■ Las reacciones de sustitución ocurren cuando dos reactivos
intercambian partes para formar dos nuevos productos; un
ejemplo es la reacción de un de un éster, tal como acetato de
metilo con agua para producir un acido carboxílico más
alcohol. Reacciones similares se producen en muchos
procesos biológicos, incluyendo el metabolismo de grasas en
la dieta.
TIPOS DE REACCIONES ORGÁNICAS
Las reacciones de transposición tienen lugar cuando un reactivo
único experimenta una reorganización de enlaces y átomos para
formar un producto isomé rico; un ejemplo es la conversión de
fosfato de dihidroxiacetona en su isómero constitucional
gliceraldehído 3-fosfato, un paso en la vía glucolisis por la cual se
metabolizan los carbohidratos.
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
La sustitución nucleófila SN consiste en la sustitución de un
átomo o grupo de átomos de una molécula por otro átomo o
grupo de átomos a consecuencia del ataque de un nucleófilo
Esquema general de una reacción de sustitución nucleofila
El nucleófilo Nu, mediante su par de electrones (:), reemplaza en
el sustrato R-X, donde R es el electrófilo, al grupo saliente X, el
cual se lleva consigo un par de electrones. El nucleófilo puede
ser una especie neutra o un anión, mientras el sustrato puede
ser neutro o tener carga positiva (catión).
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Las reacciones de sustitución nucleófila son frecuentes en
química orgánica, y pueden ser categorizadas de forma general
según tengan lugar sobre un carbono saturado o sobre un
carbono aromático o insaturado.
Siguiendo este tipo de reacción los derivados halogenados
pueden convertirse en alcoholes por tratamiento en medio
básico:
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Existen dos tipos de Sustitución nucleófila, SN1 y SN2
SN1: Sustitución nucleófila monomolecular. En este tipo de
reacción la velocidad de reacción depende solo de la
concentración del sustrato. No depende de la concentración del
reactivo nucleófilo
SN2: Sustitución nucleófila biomolecular. La velocidad de
reacción en este caso depende de la concentración del sustrato y
del reactivo nucleófilo.
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
■ En el mecanismo SN1 se rompe el enlace C – X para dar
lugar al carbocatión correspondiente.
■ En el mecanismo SN2 a la vez que se va rompiendo el enlace
C – X se va formando el nuevo enlace C – Nu.
■ Los estados de transición en cada tipo de mecanismo los
podemos representar:
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Mecanismo de una reacción SN2
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Mecanismo de una reacción SN1
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Diagramas de los perfiles de reacción:
REACCIONES DE SUSTITUCIÓN NUCLEÓFILA
Los compuestos con azufre son más nucleofílicos que los
compuestos con oxígeno correspondientes, debido a que el azufre
es más grande y más polarizable y sus electrones están retenidos
con menor fuerza en los orbitales que están más lejos del núcleo.
Aunque los éteres son nucleófílos débiles, los sulfuras son
nucleó filos relativamente fuertes. Los sulfuras atacan a los haluros
de alquilo no impedidos para formar sales de sulfonio.
REACCIONES DE
SUSTITUCIÓN NUCLEÓFILA
Gas mostaza
■ La guerra química se dio por primera vez en 1915 cuando
Alemania diseminó cloro gaseoso contra las fuerzas británicas y
francesas. En el resto de la I Guerra Mundial, ambas partes
usaron una variedad de agentes químicos como armas. Uno de
los más comunes fue el gas mostaza, reactivo que produce
ampollas en la superficie del organismo.
■ El gas mostaza es un compuesto muy reactivo por su átomo de
azufre, Cl—CH2CH2—S—CH2CH2—Cl, muy nucleofílico, que
desplaza con facilidad a los iones cloruro por reacción una SN2
intramolecular formando una sal cíclica de sulfonio que
reacciona con rapidez con un nucleófilo. La sal de sulfonio tiene
una reactividad muy grande por tener un anillo de tres
miembros, con mucha tensión, y un excelente grupo saliente
(con carga positiva).
■ Las ampollas causadas por el gas mostaza se deben a las
altas concentraciones locales de HCl producido cuando el gas
mostaza se pone en contacto con el agua -o con cualquier
otro nucleófilo- sobre la piel o en el tejido pulmonar. El gas
mostaza interfiere con el desarrollo de la médula ósea.
■ Un tratado internacional, en la década de 1980, prohibió el
uso de gas mostaza y ordenó destruir todo el que estuviera
almacenado.
Las mostazas de azufre dan origen a las mostazas nitrogenadas,
las cuales son agentes de alquilación menos reactivos que se
usan como fármacos contra el cáncer. Las mostazas
nitrogenadas alquilan al ADN, lo cual impide su reproducción y
por último mata a las células.
TRANSFORMACIONES DE HALUROS DE
ALQUILO EN ALCOHOLES
■ Se pueden emplear reacciones de sustitución nucleófila para
intercambiar el átomo de halógeno por otro sustituyente.
■ La sustitución del halógeno de un halogenuro de alquilo por
diversos nucleófilos proporciona acceso a muchos grupos
funcionales.
■ Sustitución de un halógeno para formar alcoholes por un
mecanismo SN2
■ Todos los tipos de halogenuros de alquilo sufren sustitución
para formar alcoholes. Los halogenuros de alquilo primarios y
secundarios reaccionan con el ion hidróxido en una reacción
SN2 con producción de alcoholes primarios y secundarios.
Transformaciones de haluros de
alquilo en alcoholes
■ Un haloalcano, (halogenuro de alquilo, halogenoalcano
o haluro de alquilo) es un compuesto químico derivado
de un alcano por sustitución de uno o mas átomos de
hidrogeno por átomos de halógeno: Flúor
(fluoroalcanos, Cloro (cloroalcanos), Br (bromoalcanos,
Yodo (yodoalcanos)
■ Los compuestos mixtos también son posibles, y son
aquellos en los cuales por sustitución de más de un
hidrógeno se han sustituido dos o más halógenos
diferentes. Los ejemplos más conocidos son los
clorofluorocarbonos (CFC) que son los principales
responsables del agujero en la capa de ozono.
POR EL CARBONO AL QUE SE UNEN:
(Primario, secundario y terciario)
..
CAPA DE OZONO
…
ACCCION CATALIZADORA DEL CLORO
ORIGEN DE LOS NUEVOS FÁRMACOS 1981-
2002
Muchos años de trabajo intervienen en el ensayo de varios miles de
sustancias para identificar un compuesto individual que puede obtener
en ultima instancia la aprobación como NME; pero después que ha sido
identificado este compuesto individual, apenas ha comenzado el trabajo
debido a que toma un promedio de 9 a 10 años para que un fármaco
pase por el proceso de aprobación. Primero, debe ser demostrada la
seguridad del fármaco en animales y ser diseñado un método
económico de manufactura. Con estos preliminares, se envía una
solicitud de Nuevo fármaco para Investigarse (IND) a la FDA para
permitir el inicio de las pruebas en humanos.
■ Problema
1. Dibuje estructuras de alcanos que coincidan con las
siguientes descripciones:
(a) Un alcano con dos carbonos terciarios
(b) Un alcano que contenga un grupo isopropilo.
(c) Un alcano que tenga un carbono cuaternario y uno secundario
2. Clasifique cada una de las siguientes reacciones como
adición, eliminación, sustitución o rearreglo:
(a) CH3Br + KOH → CH3OH + KBr
(b) CH3CH2Br → H2C CH2 + HBr
(c)H2C CH2 + H2 → CH3CH3
3. ¿Cuál es la diferencia entre un estado de transición y un
intermediario?
BIBLIOGRAFIA
1. L. G. Wade, Jr., "Química Orgánica", Pearson-Prentice Hall, 7a
ed., 2011
2. J. McMurry, "Química Orgánica", International Thomson
Editores, 8a ed, 2011
3. Universidad Politécnica de valencia
Potrebbero piacerti anche
- Química de macrocomponentes de alimentosDa EverandQuímica de macrocomponentes de alimentosNessuna valutazione finora
- Resumen AlquinosDocumento4 pagineResumen AlquinosNatalyPomaPerez100% (1)
- Informe 4-Alcoholes y FenolesDocumento12 pagineInforme 4-Alcoholes y FenolesJose Polanco100% (1)
- CetonasDocumento132 pagineCetonasMarlon Arturo Vilca Gonzales0% (1)
- Grupo FuncionalDocumento22 pagineGrupo FuncionalOlmo Leonardo Mosquera RiveraNessuna valutazione finora
- Acidos Carboxilicos ExpoDocumento17 pagineAcidos Carboxilicos ExpoJudith VilaNessuna valutazione finora
- ALCANOSDocumento11 pagineALCANOSAdrian BaezNessuna valutazione finora
- Estructuras de Compuestos Organicos PDFDocumento32 pagineEstructuras de Compuestos Organicos PDFCarrera Patiño OctavioNessuna valutazione finora
- Compuestos OxigenadosDocumento11 pagineCompuestos OxigenadosemiliaGS2Nessuna valutazione finora
- Contaminantes Orgánicos e InorgánicosDocumento16 pagineContaminantes Orgánicos e InorgánicosERMELY HUAMANNessuna valutazione finora
- BenzamidaDocumento8 pagineBenzamidaSaul Castro RodríguezNessuna valutazione finora
- Determinacion de C - HDocumento3 pagineDeterminacion de C - HDiego Guaman100% (1)
- ALCANOSDocumento24 pagineALCANOSloreto100% (2)
- Alcoholes, Fenoles y EteresDocumento44 pagineAlcoholes, Fenoles y EteresIlen Mandarachi EscobarNessuna valutazione finora
- Ácidos Carboxílicos y Sus DerivadosDocumento67 pagineÁcidos Carboxílicos y Sus DerivadosMatiasDiaz100% (1)
- BioventilaciónDocumento2 pagineBioventilaciónAlfredo LópezNessuna valutazione finora
- Toxicidad Del BencenoDocumento4 pagineToxicidad Del BencenoRowil Godoy100% (2)
- Alquenos 2018Documento72 pagineAlquenos 2018Antonio Ortega100% (1)
- 1 AlcanosDocumento17 pagine1 AlcanosJuanMegoNessuna valutazione finora
- Ejercitación GlúcidosDocumento4 pagineEjercitación GlúcidosGabrielaNessuna valutazione finora
- Fahrenheit Parte IIDocumento33 pagineFahrenheit Parte IIAleja MuñozNessuna valutazione finora
- Sales y Esteres de Los Acidos CarboxilicosDocumento11 pagineSales y Esteres de Los Acidos CarboxilicosAgustín SilesNessuna valutazione finora
- Compartimentación CelularDocumento16 pagineCompartimentación CelularVale Gerónimo100% (1)
- Alcanos y CicloalcanosDocumento26 pagineAlcanos y CicloalcanosDavid ZepedaNessuna valutazione finora
- Practica de Laboratorio 1 MicrosDocumento3 paginePractica de Laboratorio 1 MicrosAna MariaNessuna valutazione finora
- Ácidos Carboxílicos y Sus Derivados FuncionalesDocumento46 pagineÁcidos Carboxílicos y Sus Derivados FuncionalesJulio Adolfo Fernández TorresNessuna valutazione finora
- Tabla de BiomoléculasDocumento4 pagineTabla de BiomoléculasSusannita Vaquerizima100% (2)
- Practicas de Laboratorio de Auimica OrganicaDocumento21 paginePracticas de Laboratorio de Auimica OrganicaMARIANessuna valutazione finora
- NaftalinaDocumento8 pagineNaftalinaPsykotyko Cincuenta CincuentaNessuna valutazione finora
- Resumen Reacciones Redox OxidoDocumento2 pagineResumen Reacciones Redox OxidoAnonymous SfLVmdNessuna valutazione finora
- AldehidosDocumento10 pagineAldehidosRobin RamosNessuna valutazione finora
- Enlace Ionico, Covalente y Metalico - ActividadesDocumento4 pagineEnlace Ionico, Covalente y Metalico - ActividadesLuz Nelly Maya OrtizNessuna valutazione finora
- DienosDocumento33 pagineDienosNatalia MartínNessuna valutazione finora
- Hidrocarburos CiclicosDocumento22 pagineHidrocarburos CiclicosFransisNessuna valutazione finora
- Propiedades de Los Compuestos AromaticosDocumento4 paginePropiedades de Los Compuestos AromaticosJACQUELINE VIRGEN LÓPEZNessuna valutazione finora
- Manual de Laboratorio de Bioquímica-BiologiaDocumento46 pagineManual de Laboratorio de Bioquímica-BiologiaSebastianBeltranNessuna valutazione finora
- Metodos de Obtencion de Los AlcoholesDocumento15 pagineMetodos de Obtencion de Los Alcoholeslilianparra60% (10)
- Ligamentos de La LaringeDocumento3 pagineLigamentos de La LaringeLuis GerardoNessuna valutazione finora
- Alquenos - QUIMICA ORGANICADocumento14 pagineAlquenos - QUIMICA ORGANICARonaldo1962Nessuna valutazione finora
- Celdas ElectroquímicasDocumento15 pagineCeldas ElectroquímicasDiego ACNessuna valutazione finora
- EstereocentroDocumento2 pagineEstereocentrojosegpaNessuna valutazione finora
- Tabla Periodica y Propiedades PeriodicasDocumento2 pagineTabla Periodica y Propiedades PeriodicasJuan BiologoNessuna valutazione finora
- Nomenclatura de AlquinosDocumento13 pagineNomenclatura de AlquinosAndrea ArangoNessuna valutazione finora
- RibosomasDocumento6 pagineRibosomasismael coronelNessuna valutazione finora
- Bioquimica. RepasoDocumento8 pagineBioquimica. RepasoPaola OgandoNessuna valutazione finora
- Definicion de CitoesqueletoDocumento11 pagineDefinicion de CitoesqueletoAlberto VictorianoNessuna valutazione finora
- Trabajo Final (Éteres) PDFDocumento17 pagineTrabajo Final (Éteres) PDFDiego NievesNessuna valutazione finora
- Reacciones de AlcoholesDocumento57 pagineReacciones de AlcoholesKvn GonzálezNessuna valutazione finora
- Tipos de ArnDocumento3 pagineTipos de ArnOmar HernándezNessuna valutazione finora
- Lehninger CAPITULO 04Documento23 pagineLehninger CAPITULO 04Lyd Granados96% (23)
- Reacciones de Identificacion para Los CarbohidratosDocumento9 pagineReacciones de Identificacion para Los CarbohidratosBrian S. Cuaran ArteagaNessuna valutazione finora
- Determinacion Cloruros Calcio y MagnesioDocumento6 pagineDeterminacion Cloruros Calcio y MagnesioJosé ChamorroNessuna valutazione finora
- Modelo Celular LABORATORIO BIOLOGIADocumento3 pagineModelo Celular LABORATORIO BIOLOGIAIvanna VillalbaNessuna valutazione finora
- Quimica Organica IntroduccionDocumento10 pagineQuimica Organica IntroduccionnosoytantoNessuna valutazione finora
- Reaccion QuimicaDocumento11 pagineReaccion Quimicanilvia marcaNessuna valutazione finora
- AlquinosDocumento5 pagineAlquinosKevinNessuna valutazione finora
- Guia 1 - Tipos de Reacciones QuímicasDocumento9 pagineGuia 1 - Tipos de Reacciones QuímicasCARLOS MARIO RIOS NUÑEZNessuna valutazione finora
- Reacciones de Combinación Anibal de Noveno9Documento11 pagineReacciones de Combinación Anibal de Noveno9walter martinezNessuna valutazione finora
- Reacciones Analíticas de Haluros Orgánicos-Análisis Funcional OrgánicoDocumento17 pagineReacciones Analíticas de Haluros Orgánicos-Análisis Funcional Orgánicoraul taya perezNessuna valutazione finora
- Yogurt. VariablesDocumento7 pagineYogurt. VariablesDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Clase 3 - Capacidad de Reacción de Compuestos OrgánicosDocumento31 pagineClase 3 - Capacidad de Reacción de Compuestos OrgánicosDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Problemas de Agitación y MezcladoDocumento4 pagineProblemas de Agitación y MezcladoDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Formulario - Primer Examen Parcial - AmDocumento6 pagineFormulario - Primer Examen Parcial - AmDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Clase 6 - Alifáticos SaturadosDocumento18 pagineClase 6 - Alifáticos SaturadosDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Mecanismo de Acción de Las EnzimasDocumento29 pagineMecanismo de Acción de Las EnzimasDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Hidrogenación de AlquenosDocumento1 paginaHidrogenación de AlquenosDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Oxidación de AlquenosDocumento1 paginaOxidación de AlquenosDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Hdpe PaperDocumento2 pagineHdpe PaperDIEGO FABIAN DIAZ VERANessuna valutazione finora
- Contaminación Del Aire y Su Control - Grupo # 5Documento24 pagineContaminación Del Aire y Su Control - Grupo # 5Dario LlanosNessuna valutazione finora
- Taller No. 2 MagistralDocumento4 pagineTaller No. 2 MagistralGenesis Gamero GarciaNessuna valutazione finora
- Tema 11 - La Célula ProcariotaDocumento3 pagineTema 11 - La Célula ProcariotaMaríaNessuna valutazione finora
- 106 (104506) Indol NDWDocumento4 pagine106 (104506) Indol NDWLuna Alzate VallejoNessuna valutazione finora
- Bebida Estimulante de Chocolate y PlátanoDocumento25 pagineBebida Estimulante de Chocolate y PlátanoMarielos CubillasNessuna valutazione finora
- Ej - U4 - Equilibrio QuimicoDocumento3 pagineEj - U4 - Equilibrio QuimicomartatrimbusNessuna valutazione finora
- Tarea 8 QuimicaDocumento3 pagineTarea 8 QuimicaVaquitasFilmsNessuna valutazione finora
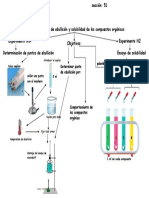
- Esquema Practica 1Documento1 paginaEsquema Practica 1edgar monsalveNessuna valutazione finora
- 40 TRABAJOS EN CALIENTE Rev. 1Documento3 pagine40 TRABAJOS EN CALIENTE Rev. 1Cote BiciclinicaNessuna valutazione finora
- Bioquímica, Acidos Grasos (Mapa Conceptual)Documento3 pagineBioquímica, Acidos Grasos (Mapa Conceptual)KAREN LINEY MORALES ALCUDIA100% (2)
- Los ActinidosDocumento46 pagineLos ActinidosAlex Neider Reina CisnerosNessuna valutazione finora
- Segunda Revolución de La QuímicaDocumento5 pagineSegunda Revolución de La QuímicaJerryNessuna valutazione finora
- Unidad IVDocumento25 pagineUnidad IVJvr GnzlzNessuna valutazione finora
- TECNOLOGIA DEL CONCRETO Unidad 1Documento12 pagineTECNOLOGIA DEL CONCRETO Unidad 1Dante GuerecaNessuna valutazione finora
- Cuestionario Catalisis EnzimaticaDocumento4 pagineCuestionario Catalisis EnzimaticaMiguel Angel Paternina RuizNessuna valutazione finora
- Exposición MATERIALESDocumento35 pagineExposición MATERIALESDaniela ArtilesNessuna valutazione finora
- Determinación de Histamina en Pescado..Documento21 pagineDeterminación de Histamina en Pescado..Jeferson Bryan echevarria alarcomNessuna valutazione finora
- Los Disfraces de La EnergíaDocumento8 pagineLos Disfraces de La EnergíasssNessuna valutazione finora
- Lab GranulometriaDocumento7 pagineLab Granulometriajuan diego carrilloNessuna valutazione finora
- Fuerzas IntermolecularesDocumento23 pagineFuerzas IntermolecularesJavier Soto0% (1)
- Practica 4Documento9 paginePractica 4diego muñoz arellanoNessuna valutazione finora
- Hidrodesoxigenación ApuntesDocumento9 pagineHidrodesoxigenación ApuntesCeci Garcia-SalasNessuna valutazione finora
- DesinfectanteDocumento4 pagineDesinfectanteFreddyE.Tovar100% (1)
- Topografia Corteza Terrestre Formación de RocasDocumento6 pagineTopografia Corteza Terrestre Formación de RocasMariaNessuna valutazione finora
- Bio SeguridadDocumento12 pagineBio SeguridadKarolina HerreraNessuna valutazione finora
- Clasificación de Las Propiedades de La MateriaDocumento7 pagineClasificación de Las Propiedades de La Materiaalexadominrodri06Nessuna valutazione finora
- Extraccion de GrasasDocumento7 pagineExtraccion de GrasasIvan Diego HuancaNessuna valutazione finora
- Notas de La Unidad 5Documento131 pagineNotas de La Unidad 5Hum BertoNessuna valutazione finora
- Dermatitis de Contacto A Gentamicina. A Propósito de Un CasoDocumento4 pagineDermatitis de Contacto A Gentamicina. A Propósito de Un CasoCarlos MachadoNessuna valutazione finora
- Humo LíquidoDocumento8 pagineHumo LíquidoValentina PeñaNessuna valutazione finora