Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Roteiro de Estudos Química - 3º Ano - 18 A 22-05
Caricato da
Douglas Ricardo de Assis0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
6 visualizzazioni2 pagineTitolo originale
Roteiro de estudos Química_3º Ano_18 a 22-05
Copyright
© © All Rights Reserved
Formati disponibili
DOCX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
6 visualizzazioni2 pagineRoteiro de Estudos Química - 3º Ano - 18 A 22-05
Caricato da
Douglas Ricardo de AssisCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 2
E.E.PROF.
FRANCISCO SILVEIRA COELHO
Habilidades: ● Reconhecer que existem transformações químicas que não se completam, atingindo um
estado chamado de equilíbrio químico, em que reagentes e produtos coexistem.
Matéria: Professor(a): Data: Série Google Sala de aula
ROTEIRO DE 3ºA: gr3w5f3
ESTUDOS QUÍMICA DOUGLAS 18 à 22/05/2020 3ºA/B/C3°B: vkwpcmo
3°C: x7k3fkv
Não se esqueçam de entrar no Google Sala de aula para entregar as atividades. Utilizem o código da turma
acima correspondente a sua sala. Vocês deverão estar logados com o GMAIL de vocês. Aqueles que não
conseguirem me envie o seu GMAIL no particular.
Orientações:
1) Realize as atividades 1 e 2 descrita abaixo.
2) Coloque em ordem as atividades anteriores. Nosso bimestre acaba em 29/05 preciso que entreguem
urgentemente. Segue as atividades que já foram passadas:
Atividade 1: 23/03 – 03/04 – Destilação fracionada do ar
Atividade 2: 04/05 – 08/05 – Fatores que alteram a velocidade das reações
Atividade 3: 11/05 – 15/05 – Retomada de Cinética Química.
3) Não se esqueçam de enviar fotos para o professor registrar a frequência e notas de vocês
4) Caso não tenham assistido segue o link da vídeo aula do Centro de Mídia – SP do dia 11/05:
https://www.youtube.com/watch?v=9FPu73jCbNA
Atividade 1: Química do Refrigerante
Tempo previsto: 45 minutos
Material necessário: Caderno do aluno - SP faz escola (Apostila - pág. 34)
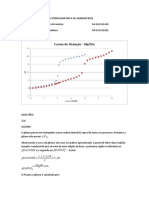
Realizar a atividade 2C da apostila apresentado na página 34. Utilize o Texto abaixo para responder as
perguntas propostas.
Texto 1: A Química do Refrigerantes: gás carbônico dissolvido e muito mais
Os refrigerantes são bebidas não alcoólicas, constituídas basicamente por água, xarope e gás carbônico (CO 2). O gás
carbônico é o responsável por seu sabor refrescante. Em geral, ingerimos o refrigerante gelado, então a temperatura do líquido
aumenta no caminho que vai da boca ao estômago. A solubilidade dos gases diminui com o aumento da temperatura; já o aumento
dela e o meio ácido estomacal favorecem a eliminação do CO2. A sensação de frescor resulta da expansão desse gás.
A solubilidade dos gases é maior em temperaturas menores. Por isso, quando abrimos uma garrafa de refrigerante e a
conservamos em geladeira seu sabor se mantém por mais tempo. Se a garrafa for deixada à temperatura ambiente, o refrigerante
perderá todo o seu sabor característico, que é resultante da presença do CO 2, e ficará com um sabor muito adocicado, como um
xarope.
A solubilidade do CO2 em água é pequena. No entanto, se essa dissolução é feita a alta pressão, consegue-se dissolver uma
quantidade bem maior. É isso o que acontece no refrigerante. A dissolução do CO 2 é feita na água a alta pressão antes que o
xarope seja adicionado. Nas condições de pressão ambiente não se conseguiria dissolver CO 2 em quantidade necessária para dar o
sabor característico dos refrigerantes.
Quando abrimos uma garrafa de refrigerante e escutamos um chiado característico, obtemos uma evidência de que a
dissolução foi feita a alta pressão, e esse som indica que o CO2 está sendo liberado para o ambiente. A dissolução do CO 2 na água
usada na fabricação do refrigerante envolve reações químicas em equilíbrio. Isso significa que após a dissolução estão presentes
os reagentes e os produtos. Você estudará sistemas como este mais profundamente no capítulo 4. Podemos representar esses
equilíbrios, simplificadamente, por duas equações:
O que essas equações nos mostram é que, em água, o gás carbônico apresenta-se sob a forma aquosa (dissolvido), e em etapa
posterior o CO2 dissolvido reage com a água, e parte dele se transforma em ácido carbônico (H 2CO3). Sabe-se, no entanto, que a
quantidade de CO2 na forma aquosa é muito maior do que a quantidade de ácido carbônico formada.
Além do gás carbônico, os refrigerantes contêm um xarope que apresenta composição variada, dependendo do tipo de
refrigerante. O açúcar cristal, constituído por sacarose – um dissacarídio de fórmula C 12H22O11 –, é o principal componente do
xarope e, depois da água, é o segundo em maior quantidade nos refrigerantes. Além de açúcar, um refrigerante possui ainda um
concentrado que confere sabor característico a ele. A composição dos concentrados é um segredo comercial guardado a sete
chaves pelos fabricantes, principalmente os do tipo cola.
Depois do CO2, é o principal responsável pelo sabor característico dos refrigerantes, que são, portanto, refrescantes (graças
ao CO2), adocicados (graças à sacarose) e de sabor característico (graças ao concentrado). Além desses produtos, o xarope contém
ainda acidulantes, antioxidantes e conservantes.
Os refrigerantes têm pH ácido devido à presença de acidulantes, usados para realçar o paladar e evitar a proliferação de
microrganismos. Cada tipo de refrigerante usa um acidulante específico para realçar seu sabor. Assim, os de limão e laranja usam
ácido cítrico, os de cola, ácido fosfórico, e os de uva, ácido tartárico.
Os antioxidantes são usados na fabricação de refrigerantes para impedir a ação do oxigênio sobre a bebida, que pode reagir
com alguns compostos presentes, como ésteres e aldeídos. A luz solar e o calor aceleram essas reações. Os antioxidantes mais
usados são os ácidos ascórbico (o mesmo da vitamina C) e isoascórbico.
Já os conservantes são usados para impedir a ação de microrganismos tolerantes a ácidos, como algumas bactérias, mofo e
leveduras. Nos refrigerantes são usados como conservantes o benzoato de sódio (um derivado do ácido benzoico, solúvel em
água) e o sorbato de potássio (derivado do ácido sórbico). As duas substâncias têm uso regulado pelas autoridades de saúde.
Os teores máximos permitidos de uso para cada 100 mL de refrigerante são: de ácido benzoico - 500 mg; de ácido sórbico -
30 mg. Finalmente, há os edulcorantes, que substituem a sacarose na fabricação de refrigerantes diet ou light. São usados os
edulcorantes comuns, como a sacarina, o ciclamato de sódio e o aspartame, além do acesulfame-K.
A água usada na fabricação dos refrigerantes deve ser tratada, para evitar a presença de cloro e fenóis, que alteram o gosto e
provocam a descoloração do líquido. Além disso, evita-se também a presença de metais como o ferro, o cobre e o manganês, que
aceleram as reações de oxidação tão indesejáveis nesse processo. A água deve ser isenta de microrganismos.
Fabricar um refrigerante, depois de ter a água tratada, uma fonte de CO 2 de alta pressão e um xarope com todas as
substâncias que relacionamos, consiste em preparar a água com CO 2 dissolvido sob pressão e misturá-lo ao xarope, tudo isso a
uma temperatura baixa para garantir a solubilidade do gás. Nas fábricas de refrigerantes são produzidas também as embalagens
PET que serão usadas para acomodá-los.
Bons Estudos!!!
Atividade 2: Química do Refrigerante - Experimento Sensorial do refrigerante.
Tempo previsto: 45 minutos
Material necessário: Caderno do Aluno – SP faz escola (Apostila pág. 34)
Se possível realizar a atividade 2D da apostila apresentado na página 34.
Potrebbero piacerti anche
- Roteiro de Estudos Química - 3º EJA - 13 A 17-07Documento3 pagineRoteiro de Estudos Química - 3º EJA - 13 A 17-07Douglas Ricardo de AssisNessuna valutazione finora
- Roteiro de Estudos Projeto de Vida - 2º Ano - 20 A 24-07Documento2 pagineRoteiro de Estudos Projeto de Vida - 2º Ano - 20 A 24-07Douglas Ricardo de AssisNessuna valutazione finora
- Roteiro de Estudos Química - 1º EJA - 13 A 17-07Documento1 paginaRoteiro de Estudos Química - 1º EJA - 13 A 17-07Douglas Ricardo de AssisNessuna valutazione finora
- Roteiro de Estudos Projeto de Vida - 2º Ano - 22 A 26-06Documento1 paginaRoteiro de Estudos Projeto de Vida - 2º Ano - 22 A 26-06Douglas Ricardo de AssisNessuna valutazione finora
- Documento Orientador - Recuperação e Aprofundamento Além de Língua Portuguesa e MatemáticaDocumento294 pagineDocumento Orientador - Recuperação e Aprofundamento Além de Língua Portuguesa e MatemáticaDouglas Ricardo de AssisNessuna valutazione finora
- Roteiro de Estudos Química - 3º Ano - 22 A 26-06Documento2 pagineRoteiro de Estudos Química - 3º Ano - 22 A 26-06Douglas Ricardo de AssisNessuna valutazione finora
- Roteiro de Estudos Química - 3º EJA - 22 A 26-06Documento1 paginaRoteiro de Estudos Química - 3º EJA - 22 A 26-06Douglas Ricardo de AssisNessuna valutazione finora
- Aula de LeitesDocumento46 pagineAula de LeitesDouglas Ricardo de AssisNessuna valutazione finora
- LicoresDocumento64 pagineLicoresDouglas Ricardo de Assis100% (1)
- Roteiro de Estudos Química - 1º EJA - 18 A 22-05Documento2 pagineRoteiro de Estudos Química - 1º EJA - 18 A 22-05Douglas Ricardo de AssisNessuna valutazione finora
- Praticas de MicrobiologiaDocumento58 paginePraticas de MicrobiologiaDouglas Ricardo de AssisNessuna valutazione finora
- Como Criar Gráficos A Partir de Uma Fórmula PDFDocumento1 paginaComo Criar Gráficos A Partir de Uma Fórmula PDFDouglas Ricardo de AssisNessuna valutazione finora
- O Poder Do Louvor e Da AdoraçãoDocumento6 pagineO Poder Do Louvor e Da AdoraçãoDouglas Ricardo de AssisNessuna valutazione finora
- CadernoDoAluno 2014 Vol1 Baixa CN Quimica EM 3SDocumento98 pagineCadernoDoAluno 2014 Vol1 Baixa CN Quimica EM 3SDouglas Ricardo de AssisNessuna valutazione finora
- Experimento - AlunosDocumento3 pagineExperimento - AlunosDouglas Ricardo de AssisNessuna valutazione finora
- Teoria Sobre FluxogramasDocumento3 pagineTeoria Sobre FluxogramasDouglas Ricardo de AssisNessuna valutazione finora
- Tabela Recomendacao CaminhaoDocumento1 paginaTabela Recomendacao CaminhaoMarília MeneguzzoNessuna valutazione finora
- Sabão Do Professor Luiz PauloDocumento63 pagineSabão Do Professor Luiz PauloLilia Fernandes Vasconcelos100% (3)
- Apostila Física IDocumento21 pagineApostila Física Ilviviane986Nessuna valutazione finora
- Natalia Lyrio DissertacaoDocumento65 pagineNatalia Lyrio DissertacaoMarcos GarcezNessuna valutazione finora
- Catalogo de OrinesDocumento51 pagineCatalogo de OrinesAlexisAlejandroSandovalFlores0% (1)
- Plano de Aula - QuimicaDocumento2 paginePlano de Aula - QuimicaThomasKauamNessuna valutazione finora
- Uc2 - Aula 7 - ArgiloterapiaDocumento27 pagineUc2 - Aula 7 - ArgiloterapiaJeova SamuelNessuna valutazione finora
- Discutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1Documento2 pagineDiscutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1karine_sperling50% (2)
- Zen Design Catalogo Alcasmacanetas WebDocumento76 pagineZen Design Catalogo Alcasmacanetas WebFabiano Souza RochaNessuna valutazione finora
- Estrutura Do DNA, Cadeias Simplesmente Versos Cadeias Dupla Estrutura Secundária.Documento7 pagineEstrutura Do DNA, Cadeias Simplesmente Versos Cadeias Dupla Estrutura Secundária.Luciano SongueNessuna valutazione finora
- A-5 - Bombas de CalorDocumento51 pagineA-5 - Bombas de CalorYan Felipe CavalcanteNessuna valutazione finora
- It30 Fogos de Artifício e PirotecniaDocumento19 pagineIt30 Fogos de Artifício e PirotecniaKézia NatalyNessuna valutazione finora
- Estudo Dirigido 01 ToxicologiaDocumento3 pagineEstudo Dirigido 01 ToxicologiaJullyara UlhNessuna valutazione finora
- Quais Os Conceitos Importantes NR-20Documento4 pagineQuais Os Conceitos Importantes NR-20vivaldoms144Nessuna valutazione finora
- Prova 2 S25 2 Semestre 2021Documento1 paginaProva 2 S25 2 Semestre 2021ВЯЕИОNessuna valutazione finora
- Bioquimica 1Documento2 pagineBioquimica 1Felipe HiroNessuna valutazione finora
- Pureza e RendimentoDocumento1 paginaPureza e RendimentoEdilson JuniorNessuna valutazione finora
- Determinação de Acidez em AlimentosDocumento2 pagineDeterminação de Acidez em AlimentosWanderson CândidoNessuna valutazione finora
- AULA - ALIMENTAÇAO ANIMAL - SLIDEpptxDocumento24 pagineAULA - ALIMENTAÇAO ANIMAL - SLIDEpptxLourenço ChiteteNessuna valutazione finora
- Quimica Relatorio ExperiementalDocumento9 pagineQuimica Relatorio ExperiementalFernando Silva MonteiroNessuna valutazione finora
- Revestimentos para Ferramenta de Corte - Vinícius Mendonça Franco CançadoDocumento13 pagineRevestimentos para Ferramenta de Corte - Vinícius Mendonça Franco CançadoVinícius MendonçaNessuna valutazione finora
- 03 Silicato de SódioDocumento10 pagine03 Silicato de SódioLeonardo CalicchioNessuna valutazione finora
- Anexo A - PentaclorobenzenoDocumento1 paginaAnexo A - PentaclorobenzenoVictor PereiraNessuna valutazione finora
- Bloco DataçãoDocumento22 pagineBloco DataçãoJorge HonzNessuna valutazione finora
- Cinetica QuimicaDocumento54 pagineCinetica QuimicaVioleta ValèryNessuna valutazione finora
- 1Documento1 pagina1Evelyn Alves Nunes SimonettiNessuna valutazione finora
- Apostila Inspeção de MotoresDocumento58 pagineApostila Inspeção de MotoresLucas Silva100% (1)
- Sercon Reverse Osmosis PDFDocumento7 pagineSercon Reverse Osmosis PDFFelipe0% (1)
- Lista de Exercicios 5 - Lic. QuimicaDocumento3 pagineLista de Exercicios 5 - Lic. QuimicaAbebeNessuna valutazione finora
- Gases Toxicos em Espaço ConfinadoDocumento94 pagineGases Toxicos em Espaço ConfinadosarajackNessuna valutazione finora