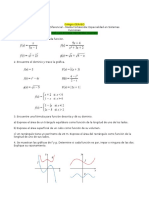
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Nivelaciones Quimica PDF
Caricato da
Lina salgadoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Nivelaciones Quimica PDF
Caricato da
Lina salgadoCopyright:
Formati disponibili
COLEGIO PABLO VI
TERCER TALLER PARA NIVELACION DE QUIMICA 2010
TEMAS: NOMENCLATURA, REACCIONES Y ECUACIONES, ESTEQUIOMETRIA
1.Nombra los siguientes compuestos, utiliza los tres tipos de nomenclatura donde sea
posible.
a. HgIO3 b. K4Fe(CN)6
c. FeCl2 d. Al2(SO4)3
e. Zn (OH)2 f. Hg (OH)2
g. CaO h. Sb2O3
i. Mg (OH)2 j. Co (OH)2
k. RaO l. As2O3
m. RbOH n. Cu (OH)2
o. SnO2 p. Se2O4
2. Construye las formulas correspondientes a los siguientes nombres
a. hidróxido cuproso b. óxido niquelico
c. hidróxido de cromo IV d. oxido de azufre VI
e. hidróxido crómico f. óxido hiposelenioso
g. hidróxido de oro III h. oxido de fósforo V
i. hidróxido férrico j. óxido cobaltico
k. hidróxido de manganeso IV l. oxido de bromo V
m. Permanganato de calcio n. Sulfito niquelico
o. carbonito crómico p. Ácido bromoso
q. ácido sulfúrico r. ácido nitrico
s. nitrito ferroso t. hipoyodito aurico
u. clorito de plata v. cloruro férrico
3. Balancea las siguientes ecuaciones por el método redox, clasifícalas y nombra reactivos y
productos
a. MnO2 + HCl ----> MnCl2 + H2O + Cl2
b. PbS + H2O2 ----> PbSO4 + H2O
c. KMnO4 + HCl ----> KCl + MnCl2 + H2O + Cl2
d. K 2Cr2O7 + FeSO4 + H2SO4 ----> Cr2SO4 + K2 SO4 + Fe2(SO4)3 +
H2O
e. H2SO4 + Cu ----> CuSO4 + SO2 + H2O
4. La combustión del etano en exceso de oxigeno se presenta por la siguiente ecuación
2 C2H6 + 7 O2 ----> 4 CO2 + 6 H2O
a. ¿Cuántos gramos de CO2 se pueden producir a partir de 180 gr de etano?
b. ¿Cuantos moles de agua se producen a partir de esa cantidad de etano?
c. ¿Cuántas moléculas de oxigeno se requieren para producir 4 moles de CO2?
d. ¿Cuántas moles de etano se requieren para producir 12 moles de agua?
5. El cloro y el metano reaccionan para formar el cloroformo, según la siguiente ecuación
CH4 + 3 Cl2 ----> CHCl3 + 3 HCl
Cuantas moles de CHCl3 se producen a partir de
a.1,5 moles de Cl2 y 1,5 moles de CH4
b. 50 gr de CH4 y 65 gr Cl2
6. El benceno reacciona con el ácido nítrico para producir nitrobenceno, según la reacción
C6H6 + HNO3 ----> C6H5NO2 + H2O
Si en un proceso de nityracion de benceno se obtienen 36 gr de nitrobenceno a partir de 312 gr
de benceno ¿Cuál es el rendimiento de la reacción?
7. ¿Cuántos gramos de Na2SO4 se pueden obtener a partir de 750 gr de NaCl de 88% de
pureza? 2 NaCl + H2SO4 ----> Na2SO4 +2 HCl
8. El perclorato de potasio se descompone produciendo cloruro de potasio y oxigeno
a. construye la ecuación
b. calcule la masa de perclorato requerida para producir 1,5 gr de oxigeno
c. calcule la masa de cloruro de potasio que produce con este oxigeno
d. calcule cuantos gramos de perclorato de potasio se requieren para producir 97 gramos de
oxigeno
9. El nitruro de magnesio se produce mediante la siguiente reacción 3Mg + N2 Mg3N2
a. Cuánto nitruro se produce a partir de 126 gr de Mg y 82gr de N2?
b. Cuál es el reactivo limite?
c. Cuál es el reactivo en exceso?, cuantos gramos quedan?
10. Cuando se calienta Cu en presencia de S, se produce Cu2S.
a. construye la ecuación y balancéala
b. nombra reactivos y producto
c. calcula los gramos de Cu2S que se producen a partir de 100gr de Cu y 50 gr de S
d. indica cual es el reactivo limite
e. indica cual es el reactivo en exceso y cuantas moles sobran
f. si en realidad se obtuvieron en el laboratorio 118,6 gramos de Cu2S, cuál fue el rendimiento
de la reacción
NOTA.
1.Este taller debe ser resuelto y entregado en la tercera semana de enero de 2011
2. La sustentación de este taller será a través de una prueba escrita individual en la misma
fecha.
3. Si te lo propones, obtendrás excelentes resultados académicos, animo.
Potrebbero piacerti anche
- Folle ToDocumento2 pagineFolle ToGaby Kt Rocha RuizNessuna valutazione finora
- Tipos de Enlace QuímicoDocumento6 pagineTipos de Enlace Químicoluna olivaresNessuna valutazione finora
- Documento de Arreglos Usando Cadenas PDFDocumento14 pagineDocumento de Arreglos Usando Cadenas PDFLina salgadoNessuna valutazione finora
- Taller1CálculoDiferencial PDFDocumento3 pagineTaller1CálculoDiferencial PDFLina salgadoNessuna valutazione finora
- Taller 2 Cálculo DiferencialDocumento2 pagineTaller 2 Cálculo DiferencialLina salgadoNessuna valutazione finora
- Temperatura CalorDocumento4 pagineTemperatura CalorLina salgadoNessuna valutazione finora
- Programa Cuarto Periodo Decimo 2016 PDFDocumento9 paginePrograma Cuarto Periodo Decimo 2016 PDFLina salgadoNessuna valutazione finora
- Aprender A Leer y Escribir en La UniversidadDocumento11 pagineAprender A Leer y Escribir en La UniversidadJohan GalloNessuna valutazione finora
- CormófitosDocumento15 pagineCormófitosLina salgadoNessuna valutazione finora
- Taller1CálculoDiferencial PDFDocumento3 pagineTaller1CálculoDiferencial PDFLina salgadoNessuna valutazione finora
- Guía AdjetivosDocumento2 pagineGuía AdjetivosLina salgadoNessuna valutazione finora
- GUIA 2. Primera Ley de La TermodinámicaDocumento3 pagineGUIA 2. Primera Ley de La TermodinámicaLina salgadoNessuna valutazione finora
- Guía SustantivoDocumento2 pagineGuía SustantivoLina salgadoNessuna valutazione finora
- Taller 2 Cálculo DiferencialDocumento2 pagineTaller 2 Cálculo DiferencialLina salgadoNessuna valutazione finora
- Aprender A Leer y Escribir en La UniversidadDocumento11 pagineAprender A Leer y Escribir en La UniversidadJohan GalloNessuna valutazione finora
- Conclusión PDFDocumento1 paginaConclusión PDFLina salgadoNessuna valutazione finora
- 1 22Documento1 pagina1 22Lina salgadoNessuna valutazione finora
- METABOLISMODocumento18 pagineMETABOLISMOLina salgadoNessuna valutazione finora
- Formato Trabajo Grado PDFDocumento1 paginaFormato Trabajo Grado PDFLina salgadoNessuna valutazione finora
- 136 MonDocumento5 pagine136 MonLina salgadoNessuna valutazione finora
- CormófitosDocumento15 pagineCormófitosLina salgadoNessuna valutazione finora
- Diseño Páginas WebDocumento2 pagineDiseño Páginas WebLina salgadoNessuna valutazione finora
- Guia 1. Mecanica de FluidosDocumento3 pagineGuia 1. Mecanica de FluidosLina salgadoNessuna valutazione finora
- Folle ToDocumento2 pagineFolle ToGaby Kt Rocha RuizNessuna valutazione finora
- 1 22Documento1 pagina1 22Lina salgadoNessuna valutazione finora
- Macro MoleDocumento14 pagineMacro MoleLina salgadoNessuna valutazione finora
- MacromoléculasDocumento14 pagineMacromoléculasLina salgadoNessuna valutazione finora
- BacteriasDocumento51 pagineBacteriasLina salgadoNessuna valutazione finora
- La EvoluciónDocumento31 pagineLa EvoluciónLina salgadoNessuna valutazione finora
- Manual de Practicas Qoiii 21-IDocumento87 pagineManual de Practicas Qoiii 21-IPaula Leonor Vera SánchezNessuna valutazione finora
- Ejercicios de TermoquímicaDocumento1 paginaEjercicios de TermoquímicaRonaldo Chiche SurcoNessuna valutazione finora
- BIOMOLECULASDocumento11 pagineBIOMOLECULASBRAYAN STEVEN MORENO SANCHEZNessuna valutazione finora
- PASN03-Guía Trabajo Práctico Materia Organica en El Suelo y Degradación de SueloDocumento5 paginePASN03-Guía Trabajo Práctico Materia Organica en El Suelo y Degradación de Suelojesus sanchezNessuna valutazione finora
- Cuaderno Practico 2011Documento103 pagineCuaderno Practico 2011Natty RiveraNessuna valutazione finora
- Cuaderno Trabajo Quimica II FEB2021-En LineaDocumento101 pagineCuaderno Trabajo Quimica II FEB2021-En Lineaalberto ayala0% (1)
- Cadena de Transporte de ElectronesDocumento67 pagineCadena de Transporte de ElectronesViviana LunaNessuna valutazione finora
- Acabados - Claudia SandovalDocumento62 pagineAcabados - Claudia SandovalcjcelysNessuna valutazione finora
- Obtención Del HierroDocumento2 pagineObtención Del HierroALEX LYNDON ESPINOZA CHANENessuna valutazione finora
- Resumen Cápítulo #2 y #3Documento29 pagineResumen Cápítulo #2 y #3Erika FigueroaNessuna valutazione finora
- Nomenclatura de OxidosDocumento2 pagineNomenclatura de OxidosFernando JoseNessuna valutazione finora
- EjerciciosDocumento10 pagineEjerciciosAntonio Garcia de DiegoNessuna valutazione finora
- ALCANOSDocumento7 pagineALCANOSCL CarmenNessuna valutazione finora
- Taller 1 Nivelatorio 2021-1Documento3 pagineTaller 1 Nivelatorio 2021-1Pablo ZapataNessuna valutazione finora
- Apuntes de Contaminación Y EcotoxicologiaDocumento14 pagineApuntes de Contaminación Y EcotoxicologiaGabriela MercadoNessuna valutazione finora
- Introducción A La QuímicaDocumento280 pagineIntroducción A La QuímicaLorena CarrizoNessuna valutazione finora
- Metalurgia para La Obtención de ColtánDocumento18 pagineMetalurgia para La Obtención de ColtánCarlos VergaraNessuna valutazione finora
- Acabados HumedosDocumento5 pagineAcabados HumedosAlfred YanaNessuna valutazione finora
- D. Célula: Biología, NP AsesorDocumento7 pagineD. Célula: Biología, NP AsesorClender ChaconNessuna valutazione finora
- Informe 4 - 2022Documento19 pagineInforme 4 - 2022Ancco PampaNessuna valutazione finora
- Practica 3Documento15 paginePractica 3Pablo Alberto Torres TellezNessuna valutazione finora
- Química ÁngelDocumento1 paginaQuímica ÁngeljoeNessuna valutazione finora
- Acidos CarboxilicosDocumento9 pagineAcidos CarboxilicosJuan camilo Rosero acostaNessuna valutazione finora
- Taller de Biomoleculas 2-18Documento2 pagineTaller de Biomoleculas 2-18nicolasNessuna valutazione finora
- Informe de Acidos CarboxilicosDocumento13 pagineInforme de Acidos CarboxilicosperxyNessuna valutazione finora
- Taller de NivelaciónDocumento2 pagineTaller de NivelaciónCLAUDIA PRIETONessuna valutazione finora
- Sintesis de La P-NitroacetanilidaDocumento1 paginaSintesis de La P-NitroacetanilidaCAMILO JOS€ BERNAL RODRIGUEZNessuna valutazione finora
- Guia QMC 200Documento10 pagineGuia QMC 200Miguel Angel Mamani AliNessuna valutazione finora
- Formulacion Inorganica CON SOLUCION PDFDocumento2 pagineFormulacion Inorganica CON SOLUCION PDFValentina MustNessuna valutazione finora
- Enlace QuimicoDocumento16 pagineEnlace QuimicoJ Joel MamaniNessuna valutazione finora