Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Ejercicios de Estructura Cristalina Resueltos
Caricato da
venom_alexTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Ejercicios de Estructura Cristalina Resueltos
Caricato da
venom_alexCopyright:
Formati disponibili
lOMoARcPSD|3804226
Ejercicios-de-estructura-cristalina resueltos
Cálculo Diferencial (Instituto Tecnológico de Tijuana)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
EJERCICIOS PROPUESTOS
1. El radio atómico del níquel CCC es 1.243 Å. Calcular: a) el
parámetro de red y b) la densidad del níquel, si se sabe que la masa atómica
del níquel es de 58.71 g/mol.
Datos:
a0 1.243 Å
M 58.71g/mol
Átomos/celda 4 átomos (por teoría)
N. de Avogadro 6.02x1023 átomos / mol
Solución:
a) Parámetro de red. En la celda CCC los átomos se contactan entre
si a través de la diagonal de las caras del cubo, de forma que la relación
entre la longitud del lado de cubo a0 y el radio atómico r es:
4r
2a 0 4r o bien a 0 (1)
2
Entonces, sustituyendo los datos en la relación anterior
4(1.243x10 8 cm)
a0
2
a0 3.5157x10-8 cm
b) Densidad. Para determinar la densidad del níquel, basta con
calcular el volumen de celda y sustituir su valor con los datos en la relación:
(número de átomos/cel da)(masa atómica)
(2)
( volumen de celda)(núm ero de Avogadro)
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Cálculo del volumen de celda: Por ser una celda cúbica los valores de lados
son iguales, de manera que el volumen viene dado por:
3
Volumen de celda a0
Volumen de celda (3.5157x10 8 )3
Volumen de celda 4.3455x10-23 cm3
Ahora bien, sustituyendo en (2)
( 4 átomos)(58.71g/mol)
( 4.3455x10 23 cm3 )(6.02x1023 átomos / mol)
8.977g / cm3
2. La densidad del potasio, que tiene una estructura CC y un átomo
por punto de red es 0.855 g/cm3. La masa atómica del potasio es 39.09
g/mol. Calcule:
a) el parámetro de red y
b) el radio atómico del potasio
Solución:
Datos:
0.855 g/cm3
Masa atómica 39.09 g/mol
Átomos/celda 2 átomos (por teoría)
N. de Avogadro 6.02 x 1023 átomos / mol
a) Parámetro de red. Como el potasio tiene una estructura cúbica, su
3
volumen de celda a0 , el cual puede obtenerse a través de la relación:
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
(átomos/ce lda)(masa atómica)
(volumen de celda)(núm ero de Avogadro)
donde:
(átomos/ce lda)(masa atómica)
volumen de celda
(número de Avogadro)
Entonces, sustituyendo los valores:
(2 átomos)(39.09 g/mol)
volumen de celda
(0.855 g/cm3 )(6.02 x 1023 átomos/mol)
volumen de celda 1.5189 x 10-22 cm3
3
y como volumen de celda a0 , despejando se obtiene el parámetro de red
a0 3
volumen de celda
a0 3
1.5189 x 10-22 cm3 a0 5.3355 x 10-8 cm
a0 5.3355 Å
b) Radio atómico. Como en la celda CC los átomos se contactan
entre si a través de la diagonal del cubo, la relación entre la longitud de la
diagonal de cubo a0 y el radio atómico r es: 3a0 4r , por lo que el radio
atómico puede calcularse despejando dicha relación
3a 0
r
4
3 (5.3355 x 10-8 cm)
r
4
r 2.3103 x 10-8 cm ó 2.3103 Å
3. Un metal con una estructura cúbica tiene una densidad de 1.892
g/cm3, un peso atómico de 132.91 g/mol y un parámetro de red de 6.13 Å. Un
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
átomo asociado a cada punto de la red. Determinar la estructura cristalina del
metal.
Solución:
Datos:
1.892 g/cm3
Masa atómica 132.91g/mol
a0 6.13 Å
N. de Avogadro 6.02x1023 átomos / mol
Para determinar la estructura cristalina y en base a los datos obtenidos,
basta con calcular el número de átomos por celda.
De la formula de densidad, se tiene
(átomos/ce lda)(masa atómica)
(volumen de celda)(núm ero de Avogadro)
(volumen de celda)(núm ero de Avogadro)
átomos/cel da (1)
masa atómica
Cálculo de volumen de celda. Como el metal tienen una estructura
3
cúbica, el volumen de celda a0 , entonces:
volumen de celda (6.13 x 10-8 cm)3
volumen de celda 2.3035 x 10-22 cm3
Una vez determinado el volumen de celda y con los datos obtenidos,
determinamos el tipo de estructura sustituyendo en la relación (1)
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
(volumen de celda)(número de Avogadro)
átomos/celda
masa atómica
(1.892 g/cm )(2.3035 x 10-22 cm·3 )(6.02 x 1023 átomos / mol)
3
átomos/celda
(132.91g/mol)
átomos / celda 1.974 átomos 2 átomos
Finalmente, en base al resultado, se puede decir que el metal tiene una
estructura CC
4. El galio tiene una estructura ortorrómbica, con a 0=0.45258 nm,
b0=0.45186 nm y c0=0.76570 nm. El radio atómico es 0.1218 nm. La
densidad es de 5.904 g/cm3 y la masa atómica es de 69.72 g/mol. Determine
a) el número de átomos en cada celda unitaria y
b) el factor de empaquetamiento de la celda unitaria
Solución:
Datos:
a0 0.45258 nm
b0 0.45186nm
c0 0.76570nm
5.904 g/cm3
Masa atómica 69.72 g/mol
N. de Avogadro 6.02 x 1023 átomos/mol
a) Número de átomos por celda. Se determinan despejándolos de la
relación de densidad
(átomos/ce lda)(masa atómica)
(volumen de celda)(núm ero de Avogadro)
(volumen de celda)(núm ero de Avogadro)
átomos/cel da (1)
masa atómica
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Cálculo del volumen de celda. Para determinar el volumen se
multiplican cada uno de los parámetros de red, es decir
volumen de celda a 0 x b 0 x c 0
volumen de celda (0.45258 x 10-7 cm)(0.45186 x 10-7 cm)(0.76570 x 10-7 cm)
volumen de celda 1.5659 x 10-22 cm3
ahora, sustituyendo los valores en (1)
(volumen de celda)(número de Avogadro)
átomos/celda
masa atómica
(5.904 g/cm )(1.5659 x 10-22 cm3 )(6.02 x 1023 átomos/mol)
3
átomos/celda
69.72 g/mol
átomos / celda 7.98 átomos 8 átomos
b) Factor de empaquetamiento. Se calcula por medio de la relación
(átomos / celda )( volumen de átomo)
FE (2)
(volumen de celda)
Cálculo del volumen de átomo. Considerando a los átomos
como esferas rígidas, se obtiene a través de la expresión
4 3
volumen de átomo r
3
4
volumen de átomo (0.1219 x 10 -7 cm)3
3
volumen de átomo 7.5875 x 10 -24 cm3
Ahora bien, sustituyendo los datos en la ecuación (2)
(8)( 7.5875 x 10 -24 cm3 )
FE
(1.5659 x 10 -22 cm3 )
FE 0.3876
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
5. Una de las formas del manganeso tiene un radio atómico de 1.12
Å, un parámetro de red de 8.931 Å, y un factor de empaquetamiento de
0.479. ¿Cuántos átomos hay en la celda unitaria?
Datos:
r 1.12 Å 1.12 x 10 -8 cm
a0 8.931 Å 8.931 x 10 -8 cm
FE 0.479
Solución: En base a los datos suministrados, el número de átomos por celda
unitaria se puede obtener mediante un simple despeje de la expresión:
(átomos / celda)(volumen de átomo)
FE
volumen de celda
(FE)(volumen de celda)
átomo/celda (1)
volumen de átomo
Para ello, se determinan el volumen de átomos y el volumen de celda
Cálculo del volumen de átomo: Considerando a los átomos como
esferas sólidas
4 3
volumen de átomo r
3
4
volumen de átomo (1.12 x 10- 8 cm)3
3
volumen de átomo 5.8849 x 10- 24 cm3
Cálculo del volumen de celda:
volumen de celda a 0 3
volumen de celda (8.931x 10 -8 cm) 3
volumen de celda 7.1236 x 10 -22 cm 3
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Sustituyendo en (1)
(0.479)(7.1236 x 10-22 cm3 )
átomo/celda
5.8849 x 10-24 cm3
átomo/celda 57.98
átomos/celda 58 átomos
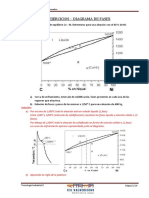
Determine los índices de Miller correspondientes a las direcciones de la
celda cúbica que aparece en la figura
z
3/4
A y
1/2
Solución:
Dirección A
1) Se determinan coordenadas iniciales (1,0,0) y coordenadas finales
(0,0,1)
2) Se restan las coordenadas finales menos las iniciales:
(0,0,1) (1,0,0) - 1, 0, 1
3) No hay fracciones por simplificar o enteros por reducir
4) [1 0 1]
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Dirección B
1) Se determinan coordenadas iniciales (1/2,1,0) y coordenadas
finales (1,0,1)
2) Se restan las coordenadas finales menos las iniciales:
(1,0,1) (1/ 2,1,0) - 1/2, - 1, 1
3) Se simplifican fracciones: 2( 1 2, 1, 1) 1, - 2, 2
4) [1 2 2]
Dirección C
1) Se determinan coordenadas iniciales (0,3/4,1) y coordenadas
finales (1,0,0)
2) Se restan las coordenadas finales menos las iniciales:
(1,0,0) (0, 3 4 ,1) 1, - 3 4,-1
3) Se simplifican fracciones: 4( 1, 3 4 , - 1) 4, - 3, - 4
4) [ 4 3 4]
6. Determine los índices para los planos de la celda unitaria cúbica
que aparece en la figura
z
1/3
B y
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Solución:
Plano A
1) Se deberá mover el origen, ya que el plano pasa a través de 0,
0,0. Se mueve también el origen un parámetro de red en la dirección “y” (ver
figura). Entonces x 1, y -1, z 1
y
Y
2) Se determinan los recíprocos de las intersecciones:
1 1 1
1; 1; 1
x y z
3) No hay fracciones que simplificar
4) (111)
Plano B
1) Se determinan las intersecciones: x , y 1 3, z
2) Se determinan los recíprocos de las intersecciones:
1 1 1
0; 3; 0
x y z
3) No hay fracciones que simplificar
4) (0 3 0)
10
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
7. Un vector dirección pasa a través de cubo unidad (o celda unitaria)
desde la posición ( 1 , 0, 1 ) a la ( 1 , 3 , 1) . ¿Cuáles son los índices de
4 4 4 4
dirección?
Solución: Se sigue el mismo procedimiento que el presentado en el ejercicio
5
1) Se restan las coordenadas finales menos las iniciales:
1 , 3 ,1 1 , 0, 1 0, 3 , 3
4 4 4 4 4 4
2) Se simplifican fracciones: 4 0, 3 , 3 0, 3, 3
4 4
3) [0 3 3]
8. Dibuje los vectores dirección en celdas unitarias para las
siguientes direcciones cúbicas: a) [111] ; b) [121] y c) [110]
Solución:
Para [111] : Las coordenadas de posición para la dirección son (1,-
1,-1). Para su representación tendrá que llevarse el origen del vector
dirección al vértice inferior izquierdo de la parte trasera del cubo.
O
Nuevo origen
11
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Para la dirección [121] : Las coordenadas posición para la
dirección, se obtienen dividiendo los índices de dirección por 2 de modo que
puedan estar dentro de la celda unitaria. Son,
por tanto 1 , 1, - 1
2 2
z
1/2
y
1/2
Para la dirección [110] : La coordenadas posición para la dirección,
son (1,-1,0). El origen del vector dirección tiene que llevarse al vértice inferior
izquierda de la parte trasera del cubo.
Nuevo origen
O
y
9. Determine los índices de Miller del plano cristalino cúbico que
cortan las siguientes coordenadas de posición: (0,0, 12 ); (1,0,0); ( 12 , 14 ,0)
Solución: Primero, se localiza como A, B y C las tres coordenadas de
posición tal como se indica en la figura
12
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
D
Y
C
B
X
A continuación, se unen B y C y se prolonga BC hasta D, y se unen A y
B. Por último, se unen A y D hasta completar el plano ABD. El origen para
este plano en el cubo puede ser elegido en E, que da las intersecciones
axiales con el plano ABD en x 1, y 1 2, z 1 2 . Los recíprocos de estas
intersecciones axiales son: 1, 2, 2. No hay fracciones que eliminar y
finalmente, los índices de Miller para el plano dado: (12 2)
10. El hierro puro experimenta un cambio polimórfico de CC a CCC
calentándolo al pasar los 912 ºC. Calcular el cambio de volumen asociado
con el cambio de estructura de CC a CCC si a 912 ºC la celda unitaria CC
tiene un parámetro de red de 0.293 nm y la celda unitaria CCC 0.363 nm.
Datos:
Para CC
a0 0.293 nm
Átomos/celda 2 átomos (teoría)
Para CCC
a0 0.363 nm
Átomos/celda 4 átomos (teoría)
13
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Solución: El cambio volumétrico durante la transformación puede calcularse a
partir de datos cristalográficos. El volumen por átomo para la red cristalina
del hierro CC antes de transformarse es:
a0 3
VCC
2
(0.293 nm )3
Vcc
2
VCC 0.0251 nm 3
El volumen por átomo para la red cristalina CCC que tiene cuatro átomos por
celda unitaria es
a0 3
VCCC
4
(0.363 nm)3
Vccc
4
VCC 0.01196 nm3
El cambio porcentual en volumen durante la transformación CC a CCC,
viene dado por:
V. después de la transformación - V. antes de la transformación
V x 100%
V. antes de la transformación
V 0.01196nm3 0.01258nm3
x 100%
VCC 0.01258nm3
V
- 4.9%
VCC
Esto indica que el hierro se contrae al calentarse 4.9%
11. Un cristal único de un metal CCC está orientado de tal forma que
la dirección [001] es paralela a un esfuerzo aplicado de 5000 psi. Calcular el
14
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
esfuerzo cortante resultante que actúa sobre el plano de deslizamiento (111)
en las direcciones de deslizamiento [110] y [011].
Solución:
Para (111)/ [110]: Se aplica un esfuerzo normal en la dirección
[001] de la celda unitaria. Esto produce un ángulo de 90º (por inspección)
con la dirección de deslizamiento [110] y un ángulo con la normal al plano
(111) (dirección [111] por ser celda cúbica). En la gráfica se muestra lo
planteado anteriormente
[111]
[110]
x
Cálculo de : Aplicando identidades geométricas
[111]
a0
3a0
[110]
2a0
a0 1
Cos Ar cos
3a 0 3
54.76º
15
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Cálculo del esfuerzo cortante: Aplicando la relación cos . cos y
sustituyendo los valores obtenidos
5000psi(cos90º )(cos54.76º )
0
Para (111)/ [011]: Se aplica un esfuerzo normal en la dirección
[001] de la celda unitaria. Esto produce un ángulo con la dirección de
deslizamiento [011] y un ángulo con la normal al plano (111) (dirección
[111] por ser celda cúbica). En la gráfica se muestra lo planteado
anteriormente
[011]
[111]
Cálculo de : Aplicando identidades geométricas
[011]
a0
2a0
a0
a0
Cos Ar cos(1)
a0
45º
16
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Cálculo del esfuerzo cortante: Aplicando la relación cos . cos y
sustituyendo los valores obtenidos
5000 psi(cos 45 º )(cos 54 .76 º )
2040 psi
12. Determinar la distancia entre los planos adyacentes (121) en el
cobre, el cual tiene un parámetro de red de 3.615Å.
Solución: Sustituyendo los valores dados en la ecuación general
a0
d(h,k,l )
h2 k 2 l2
3.615 Å
d 121
12 2 2 12
d(121) 1.476 Å
13. El litio CC tiene un parámetro de red de 3.5089 x 10 -8 cm y
contiene una vacancia por cada 200 celdas unitarias. Calcule:
a) el número de vacancias por centímetro cúbico
b) la densidad del litio
Datos:
a0 3.5089 x 10 -8 cm
1
Vacancias
200
Masa atómica 6.94 g/mol (Por tabla)
. de Avogadro 6.02 x 10 23 átomos / mol
Solución:
17
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
a) Vacancias por centímetro cúbico: Para determinarlas, se emplea la
siguiente relación:
Vacancias Número de vacancias
(1)
3 Volumen de celda
cm
Cálculo del volumen de celda
volumen de celda a 0 3
volumen de celda (3.5089 x 10 -8 cm) 3
volumen de celda 4.32029 x 10 -23 cm 3
Sustituyendo
1
Vacancias 200
cm 3 4.32029 x 10 -23 cm3
Vacancias
1.157 x 10 20 Vacancias/ cm 3
3
cm
b) Densidad del litio. Se obtiene aplicando la relación de densidad.
Cálculo del número de átomos por celda. Considerando que la
celda presenta defectos, es necesario obtener el número de átomos (átomos
calculados), mediante la definición de vacancias y asumiendo que la celda en
condiciones normales presenta 2 átomos
Vacancias Átomos en condiciones normales - Átomos calculados
Átomos calculados Átomos en condiciones normales - Vacancias
1
Átomos calculados 2 -
200
Átomos calculados 1.995 átomos
Ahora sustituyendo en la relación de densidad
18
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
(átomos/celda)(masa atómica)
(volumen de celda)(número de Avogadro)
(1.995 átomos)(6.94g/mol)
(4.32029 x 10 -23 cm 3 )(6.02 x 10 23 átomos / mol)
0.5323 g/cm3
14. Una aleación de niobio se produce al introducir átomos
sustitucionales de tungsteno en la estructura CC; finalmente se produce una
aleación con un parámetro de red de 0.32554 nm y una densidad de 11.95
g/mol. Calcular la fracción de átomos de tungsteno dentro de la aleación.
Datos:
a0 0.32554 nm 0.32554 x 10-7 cm
11.95 g/mol
Masa atómica del niobio 92.91 g/mol
Solución: Para determinar la fracción de átomos de tungsteno dentro de la
aleación, se debe obtener primeramente el número de átomos por celda
unitaria de la aleación, el cual se calcula a partir de la relación de densidad.
(átomos/celda)(masa atómica)
(volumen de celda)(número de Avogadro)
(volumen de celda)(número de Avogadro)
átomos / celda (1)
masa atómica del niobio
Cálculo del volumen de celda: Por ser una celda cúbica los valores
de lados son iguales, de manera que el volumen viene dado por:
volumen de celda a 0 3
volumen de celda (0.32554 x 10 -7 cm) 3
volumen de celda 3.44995 x 10 -23 cm 3
Una vez determinado el volumen de celda, se sustituye en (1)
19
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
(11.95 g/mol)(3.44995 x 10 -23 cm3 )(6.02 x 10 23 átomos/mol)
átomos / celda
92.91g/mol
átomos/celda 2.671átomos
Una vez conseguidos el número de átomos por celda unitaria de la aleación,
se emplea la definición de átomos sustitucionales para determinar así, el
número de átomos de tungsteno introducido en la aleación
átomos sustitucionales átomos en condicione s normales átomos de tungsteno (2)
Es importante destacar, que los átomos sustitucionales representa el
número de átomos por celda en la aleación y los átomos en condiciones
normales son el número de átomos por red cristalina en una celda CC (2
átomos). De ahí que el número de átomos por celda de tungsteno se calcula
a través de un simple despeje de la expresión (2)
átomos de tungsteno átomos sustitucionales - átomos en condiciones normales
átomos de tungsteno 2.671átomos - 2 átomos
átomos de tungsteno 0.671átomos
Cálculo de la fracción de átomos de tungsteno: Se miden por
medio de la relación siguiente
átomos de tungsteno
Fracciónde átomos
átomos en condiciones normales
0.671átomos
Fracciónde átomos
2 átomos
Fracciónde átomos 0.335
20
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
15. El platino CCC tiene una densidad de 21.45 g/cm3 y un parámetro
de red de 3.9231 Å. En promedio ¿qué porcentaje de los puntos de red
contiene vacantes? (asúmase un átomo por punto de red)
Datos:
21.45 g/cm3
a0 3.9232 Å 3.9232 x 10 -8 cm
Masa atómica 195.09 g/mol (tabla)
N. de Avogadro 6.02 x 10 23 átomos / mol
Puntos de red 4 (teoría)
Solución: Para saber el número de vacancias, es necesario determinar el
número de átomos por celda, el cual se determina despejándolo de la
expresión de densidad
(átomos/celda)(masa atómica)
(volumen de celda)(número de Avogadro)
(volumen de celda)(número de Avogadro)
átomos / celda (1)
masa atómica
Cálculo del volumen de celda: Por ser una celda cúbica los valores
de lados son iguales, de manera que el volumen viene dado por:
volumen de celda a 0 3
volumen de celda (3.9231x 10 -8 cm) 3
volumen de celda 6.0379 x 10 -23 cm 3
Sustituyendo en (1)
(21.45 g/cm3 )(6.0379 x 10 -23 cm 3 )(6.02 x 10 23 átomos/mol)
átomos / celda
195.09 g/mol
átomos/celda 3.9964529 átomos
21
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Como puede observarse, de haber 4 átomos/celda sería un cristal
perfecto de platino; de aquí la diferencia se debe a la presencia de vacantes.
Para obtener el número de vacantes se aplica la definición
Vacancias Átomos en condiciones normales - Átomos calculados
Vacancias 4 - 3.9964529
Vacancias 0.0035471
Cálculo del porcentaje de vacantes por puntos de red: Se obtienen
a través de:
Vacantes 0.0035471
Ptos de red 4
Vacantes
0.000886
Ptos de red
16. Determinar el ángulo de un borde de grano de ángulo pequeño
en el cobre CCC cuando las dislocaciones están separadas 1000 Å. El
parámetro de red del cobre es de 3.615 Å.
Datos:
a0 3.615 Å
D 1000 Å
Direccióncompacta [110] (Teoría)
Solución: Los granos se encuentran inclinados un vector de Burgers en cada
dirección cada 1000 Å. El vector de Burgers en el cobre CCC es [110], de
manera que la longitud del vector de Burgers es de d110 (distancia
interplanar)
22
Descargado por Alexis Vergara (aavergara@gmail.com)
lOMoARcPSD|3804226
Elaborado por: Ing. Roger J. Chirinos
Tomados de los libros de Askeland y Smith
Primero de 2012
Cálculo de la longitud del vector de Burgers: Se determina
mediante la relación
b
a0
d (h,k,l)
h2 k 2 l2
3.615 Å
d110
D 12 12 02
d110 2.557 Å
Cálculo del ángulo : Aplicando identidades trigonométricas
b
Sen
2 D
2.557 Å
Sen
2 1000 Å
Sen 0.002557
2
0.293º
23
Descargado por Alexis Vergara (aavergara@gmail.com)
Potrebbero piacerti anche
- Ejercicios de Estructura Cristalinaresueltos 171129042918Documento30 pagineEjercicios de Estructura Cristalinaresueltos 171129042918Julian Andres Gorron50% (2)
- Interfases y Superficies.Documento8 pagineInterfases y Superficies.marianaNessuna valutazione finora
- Ejercicios de Estructura Cristalina ResueltosDocumento23 pagineEjercicios de Estructura Cristalina ResueltosPatricio Robles55% (11)
- Arranques InundadosDocumento3 pagineArranques InundadosElkin Javier Palacio MartinezNessuna valutazione finora
- Ejercicios Resueltos Diagrama de Fases IES ValdehierroDocumento21 pagineEjercicios Resueltos Diagrama de Fases IES ValdehierroAnaNessuna valutazione finora
- Procesos de ManufacturaDocumento61 pagineProcesos de ManufacturaDanilo ZapataNessuna valutazione finora
- Atlas de Fractografía ASMDocumento2 pagineAtlas de Fractografía ASMJorge Humberto Flores AvilaNessuna valutazione finora
- Taller Ley de FickDocumento20 pagineTaller Ley de FickjohanaNessuna valutazione finora
- P12 Mci Reyes Romualdo HeliatDocumento32 pagineP12 Mci Reyes Romualdo HeliatNicolas VelascoNessuna valutazione finora
- Defectos e ImperfeccionesDocumento40 pagineDefectos e ImperfeccionesKattia Vazquez80% (5)
- Unidad2-Propiedades Mecánicas-Parte 2Documento93 pagineUnidad2-Propiedades Mecánicas-Parte 2Cristian Junior Incacutipa PerezNessuna valutazione finora
- Práctica 9 Temple y RevenidoDocumento3 paginePráctica 9 Temple y RevenidoFernando RodasNessuna valutazione finora
- Practica 6Documento24 paginePractica 6Nicolas VelascoNessuna valutazione finora
- Taller TI-NSPIRE CX CASDocumento46 pagineTaller TI-NSPIRE CX CASvenom_alexNessuna valutazione finora
- Metalografia de Un Acero 1020Documento8 pagineMetalografia de Un Acero 1020EDWIN ANDRES RAMOS NIÑONessuna valutazione finora
- Solidificacion e Imperfecciones Taller Francisco de Los ReyesDocumento17 pagineSolidificacion e Imperfecciones Taller Francisco de Los ReyesThomas Martinez0% (1)
- Determinacion Del Tamaño Del Grano AstmDocumento7 pagineDeterminacion Del Tamaño Del Grano AstmXander HingisNessuna valutazione finora
- Tipos de Ensayo para MaterialesDocumento49 pagineTipos de Ensayo para MaterialeseduardoadiazNessuna valutazione finora
- Victor Hugo Beristain Colorado - PROBLEMAS - ALEACIÓN - CDLM - 2020Documento4 pagineVictor Hugo Beristain Colorado - PROBLEMAS - ALEACIÓN - CDLM - 2020Victor Hugo Beristain ColoradoNessuna valutazione finora
- Mecanizado de Piezas FresadoraDocumento25 pagineMecanizado de Piezas FresadoraAngelNessuna valutazione finora
- Ejercicio 04Documento16 pagineEjercicio 04Energya CorporacionNessuna valutazione finora
- Defectos Cristalinos 2015 1Documento37 pagineDefectos Cristalinos 2015 1Fernando Paez Mendizabal100% (1)
- Problemas CharpyDocumento9 pagineProblemas CharpysulayNessuna valutazione finora
- Practica 2 Quimica Esime Zacatenco CristalesDocumento8 paginePractica 2 Quimica Esime Zacatenco CristalesADADNARUTONessuna valutazione finora
- Practica 1 Estructuras y Defectos CristalinosDocumento24 paginePractica 1 Estructuras y Defectos CristalinosAlan HernándezNessuna valutazione finora
- Diagrama de Fases IsomorfosDocumento29 pagineDiagrama de Fases IsomorfosEMILIANO MAXIMO FUENTES ORTIZ100% (1)
- 5 4Documento3 pagine5 4Alvaro50% (2)
- Taller Difracción de Rayos XDocumento9 pagineTaller Difracción de Rayos XReynaldo Andres Reyes GualteroNessuna valutazione finora
- Práctica-04 G2Documento4 paginePráctica-04 G2user1995Nessuna valutazione finora
- CPR Cticas t3Documento3 pagineCPR Cticas t3Yojan Alejandro QuintalNessuna valutazione finora
- T3 CienciasDocumento6 pagineT3 CienciasJosh FuentesNessuna valutazione finora
- NitalDocumento2 pagineNitalvampiredraak2712Nessuna valutazione finora
- Ejercicio SchmidDocumento1 paginaEjercicio SchmidOscar SolisNessuna valutazione finora
- Informe de TemplabilidadDocumento8 pagineInforme de TemplabilidadJorge Armando Veloza NuñezNessuna valutazione finora
- Analizar La Diferencia Entre Maclaje y Deslizamiento: Deformación Por DeslizamientoDocumento4 pagineAnalizar La Diferencia Entre Maclaje y Deslizamiento: Deformación Por DeslizamientoLucia JayaNessuna valutazione finora
- Control de La Microestructura y Propiedades Mecánicas deDocumento31 pagineControl de La Microestructura y Propiedades Mecánicas deRoxana VargasNessuna valutazione finora
- Taller Numero 2 MaterialesDocumento10 pagineTaller Numero 2 MaterialesDiego GonzalezNessuna valutazione finora
- Estructura y Geometría CristalinaDocumento8 pagineEstructura y Geometría CristalinaPabloNessuna valutazione finora
- Trabajo #2 (Grupal)Documento15 pagineTrabajo #2 (Grupal)RAFAEL ANTHONY SANCHEZ COLLQUENessuna valutazione finora
- Choque TérmicoDocumento4 pagineChoque TérmicojaumeNessuna valutazione finora
- Unidad 1 - Parte ADocumento66 pagineUnidad 1 - Parte AKarla RamirezNessuna valutazione finora
- U-5 Ing de Matls Tratamientos Termoquímicos y Superficiales de Los AcerosDocumento62 pagineU-5 Ing de Matls Tratamientos Termoquímicos y Superficiales de Los AcerosRicardo Fabela25% (4)
- Indices de MillerDocumento30 pagineIndices de MillerAndrea PeñaNessuna valutazione finora
- 003 - Defectos CristalinosDocumento31 pagine003 - Defectos CristalinosSelene CancelareNessuna valutazione finora
- Cuestionario Difracción de Rayos XDocumento2 pagineCuestionario Difracción de Rayos XDIANA LAURA TREJO GODOYNessuna valutazione finora
- T2 Ejercicio3 20030085 IscDocumento3 pagineT2 Ejercicio3 20030085 IscSanchez EricksonNessuna valutazione finora
- Tarea de Unidad 2Documento3 pagineTarea de Unidad 2ironalejanNessuna valutazione finora
- UNIDAD 13 - MC 118-2019-2 Mat. Comp - CLASEDocumento66 pagineUNIDAD 13 - MC 118-2019-2 Mat. Comp - CLASElides fernandez saldivarNessuna valutazione finora
- Aplicacion Diseño de Sistemas de EngranajesDocumento3 pagineAplicacion Diseño de Sistemas de EngranajesMaría Gabriela MantillaNessuna valutazione finora
- Tarea MaterialesDocumento4 pagineTarea MaterialesCristhian CarrilloNessuna valutazione finora
- Guia de Probabilidad ArveloDocumento42 pagineGuia de Probabilidad ArveloFernando de LeonNessuna valutazione finora
- Laboratorio 03 - Laminado de Fibra de Vidrio y Matriz PoliésterDocumento4 pagineLaboratorio 03 - Laminado de Fibra de Vidrio y Matriz PoliésterRobert Antony Alvarado Marquina100% (1)
- Tema2 EnlaceAtomicoDocumento47 pagineTema2 EnlaceAtomicoMabel Pezo MeléndezNessuna valutazione finora
- Curva de MagnetizaciónDocumento9 pagineCurva de MagnetizaciónMario ClairgueNessuna valutazione finora
- Ensayo Flexion Informe de Laboratorio PDFDocumento8 pagineEnsayo Flexion Informe de Laboratorio PDFRomel ArteagaNessuna valutazione finora
- Aputes de SolidifaciónDocumento37 pagineAputes de SolidifaciónCaballero RrzNessuna valutazione finora
- Taller Materiales PlanosDocumento5 pagineTaller Materiales Planossebastian mejia cabralesNessuna valutazione finora
- 4340Documento2 pagine4340Carlos G. Rodríguez100% (1)
- Guia 4 Solidos CelularesDocumento4 pagineGuia 4 Solidos CelularesCesar Jhovanny PaezNessuna valutazione finora
- JederDocumento3 pagineJederJefer Vega100% (1)
- Defectos SuperficialesDocumento11 pagineDefectos SuperficialesAndres HernandezNessuna valutazione finora
- Ejercicios de Estructura Cristalina ResueltosDocumento23 pagineEjercicios de Estructura Cristalina Resueltospeloduro1010Nessuna valutazione finora
- Flutter en Avión F-117Documento5 pagineFlutter en Avión F-117venom_alexNessuna valutazione finora
- Generalidades Motor ROTAX914UL3Documento11 pagineGeneralidades Motor ROTAX914UL3venom_alexNessuna valutazione finora
- Ejercicio 5 AeroelasticidadDocumento3 pagineEjercicio 5 Aeroelasticidadvenom_alexNessuna valutazione finora
- Introducción A La DinámicaDocumento8 pagineIntroducción A La Dinámicavenom_alexNessuna valutazione finora
- Guia 2 Metodos EnergeticosDocumento2 pagineGuia 2 Metodos Energeticosvenom_alexNessuna valutazione finora
- Resistencia de Materiales Básica para Estudiantes de IngenieríaDocumento60 pagineResistencia de Materiales Básica para Estudiantes de Ingenieríavenom_alexNessuna valutazione finora
- Balance Diferencial de MomentumDocumento31 pagineBalance Diferencial de Momentumvenom_alex100% (1)
- Mecánica de Fluidos, Conservación de MasaDocumento32 pagineMecánica de Fluidos, Conservación de Masavenom_alexNessuna valutazione finora
- Mecánica de Fluidos, Conservación de MasaDocumento32 pagineMecánica de Fluidos, Conservación de Masavenom_alexNessuna valutazione finora
- Momentum Lineal y ChoquesDocumento15 pagineMomentum Lineal y Choquesvenom_alex0% (1)
- Proyecto de 404 Biopolimeros A Partir Del Almidon de YucaDocumento30 pagineProyecto de 404 Biopolimeros A Partir Del Almidon de YucaKattita Mero0% (1)
- Guía TallerDocumento108 pagineGuía Talleralexander cordobaNessuna valutazione finora
- Docsity Solucion de Equilibrio QuimicoDocumento15 pagineDocsity Solucion de Equilibrio QuimicocaritoNessuna valutazione finora
- Ejercicios RedoxDocumento9 pagineEjercicios RedoxUnidad ControlNessuna valutazione finora
- Ácidos NucleicosDocumento8 pagineÁcidos Nucleicosmayerly jimenezNessuna valutazione finora
- NitrogenoDocumento5 pagineNitrogenoMartinPierantoniNessuna valutazione finora
- Modelos AtómicosDocumento2 pagineModelos Atómicosprofeafrancoh100% (2)
- Termoterapia PDFDocumento8 pagineTermoterapia PDFIvania Carolina Broca Bermudez0% (1)
- Informe CementoDocumento25 pagineInforme CementoLuis EscobedoNessuna valutazione finora
- PROBLEMA 3.14 y 3.17Documento5 paginePROBLEMA 3.14 y 3.17Yahir VillanuevaNessuna valutazione finora
- Presentacion ProcesosDocumento13 paginePresentacion ProcesosMajo Bulnes'Nessuna valutazione finora
- Cadena RespiratoriaDocumento1 paginaCadena RespiratoriaKeila MartinezNessuna valutazione finora
- CLASE 2 Tecnicas para Resolver Problemas (Ejercicios)Documento15 pagineCLASE 2 Tecnicas para Resolver Problemas (Ejercicios)Cayra MaydiNessuna valutazione finora
- Informe de Laboratorio 1 Corte ConducciónDocumento11 pagineInforme de Laboratorio 1 Corte ConducciónAndres MartinezNessuna valutazione finora
- Proceso de Sistematizacion PNF 2019Documento101 pagineProceso de Sistematizacion PNF 2019LISBETH PEREIRANessuna valutazione finora
- Bioflocs en AcuiculturaDocumento15 pagineBioflocs en AcuiculturaCellus Arenales Esquina PizarroNessuna valutazione finora
- Cuál Es La Diferencia Entre El Aceite Sintético y MineralDocumento2 pagineCuál Es La Diferencia Entre El Aceite Sintético y MineralDëlïnä Q. ČhämbîNessuna valutazione finora
- El Cloruro de ViniloDocumento2 pagineEl Cloruro de ViniloNatalia GonzalezNessuna valutazione finora
- Separacion de FasesDocumento25 pagineSeparacion de FasesjdangladNessuna valutazione finora
- Teorías Acido-BaseDocumento3 pagineTeorías Acido-BaseAlbertoNessuna valutazione finora
- Proyecto Final de PisDocumento40 pagineProyecto Final de PisAntHony ChaVezNessuna valutazione finora
- Fester A3 Blanco - Impermeabilizante Acrilico-Comprimido-1Documento3 pagineFester A3 Blanco - Impermeabilizante Acrilico-Comprimido-1Jose Manuel Martínez SuárezNessuna valutazione finora
- Evaporador Tipo Circulación Forzada (Introducción y Conclusión)Documento2 pagineEvaporador Tipo Circulación Forzada (Introducción y Conclusión)Oliver100% (1)
- Turbinium T v0 05.12.16Documento2 pagineTurbinium T v0 05.12.16JeefNessuna valutazione finora
- Equilibrio - Acido-BaseDocumento25 pagineEquilibrio - Acido-BaseStela MarisNessuna valutazione finora
- Enzima OGTDocumento11 pagineEnzima OGTM Mónica CamposNessuna valutazione finora
- Problemario Unidad 3Documento1 paginaProblemario Unidad 3Iridy Feria ReyesNessuna valutazione finora