Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Acordeon de Maurilio
Caricato da
Tano TGCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Acordeon de Maurilio
Caricato da
Tano TGCopyright:
Formati disponibili
Efecto inductivo: Si el átomo más electronegativo se une a una cadena de carbonos, por ejemplo, la carga
positiva es inducida en los átomos que forman esta cadena. A este fenómeno se le llama efecto inductivo
estático. El efecto de inducción de cargas también puede ser ejercido por un medio polar, en este caso el
fenómeno se denomina efecto inductivo dinámico.
La Resonancia (denominado también Mesomería) en química es una herramienta empleada (predominantemente en
química orgánica) para representar ciertos tipos de estructuras moleculares. La resonancia consiste en la combinación
lineal de estructuras de una molécula (estructuras resonantes) que no coinciden con la estructura real, pero que
mediante su combinación, nos acerca más a su estructura real.El efecto es usado en una forma cualitativa, y describe las
propiedades de atracción o liberación de electrones de los sustituyentes, basándose en estructuras resonantes
relevantes, y es simbolizada por la letra R o M (a veces también por la letra K). El efecto resonante o mesomérico es
negativo (-R/-M) cuando el sustituyente es un grupo que atrae electrones, y el efecto es positivo (+R/+M) cuando, a partir de la resonancia, el sustituyente es un grupo que
libera electrones.
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su
capacidad para atraerlos.
El efecto estérico (o efecto de la orientación) es un efecto descrito en la química orgánica causado por la influencia del volumen de un grupo funcional de una molécula en el
curso de una reacción química, en la conformación o en las interacciones intermoleculares de una molécula.
La energía de ionización, I, es la energía necesaria para arrancar un electrón a un átomo gaseoso, aislado y en estado fundamental. Los electrones se encuentran atraídos por el
núcleo y es necesario aportar energía para arrancarlos. Siempre se pierden los electrones de la última capa, que son los más débilmente atraídos por el núcleo.
Nomenclatura de alcoholes nomenclatura de aldehídos nomenclatura de Acidos carboxílicos
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen y también se produce por
Comportamiento de electrones, para alcanzar el octeto estable, compartiendo electrones del último nivel.
Un Enlace Iónico o electrovalente es el resultado de la presencia de atracción electrostática entre los iones de
distinto signo, es decir, uno fuertemente electropositivo y otro fuertemente electronegativo. Eso se da cuando en el
enlace, uno de los átomos capta electrones del otro.
Métodos de obtención
Reducción de aldehídos: Los aldehídos con hidrógeno y en presencia de
un catalizador como el níquel forman alcoholes primarios.
Combinando halogenuros de alquilo con hidróxidos fuertes.
Por reducción de ácidos:
A través del reactivo de Grignard:
El reactivo es el ioduro de alquil magnesio.
Este intermediario reacciona posteriormente con agua para dar yoduro
básico de Magnesio y el
alcohol buscado. En este
caso Propanol.
Propiedades Físicas: alcoholes
Son todos menos densos que el agua, aunque aumenta con el número
de carbonos.
Hasta el alcohol de 4 carbonos son líquidos, entre el 5 y el 11 son
aceitosos y después son sólidos.
El punto de ebullición aumenta con la cantidad de carbonos.
Los alcoholes de pocos carbonos son muy solubles en agua.
Los primeros poseen un olor particular.
Propiedades Químicas:
Combustión: Los alcoholes arden a la llama.
Reacción de canizzaro
Oxidación: Los alcoholes se oxidan con facilidad.
1. Protonación del acido esto aumenta la reactividad del acido
carboxílico
2. Ataque nucleofílico de la molecula de alcohol
3. El proton cambia de sitio hacia un grupo oh liberando agua
Si la oxidación continua se formara un ácido.
Reacción con metales alcalinos:
Reactivo de lucas
La prueba de Lucas, en los alcoholes es un ensayo químico para
Reacción con ácidos orgánicos: diferenciar entre alcoholes primarios, secundarios y terciarios. Se
basa en la diferencia en reactividad de los tres tipos de alcoholes
con halogenuros de hidrógeno.
Teoría Ácido-Base de Arrhenius
El concepto de ácido-base de Arrhenius clasifica una sustancia
como un ácido si produce iones hidrógeno H(+) o iones hidronio
H3O(+) en agua. Una sustancia se clasificará como una base si
produce iones hidróxido OH(-) en agua. Esta manera de definir
los ácidos y las bases funciona bien para las soluciones acuosas,
pero las propiedades de ácido y de base se observan en otros
entornos. Otras formas de clasificar las sustancias como ácidos o
bases son el concepto de Bronsted-Lowry y el concepto de Lewis.
Concepto de Ácido-Base de Bronsted-Lowry
La teoría de Bronsted-Lowry clasifica una sustancia como ácido si
actúa como donador de protones, y como una base si actúa como
aceptor de protones. Otras formas de clasificar las sustancias
como ácidos o bases son el concepto de Arrhenius y el concepto de
Lewis.
Concepto de Ácido-Base de Lewis
La teoría de Lewis clasifica una sustancia como ácido si actúa
como un aceptor de par de electrones y como una base si actúa
como un donador de par de electrones. Otras formas de clasificar
las sustancias como ácidos o bases son el concepto de Arrhenius, y
el concepto de Bronsted-Lowry.
Potrebbero piacerti anche
- Métodos de Separación de MezclasDocumento11 pagineMétodos de Separación de MezclasDavid Martin RobayoNessuna valutazione finora
- Anexo 2 - Tarea 3 - Grupo - 266 - Yulima - AcostaDocumento18 pagineAnexo 2 - Tarea 3 - Grupo - 266 - Yulima - Acostayulima1409Nessuna valutazione finora
- Anexo 2Documento17 pagineAnexo 2yulima1409Nessuna valutazione finora
- Resumen Acidos Bases y SalesDocumento22 pagineResumen Acidos Bases y SalesALIRIO LOPEZNessuna valutazione finora
- Erinson Marriaga Guias 2p Quimica Central Mañana 11-01Documento8 pagineErinson Marriaga Guias 2p Quimica Central Mañana 11-01MAYELITHNessuna valutazione finora
- Reacciones QuímicasDocumento28 pagineReacciones QuímicasAna GuerreroNessuna valutazione finora
- GLOSARIOS TODOS de JM QG FUN Nov 2020Documento7 pagineGLOSARIOS TODOS de JM QG FUN Nov 2020Victor AtzinNessuna valutazione finora
- Informe de Laboratorio Enlace QuimicoDocumento5 pagineInforme de Laboratorio Enlace QuimicoLuis Jorge Trujillo CespedesNessuna valutazione finora
- CONSULTA Acido y BasesDocumento7 pagineCONSULTA Acido y BasesDaniela AlejandroNessuna valutazione finora
- Apuntes de RXN QuímicaDocumento9 pagineApuntes de RXN QuímicaAneth MartínezNessuna valutazione finora
- à Cidos y Bases (1) - 2Documento27 pagineà Cidos y Bases (1) - 2SANTOS LUNA DALIA MONTSERRATNessuna valutazione finora
- Qui MicaDocumento3 pagineQui MicaEDWIN GUSQUINessuna valutazione finora
- DocumentoDocumento5 pagineDocumentohanoyed13Nessuna valutazione finora
- REDOXDocumento2 pagineREDOXMariel Ángeles Cruz MirandaNessuna valutazione finora
- Informe 8 Quimica LaboratorioDocumento13 pagineInforme 8 Quimica LaboratorioMarycielo Leaño LugoNessuna valutazione finora
- Bioqu ¡MicaDocumento147 pagineBioqu ¡MicaCrash PolloNessuna valutazione finora
- QUIMICA ORGANICA - Clubdelquímico UpaguDocumento361 pagineQUIMICA ORGANICA - Clubdelquímico UpaguMartin ToledoNessuna valutazione finora
- Alquenos 1aDocumento33 pagineAlquenos 1aCHRISTOPHER ANDERSON ROSALES FERNANDEZNessuna valutazione finora
- Her GlosarioDocumento8 pagineHer GlosarioSam Lopez TovarNessuna valutazione finora
- Portafolio de EvidenciasDocumento14 paginePortafolio de EvidenciasAndres MartinezNessuna valutazione finora
- Informe Nro 8Documento13 pagineInforme Nro 8Dayanna GuzmánNessuna valutazione finora
- Informe 8Documento21 pagineInforme 8Dayanna GuzmánNessuna valutazione finora
- Portafolio de EvidenciasDocumento29 paginePortafolio de EvidenciasAndres MartinezNessuna valutazione finora
- Practica 13 Lab OrganicaDocumento6 paginePractica 13 Lab OrganicaValerie SantamariaNessuna valutazione finora
- Quimica Taller 17Documento4 pagineQuimica Taller 17SANDRA NICOLE ZAVALA LORENTYNessuna valutazione finora
- 1 - Tema 1. Fundamentos BioquimicosDocumento13 pagine1 - Tema 1. Fundamentos BioquimicosVegelNessuna valutazione finora
- Alcoholes y FenolesDocumento3 pagineAlcoholes y FenolesLizz IzidroNessuna valutazione finora
- Clase 2 HoyDocumento45 pagineClase 2 HoyAlfredo José Batres MoralesNessuna valutazione finora
- Reacciones Químicas InorgánicasDocumento30 pagineReacciones Químicas InorgánicasJulissa TaviraNessuna valutazione finora
- Tarea de Quimica 20 de Febrero Del 2011Documento6 pagineTarea de Quimica 20 de Febrero Del 2011emr_30075% (4)
- RelationshipDocumento19 pagineRelationshipEvariet PereiraNessuna valutazione finora
- Investigacion Previa Alquenos y AlquinosDocumento7 pagineInvestigacion Previa Alquenos y AlquinosSalvador ZúñigaNessuna valutazione finora
- Guia 2 Quimica TareaDocumento5 pagineGuia 2 Quimica TareaMaria Jose Rivera MiraldaNessuna valutazione finora
- Informe N°2 (QM 135) - Propiedades Físicas y Químicas de Hidrocarburos Alifáticos y AromáticosDocumento16 pagineInforme N°2 (QM 135) - Propiedades Físicas y Químicas de Hidrocarburos Alifáticos y AromáticosRubén Gabriel Calderón GarcíaNessuna valutazione finora
- Info 1 Organica 3Documento8 pagineInfo 1 Organica 3enrique ferney yela martinezNessuna valutazione finora
- Quimica Civil 25.11.2021Documento6 pagineQuimica Civil 25.11.2021Ronaldo Eleazar Arcos LopezNessuna valutazione finora
- Conclusiones de Acuerdo A Las Capacidades-Informe 8Documento1 paginaConclusiones de Acuerdo A Las Capacidades-Informe 8jhonatanramosminano7Nessuna valutazione finora
- Clase de Acidos y BasesDocumento3 pagineClase de Acidos y BasesrobertoalfredocalonaNessuna valutazione finora
- Soluiones Electroliticas - DiandraDocumento15 pagineSoluiones Electroliticas - DiandraLisbeth CasasNessuna valutazione finora
- Ácidos y BasesDocumento2 pagineÁcidos y Basesdz.jazmin11Nessuna valutazione finora
- Síntesis Del BenzopinacolDocumento4 pagineSíntesis Del BenzopinacolEliecer GonzalezNessuna valutazione finora
- QUIMICA ANALÍTICA I-Equilibrio QuímicoDocumento85 pagineQUIMICA ANALÍTICA I-Equilibrio QuímicoWilliam Stiven Arias Arenas0% (1)
- informeREACCIONES QUÌMICASDocumento11 pagineinformeREACCIONES QUÌMICASBetsy RodriguezNessuna valutazione finora
- Equilibrio IonicoDocumento12 pagineEquilibrio IonicoZayetzi Martínez RomeroNessuna valutazione finora
- Oxidacion - ReduccionDocumento13 pagineOxidacion - Reduccionjose luis moncayoNessuna valutazione finora
- AlquenosDocumento9 pagineAlquenosruben.perezNessuna valutazione finora
- Proyecto Final GlosarioDocumento23 pagineProyecto Final GlosarioLeidy Laura HRNessuna valutazione finora
- Investigacion QuimicaDocumento4 pagineInvestigacion QuimicaGerardo Solano RodriguezNessuna valutazione finora
- Ecuaciones QuimicasDocumento30 pagineEcuaciones Quimicasjedaymc27Nessuna valutazione finora
- Equilibrio Iónico Angel Duarte Sec9Documento13 pagineEquilibrio Iónico Angel Duarte Sec9jeankeh perezNessuna valutazione finora
- Presentación 5 - Q. InorgánicaDocumento16 paginePresentación 5 - Q. InorgánicaMarlon Ed HernandezNessuna valutazione finora
- Informe 5Documento9 pagineInforme 5savillalobosfNessuna valutazione finora
- Informe # 2 - Química OrgánicaDocumento18 pagineInforme # 2 - Química OrgánicaGermán OrellanaNessuna valutazione finora
- Infografía Hidrocarburos AromáticosDocumento1 paginaInfografía Hidrocarburos Aromáticospatricia villalobos100% (1)
- Acido y BaseDocumento24 pagineAcido y BaseMaría CelesteNessuna valutazione finora
- DiccionaDiccionario Basico de Quimica AnaliticarioDocumento147 pagineDiccionaDiccionario Basico de Quimica AnaliticariokomodiemoNessuna valutazione finora
- Practica 4Documento19 paginePractica 4Mayra Virginia Aguilar GuzmanNessuna valutazione finora
- Informe N°4Documento27 pagineInforme N°4JACKELIN ROSARIO PAUCAR POMAHUALINessuna valutazione finora
- SectoresDocumento8 pagineSectoresTano TGNessuna valutazione finora
- Recibo de La ErmitaDocumento2 pagineRecibo de La ErmitaTano TGNessuna valutazione finora
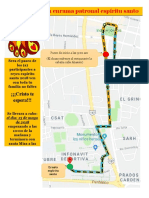
- Curso de Vareno 2019Documento1 paginaCurso de Vareno 2019Tano TGNessuna valutazione finora
- PosadaDocumento3 paginePosadaTano TG0% (1)
- Enrama 2018Documento1 paginaEnrama 2018Tano TGNessuna valutazione finora
- San Miguel ArcángelDocumento9 pagineSan Miguel ArcángelTano TGNessuna valutazione finora
- Hoja de SeguridadDocumento8 pagineHoja de Seguridadrlh2022Nessuna valutazione finora
- Segundo Semestre Febrero - Julio 2018Documento61 pagineSegundo Semestre Febrero - Julio 2018Tano TGNessuna valutazione finora
- Sexto Semestre Febrero - Julio 2018Documento26 pagineSexto Semestre Febrero - Julio 2018Tano TGNessuna valutazione finora
- Lectura ComplementariaDocumento20 pagineLectura ComplementariaLalo Vásquez MachicaoNessuna valutazione finora
- Comp Rob AnteDocumento2 pagineComp Rob AnteTano TGNessuna valutazione finora
- Tema 3 EjerciciosDocumento7 pagineTema 3 EjerciciosNeenittoh CnNessuna valutazione finora
- Cuarto Semestre Febrero - Julio 2018Documento25 pagineCuarto Semestre Febrero - Julio 2018Tano TGNessuna valutazione finora
- Centro de Bachillerato Tecnologico Industrial y de ServiciosDocumento46 pagineCentro de Bachillerato Tecnologico Industrial y de ServiciosTano TGNessuna valutazione finora
- Port AdaDocumento1 paginaPort AdaTano TGNessuna valutazione finora
- Tabla de Distribución de Frecuencias MAYRADocumento6 pagineTabla de Distribución de Frecuencias MAYRATano TGNessuna valutazione finora
- Programa de ReinitasDocumento2 paginePrograma de ReinitasTano TGNessuna valutazione finora
- Rosario de La VirgenDocumento1 paginaRosario de La VirgenTano TGNessuna valutazione finora
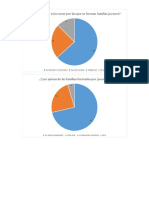
- GraficasDocumento8 pagineGraficasTano TGNessuna valutazione finora
- DocDocumento2 pagineDocTano TGNessuna valutazione finora
- RifaDocumento13 pagineRifaTano TGNessuna valutazione finora
- Introducción PEDocumento1 paginaIntroducción PETano TGNessuna valutazione finora
- VAle ErmitaDocumento1 paginaVAle ErmitaTano TGNessuna valutazione finora
- Graficas2 0Documento5 pagineGraficas2 0Tano TGNessuna valutazione finora
- GraficasDocumento8 pagineGraficasTano TGNessuna valutazione finora
- Domingo Mundial de La Palabra de DiosDocumento13 pagineDomingo Mundial de La Palabra de DiosTano TGNessuna valutazione finora
- Graficas2 0Documento5 pagineGraficas2 0Tano TGNessuna valutazione finora
- Introducción PEDocumento1 paginaIntroducción PETano TGNessuna valutazione finora
- Centro de Bachillerato Tecnologico Industrial y de ServiciosDocumento46 pagineCentro de Bachillerato Tecnologico Industrial y de ServiciosTano TGNessuna valutazione finora
- Esquema Del Mes de DiciembreDocumento5 pagineEsquema Del Mes de DiciembreTano TGNessuna valutazione finora
- Glosario de Terminos Usados en LubricantesDocumento15 pagineGlosario de Terminos Usados en LubricantesrpichoNessuna valutazione finora
- Presencia de Poligodial y Drimenol en Drimys Poblaciones de ChileDocumento5 paginePresencia de Poligodial y Drimenol en Drimys Poblaciones de ChileJose Sebastian Cabañas ValdesNessuna valutazione finora
- Practica1 BioqDocumento2 paginePractica1 BioqKari PaysNessuna valutazione finora
- Clase 9 Genética BacterianaDocumento45 pagineClase 9 Genética Bacterianaapi-19878431100% (1)
- Resumen Grupos FuncionalesDocumento1 paginaResumen Grupos FuncionalesBelén Aguayo DuránNessuna valutazione finora
- InsecticidasDocumento42 pagineInsecticidasDilanNessuna valutazione finora
- Guantes FichasDocumento12 pagineGuantes FichasMiguelNessuna valutazione finora
- Comunicacion CelularDocumento44 pagineComunicacion CelularJulio BarrancoNessuna valutazione finora
- Universidad Tecnológica de Los Andes: Facultad de Ingenieria Escuela Profesional de AgronomíaDocumento92 pagineUniversidad Tecnológica de Los Andes: Facultad de Ingenieria Escuela Profesional de AgronomíaManayay EverNessuna valutazione finora
- ACETONASDocumento15 pagineACETONASDrossianaReptilianaNessuna valutazione finora
- Biologia Guia UrpDocumento27 pagineBiologia Guia UrpLuisPerezNessuna valutazione finora
- Presentación TransesterificaciónDocumento5 paginePresentación TransesterificaciónMARA FERNANDA JUAREZ COTANessuna valutazione finora
- Lab 3 PH y AmortiguadoresDocumento3 pagineLab 3 PH y AmortiguadoresDiego Giraldo BoteroNessuna valutazione finora
- Glutaraldehido 1Documento7 pagineGlutaraldehido 1Minna Muñoz VivasNessuna valutazione finora
- Aminoacidos Esenciales y No EsencialesDocumento5 pagineAminoacidos Esenciales y No EsencialesHumberto RoseroNessuna valutazione finora
- Informe de Química 4Documento7 pagineInforme de Química 4Davis Cristofer Ramos CollasNessuna valutazione finora
- AE033 Fundamentos de Quimica OrganicaDocumento9 pagineAE033 Fundamentos de Quimica OrganicaEduardo LozanoNessuna valutazione finora
- S07.s1 MaterialDocumento27 pagineS07.s1 MaterialAngel CondoriNessuna valutazione finora
- Porcelanosa Bu Shower Deck 2018 EsDocumento15 paginePorcelanosa Bu Shower Deck 2018 EsAlejandro Bravo CastilloNessuna valutazione finora
- Adaptación Metabólica Al AyunoDocumento26 pagineAdaptación Metabólica Al AyunoJay Dalton0% (1)
- AcabadoDocumento14 pagineAcabadoYuren IbarraNessuna valutazione finora
- Informe 3 DestilaciónDocumento10 pagineInforme 3 DestilaciónDaysi LuNessuna valutazione finora
- Kingspan Col FT Panel KingfrigoDocumento2 pagineKingspan Col FT Panel Kingfrigocamilocastro19Nessuna valutazione finora
- Reacciones Quimicas Simples: La Transformación Deunaomás Sustancias en Otras DistintasDocumento2 pagineReacciones Quimicas Simples: La Transformación Deunaomás Sustancias en Otras DistintasⱣandi ΔgarNessuna valutazione finora
- Cuestionario 9 de LabDocumento4 pagineCuestionario 9 de LabMidori NamisatoNessuna valutazione finora
- Sacarificacion Del Almidon.Documento19 pagineSacarificacion Del Almidon.Hessel Valle100% (3)
- Qui MicaDocumento9 pagineQui MicaSebastian NizamaNessuna valutazione finora
- Determinacion de Acidez y Solidos SolublesDocumento10 pagineDeterminacion de Acidez y Solidos SolublesAlexandra Jeniffer Ruiz CarranzaNessuna valutazione finora
- 04 Presupuesto de EdificacionesDocumento30 pagine04 Presupuesto de EdificacionesLuciano Ramos LujanNessuna valutazione finora