Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Libro 4 Medio Guia Profesor PDF
Caricato da
Mikoko YanosudaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Libro 4 Medio Guia Profesor PDF
Caricato da
Mikoko YanosudaCopyright:
Formati disponibili
QUÍMICA IV
GUÍA DIDÁCTICA PARA EL PROFESOR
Mónica Rojas Rosales
Profesora de Química y Ciencias Naturales.
Universidad Metropolitana de Ciencias de la Educación.
Jorge Valenzuela Pedevila
Profesor de Biología y Química.
Universidad de Chile.
Doctor en Química (PhD).
The University of Texas, USA.
Martín Contreras Slotosch
Doctor en Ciencias Naturales. Dr. Rer. Nat.
Universidad de Karlsruhe, Alemania.
Profesor de Estado en Química.
Universidad de Chile.
Gianni Cordano Carrara
Químico Farmacéutico.
Universidad de Chile.
QUIM4M Prof01-92 MINIST_2010.indd 1 20/10/09 10:52:13
I.S.B.N.: 978-956-12-1973-1.
QUÍMICA IV MEDIO
2ª edición: octubre de 2009.
GUÍA DIDÁCTICA PARA EL PROFESOR
Número de ejemplares: 3.401 Es un proyecto del Departamento Editorial
© 2008 por Empresa Editora Zig-Zag, S.A. de Empresa Editora Zig-Zag S.A.
Inscripción Nº 176.071. Santiago de Chile.
Derechos exclusivos de edición reservados por Gerencia General
Empresa Editora Zig-Zag, S.A. Ramón Olaciregui
Editado por Empresa Editora Zig-Zag, S.A.
Los Conquistadores 1700. Piso 10. Providencia. Dirección Editorial
Teléfono 8107400. Fax 8107455. Mirta Jara
E-mail: zigzag@zigzag.cl Edición
Santiago de Chile. Cristián Galaz Esquivel
Asesoría pedagógica
El presente libro no puede ser reproducido ni en todo
José Navarrete Palominos
ni en parte, ni archivado ni transmitido por ningún medio Guillermo Salgado Morán
mecánico, ni electrónico, de grabación, CD-Rom, fotocopia,
microfilmación u otra forma de reproducción, Corrección de estilo
sin la autorización escrita de su editor. Elisa Castillo
Director de Arte
Impreso por RR Donnelley.
Juan Manuel Neira
Antonio Escobar Williams 590. Cerrillos.
Santiago de Chile. Equipo de diseño
Erika Federici
Pamela Buben
Daniel Brown
Franco Giordano
Ilustraciones
Jaime Castro Leyton
Fotografías
Archivo editorial
2 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 2 20/10/09 10:52:13
1. Índice
1. Índice 3 5.2.5 Anexos 85
5.2.5.1 Instrumentos de evaluación
2. Organización del texto 4 fotocopiables 85
• Contenidos de las Unidades 5 5.2.6 Bibliografía de la Unidad 92
5.3 Tercera Unidad:
3. Estructura del texto 6 Procesos de la industria química 93
5.3.1 Planificación de la Unidad 3 94
4. Planificación General 8 5.3.2 Orientaciones didácticas de la Unidad 3 95
• Unidad 1: Los polímeros 8 • Capítulo 1: Minerales metálicos 95
• Unidad 2: Fenómenos nucleares • Capítulo 2: Minerales no metálicos 102
y sus aplicaciones 8 • Capítulo 3: Vidrios, cerámicas y cemento 110
• Unidad 3: Procesos químicos industriales 9 5.3.3 Solucionarios 114
• Evaluación del capítulo 1 114
• Evaluación del capítulo 2 116
5. Orientaciones didácticas por Unidad 10 • Evaluación del capítulo 3 117
• Evaluación de la Unidad 3 119
5.1 Primera Unidad: • Preguntas abiertas 125
Polímeros 10 5.3.4 Errores y dificultades más frecuentes 127
5.1.1 Planificación de la Unidad 1 11 5.3.5 Anexos 127
5.1.2 Orientaciones didácticas de la Unidad 1 12 5.3.5.1 Actividades complementarias
• Capítulo 1: Polímeros naturales 12 para la Unidad 127
• Capítulo 2: Polímeros sintéticos 30 5.3.5.2 Instrumento de evaluación 130
5.1.3 Solucionarios 38 5.3.6 Bibliografía de la Unidad 136
• Evaluación capítulo 1 38
• Evaluación capítulo 2 41
• Evaluación de la Unidad 1 44 6. Anexos 137
5.1.4 Errores y dificultades más frecuentes 51 6.1 Instrumentos de evaluación fotocopiable 137
5.1.5 Anexos 52 • 1. Ejemplos de pautas para evaluar
5.1.5.1 Material complementario diversas modalidades de trabajo
de apoyo a los CMO 52 colaborativo 137
• Elaboración de Mapas Conceptuales • 2. Pautas para evaluar habilidades
para los capítulos de la Unidad 1 53 de aprendizaje colaborativo 138
• Autoevaluación (KSPI) 54 • 3. Ejemplos de modelos para diseñar
5.1.5.2 Recursos electrónicos protocolos experimentales, pautas
para la Unidad 1: Los Polímeros 55 de entrevista, fichas, encuestas. 140
5.1.5.3 Instrumento de evaluación fotocopiable 57 • 4. Ejemplos de fichas de autoevaluación 143
5.1.6 Bibliografía de la Unidad 59 • 5. Escala para la valoración de dibujos
de ciencias 144
• 6. Pauta para evaluar el cuaderno de ciencias 145
5.2 Segunda Unidad: • 7. Pauta para evaluación de lectura de
Fenómenos nucleares y sus aplicaciones 60 textos científicos en parejas 146
5.2.1 Planificación de la Unidad 2 61 • 8. Pauta de seguimiento del desarrollo de
5.2.2 Orientaciones didácticas de la Unidad 2 62 habilidades científicas 147
• Capítulo 1: Propiedades del núcleo 62 • 9. Breve guía metodológica para orientar
• Capítulo 2: Radioactividad 66 el trabajo grupal 148
• Capítulo 3: Fisión y fusión nuclear 73
5.2.3 Solucionarios 77
• Evaluación del capítulo 1 77
• Evaluación del capítulo 2 78
• Evaluación del capítulo 3 80
• Evaluación de la Unidad 2 82
5.2.4 Errores y dificultades más frecuentes 85
Guía didáctica para el profesor 3
QUIM4M Prof01-92 MINIST_2010.indd 3 20/10/09 10:52:13
2. Organización del texto
2.1. Introducción
El programa de 4º año de Enseñanza Media muestra primera etapa. De esta manera, el o la estudiante
un énfasis en la integración de las ciencias. En la construye su propio conocimiento en forma autó-
primera Unidad, Polímeros sintéticos y naturales, noma. El trabajo en equipo en esta etapa refuerza
sus contenidos señalan una clara relación de la competencias intelectivas, valorativas argumentativas,
Química Orgánica con la Biología; en la segunda interpretativas propositivas, entre otras.
Unidad, Fenómenos nucleares y sus aplicaciones, la Durante la etapa de Reflexión, se comparan o
Química se relaciona con la Física y la Medicina, y contrastan sus respuestas con lo obtenido experi-
en la tercera Unidad, Procesos químicos industriales, mentalmente. En esta etapa, si el trabajo ha sido
se abarcan contenidos en los que están presentes hecho responsablemente, los alumnos o alumnas
la Química Orgánica y la Química Inorgánica. deberían lograr aprendizajes significativos sobre
El texto de Química para Cuarto Año Medio ha el tema en desarrollo. Posteriormente, los o las
sido construido alternando actividades basadas en estudiantes pueden transferir lo aprendido a si-
el método indagatorio con las materias propias tuaciones nuevas, lo que constituye la etapa final
de cada unidad. A su vez, cada una se distribuye de Aplicación.
en capítulos que se correlacionan. Este método Lo interesante de esta metodología, es que los
de enseñanza asegura en el alumno o alumna la o las estudiantes no son seres pasivos frente al
incorporación de aprendizajes a través de la inves- proceso de enseñanza-aprendizaje, sino que pasan
tigación y experimentación por sí mismos de los a ser los actores principales en la adquisición de
conceptos científicos necesarios para internalizar conocimientos, habilidades y competencias, con-
los contenidos y lograr los objetivos propuestos firmando o modificando sus preconceptos, en este
por el Mineduc para este nivel. caso de Química.
Por otro lado, al ser esta una metodología que re-
quiere del trabajo cooperativo, en equipo, refuerza
y/o desarrolla en los estudiantes habilidades y com-
El Método Indagatorio
petencias sociales, argumentativas, de comprensión
Este método está siendo ampliamente utilizado lectora, de responsabilidad, entre otros, que están
como alternativa metodológica para la enseñanza presentes en los objetivos transversales de la Química
de las ciencias. La metodología indagatoria, basada y de todas las asignaturas científicas.
en el razonamiento científico, contempla cuatro El profesor, por su parte, se transforma en un guía
etapas: Focalización, Exploración, Reflexión y y deja de ser el único conductor de la clase, como
Aplicación. también se traslada la responsabilidad del apren-
La Focalización es la etapa en la que se formula dizaje del profesor al estudiante.
una situación problemática a través de preguntas Este cambio de mirada en la metodología de
que conllevan el objetivo a lograr. Estas preguntas la enseñanza de las ciencias, en este caso de la
son sobre preconceptos que el alumno o alumna Química, es una buena oportunidad para tener
tiene acerca de un determinado tema. estudiantes más participativos y comprometidos
La Exploración es la segunda etapa. En ella los con su aprendizaje y con la sociedad.
alumnos o alumnas realizan experimentos o análisis
de textos que los llevan a corroborar o descartar
las posibles respuestas o hipótesis planteadas en la
4 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 4 20/10/09 10:52:13
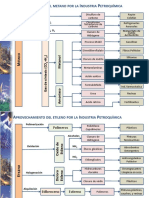
Contenidos de las Unidades
Unidad 1: Unidad 2: Unidad 3:
Polímeros naturales Fenómenos nucleares Procesos químicos
y sintéticos y sus aplicaciones industriales
• Concepto de polímeros • Isótopos y estabilidad nuclear. • Fuentes de materias primas en la hidrós-
Formación de polímeros de adición. Radiactividad nuclear y cinética de fera, litósfera y biósfera para algunos
Descubrimiento y aplicaciones comer- desintegración. Conceptos de vida procesos industriales.
ciales de algunos polímeros. Caucho media y de serie radiactiva.
sintético y natural. Datación de objetos de interés arqueo-
Vulcanización. lógico e histórico. • Estudio de los procesos de obtención de
los metales cobre, hierro y litio, y de los
no metales yodo y azufre a partir de sus
• Composición de péptidos: aminoácidos • Fisión y fusión nuclear. La bomba minerales.
esenciales. Estructura y propiedades atómica y los reactores nucleares. El Obtención de ácido sulfúrico.
de péptidos y polipéptidos. Niveles de impacto de las tecnologías nucleares Reacciones químicas involucradas en
organización de proteínas. Importan- sobre la vida del ser humano, en los procesos anteriores y sus aspectos
cia de la estructura de las proteínas en especial, sus consecuencias éticas, estequiométricos, termodinámicos y
relación con su función biológica. sociales y sicológicas. cinéticos. Estudio del valor agregado en
Clasificación de las proteínas. Ventajas, beneficios, peligros y ame- la purificación de los metales hierro y
Estructura simplificada y replicación nazas de la utilización de las tecnolo- cobre.
de ácidos desoxirribonucleicos. gías nucleares en diversos ámbitos. Aceros.
• Procesos industriales de algunos mate-
• Aplicación de los isótopos y de la riales de uso masivo.
radiación a la medicina, agricultura e
investigación química y bioquímica.
Efecto de la radiación sobre los seres • Materias primas principales y los pro-
vivos. cesos básicos de obtención del vidrio,
cemento y cerámica.
• Fabricación de polímeros sintéticos:
polietileno, nailon y siliconas.
• Aspectos elementales de la cinética de
estas reacciones. Uso de catalizadores.
Guía didáctica para el profesor 5
QUIM4M Prof01-92 MINIST_2010.indd 5 20/10/09 10:52:13
3. Estructura del texto
Tal como se ha planteado, este texto está orientado hacia el aprendizaje
significativo del estudiante, para lo cual se promueve la autonomía y cu-
riosidad, mediante una organización de la información y actividades, que
considera los siguientes aspectos y recursos:
• Un inicio de cada capítulo mediante una actividad indagatoria que busca
contextualizar y explorar ideas previas de los estudiantes.
• Presentación coloquial de los contenidos, partiendo fundamentalmente
de interrogantes o situaciones que generen “quiebre cognitivo”, invitan-
do a la lectura y estimulando la curiosidad e interés por aprender. En
esta sección, se busca que el estudiante se apropie de manera gradual
y significativa de los conceptos tratados.
• Actividades no experimentales para desarrollar en clases, cuyo objetivo
es la aplicación y uso significativo del conocimiento.
• Actividades experimentales para la profundización, extensión y cons-
trucción del conocimiento.
• Síntesis gráfica de cada capítulo.
• Actividades de evaluación.
• Al finalizar cada unidad, se plantea, además, el desarrollo de un proyecto
de integración y la lectura de un artículo periodístico que ilustra relaciones
entre ciencia, tecnología y sociedad, a lo largo de la historia.
Estos recursos se presentan en el texto mediante las siguientes secciones:
Para cada capítulo se contempla:
• Exploremos: consiste en una pequeña actividad o preguntas de tipo in-
dagatorio para estimular el aprendizaje significativo de los estudiantes.
• Para tener en cuenta: es un microtexto que establece aclaraciones y/o
profundizaciones referidas a los conceptos involucrados en el tema que
se está desarrollando.
• Concepto clave: al igual que “para tener en cuenta” es un microtexto,
pero focalizado en la precisión de un concepto determinado, es decir,
reemplaza al tradicional glosario, puesto a pie de página o al fin de
cada unidad, pero con una aclaración inmediata y, por lo tanto, más
significativa.
6 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 6 20/10/09 10:52:13
• Actividad experimental: es un desafío para el estudiante, en el que
debe poner en práctica una metodología de tipo indagatorio. Esta acti-
vidad busca integrar y organizar el conocimiento del estudiante.
• Actividad indagatoria: es una actividad breve de reflexión, orientada
a la indagación, pero no necesariamente experimental.
• Síntesis del capítulo: mediante un mapa conceptual, se organizan gráfi-
camente los principales conceptos tratados en el capítulo, estableciendo
relaciones entre ellos. Esta síntesis gráfica se acompaña, además, de un
texto de resumen.
• Evaluación: se propone como una instancia más de aprendizaje, con
el objeto de establecer en qué medida los estudiantes se han apropiado
de los aprendizajes esperados de la unidad relacionados con los temas
tratados en el capítulo.
Cierre de la Unidad
• Proyecto científico: es una propuesta de trabajo experimental que busca
integrar de manera global los aprendizajes del estudiante desarrollados
en la unidad. Esta propuesta de actividad incentiva el trabajo autónomo
y colaborativo del estudiante.
• Camino al Bicentenario: es una actividad de reflexión y aplicación
basada en la lectura de un artículo de tipo periodístico, que ilustra las
relaciones e impactos de la ciencia en la cultura, a través de la historia.
• Síntesis de la Unidad: de manera análoga a la síntesis propuesta para
cada capítulo, este es un resumen global que relaciona de manera gráfica
(en un mapa conceptual) los principales conceptos de la unidad.
• Evaluación de la Unidad: propone diferentes formas de verificar el
nivel de dominio de los aprendizajes por parte de los estudiantes.
Guía didáctica para el profesor 7
QUIM4M Prof01-92 MINIST_2010.indd 7 20/10/09 10:52:13
4. Planificación general
Tiempo
Unidad 1 Temas/aprendizajes Recursos didácticos Tipo de evaluación
(semanas)
Exploremos (1) Evaluación del
Actividad indagatoria (10) capítulo (1)
Concepto clave (4) (Evaluación de
1. Polímeros naturales. 6
Para tener en cuenta (9) contenidos, para cada
Los polímeros
Actividad experimental (4) capítulo o tema de la
Síntesis (1) unidad).
Exploremos (1) Evaluación del
Actividad indagatoria (4) capítulo (1)
Concepto clave (2) (Evaluación de
2. Polímeros sintéticos. 5
Para tener en cuenta (6) contenidos, para cada
Actividad experimental (3) capítulo o tema de la
Síntesis (1) unidad).
Camino al Bicentenario
Proyecto de Ciencias Evaluación de unidad.
Síntesis de la unidad
Tiempo
Unidad 2 Temas/aprendizajes Recursos didácticos Tipo de evaluación
(semanas)
Exploremos (1) Evaluación del
Actividad indagatoria (1) capítulo (1)
Concepto clave (2) (Evaluación de
1. Propiedaades del núcleo. 2
Para tener en cuenta (11) contenidos, para cada
Fenómenos nucleares y
Actividad experimental (3) capítulo o tema de la
Síntesis (1) unidad).
sus aplicaciones
Evaluación del
Exploremos (1)
capítulo (1)
Actividad indagatoria (1)
(Evaluación de
2. Radiactividad. 7 Para tener en cuenta (10)
contenidos, para cada
Actividad experimental (7)
capítulo o tema de la
Síntesis (1)
unidad).
Exploremos (1)
Actividad indagatoria (1)
Concepto clave (3)
3. Fisión y fusión nuclear. 2 Evaluación de unidad.
Para tener en cuenta (8)
Actividad experimental (3)
Síntesis (1)
Proyecto de ciencias Evaluación de la
Síntesis de la unidad Unidad
8 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 8 20/10/09 10:52:13
Tiempo Tipo de
Unidad 3 Capítulo Temas / Aprendizajes Recursos didácticos
(semanas) evaluación
Reconocer las principales Exploremos (1)
materias primas de la Actividad indagatoria (1) Evaluación del
1. Minerales industria química nacional. Concepto clave (2) capítulo (1)
metálicos en Describir procesos moderno Vocabulario (3) (Evaluación de
6
Chile y su de obtención de metales Para tener en cuenta (7) contenidos, para cada
metalurgia Comprender y analizar Tablas (11) capítulo o tema de la
Procesos químicos industriales
aspectos básicos Actividades (7) unidad).
estequiométricos. Síntesis (1)
Reconocer las principales
materias primas de la
industria química nacional.
Evaluación del
Describir procesos moderno Exploremos (1) capítulo (1)
de obtención de no metales. Actividad indagatoria (1) (Evaluación de
2. Minerales
Para tener en cuenta (16) contenidos, para cada
no Comprender y analizar 5
Tablas (13) capítulo o tema de la
metálicos aspectos básicos Actividades (11)
estequiométricos. Síntesis (1) unidad).
Comprender y analizar los
apectos básicos del ácido
sulfúrico.
Exploremos (1) Evaluación del
Actividad indagatoria (1) capítulo (1)
3. Vidrios, Mostrar conocimiento de Vocabulario (3) (Evaluación de
cerámicas y materiales de uso masivo: Para tener en cuenta (16) contenidos, para cada
cemento vidrio, cemento y cerámica Tablas (4) capítulo o tema de la
Actividades (3) unidad).
Síntesis (1)
Guía didáctica para el profesor 9
QUIM4M Prof01-92 MINIST_2010.indd 9 20/10/09 10:52:13
5. Orientaciones didácticas por Unidad
5.1 Primera Unidad: Polímeros
Mapa conceptual de la Unidad
Polímeros
son
Macromoléculas
conformadas por se clasifican según
Monómeros Composición Estructura Propiedades físicas en
que si son que puede ser
Iguales Distintos Lineal Ramificada Termorrígidos
en como
se denominan
La baquelita
Homopolímeros Copolímeros Entrecruzada Resinas epoxídicas
Termoplásticos
como
Orgánicos Inorgánicos
El polietileno
como la
los hay El poliestireno
Silicona
Elastómeros
Naturales Sintéticos como
como como el El caucho natural
La celulosa Polietileno
El almidón Polipropileno Fibras
Las proteínas Poli (cloruro de vinilo)
como
El ADN Teflón
El ARN Policarbonato nylon
dacrón
10 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 10 20/10/09 10:52:13
5.1.2 Planificación de la Unidad 1
Tiempo
Capítulo Aprendizajes Recursos didácticos Destrezas científicas
(Semanas)
• Reconocer las estructuras de polímeros Observar, describir, predecir,
Polímeros naturales
Exploremos (1)
orgánicos y sus monómeros. verificar, formular objetivos,
Actividad indagatoria (10)
• Identificar la estructura, composición y concluir.
Concepto clave (4)
organización de las proteínas. Medir, ordenar y clasificar,
Para tener en cuenta (9)
• Comprender el rol biológico de las proteínas. tabular, registrar datos,
Actividad experimental (4)
• Reconocer la estructura de ácidos nucleicos y comparar, graficar, calcular,
Síntesis (1)
sus funciones. relacionar.
Observar, describir, predecir,
Polímeros sintéticos
Exploremos (1) verificar, formular objetivos,
• Comprender la formación de polímeros de Actividad indagatoria (4) concluir.
adición y condensación. Concepto clave (2)
• Distinguir propiedades físicas de algunos Para tener en cuenta (6) Medir, ordenar y clasificar,
polímeros de uso común. Actividad experimental (3) tabular, registrar datos,
Síntesis (1) comparar, graficar, calcular,
relacionar.
Habilidades del
Recursos tecnológicos Evaluación
pensamiento
Sitios Web
• http://www.textoscientíficos.com/polímeros/introduccion
• http://www.consumer.es/web/es/medio_ambiente/
urbano/2006/04/06/150776.php
• http://www.revistainterforum.com/espanol/
articulos/072902Naturalmente.html
• http://www.monografias.com/trabajos14/polimeros/polimeros.shtml
Reflexionar, comprender
información, discutir.
Polímeros naturales: Mapas conceptuales y
Comprender, interpretar, aplicar,
• http://www.pslc.ws/spanish/natupoly.htm
Autoevaluación (KPSI)
interpretar, inferir, analizar y
sintetizar. • http://es.wikipedia.org/wiki/Pol%C3%ADmero
• http://es.wikipedia.org/wiki/
Categor%C3%ADa:Pol%C3%ADmeros_naturales
• http://www.monografias.com/trabajos11/polim/polim.shtml http://
es.wikipedia.org/wiki/Seda
• http://www.icarito.cl/medio/articulo/0,0,38035857_157509696_2002
76008,00.html
Reflexionar, comprender
información, discutir.
Sitios Web: Mapas conceptuales y
Comprender, interpretar, aplicar, • http://wwwprof.uniandes.edu.co/infquimi/revista01/id89.htm Autoevaluación (KPSI)
interpretar, inferir, analizar y
sintetizar.
Guía didáctica para el profesor 11
QUIM4M Prof01-92 MINIST_2010.indd 11 20/10/09 10:52:14
Unidad 1
5.1.2 Orientaciones didácticas de la Unidad 1
UNIDAD 1
Los polímeros
Los autores han estimado procedente dividir esta unidad en dos capítulos: el primero, de Polímeros Naturales,
y el segundo, de Polímeros Sintéticos. Este orden corresponde exclusivamente a razones temporales. Los
polímeros naturales siempre han estado con nosotros, en cambio, los sintéticos son producto de la creati-
vidad humana.
A los y las docentes del área química se les recomienda que, al enfrentar estos temas, los aborden funda-
mentalmente desde el punto de vista químico básico. Corresponde a los profesores de biología referirse a
los papeles y funciones de proteínas y ácidos nucleicos.
Polímeros naturales
1 Páginas 14 a 39
Exploremos: Mi primer polímero
(Página 15)
En esta actividad, se pretende acercar al alumno o alumna al concepto de polímero
haciendo una analogía con la unión de clips. El concepto de monómero también
es deducido a partir de esta actividad, como, asimismo, algunas características que
debe tener una molécula para ser un monómero. Los o las estudiantes observarán
que la nueva estructura se va haciendo cada vez más grande. Deberían concluir
que las propiedades de la nueva molécula polimérica deben ser diferentes, ya
que se han modificado enlaces y ha cambiado su tamaño. En esta actividad los
estudiantes podrían mencionar algunas propiedades que cambian de monóme-
ro a polímero. Claramente hay diferencias en puntos de ebullición y fusión, su
densidad, aspectos físicos, como fase, dureza, flexibilidad, entre otras. Fácilmente
deberían concluir que la masa molar será mayor y dependerá de la cantidad de
monómeros unidos. Debido a que la cantidad de monómeros en un determinado
polímero es variable, se acostumbra en la literatura especializada informar para
el polímero una masa molar promedio.
Con la pregunta de cómo debe ser una molécula para ser monómero de un
polímero, la respuesta esperada es que la molécula inicial debe tener al me-
nos dos sitios de enlace para unirse con otras dos moléculas. Se espera que el
estudiante observe que esta nueva disposición de los monómeros dará mayor
rigidez al polímero.
12 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 12 20/10/09 10:52:14
1. Introducción a las macromoléculas poliméricas
(Página 16)
Es importante que al término de la actividad se haga una integración a nivel del
curso para reforzar y dar una definición común de los conceptos de polímero
y monómero.
Por ejemplo:
Monómero: unidad molecular mínima que se repite en un polímero, molécula
individual con características propias.
Polímero: larga cadena molecular formada por unidades moleculares más pe-
queñas, iguales o diferentes.
En las siguientes páginas Web se encuentra información sobre cristalización y
estado vítreo de polímeros.
http://www.textoscientificos.com/polimeros/temperatura
http://pslc.ws/spanish/tg.htm
Actividad indagatoria:
¿Qué polímeros encontramos en nuestro entorno?
(Página 18)
En esta segunda actividad, los objetivos son recolectar, clasificar y comparar
algunos polímeros que se encuentran en nuestra vida cotidiana. El estudiante ya
tiene una idea del concepto de polímero y sabe que los plásticos son un tipo de
ellos. Sin embargo, a través de la indagación, conocerá otros polímeros presentes
en su cuerpo, en los de animales y en las plantas.
Partiendo de la premisa de que todos los materiales recolectados tienen estruc-
turas poliméricas, el estudiante clasifica y ordena en una tabla dichos materiales,
según su origen, natural o artificial.
Posible tabulación:
Naturales Artificiales
Lana, algodón, pelo, madera Papel, recipiente de yogur, caja de CD, botella, cola fría
Según sus preconceptos, el estudiante debe saber que son materias primas la
lana, el algodón y la madera. Para identificar la composición química, podrían
diseñar experiencias simples como quemar y verificar la presencia de C, H y O.
Pueden buscar en la literatura la estructura de cada material y luego comentar
y comparar. De acuerdo con sus conocimientos, el estudiante concluirá que
la lana y pelo tienen un origen animal, y el algodón y la madera son materias
vegetales.
Las actividades realizadas lograrán que el estudiante identifique algunos polímeros
existentes en la naturaleza.
Guía didáctica para el profesor 13
QUIM4M Prof01-92 MINIST_2010.indd 13 20/10/09 10:52:14
Unidad 1
Más sobre polímeros:
http://www.textoscientificos.com/imagenes/polimero-aromatico.gif
http://www.freepatentsonline.com/6936399-0-large.jpg
http://www.steve.gb.com/images/molecules/polymers/lignin.png
2. Polímeros en plantas e insectos
(Página 19)
Actividad indagatoria: ¿Qué es la β-D-glucosa?
(Página 19)
En esta actividad se pretende que el estudiante aplique algunos preconceptos
aprendidos en Biología sobre la glucosa y fortalezca los mismos con respecto a
la parte estructural, ya que esta molécula es el monómero de algunos polímeros
que se tratan más adelante.
El o la docente deben tener especial preocupación en la representación de sacáridos,
dado que es algo compleja la representación de estructuras comprensibles de molé-
culas tridimensionales, en particular, en moléculas que poseen centros asimétricos. El
problema es cómo representar en un plano tanto moléculas abiertas como cíclicas.
Generalmente se utilizan las fórmulas de proyección de Fischer y de Haworth.
Estructuras de Fischer
Es una forma de representar moléculas orgánicas en donde existen enantiómeros.
Todas las uniones son líneas simples en el plano de la hoja. Las líneas verticales
son uniones que se proyectan hacia atrás del plano y las horizontales son uniones
que se proyectan hacia adelante del plano (hacia el lector).
Estructuras de Haworth
Corresponde a la estructura cíclica de una molécula orgánica dibujada en el
plano, pero tratando de representarla en el espacio. Para ello se marcan en ne-
grita los enlaces C-C que están hacia delante del plano, ubicando el átomo de
oxígeno en la parte superior derecha. Los sustituyentes de cada carbono están
sobre el plano y bajo él.
A continuación, se presenta la estructura de cadena abierta de la D-glucosa.
14 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 14 20/10/09 10:52:14
Los monosacáridos se encuentran principalmente en forma cíclica. Por ejemplo,
la glucosa habitualmente presenta las siguientes estructuras:
Estructura A Estructura B
Observa las estructuras A y B. ¿Qué diferencia notas entre ellas? Averigua qué
nombre recibe cada una de estas moléculas.
Con esta pregunta se logrará que el estudiante, a través de la observación, iden-
tifique la estructura de la glucosa y diferencie entre las estructuras denominadas
a-glucosa (estructura A) y b-glucosa (estructura B), observando la posición del
grupo OH del carbono que se encuentra a la derecha de cada estructura. Notará
que el resto de los grupos OH presentan la misma ubicación.
Dos moléculas de glucosa pueden formar un disacárido a través de la unión entre
los carbonos 1 de una molécula y 4 de la otra. El alumno debería darse cuenta
de la liberación de una molécula de agua al unir dos moléculas de glucosa. De
acuerdo con los preconceptos de Biología, debería saber que dicho enlace se
denomina glicosídico o glucosídico.
Aquí es importante que el profesor o profesora dibujen en la pizarra o muestren
al curso la estructura de dos moléculas de glucosa e indiquen la forma en que
se produce este enlace y el desprendimiento de la molécula de agua.
A continuación se representa la formación de la maltosa por condensación de
2 moléculas de glucosa.
Maltosa: 4-O-(a–D-glucopiranosil)-a-D-glucopiranosa
Guía didáctica para el profesor 15
QUIM4M Prof01-92 MINIST_2010.indd 15 20/10/09 10:52:14
Unidad 1
En esta etapa, el profesor o profesora pueden hacer una clase expositiva don-
de clasifique los carbohidratos o azúcares, en monosacáridos, oligosacáridos y
polisacáridos, conectando de esta manera la Química con la Biología. A través
de la estructura, aplicará los conceptos aprendidos en Química Orgánica con
respecto a los grupos funcionales presentes, diferenciando entre cetohexosa y
aldohexosa.
También aquí se pueden introducir las pentosas como la ribosa y la desoxirribosa
que se encuentran en los ácidos nucleicos.
Pentosa Hexosa Hexosa
Aldopentosa Aldohexosa Cetohexosa
Algunas aldopentosas naturales son:
Ciclación de la glucosa
La molécula de cadena abierta (proyección de Fisher) de la glucosa se puede
ciclar por condensación entre el grupo carbonilo del carbono 1 con el OH del
carbono 5, lo que se puede representar de la siguiente manera:
16 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 16 20/10/09 10:52:14
β a
β-D-glucosa D-glucosa α-D-glucosa
Forma hemiacetálica Cadena abierta Forma hemiacetálica
Un carbono hemiacetálico es aquel que tiene enlaces con hidrógeno, un hidroxilo,
un grupo R-O y un grupo R, tal como se muestra en la figura siguiente:
En la ciclación se forman dos isómeros ópticos llamados anómeros, que en su
nomenclatura se diferencian con las letras griegas α y b.
En esta reacción, se forman dos isómeros ópticos llamados anómeros. Estas
especies se diferencian en su nomenclatura con las letras griegas α y b.
Otra forma de representar la ciclación de la D-glucosa es a través de las pro-
yecciones de Haworth, en las que en un plano se representa el ciclo en tres
dimensiones, marcando más fuertemente los enlaces que están más cerca del
lector y colocando el átomo de oxígeno en la parte superior derecha del ciclo
(hacia atrás). En cada átomo de carbono hay un sustituyente sobre el plano del
anillo y otro bajo el plano del anillo.
¿Cuál parece más entendible, la estructura de Haworth o la hemiacetálica?
Se le da la denominación α, a aquella molécula que, en la proyección de Haworth
para la glucosa (estructura cíclica a la derecha), presenta el grupo OH del carbono
anomérico bajo el plano del anillo, y b a aquella estructura que tiene el grupo
OH del carbono anomérico sobre el plano del anillo.
Guía didáctica para el profesor 17
QUIM4M Prof01-92 MINIST_2010.indd 17 20/10/09 10:52:15
Unidad 1
Representación de la ciclación con fórmulas de Haworth.
Se recomienda ver las siguientes páginas Web sobre estructuras de glúcidos.
http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B1_BIOQUIMICA/
t13_GLUCIDOS/informacion.htm
http://www.monografias.com/trabajos24/carbohidratos/carbohidratos.shtml
http://www.um.es/qcba/carbo/carbo1.ppt#2
Actividad indagatoria: El almidón
(Página 21)
En el texto del estudiante se pregunta si las estructuras de la amilosa y amilo-
pectina pueden ser consideradas polímeros.
Enlace α 1-4
Una sección de la amilosa.
18 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 18 20/10/09 10:52:15
Una sección de la amilopectina.
Al realizar esta actividad, los estudiantes observarán en los esquemas que el
monómero del almidón es la glucosa. Podrán identificar las diferentes uniones
de la glucosa en la amilosa y en la amilopectina. En estas estructuras observarán
que la amilosa tiene estructura lineal y la amilopectina, ramificada. Finalmente,
comparando la estructura del almidón y de la celulosa, observarán que están
formadas por el mismo monómero: la glucosa.
El profesor o profesora pueden realizar otra actividad, construyendo las estruc-
turas de tres moléculas de glucosa con esferas de plumavit y mondadientes,
para luego realizar las uniones pertinentes entre ellas, verificando la formación
de polímeros como el almidón o la celulosa. Por otra parte, al relacionar las es-
tructuras del almidón y la celulosa, el o la estudiante podrán justificar alguna de
las diferencias entre estos dos polímeros naturales. Por ejemplo, que el almidón
es parcialmente soluble en agua y la celulosa es insoluble.
Se sabe, además, que el almidón sirve de alimento a los humanos y a muchos
animales, ya que existen enzimas digestivas en sus organismos que catalizan la
hidrólisis de los enlaces α-glucosídicos presentes en el almidón, pero no tienen
enzimas capaces de catalizar la hidrólisis de enlaces b-glucosídicos, como los que
tiene la celulosa. Los rumiantes pueden degradar la celulosa de hierbas y otros
vegetales, ya que poseen microorganismos que contienen las enzimas apropiadas
para ello (b-glucosidasas). Las termitas también poseen estas enzimas, de ahí que
su principal alimento es la madera.
Actividad experimental: Reconociendo el almidón
(Página 22)
En esta actividad, el estudiante aplica sus conocimientos previos en cuanto a
alimentos que contienen almidón.
Experimentalmente reconoce la presencia de esta sustancia con lugol. La colo-
ración violeta observada en el reconocimiento del almidón con lugol se debe a
que el yodo se introduce entre las espiras de la molécula de almidón, formando
Guía didáctica para el profesor 19
QUIM4M Prof01-92 MINIST_2010.indd 19 20/10/09 10:52:15
Unidad 1
un compuesto de inclusión. Si bien esta reacción modifica las propiedades físicas
del almidón (coloración), no produce un cambio químico en el mismo. Este
cambio se observa en frío. Al calentar la solución violeta del almidón con lugol,
el color violeta desaparece, debido a que el lugol se desplaza de la molécula de
almidón. Si se vuelve a enfriar nuevamente, aparece el color violeta.
El lugol da coloración azul intenso con la amilosa (20% del almidón), fracción
soluble en agua y es rojiza con la amilopectina (80% del almidón), fracción
insoluble
Actividad indagatoria: El caucho o hule
(Página 23)
En esta actividad, el estudiante podrá relacionar lo aprendido en Química Orgánica
de Segundo Año Medio sobre la nomenclatura de compuestos orgánicos con
la estructura del caucho o hule (poli-cis-isopreno). Además, el profesor puede
comenzar a introducir los polímeros semisintéticos con el concepto de vulcani-
zación, que se estudia más adelante.
Actividad indagatoria: Descubriendo la seda
(Página 24)
Esta es otra actividad de indagación, ocupando en este caso un polímero na-
tural como lo es la seda. Es un material que los estudiantes han oído nombrar
o conocen en su vida diaria, pero del que no saben su origen ni su estructura
química. Existe bastante información en Internet sobre este tema que puede
resultar atractivo para el estudiante, por ser algo conocido.
¿Cómo producen la seda las orugas de la mariposa de seda?
La oruga de la mariposa de seda, conocida como Bombyx mori, tiene bajo su labio
inferior la trompa de seda o hilera, que es el orificio por donde sale la hebra de
seda. Al deglutir, el alimento pasa por el esófago y recibe el líquido secretado
por las glándulas salivales. Después, este mismo líquido viscoso transforma en
dextrina el almidón de las hojas de la morera y el líquido alcalino secretado por
el estómago continúa la digestión y la asimilación. Las glándulas sedosas, donde
se acumula la seda, tienen la forma de dos tubos alargados y brillantes, situados
debajo del tubo digestivo, los que se unen de modo que solo sale un
fino hilo de seda.
Las dextrinas son un grupo de carbohidratos de baja masa molar pro-
ducidas por la hidrólisis del almidón. Tienen la misma fórmula general
que los carbohidratos, pero son de una longitud de cadena más corta. La
producción industrial es realizada generalmente por la hidrólisis ácida del
almidón de patata. Las dextrinas son solubles en agua, sólidos de color
blanco hasta levemente amarillo, ópticamente activos. De manera ana-
lítica, las dextrinas se pueden detectar con la solución del yodo, dando
una coloración roja.
La mayor parte de las sedas están constituidas por la proteína fibrosa
fibroína y por una proteína amorfa viscosa llamada sericina, que desem-
Dextrina
peña el papel de cementación.
20 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 20 20/10/09 10:52:15
La fibroína de la seda está formada por cadenas con plegamiento β antiparalelo,
en el cual las cadenas se extienden paralelamente al eje de la fibra. Los estudios
muestran que grandes extensiones de la cadena están constituidas por seis re-
siduos que se repiten.
(- gli -ser - gli - ala - gli - ala - )n
Dos cadenas polipeptídicas vecinas; se muestra la alternancia de glicina y alanina
intra e intercadena.
Las hojas β proyectan la glicina hacia una superficie, las cadenas laterales de la
alanina y la serina están dispuestas hacia la otra superficie. Además, las cadenas
se apilan, de modo que las capas en las que se establece contacto con las cadenas
laterales de la glicina se alternan con aquellas de alanina y serina. Esta estructura
explica, en parte, las propiedades mecánicas de la seda.
Dos cadenas polipeptídicas antiparalelas de la fibroína de la seda (modelo
de esferas llenas).
Más información se puede encontrar en los sitios:
http://es.wikipedia.org/wiki/Seda
http://www.icarito.cl/medio/articulo/0,0,38035857_157509696_200276008,00.
html
http://www.agrobit.com/Microemprendimientos/cria_animales/MI000003cr.htm
http://es.encarta.msn.com/encyclopedia_761561821_2/Textiles.html
http://www2.uah.es/biomodel/model5/beta/j/inicio.htm
http://bifi.unizar.es/jsancho/estructuramacromoleculas/6Proteinasfibrosas/
fibroina.JPG
http://www.bioquimicaqui11601.ucv.cl/unidades/proteinas/ptnas6fid.html
Guía didáctica para el profesor 21
QUIM4M Prof01-92 MINIST_2010.indd 21 20/10/09 10:52:15
Unidad 1
3. Proteínas (Página 25)
Actividad indagatoria: Recordemos las proteínas
(Página 25)
Nuevamente en esta actividad se relaciona la Química con la Biología. Las pro-
teínas son un tema que los estudiantes han visto y, por lo tanto, en esta actividad
de indagación recordarán algunos preconceptos.
El profesor o profesora pueden hacer en esta parte un esquema en la pizarra
con las funciones que tienen las proteínas en los seres vivos y nombrar algunas
características generales que son específicas y que a través de algunas de ellas se
expresa la información genética.
Un posible esquema de funciones se presenta en la siguiente representación:
transporte
reserva enzimática
movimiento proteínas homeostática
hormonal estructural
inmunológica
Respuesta a algunas preguntas del texto del alumno:
¿Qué grupos funcionales orgánicos aparecen en las unidades moleculares que
forman las proteínas?
R: amino y ácido carboxílico
¿Qué elementos químicos están presentes en las proteínas?
R: C, H, O, N y en algunas S y P.
¿Qué estructuras presentan las proteínas?
R: Estructuras primaria, secundaria, terciaria y cuaternaria.
Actividad experimental:
¿Qué elementos químicos están presentes en las proteínas?
(Página 25)
Con esta actividad experimental se corroboran preconceptos con respecto a la
composición química de las proteínas. El profesor o profesora pueden inducir-
los a experimentar con otros materiales que el alumno o alumna suponga que
contienen proteínas.
a) ¿Qué elemento reconoces en la carbonización?
R: Se reconoce el carbono.
b) Observa las paredes del tubo. ¿Qué sustancia identificas?
22 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 22 20/10/09 10:52:15
R: En las paredes del tubo se observa condensación de agua, con lo que se
estaría reconociendo la presencia de hidrógeno y oxígeno, aunque parte del
oxígeno lo aporta el aire.
c) ¿Cuáles son los elementos químicos que la forman?
R: C-H-O-N a veces S y P.
d) Acerca un fósforo encendido a la boca del tubo. ¿Qué ocurre? ¿Qué sustancia
reconoces?
R: Al acercar el fósforo encendido a la boca del tubo, observarán que este
se apaga.
Cuando las proteínas se oxidan se forma N2, H2O y CO2. Por ejemplo:
NH2 O CH3
15
CH3 CH C NH CH COOH + O 6CO2 + 6 H2O + N2
2 2
Con la muestra de pelo u otras sustancias que contienen proteínas, se deberían
obtener resultados similares.
Actividad indagatoria: Unión entre aminoácidos
(Página 28)
La siguiente actividad permitirá que los estudiantes concluyan que las proteínas
también son polímeros, cuyos monómeros son los aminoácidos. El realizar la
modelación de aminoácidos para formar un dipéptido es una forma de interna-
lizar la estructura básica de una proteína y de sus monómeros. Nuevamente el
trabajo en grupo refuerza competencias sociales, argumentativas, etc.
Exponer y fundamentar las respuestas dadas por los o las estudiantes ante el
curso y discutirlas con la profesora o profesor, nuevamente es una instancia para
reforzar competencias que se quieren fomentar en los o las estudiantes.
¿Cómo se unen los aminoácidos para formar las proteínas?
R: Para explicar la unión de aminoácidos se sugiere, por ejemplo, copiar en la
pizarra el esquema que aparece en el libro e indicar el proceso químico que ocurre
en la unión. Los aminoácidos se unen a través de enlaces llamados peptídicos.
El enlace peptídico se forma entre el grupo amino de un aminoácido y el grupo
ácido carboxílico de otro, con la liberación de una molécula de agua.
Esquema de la unión peptídica de dos aminoácidos.
Guía didáctica para el profesor 23
QUIM4M Prof01-92 MINIST_2010.indd 23 20/10/09 10:52:16
Unidad 1
¿Pueden considerarse las proteínas como polímeros?
R: Las proteínas se consideran como polímeros biológicos por ser moléculas
polipeptídicas con masas moleculares muy elevadas (hasta 50 millones en uni-
dades uma).
¿Cuántos dipéptidos pueden formarse por la unión de dos aminoácidos
diferentes?
R: Suponiendo que ambos aminoácidos tienen un grupo carboxilo y un grupo
amino, por ejemplo, glicina y alanina, sólo pueden formarse dos dipéptidos:
gli-ala y ala-gli, lo que depende de cuál grupo amino reacciona con el grupo
carboxilo del otro aminoácido.
Si los aminoácidos tienen más de un grupo carboxilo o más de un grupo amino,
por ejemplo, el ácido aspártico (2 grupos COOH) o la lisina (2 grupos NH2), se
puede formar mayor cantidad de dipéptidos de acuerdo con las combinaciones
posibles.
¿Cuántos tripéptidos pueden formarse por la unión de tres aminoácidos
diferentes?
R: Según lo indicado anteriormente, si los aminoácidos tienen sólo un grupo
amino y sólo un grupo carboxilo, por ejemplo, glicina (gli), alanina (ala) y
fenilalanina (fen), se pueden dar 6 combinaciones: 1) gli-ala-fen; 2) gli-fen-ala;
3) ala-gli-fen; 4) ala-fen-gli; 5) fen-gli-ala; y 6) fen-ala-gli.
Actividad experimental:
¿Cómo reconocer la presencia de proteínas?
(Página 31)
Esta actividad grupal de exploración a través de la experimentación tiene como
objetivo que el alumno o alumna identifiquen y apliquen algunas técnicas de
reconocimiento de proteínas en alimentos de consumo diario.
a) Al agregar ácido nítrico concentrado en el trozo de carne notará la desnatu-
ralización de la proteína, que toma un aspecto de carne cocida y en algunas
zonas un tono amarillento.
24 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 24 20/10/09 10:52:16
b) En el caso de la clara de huevo, por desnaturalización se coagula, adquiriendo
un color blanco y también puede aparecer alguna zona amarillenta. Al agregar
la solución de NaOH, se ve claramente una coloración naranja que indica
la presencia de proteínas. Este método de reconocimiento de proteínas se
conoce como reacción xantoproteica, método donde el ácido nítrico, al actuar
sobre ciertas proteínas, produce el ácido xantoproteico de color amarillo.
c) Con la acción del ácido acético sobre la leche, se logra extraer la proteína de
la leche llamada caseína. Al practicar el método xantoproteico se observa la
típica coloración amarilla. Una vez realizada la actividad, el alumno o alumna
pueden practicar este método de reconocimiento de proteínas sobre otros
alimentos de su vida diaria.
Otro método que se puede utilizar para reconocer proteínas es el Método de
Biuret. Las proteínas y péptidos, en presencia del ion Cu2+, forman complejos
de color violeta en medio básico, que dependen de la presencia de enlaces
peptídicos. La práctica consiste en preparar una solución con la sustancia que
tiene proteínas, agregarle 1 mL de solución de NaOH al 10% m/m, y luego
5 gotas de solución de sulfato cúprico (Reactivo
de Benedict).
Reactivo de Benedict: Solución de 17,3 g de
sulfato de cobre cristalizado, 17,3 g de citrato de
sodio o potasio, 200 g de carbonato de sodio en
1 L de agua destilada
En la siguiente página Web se encuentran variados
experimentos de reconocimiento: http://www.
ellaboratorio.8k.com/bioquimica.htm
Actividad experimental:
Ruptura de los polímeros que forman
las proteínas
(Página 32)
En esta actividad los alumnos o alumnas identifican
el concepto de desnaturalización de las proteínas
y pueden aplicarlo a las actividades anteriores.
El siguiente esquema muestra el proceso de
desnaturalización de una proteína.
En el proceso de desnaturalización de una
proteína, se altera la disposición espacial de sus
cadenas polipeptídicas, transformándose en una
estructura más desordenada. La desnaturalización
puede ser reversible o irreversible. Esto último
ocurre cuando se rompen enlaces bisulfuros. Los
efectos de la desnaturalización pueden ser varios,
entre ellos, la disminución de la solubilidad por
el desbloqueo de los grupos hidrófobos, una
alteración en la retención de agua y la pérdida
de la actividad biológica. La desnaturalización
puede ser causada por diferentes agentes.
Guía didáctica para el profesor 25
QUIM4M Prof01-92 MINIST_2010.indd 25 20/10/09 10:52:16
Unidad 1
Agentes físicos Agentes químicos
Calentamiento Ácidos
Enfriamiento Bases
Tratamientos mecánicos Metales
Presión hidrostática Disolventes orgánicos
Soluciones de sustancias orgánicas
Irradiación
(urea, guanina)
Conclusiones:
• La estructura de las proteínas se mantiene estable, mientras se encuentre en
un medio adecuado.
• Diversos factores pueden alterar la estructura de una proteína provocando su
desnaturalización, lo que la hace perder su función. Algunos de estos facto-
res son alteraciones en: pH, temperatura, concentración de sales, sustancias
básicas, entre otros.
• Al desnaturalizarse una proteína, generalmente se mostrará como un preci-
pitado. Su reconocimiento experimental puede ser efectuado con el método
xantoproteico.
En las siguientes páginas se encuentra información adicional sobre proteínas y
su desnaturalización:
http://docencia.izt.uam.mx/docencia/alva/fisicoquimica20.html
http://es.wikipedia.org/wiki/Desnaturalizaci%C3%B3n_(bioqu%C3%ADmica)
http://www.monografias.com/trabajos13/prote/prote.shtml
4. Ácidos nucleicos: ADN y ARN (Página 33)
Actividad exploratoria:
En el baúl de la memoria
(Página 33)
Actividad de refuerzo e indagación de conocimientos previos tendiente a aproximar
a los alumnos en el recuerdo de información acerca de los ácidos nucleicos.
Actividad indagatoria:
¿Cuál es la estructura del polímero de ADN y de ARN?
(Página 35)
Utilizando la nomenclatura de códigos de color, los alumnos o alumnas esque-
matizan estructuras de ADN y ARN, concluyendo que estas macromoléculas
también pueden ser consideradas polímeros, cuyos monómeros serían los ácidos
nucleicos. Por otra parte, identifican las secuencias de las bases nitrogenadas en
el ADN y ARN, constatando sus semejanzas y diferencias.
26 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 26 20/10/09 10:52:16
Actividad indagatoria: El polímero de ADN
(Página 37)
Esta actividad representa cierta complejidad, dado que son muchas las posibili-
dades de combinación.
La siguiente figura representa una sección de ADN. Indica la base nitrogenada
que debería ir en cada número.
1 2 3 T 5 6 7 A
A G C 4 G C T 8
¿Cuál sería la secuencia de bases nitrogenadas en las moléculas de ARN, formadas
de cada cadena de la estructura de ADN del ejercicio?
R: Cadena superior ADN: T – C – G– T – C – G – A – A
ARNm: A – G – C – A – G – C – U – U
Cadena inferior ADN: A – G – C – A – G – C – T – T
ARNm: U – C – G – U – C – G – A - A
¿Qué aminoácidos presentaría la sección de las proteínas formadas por cada una
de las cadenas de ARN encontradas? Para responder se debe utilizar la tabla de
codones incluida en el texto del estudiante.
R: el alumno o alumna deben recordar, y si no lo sabe lo expondrán el profesor
o profesora, que el ARNm se sintetiza a partir de la hebra molde del ADN;
estos a su vez transfieren la información al ARNt, quien finalmente une los
aminoácidos correspondientes.
Cadena superior ADN: T – C – G – T – C – G – A – A
ARNm: A – G – C – A – G – C – U – U
ARNt: U – C – G – U – C – G – A – A
Aminoácidos: Ser – Ser -
Cadena inferior ADN: A – G – C – A – G – C – T – T
ARNm: U– C – G – U – C – G – A – A
ARNt: A – G – C – A – G – C – U – U
Aminoácidos: Ser – Ser -
Recordar que cada aminoácido se codifica a partir de tres bases nitrogenadas,
en el ejemplo se pueden distinguir dos aminoácidos, que en la cadena superior
corresponden a la cisteína y en la inferíor a la serina. El profesor o profesora
pueden hacer múltiples ejercicios, agregando más bases para obtener cadena de
aminoácidos de mayor tamaño.
Guía didáctica para el profesor 27
QUIM4M Prof01-92 MINIST_2010.indd 27 20/10/09 10:52:16
Unidad 1
Páginas para consultas:
http://www2.uah.es/biomodel/model4/dna/codons.htm
http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B4_INFORMACION/
T402_ACIDNUCLE/INDICE.htm
Actividad complementaria para el profesor
Enzimas de importancia biológica
El estudio de las enzimas es un tema que el profesor o profesora pueden anexar
al contenido de proteínas. El tratamiento puede ser a través de experimentación
simple, como la que se sugiere más abajo.
Las enzimas son proteínas especializadas, por lo tanto, son estructuras poliméricas
cuyos monómeros son aminoácidos
El término enzima, propuesto en 1867 por Wilhelm Kühne, deriva del griego
zymc que significa “en fermento”.
Algunos tipos de enzimas son:
• Enzimas hidrolíticas: Son aquellas que aceleran reacciones de rompimiento
de sustancias al reaccionar con moléculas de agua.
• Enzimas oxidantes: Son aquellas que aceleran las reacciones de
oxidación.
• Enzimas reductoras: Son aquellas que actúan en reacciones de reducción
con desprendimiento de oxígeno.
Para nombrar las enzimas, se agrega el sufijo “asa” al nombre del sustrato sobre
el que actúan. Por ejemplo, las que actúan sobre las proteínas se denominan
proteasas: Dentro de ellas se encuentran la pepsina y la tripsina.
1. Un experimento simple consiste en el reconocimiento de la catalasa. Esta
enzima se encuentra formando parte de las células animales y vegetales y
su función es descomponer el peróxido de hidrógeno que se desprende en
algunos procesos metabólicos. La función de esta enzima es actuar sobre la
reacción de descomposición del peróxido de hidrógeno para transformarlo
en agua y oxígeno.
Materiales: tubo de ensayo, trocito de hígado, agua oxigenada, pipeta.
Procedimiento: colocar el trozo de hígado crudo en el tubo de ensayo y
agregar 5 mL de agua oxigenada. Observar y anotar.
El intenso burbujeo que el alumno o alumna notarán es oxígeno. El profesor
o profesora puede proponer acercar una pajuela de escoba incandescente
a la boca del tubo lo que hará arder la pajuela. Con ello se comprobará el
poder comburente del oxígeno.
2. Otra experiencia que el profesor o profesora pueden realizar con sus alumnos o
alumnas es la desnaturalización de la catalasa. Se realiza el mismo procedimiento
anterior, pero con hígado cocido. El alumno o alumna observarán que no se
produce ningún tipo de reacción. Aquí el profesor o profesora recordarán al
alumno o alumna el concepto de desnaturalización de las proteínas.
28 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 28 20/10/09 10:52:16
3. Se puede realizar otra experiencia simple con la hidrólisis del almidón que
ocurre en la saliva por acción de la amilasa o ptialina, enzima que ayuda
en la reacción de rompimiento del almidón para transformarse en maltosa.
Sobre esta actúa la maltasa que rompe la maltosa (disacárido) para convertirlo
finalmente en glucosa.
Una forma muy simple de observar estos cambios es masticar un trozo de
pan durante algunos minutos hasta sentir el sabor dulce de la glucosa, por
degradación del almidón.
4. Si el establecimiento educacional cuenta con laboratorio y reactivos de Fehling
A y B y Lugol, otra forma de observar la acción de la amilasa, podría ser la
siguiente:
Materiales: soluciones de glucosa y almidón al 1%, cuatro tubos de ensayos
rotulados, gradilla, reactivo de Fehling A y B, Lugol, pipeta, termómetro.
Procedimiento: Colocar en el tubo 1 solución de glucosa y realizar la reacción
de Fehling. Anotar coloración.
En el tubo 2, poner 5 mL de solución de almidón y agregar Lugol. Anotar
coloración.
En los tubos 3 y 4 colocar unos 3 mL de almidón y agregar aproximada-
mente 1 mL de saliva donada por un alumno del grupo. Poner ambos tubos
a calentar en un baño de agua a 37ºC por unos 15 minutos. Cuidar que la
temperatura no suba, de lo contrario la enzima se inactivará. Luego, efectuar
la reacción de Fehling en el tubo 3 y la del Lugol en el tubo 4.
Resultados esperados.
Tubo Nº Reacción al Fehling Reacción al Lugol Conclusiones
1 Rojo ladrillo Presencia de glucosa
2 Violeta intenso Presencia de almidón
3 Rojo ladrillo Presencia de glucosa
4 Café No hay almidón
Guía didáctica para el profesor 29
QUIM4M Prof01-92 MINIST_2010.indd 29 20/10/09 10:52:16
Unidad 1
Polímeros sintéticos
2 Páginas 40 a 59
Los materiales plásticos tienen una enorme importancia en la vida del ser hu-
mano. A medida que aparecen nuevos tipos de plásticos, los objetos fabricados
a partir de ellos desplazan a los materiales tradicionales (madera, metales, etc.)
por su mayor durabilidad, comodidad y su menor costo.
Actividad exploratoria:
Polímeros sintéticos en nuestra vida cotidiana
(Página 41)
Esta actividad tiene por objeto que el alumno comprenda que el uso cotidiano
de los objetos plásticos, si bien ha contribuido a una mejor calidad de vida, ha
provocado la legítima preocupación por el origen de ellos, debido a que las
materias primas que se utilizan en su fabricación (petróleo, gas natural, carbón)
no son renovables. Estos recursos se utilizan también para otros fines (princi-
palmente energéticos). En un futuro no muy lejano, el progresivo agotamiento
de estos recursos pondrá en peligro la subsistencia del ser humano. Por ello, es
necesario que el alumno conozca las limitaciones que se producen por el uso de
los materiales plásticos para crear conciencia de su uso racional y de la necesidad
de la búsqueda de sustitutos que no afecten el sistema ecológico. El profesor o
profesora deben hacer referencia a todas estas ideas, con el fin de incentivar a
los o las estudiantes en el tema de los polímeros sintéticos, haciéndoles sentir
que no es algo alejado de ellos, sino algo con lo que conviven día a día y de
cuyo uso racional y manejo de desechos son también responsables.
1. Generalidades sobre los polímeros sintéticos (Página 42)
Actividad experimental:
¿Se puede cambiar la estructura de un polímero?
(Página 43)
Esta actividad es interesante de realizar, ya que a través de la experimentación
el alumno o alumna pueden descubrir que es posible cambiar las propiedades
de un polímero. La fundamentación que se adjunta puede servir al profesor o
profesora en el momento de la integración del Laboratorio.
http://www.rmm.cl/index_sub.php?id_seccion=4152&id_portal=622&id_con-
tenido=9520
La cola fría es un polímero del acetato de vinilo (PVAC), que tiene la consistencia
de un líquido viscoso.
30 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 30 20/10/09 10:52:16
Cuando se agrega bórax, se produce un entrecruzamiento con el polímero y se
genera un sólido esponjoso que, si se le da forma esférica y seca bien, rebota.
Se puede volver a la forma líquida por agregado de un ácido (se neutraliza el
bórax) y si se neutraliza el ácido agregado, se regenera el sólido nuevamente.
Ese tipo de polimerización es reversible, ya que depende de interacciones elec-
trostáticas. Cuando se agrega un ácido, por ejemplo vinagre, se rompe este tipo
de enlace, observándose la formación del líquido espeso blanco. Si se neutraliza
el ácido agregado con una base, por ejemplo bicarbonato, se vuelve a producir
la interacción eléctrica intermolecular y se forma nuevamente el sólido.
Esta actividad demuestra que, con reacciones muy simples, es posible cambiar la
estructura de ciertos polímeros y con ello cambiar sus propiedades físicas.
Otra actividad que se podría pedir a los alumnos que realicen en su casa es la
preparación de engrudo e investiguen la química del proceso.
http://es.wikihow.com/hacer-engrudo
www.explora.cl/nuevo/nacional/medioteca_libros.php
2. Primeros polímeros sintetizados (Página 44)
Caucho vulcanizado
(Página 44)
¿Qué pasaría si se produce un entrecruzamiento excesivo en la vulcanización
del caucho natural?
R: Se produciría un caucho más duro y menos flexible.
¿Qué usos tiene actualmente el caucho vulcanizado?
R: Neumáticos para automóviles o bicicletas, accesorios de maquinarias eléc-
tricas, etc.
Guía didáctica para el profesor 31
QUIM4M Prof01-92 MINIST_2010.indd 31 20/10/09 10:52:16
Unidad 1
Actividad experimental:
Fabricando un polímero sintético
(Página 45)
Cuando el fenol y la formalina (aldehído fórmico o formaldehído) se hacen
reaccionar en caliente, se forman muchos enlaces entrecruzados, produciéndose
la condensación tridimensional múltiple entre estas moléculas, con pérdida de
moléculas de agua. El polímero obtenido es una masa sólida, muy dura e inso-
luble (polímero termorrígido).
Esta experiencia demuestra que la preparación de un polímero sintético es re-
lativamente simple y que los monómeros utilizados son moléculas sencillas de
uso habitual en un laboratorio.
http://www.answers.com/topic/bakelite
http://www.techtransfer.ugent.be/pdf/gazeTTe/gazeTTe-2007-06-EN.pdf
Inicialmente, la baquelita se usó para la fabricación de teléfonos, enchufes,
interruptores, etc. Actualmente se usa en la industria automotriz como aislante
de ruidos, materiales técnicos y en sistemas de frenos. Se usa también en recu-
brimientos y como aislante general; en aviación se usa como partes aislantes del
fuego e impregnación de maderas. Sin embargo, debido a que los artículos de
uso casero van perdiendo el color, la baquelita ha sido desplazada por polímeros
termoplásticos que presentan estabilidad en el color.
3. Formación de los polímeros sintéticos (Página 46)
Actividad indagatoria:
¿Qué estructuras puede presentar el polipropileno?
(Página 48)
El objetivo de esta actividad es que el alumno o alumna relacionen las diferentes
estructuras espaciales de polipropilenos isómeros con sus propiedades físicas.
32 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 32 20/10/09 10:52:17
Isotáctica
Sindiotáctica
Atáctica
Algunas respuestas a preguntas en el texto del estudiante:
¿Cómo podrían unirse monómeros de un alqueno?
R: La polimerización de alquenos se produce por reacciones de adición a través
de mecanismos catalizados por aniones, cationes o radicales libres.
¿Cuál es la semejanza de las estructuras esquematizadas?
R: Los polipropilenos indicados tienen la misma secuencia de átomos y grupos
que se puede dibujar de la siguiente manera:
¿Cuál es la diferencia de las estructuras esquematizadas?
R: En relación al esqueleto de átomos de carbono, en la estructura isotáctica todos
los grupos metilo están ubicados al mismo lado; en la estructura sindiotáctica
los grupos metilo están alternados regularmente y en la estructura atáctica los
grupos metilo están orientados al azar.
Es importante que esta actividad esté dirigida por el profesor o profesora con el
fin de reforzar los conceptos que de ella derivan; por ejemplo, la importancia
que tiene la estructura de una molécula con respecto a las propiedades que ella
presenta.
¿Cómo influyen las diferencias estructurales en las propiedades del polipropileno?
R: Las formas isotácticas y sindiotácticas, que pueden obtenerse por el uso de
los catalizadores de Ziegler-Natta, tienen mayor rigidez y resistencia a la fractura
que la forma atáctica. Al poseer una estructura ordenada, el polímero isotáctico
tiende a ser cristalino; en cambio, la forma atáctica es amorfa, debido a la distri-
bución aleatoria de los grupos metilo en las cadenas poliméricas.
Guía didáctica para el profesor 33
QUIM4M Prof01-92 MINIST_2010.indd 33 20/10/09 10:52:17
Unidad 1
Actividad de aplicación:
Reacción de formación del teflón
(Página 50)
a) ¿Cuál es el mecanismo de polimerización del tetrafluoretileno?
R: Se produce por el mecanismo de radicales libres.
b) ¿Cómo se representa el polímero?
c) ¿A qué tipo de polímero corresponde? (homopolímero o copolímero)
R: Es un homopolímero, porque está constituido por un solo monómero.
d) ¿Qué aplicaciones tiene el teflón?
R: Como antiadherente en utensilios de cocina.
Como fibras para empaquetaduras.
En revestimientos de aviones, cohetes y naves espaciales, debido a las grandes
diferencias de temperatura que es capaz de soportar. En medicina, aprove-
chando que no reacciona con sustancias o tejidos y es flexible y antiadherente,
se utiliza para prótesis, creación de tejidos artificiales y vasos sanguíneos. En
revestimiento de cables y electrónica, por su gran capacidad aislante y resis-
tencia a la temperatura. En pinturas y barnices. En estructuras y elementos
sometidos a ambientes corrosivos, así como en mangueras y conductos por
los que circulan productos químicos.
En la página Web se encuentra algo más sobre el teflón:
http://www.jotea.cl/foro/showthread.php?t=127
Profundización de contenidos
Algo más sobre la silicona
(Página 53)
La silicona ha sido utilizada por más de 50 años para las más variadas aplicaciones,
tanto en la vida diaria como en la medicina, siendo empleada por la industria
farmacéutica y alimenticia, como también en dispositivos médicos como marca-
pasos, válvulas cardiacas, implantes mamarios, materiales de sutura, lubricantes
y recubrimientos de agujas hipodérmicas y jeringas.
Un mini-implante de silicona puede contener en su interior nanopartículas
diseñadas con distintos fines; bien para evaluar los efectos de ciertos fármacos,
para saber si estos han llegado al tumor e incluso determinar si la neoplasia está
creciendo o respondiendo bien al tratamiento.
El estudio de las siliconas puede ser un tema de investigación para un grupo de
alumnos que culmine con una exposición ante el curso.
En la siguiente página se informan usos de la silicona, además de abundantes
datos sobre otros polímeros.
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen2/ciencia3/072/htm/
sec_7.htm
34 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 34 20/10/09 10:52:17
4. Procesos industriales (Página 54)
Actividad indagatoria:
¿Qué inconvenientes tiene y tendrá el uso de plásticos en nuestra
sociedad?
(Página 54)
Objetivo: Analizar el impacto del amplio uso de plásticos en nuestra sociedad.
Esta actividad la puedes desarrollar en un grupo de cuatro estudiantes. De ellos,
uno debe ser el moderador y otro el secretario, que tome apuntes de la discu-
sión. Para contestar la pregunta del inicio, te proponemos limitar la discusión a
los siguientes aspectos:
a) Biodegradabilidad.
b) Reciclaje.
c) Materia prima.
d) Contaminación ambiental.
e) Educación de la sociedad en cuanto al desecho de estos materiales.
f) Medidas para reducir los problemas y aprovechar su utilidad.
Algunas respuestas esperadas:
• Alto costo energético para la producción de plásticos a partir de recursos no
renovables, como el petróleo.
• Muchos plásticos no son biodegradables ni reciclables.
• Desarrollo insuficiente en la obtención de plásticos biodegradables.
• Acumulación de productos plásticos, debido a su bajo reciclaje (ver pág.
Web)
• Desconocimiento y falta de educación de la sociedad en cuanto a normas
ecológicas de desecho y/o eliminación de estos materiales.
• Insuficiencia en lugares de acopio para el reciclaje.
• Para reducir los problemas que provoca el exceso de desechos plásticos, se
requiere de una legislación medioambiental adecuada y de organismos cen-
trales y municipales que incentiven la participación masiva de las personas en
la clasificación y entrega de los plásticos desechados para su reciclaje.
http://www.eia.doe.gov/kids/energyfacts/saving/recycling/solidwaste/plastics.
html
Guía didáctica para el profesor 35
QUIM4M Prof01-92 MINIST_2010.indd 35 20/10/09 10:52:17
Unidad 1
Actividad de aplicación:
Eres el dueño de una manufactura de plásticos
(Página 55)
Algunos objetos plásticos y técnicas principales de manufacturación.
Objeto plástico Técnica de fabricación
Envases para yogur Moldeo
Tubos de PVC Extrusión
Cucharas plásticas Moldeo
Botellas de bebida Moldeo
Bidones Moldeo
Fundas para computador Calandrado
Bolígrafos Inyección
Juguetes Inyección
Espumas plásticas Espumación
Portafolios Calandrado
Actividad indagatoria:
¿Cómo se identifican los plásticos para poder reciclarlos?
(Página 56)
Se clasifican en 7 categorías, que algunas veces vienen incorporadas en artículos
plásticos
1. Polietiléntereftalato (PET)
2. Polietileno de alta densidad (PEAD)
3. Poli (cloruro de vinilo) (PVC)
4. Polietileno de baja densidad (PEBD)
5. Polipropileno (PP)
6. Poliestireno (PS)
7. Otros polímeros (policarbonatos, poliuretanos, etc.)
Sugerencia: Para el reciclaje de plásticos, consultar la siguiente página web:
ttp://www.reschile.cl/default_26.html
Esta actividad es muy enriquecedora para el o la estudiante, ya que el profesor
o profesora tendrían la opción de promover en su Liceo o Colegio una brigada
ambientalista de recolección y clasificación de plásticos de desecho que se pro-
ducen en su establecimiento. Una vez realizada la recolección y clasificación,
podrían ser entregados a la municipalidad de la comuna o algún organismo
encargado del reciclaje.
36 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 36 20/10/09 10:52:17
Actividad experimental:
Propiedades físicas de los plásticos
(Página 57)
A continuación se indican algunas propiedades físicas de plásticos comunes
que el profesor o profesora pueden utilizar al integrar el Laboratorio con sus
alumnos.
PLÁSTICO
Polietileno alta
Material Prueba Polipropileno PVC Poliestireno
densidad
Flexibilidad Buena Excelente Buena Mala
Color del pliegue Ligeramente blanco No cambia No cambia Blanco
Dureza Se raya Se raya Se raya Se raya
Se reblandece
Efecto de la acetona No le afecta No le afecta Se reblandece
mucho
Tiras
Efecto del calor No le afecta Se dobla mucho Se dobla No le afecta
Transmisión de la luz
Opaco /
(transparente, translúcido u Translúcido Transparente Transparente
translúcido
opaco)
Alcohol +
Flota Se hunde Se hunde Se hunde
agua
Granos
Densidad
Agua Flota Se hunde Flota Se hunde
Flota o se hunde
Agua + sal Flota Se hunde Flota Flota
Advertencia: Las experiencias de solubilidad con acetona y de calentamiento con
mechero deben hacerse bajo una estricta supervisión del profesor o profesora.
Guía didáctica para el profesor 37
QUIM4M Prof01-92 MINIST_2010.indd 37 20/10/09 10:52:17
Unidad 1
5.1.3 Solucionarios
Evaluación capítulo 1
Polímeros naturales (Página 39)
Mapas conceptuales y autoevaluación (KPSI)
1. Observa las estructuras de la α-D-glucosa y de la b-D-glucosa. ¿Cuál es la
diferencia entre ellas?
R: En el carbono anomérico de la forma cíclica hemiacetálica, la α-D-glucosa
tiene un grupo OH por debajo del plano del anillo; en cambio, en la b-D-
glucosa el grupo OH está por arriba del plano del anillo.
2. ¿Cuál es la estructura que resulta de la condensación entre dos moléculas de
glucosa, si la unión es α 1, 4? ¿A cuál compuesto corresponde? Averígualo.
R: Al producirse esta condensación, la molécula resultante es la maltosa.
3. ¿Cuál es la estructura que resulta de la condensación entre dos moléculas de
glucosa, si la unión es b 1, 4? ¿A cuál compuesto corresponde? Averígualo.
R: Al producirse esta condensación, la molécula resultante es la celobiosa.
4. La celulosa y el almidón son polímeros naturales. ¿Cuáles son sus semejanzas
y cuáles sus diferencias?
R: Semejanzas: Son los polisacáridos más abundantes. Están formados por
la unión de unidades de glucosa. Por no poseer grupos OH libres, en el
carbono anomérico (salvo en el último), no son reductores y no presentan
mutarrotación.
Diferencias: En la celulosa las unidades de glucosa están unidas por enlaces
b-1,4 y en el almidón por enlaces α-1,4 con ramificaciones α-1,6. La celulosa
es completamente insoluble en agua y es el principal constituyente de las
paredes celulares en las plantas. El almidón es parcialmente soluble en agua
y constituye la reserva energética de las plantas.
5. ¿Cuál es el monómero del caucho natural?
R: El monómero del caucho natural es el isopreno, en el que los dobles en-
laces tienen la configuración cis.
6. ¿Qué significa que un aminoácido se clasifique como esencial?
R: Los aminoácidos que no pueden ser sintetizados por el organismo humano se
clasifican como esenciales, por lo que deben ser suministrados en la dieta.
38 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 38 20/10/09 10:52:17
7. ¿Qué diferencia a un aminoácido de carácter ácido de un aminoácido de
carácter básico?
R: Un aminoácido de carácter ácido es el que tiene mayor cantidad de grupos
ácidos que básicos en la molécula, y un aminoácido de carácter básico es el
que tiene mayor cantidad de grupos básicos que ácidos en la molécula.
8. ¿Cuáles son los aminoácidos presentes en la mayor parte de la fibroína de
la seda?
R: La fibroína tiene un alto contenido de los aminoácidos glicina, alanina y
serina.
9. ¿Cuáles son los monómeros constituyentes de la lana y el pelo?
R: Están formados, principalmente, por queratina, proteína fibrosa, rica en
cisteína.
10. ¿Cuáles son las características que debe tener una molécula para ser el mo-
nómero de un polímero?
R: Debe tener un grupo funcional que le permita reaccionar consigo misma a
través de reacciones de adición o con otro grupo funcional igual o diferente
a través de reacciones de condensación.
11. Define “estructura primaria de una cadena polipeptídica”.
R: Corresponde a la secuencia lineal de aminoácidos de la cadena polipep-
tídica, que le confiere su identidad individual.
12. ¿Cuál es la diferencia entre las estructuras secundarias y terciarias de una
proteína con la estructura cuaternaria de la misma?
R: Las estructuras secundarias y terciarias se originan por las interacciones
internas, principalmente enlaces de hidrógeno, de los grupos CO y NH en
una cadena polipeptídica; en cambio, la estructura cuaternaria resulta de las
interacciones entre distintas cadenas polipeptídicas.
13. Explica brevemente la desnaturalización de una proteína.
R: Corresponde a la destrucción, generalmente irreversible, principalmente
de la estructura terciaria de una proteína globular por un cambio en el pH
o en la temperatura. De esta forma, se pierde la forma esférica resultante
de las débiles interacciones intramoleculares y con ello se pierde su acción
específica.
14. ¿Por qué las proteínas, el ADN y el ARN se consideran como polímeros?
R: Porque están constituidas por la repetición de unidades monómericas.
En el caso de las proteínas por polipéptidos y en los ácidos nucleicos por
nucleótidos.
Guía didáctica para el profesor 39
QUIM4M Prof01-92 MINIST_2010.indd 39 20/10/09 10:52:17
Unidad 1
15. Las proteínas presentan una organización estructural que depende de las
interacciones entre los aminoácidos que las forman. ¿Cuáles son las carac-
terísticas de las estructuras primaria, secundaria, terciaria y cuaternaria?
R: Estructura primaria. Indica la secuencia de los aminoácidos en una cadena
polipeptídica.
Estructura secundaria. Se refiere a la forma como interacciona una cadena
polipeptídica consigo misma a través de enlaces de hidrógeno.
Estructura terciaria. Caracteriza la forma en que se curvan o pliegan en el
espacio los segmentos del esqueleto peptídico.
Estructura cuaternaria. Es la forma como se agrupan espacialmente varias molé-
culas de proteínas globulares para formar grandes agregados estructurales.
16. Una hebra de ADN contiene la siguiente secuencia de bases nitrogenadas:
ATC – CCT – TTT – ATT – TCA – ATG
a) ¿Cuál será la secuencia del ARNm?
AUC – CCU – UUU – AUU – UCA – AUG
b) ¿Cuál será la secuencia de aminoácidos de la cadena de proteína
formada?
Ile – Pro – Fen – Ile – Ser – Met
17. Una proteína presenta la siguiente estructura primaria de un péptido:
Ala – Val – Lys – Asp – Glu – Met – Ala – Pro – Thr – Leu
a) ¿Cuál podría ser la secuencia de bases nitrogenadas de la hebra de ADN
que formó este péptido?
GCT – GTT – AAA – GAT – GAA – ATG – GCT – CCT – ACT – UUT
b) Representa el enlace entre tres de los aminoácidos de la estructura primaria
del péptido citado.
Por ejemplo, para el segmento inicial Ala – Val – Lis.
40 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 40 20/10/09 10:52:17
Evaluación capítulo 2
Polímeros sintéticos (Página 59)
Mapas conceptuales y autoevaluación (KPSI)
1. ¿Cuál es la diferencia entre el caucho natural y el caucho vulcanizado?
R: El caucho natural es un polímero del isopreno. Cuando se somete a un
tratamiento con azufre elemental se producen enlaces S-S entre las cadenas
isoprénicas, obteniéndose el caucho vulcanizado.
2. La baquelita es uno de los primeros polímeros sintéticos. ¿A partir de cuáles
monómeros se sintetiza?
a) fenol y formaldehído
b) estireno y butadieno
c) caucho natural y alcohol polivinílico
R: Se sintetiza por sucesivas condensaciones entre fenol y formaldehído.
3. Explica por qué una polimerización aniónica se produce de preferencia por
ataque de un anión sobre el doble enlace de un alqueno que posee sustitu-
yentes atractores de electrones.
R: Los sustituyentes atractores de electrones unidos a un doble enlace lo
polarizan, disminuyendo la densidad electrónica sobre él; luego el ataque de
un anión (con carga negativa) sobre el doble enlace está favorecido.
4. Explica por qué una polimerización catiónica se produce de preferencia por
ataque de un catión sobre el doble enlace de un alqueno que posee sustitu-
yentes dadores de electrones.
R: Los sustituyentes dadores de electrones unidos a un doble enlace lo po-
larizan aumentando la densidad electrónica sobre él; luego el ataque de un
catión (con carga positiva) sobre el doble enlace está favorecido.
5. Explica las diferentes etapas de una polimerización por radicales libres.
R: En la primera etapa se produce el radical libre por descomposición de un
iniciador, habitualmente un peróxido (Etapa de iniciación).
En la segunda etapa, el radical libre reacciona con el sustrato, produciéndose
el polímero por una reacción en cadena (Etapa de propagación).
En una tercera etapa, se produce la combinación de radicales libres terminando
de este modo la propagación (Etapa de término).
Guía didáctica para el profesor 41
QUIM4M Prof01-92 MINIST_2010.indd 41 20/10/09 10:52:17
Unidad 1
6. Nombra al menos cinco polímeros sintéticos de adición y describe estructu-
ralmente sus monómeros.
R:
Polímero Monómero
Polietileno Etileno
Poliestireno Etenilbenceno
Polipropileno Propileno
PVC Cloruro de vinilo
Teflón Tetrafluoroetileno
7. Indica cinco tipos de polímeros sintéticos de condensación e indica, por lo
menos, dos usos de cada uno de ellos en la vida cotidiana.
R:
Polímero Monómero
Siliconas Lubricantes, selladores.
Fibras textiles para tapices, secadores de
Poliamidas
pelo, medias.
Policarbonatos Cascos de seguridad, cielos artificiales.
Poliuretanos Espumas, aislantes térmicos.
Fibras para confección de ropa, envases para
Polietilen tereftalato (PET)
alimentos y bebidas gaseosas.
8. Los polímeros sintéticos se pueden obtener por adición o condensación. ¿Cuáles
son las diferencias entre estos dos tipos de procesos de polimerización?
R: Un polímero de adición resulta de un proceso por adición consecutiva de
una molécula a una cadena sin pérdida de átomos en el proceso; en cambio,
un polímero de condensación resulta de la reacción entre sí de monómeros
bifuncionales con pérdida de moléculas pequeñas, como agua o alcoholes.
9. Clasifica los siguientes productos comerciales como polímeros de condensa-
ción o de adición:
a) Nylon b) Polietileno
c) Policarbonatos d) Teflón
e) Dacrón f) PVC
R: Polímeros de adición: b, d , f
Polímeros de condensación: a, c, e
42 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 42 20/10/09 10:52:17
10. Escribe el nombre del polímero representado por las siguientes siglas:
a) PP
b) PVC
c) PS
d) PET
e) PEAD
R:
a) Polipropileno
b) Poli(cloruro de vinilo)
c) Poliestireno
d) Polietiléntereftalato
e) Polietileno de alta densidad.
11. ¿Cuál(es) de los siguientes polímeros artificiales se clasifica(n) como
homopolímeros?
I) Polietileno II) Poliestireno III) Caucho natural
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
R: I, II y III (alternativa e)
Un homopolímero es un polímero formado por la repetición de un solo tipo
de monómero. Por ejemplo, polietileno (I) formado Solo por monómeros de
etileno, poliestireno formado Solo por unidades de estireno y el caucho natural
(III) que está formado Solo por unidades de isopreno.
12. ¿Cuáles de los polímeros citados a continuación se obtienen por
condensación?
I) PE II) PP III) PET IV) Policarbonatos
A) Solo I y II
B) Solo III y IV
C) Solo I y III
D) Solo II y IV
E) Solo II, III y IV
R: Solo III y IV. El polietileno (PE) y el polipropileno son polímeros formados
por la adición sucesiva de etileno y propileno, respectivamente. En cambio,
el polietiléntereftalato (III) se produce por condensación entre tereftalato
de dimetilo y etilénglicol, y el policarbonato se produce por condensación
entre carbonato de difenilo y un difenol (por ej.; carbonato de difenilo y
bisfenol A).
Guía didáctica para el profesor 43
QUIM4M Prof01-92 MINIST_2010.indd 43 20/10/09 10:52:17
Unidad 1
Evaluación de la Unidad 1
Polímeros naturales y sintéticos (Página 63)
Respuestas: 1C 2B 3B 4D 5E 6D 7D 8C 9E
10D 11B 12A 13C 14C 15D 16E 17D 18D
19A 20D 21B 22B 23E
1. De los siguientes polímeros, ¿cuáles tienen un origen natural?
I) Teflón
II) Nylon
III) Algodón
IV) Seda
A) Solo I y II
B) Solo II y III
C) Solo III y IV
D) Solo I y III
E) Solo II y IV
2. Se afirma que, en su estructura de cadena abierta, la glucosa presenta grupos
funcionales:
I) aldehído
II) cetona
III) alcohol primario
IV) alcohol secundario
V) alcohol terciario
Es (son) correcta(s)
A) Solo I, II y III.
B) Solo I, III y IV
C) Solo II, III y V
D) Solo III, IV y V
E) Solo I, III, IV y V
3. El almidón es un polímero natural formado por moléculas de:
A) ribosa
B) glucosa
C) sacarosa
D) galactosa
E) fructosa
44 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 44 20/10/09 10:52:18
4. Se afirma que la celulosa se diferencia del almidón por:
I) su solubilidad en agua.
II) el monómero que lo compone.
III) el enlace glicosídico.
Es (son) correcta(s)
A) Solo I
B) Solo II
C) Solo III
D) Solo I y III
E) I, II y III
5. ¿Cuántos tripéptidos pueden resultar de la unión peptídica entre alanina,
valina y glicina?
A) 2
B) 3
C) 4
D) 5
E) 6
6. La hidrólisis enzimática de un ácido nucleico origina los nucleósidos que
están constituidos:
A) Solo por una base heterocíclica.
B) Solo por una pentosa.
C) Solo por una pentosa y ácido fosfórico.
D) Solo por una pentosa y una base heterocíclica.
E) Por una pentosa, ácido fosfórico y una base heterocíclica.
7. Una aldohexosa es una molécula que contiene:
A) 1 grupo aldehído y 6 grupos alcohol.
B) 1 grupo cetona y 5 grupos alcohol.
C) 6 grupos alcohol.
D) 1 grupo aldehído y 5 grupos alcohol.
E) 1 grupo cetona y 6 grupos alcohol.
8. ¿Cuál de los siguientes polímeros artificiales se clasifica como un polímero
termoplástico?
A) Baquelita
B) Teflón
C) Poliestireno
D) Caucho
E) PVC
Guía didáctica para el profesor 45
QUIM4M Prof01-92 MINIST_2010.indd 45 20/10/09 10:52:18
Unidad 1
9. Los polímeros pueden obtenerse en forma de granulados mediante un
proceso de:
A) moldeo
B) vulcanización
C) calandrado
D) espumación
E) extrusión
10. ¿En cuál método de procesamiento de plásticos se adiciona un gas para
otorgar mayor porosidad al polímero obtenido?
A) moldeo
B) vulcanización
C) calandrado
D) espumación
E) extrusión
11. ¿Cuál es el polímero de mayor uso en la fabricación de bolsas para el em-
paque de productos en supermercados?
A) PVC
B) Polietileno
C) PET
D) Poliestireno
E) Polipropileno
12. Uno de los materiales poliméricos que habitualmente no se somete a reci-
claje es el:
A) teflón
B) polipropileno
C) poliestireno
D) PVC
E) polietileno
13. ¿Cuáles de los siguientes materiales son polímeros naturales?
I) PVC II) baquelita III) proteínas
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo I y III
46 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 46 20/10/09 10:52:18
14. Son características de un polímero tener:
I) varias unidades de un compuesto llamado monómero.
II) propiedades físicas similares al monómero.
III) propiedades físicas distintas al monómero.
IV) masa molar variable.
A) Solo I
B) Solo I y II
C) Solo I y III
D) Solo I y IV
E) Solo I, III y IV
15. Una polimerización por condensación se caracteriza por:
A) la reacción de monómeros insaturados.
B) el desprendimiento de oxígeno durante la reacción.
C) la absorción de agua durante el proceso.
D) la liberación de moléculas simples durante el proceso.
E) el desprendimiento de hidrógeno.
16. ¿Cuál (es) de las siguientes materias primas se pueden usar para producir
plásticos orgánicos?
I) Petróleo
II) Gas natural
III) Carbón
A) Solo I
B) Solo II
C) Solo III
D) Solo II y III
E) I, II y III
17. ¿Cuál es el significado químico de la sigla PP?
A) Polietileno de alta densidad.
B) Poliestireno.
C) Poli(cloruro de vinilo).
D) Polipropileno.
E) Polietileno de baja densidad.
Guía didáctica para el profesor 47
QUIM4M Prof01-92 MINIST_2010.indd 47 20/10/09 10:52:18
Unidad 1
18. El poli(cloruro de vinilo) proviene de la polimerización de:
A) Dicloroetano
B) Dicloroeteno
C) Cloroetano
D) Cloroeteno
E) Cloroformo
19. Para fabricar una tubería plástica, el mejor método sería:
A) Extrusión
B) Inyección
C) Extrusión y soplado
D) Calandrado
E) Espumación
20. La transferencia de diferentes aditivos desde el material plástico hacia los
alimentos, se denomina
A) Extrusión
B) Reciclaje
C) Calandrado
D) Migraciones
E) Oxidaciones
21. Los plásticos que una vez moldeados no pueden modificar su forma se
denominan:
A) termoplásticos.
B) termorrígidos.
C) resinas.
D) coloides.
E) proteínas.
22. Son polímeros obtenidos por una reacción de condensación:
I) Caucho natural
II) Proteínas
III) Nylon
IV) Poliestireno
A) Solo I y II
B) Solo II y III
C) Solo III y IV
D) Solo I y III
E) Solo II y IV
48 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 48 20/10/09 10:52:18
23. Son polímeros obtenidos por polimerización de adición el:
I) polipropileno.
II) poliestireno.
III) poli(cloruro de vinilo).
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
Preguntas abiertas
24. ¿Cuál es la diferencia estructural entre el almidón y la celulosa?
25. ¿Cuál es la estructura del monómero del caucho natural?
26. ¿Cuándo se puede considerar a un polipéptido como una proteína?
27. ¿Por qué no se puede considerar a una proteína como un polímero de un
determinado polipéptido?
28. La siguiente estructura corresponde a una parte de un polipéptido:
La hidrólisis de esta parte del polipéptido origina tres aminoácidos. Escribe
las estructuras para estos tres aminoácidos, identifícalos y clasifícalos, según
corresponda como ácido, neutro o básico.
29. ¿Qué tipo de compuestos se producen por hidrólisis de los nucleótidos?
30. ¿Cuáles son los azúcares presentes en los ácidos nucleicos?
31. ¿Qué diferencia hay entre un nucleótido y un nucleósido?
32. ¿Cuál es el proceso químico que ocurre en la vulcanización del caucho
natural?
33. ¿Cómo se produce la polimerización del estireno por radicales libres?
34. Nombra tres polímeros obtenidos por reacciones de condensación.
35. ¿Cuál es la diferencia entre un polímero termoplástico y un polímero
termorrígido?
Guía didáctica para el profesor 49
QUIM4M Prof01-92 MINIST_2010.indd 49 20/10/09 10:52:18
Unidad 1
36. Escribe la estructura de un segmento del teflón que se considere como su
monómero.
37. ¿Qué problemas pueden presentarse en el reciclaje de los materiales
plásticos?
Solucionario de preguntas abiertas
24. La diferencia entre el almidón y la celulosa está en el tipo de enlace gluco-
sídico que une sus distintos monómeros.
25. El monómero del caucho es el isopreno (2-metil-1,3-butadieno), el cual es
un líquido volátil.
26. Cuando un dipéptido participa en una reacción de condensación con otro
aminoácido forman un tripéptido. Si esto se repite sucesivamente, obten-
dremos un producto final que es una molécula de proteína, un polipéptido,
que puede representar un polímero de aminoácido.
27. Porque las proteínas se forman a partir de los aminoácidos y cada una
posee una secuencia única de aminoácidos que la forman, por lo que son
un polímero de aminoácidos; y no corresponden a una repetición de un
determinado polipéptido.
28. Fenilalanina, básico; Histidina, neutro; ácido aspártico, ácido.
29. Se producen nucleósidos.
30. Las pentosas, ribosa y desoxirribosa, las cuales son monosacáridos compuestos
de una cadena carbonada.
31. Un nucleótido está formado por una pentosa, una base nitrogenada y un
grupo fosfato, mientras que el nucleósido es una mólecula monomérica
orgánica, con una base nitrogenada y una pentosa.
32. El proceso químico corresponde a reacciones de adición: en este proceso se
adicionan en algunos dobles enlaces de la macromolécula de caucho azufre,
el que forma enlaces covalentes S-S, llamados puentes di sulfuros. Esto le
otorga mayor estabilidad al caucho y aumenta su elasticidad.
33. La polimerización del estireno necesita de un iniciador, que generalmente
es un peróxido, que rompe y genera radicales libres. Estos radicales permiten
que se inicie la reacción y que se formen radicales tipo R- , que reaccionan
durante la propagación de la polimerización.
34. Nylon, dracón (poliéster) y poliuretano.
50 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 50 20/10/09 10:52:18
35. La diferencia es que los polímeros termoplásticos son maleables al aumentar
su temperatura, por lo que son reciclables; mientras que los termorrígidos,
no son pueden ser nuevamente modelados al aumentar su temperatura,
siendo rígidos y duros.
36. El monómero del teflón es llamado tetrafluoretileno el cual se puede repre-
sentar de acuerdo a la siguiente figura:
37. Existen una serie de problemas, entre los cuales se pueden mencionar: el alto
costo económico conlleva a reutilizar los plásticos; el valor en el mercado
económico es bajísimo, por lo que no es rentable; su recolección es difícil
y costosa, etc.
5.1.4 Errores y dificultades más frecuentes
En el tratamiento de esta unidad, es posible encontrar algunas dificultades oca-
sionadas por algunas preconcepciones erróneas que los estudiantes manifiestan
al momento de abordar los contenidos de cada capítulo.
Una de las dificultades principales en la enseñanza de polímeros, especialmente
biopolímeros, es que ha sido un tema con características diferentes a los tópi-
cos tradicionales de la química y que han sido abordados unilateralmente en la
asignatura de Biología.
a) Relación entre macromoléculas y polímeros. El alumno puede creer que to-
das las macromoléculas son polímeros. Los polímeros están formados por la
unión de un gran número de moléculas más pequeñas (monómeros). Luego,
un polímero es una macromolécula, pero no debe confundirse con otras
macromoléculas como la clorofila o la hemoglobina.
b) En las polimerizaciones por adición puede producirse una cierta dificultad en
la comprensión de los mecanismos por radicales libres, aniónicos o catiónicos.
En las polimerizaciones por condensación, la identificación de los reactivos
iniciales también es compleja, porque hay que considerar las moléculas que
se pierden en la fornación del polímero.
Con respecto a las estructuras tridimensionales de los polímeros naturales
o biomoléculas.
Preguntas iniciales:
¿Cuáles son las principales funciones de los polímeros naturales?
¿Qué diferencia al almidón del glicógeno?
¿Por qué las proteínas adoptan diversas estructuras tridimensionales?
Animación tridimensional de la hemoglobina: Software (ACDLABS, PYMOL,
ARGUSLAB, WEBLAB LITE) o Sitio Web.
Guía didáctica para el profesor 51
QUIM4M Prof01-92 MINIST_2010.indd 51 20/10/09 10:52:18
Unidad 1
Con respecto a la presencia y usos de los polímeros sintéticos en nuestra
vida cotidiana.
Preguntas iniciales:
¿Cuáles son los principales usos de los polímeros de adición?
¿Cuáles son los principales usos de los polímeros de condensación?
Animaciones de las diferentes reacciones de polimerización y videos del uso de
estos polímeros sintéticos. (Por ejemplo: los policarbonatos en la fabricación de
lentes ópticos)
5.1.5 Anexos
5.1.5.1 Material complementario de apoyo a los CMO
Animaciones (applets/flash) para ejercitar y profundizar los temas tratados en
la Unidad.
http://www.colegioheidelberg.com/deps/fisicaquimica/
Capítulo 1: Polímeros naturales
El ADN
Animación que explica qué es el ADN, los tipos de ADN, los procesos de análisis
del ADN, sus aplicaciones y enlaces para saber más.
http://www.andaluciainvestiga.com/espanol/cienciaAnimada/cienciaAnimada.
asp
Forma cíclica de la glucosa
Animación que simula la constitución de la forma cíclica de la glucosa.
http://www.juntadeandalucia.es/averroes/manuales/glucidos/glucosa.swf
Formación de un disacárido (Maltosa)
Animación sobre la formación del disacárido maltosa.
http://www.juntadeandalucia.es/averroes/manuales/glucidos/disacaridos/
carbohyd.htm
http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/biomol/conte-
nidos7.htm
Biomoléculas: aminoácidos, proteínas y ácidos nucleicos.
Biomoléculas animadas en tres dimensiones.
http://www.um.es/bbmbi/Docencia/Practicas/Medicina/VirtualesMedicina/
contenido/biomodel/model3/inicio.htm
52 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 52 20/10/09 10:52:18
Capítulo 2: Polímeros sintéticos
Así se hace una botella de plástico
Video que muestra el proceso de formación de una botella de plástico.
http://tecnotic.wordpress.com/2008/02/01/asi-se-hace-botella-de-plastico/
Así se hace una bolsa de plástico
Video que muestra el proceso de formación de una bolsa de plástico.
http://tecnotic.wordpress.com/2008/02/01/asi-se-hace-bolsas-de-plastico/
• Elaboración de Mapas Conceptuales para los capítulos
de la Unidad 1: Los polímeros
Capítulo 1: Polímeros naturales
Conceptos Conectores (palabras de enlace)
Polímeros naturales.
Proteína.
Aminoácido.
Estructura primaria, secundaria, terciaria y
cuaternaria.
Ácidos nucleicos: ADN y ARN.
Nucleótido.
Capítulo 2: Polímeros sintéticos
Conceptos Conectores (palabras de enlace)
Polímero sintético.
Monómero: Homopolímeros y Copolímeros.
Polimerización por adición: aniónica, catiónica y por
radicales libres.
Polimerización por condensación.
Procesos industriales: Moldeo o inyección, extrusión,
calandrado, espumación.
Identificación industrial de los polímeros.
Guía didáctica para el profesor 53
QUIM4M Prof01-92 MINIST_2010.indd 53 20/10/09 10:52:18
Unidad 1
• Autoevaluación (KSPI)
Utilizando las categorías siguiente, marque con una X en el recuadro que corres-
ponde a su nivel de conocimiento de acuerdo a lo afirmado.
Categorías:
1. Se lo podría explicar a mis compañeros.
2. Creo que lo sé.
3. No lo entiendo.
4. No lo sé.
Capítulo 1: Polímeros naturales
Afirmaciones 1 2 3 4
Polímeros naturales.
Proteína.
Aminoácido.
Estructura primaria, secundaria, terciaria y cuaternaria.
Ácidos nucleicos: ADN y ARN.
Nucleótido.
Capítulo 2: Polímeros sintéticos
Afirmaciones 1 2 3 4
Polímero sintético.
Monómero: Homopolímeros y Copolímeros.
Polimerización por adición: aniónica, catiónica y por radicales libres.
Polimerización por condensación.
Procesos industriales: Moldeo o inyección, extrusión, calandrado,
espumación.
Identificación industrial de los polímeros.
54 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 54 20/10/09 10:52:18
5.1.5.2. Recursos electrónicos para la Unidad 1: Los Polímeros
Capítulo 1: Polímeros naturales
Modelos moleculares
http://www.usal.es/~dbbm//modmol/
Ayudas al aprendizaje de bioquímica, biotecnología y biología molecular.
http://www.biorom.uma.es/indices/index.html
Capítulo 2: Polímeros sintéticos
Macrogalleria: el maravilloso mundo de los polímeros.
http://pslc.ws/spanish/index.htm
Polímeros: material del futuro.
http://www.consumer.es/web/es/medio_ambiente/urbano/2006/04/06/150776.
php
Ficha temática: Polímeros sintéticos y naturales
h t t p : / / w w w. e d u c a r c h i l e . c l / Po r t a l . B a s e / We b / Ve r C o n t e n i d o .
aspx?GUID=956d0e27-85f4-48ec-bd90-137b6963f06c&ID=136400
Microproyectos de investigación.
Polímeros naturales y sintéticos
La propuesta didáctica presentada en este artículo está diseñada con la finalidad
de que los alumnos recojan, analicen y procesen saberes y actitudes propias de
la actividad científica, y aprendan a utilizarlos en la toma de decisiones sobre
problemas sociales actuales. Del mismo modo, permite relacionar los nuevos
conocimientos que se proponen con los ya existentes en las estructuras cog-
nitivas, realizando una asimilación eficaz de los nuevos contenidos a partir del
aprendizaje significativo (Ausubel, 1983).
La realización de experiencias y el planteamiento de preguntas abiertas y de situa-
ciones simuladas favorecen la transición del pensamiento concreto al abstracto,
lo cual es importante para el desarrollo del razonamiento intelectual formal de
los estudiantes, al mismo tiempo que motivan a conocer y experimentar qué es
realmente la ciencia, a comprender su potencial y sus limitaciones, y a integrar
diversas disciplinas de estudio.
La propuesta relaciona contenidos de Química con temas medioambientales,
tecnológicos y sociales. Plantea, además, el aprendizaje de las ciencias a partir
del estudio experimental y la discusión de temas de actualidad relacionados con
los productos químicos.
http://www.rieoei.org/experiencias79.htm (accesada el 20/02/2008)
Software para hacer mapas conceptuales
EDraw: es un software para crear mapas conceptuales y mentales, permite dibujar
de manera rápida y fácil los mapas mentales y conceptuales (representaciones
gráficas de los procesos del pensamiento) para reflexionar sobre un concepto,
Guía didáctica para el profesor 55
QUIM4M Prof01-92 MINIST_2010.indd 55 20/10/09 10:52:18
Unidad 1
solucionar un problema. Incluye millares de gráficos confeccionados para que
el usuario los utilice de manera simple en la elaboración de su mapa.
http://www.edrawsoft.com/freemind.php (accesado el 21/02/2008)
FreeMind: es un software para crear y visualizar mapas conceptuales; este pro-
grama es software libre (GNU)
http://freemind.sourceforge.net/wiki/index.php/Main_Page (accesado el
21/02/2008)
CmapTools: este software, desarrollado por el “Institute for Human and Machine
Cognition” (IHMC), de la Universidad de West Florida (Estados Unidos), se diseñó
con el objeto de apoyar la construcción de modelos de conocimiento represen-
tados en forma de “Mapas Conceptuales”, aunque también pueden elaborarse
con él “Telarañas”, “Mapas de Ideas” y “Diagramas Causa-Efecto”, todos dentro
de un entorno de trabajo intuitivo, amigable y fácil de utilizar
http://cmap.ihmc.us/
56 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 56 20/10/09 10:52:18
Material fotocopiable
5.1.5.3. Instrumento de evaluación
Nombre del alumno(a):_____________________________________
Tema: Evaluación 1 Polímeros naturales
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. Una de las siguientes asociaciones carbohidrato-función no corresponde:
A) glucosa – principal fuente de energía del organismo.
B) celulosa – constituyente principal de la pared celular de los hongos.
C) desoxirribosa – constituyente del ADN.
D) maltosa – fuente energética para el desarrollo del embrión de cereales.
E) lactosa – fuente energética en mamíferos lactantes.
2. Son considerados compuestos orgánicos constituyentes de los seres vivos:
I. Los carbohidratos.
II. El agua.
III. Los lípidos.
IV. Las proteínas.
A) Solo I y III
B) Solo I y IV
C) Solo II, III y IV
D) Solo I, III y IV
E) I, II, III y IV
3. Los nucleósidos son:
A) Estructuras constituidas por un azúcar, un grupo fosfato y una base nitrogenada.
B) Glucósidos constituidos por una pentosa y un grupo fosfato.
C) Glucósidos constituidos por una hexosa y una pentosa.
D) Glucósidos constituidos por una pentosa y una base nitrogenada.
E) Estructuras constituidas por dos unidades de pentosa y una base.
4. Se considera que la forma piranósica de la D-glucosa es un hemiacetal
cíclico producido por la reacción entre:
A) El grupo aldehído de la posición 1 y el OH del Carbono 6
B) El grupo aldehído de la posición 1 y el OH del Carbono 4
C) El grupo OH del Carbono 2 y el OH del Carbono 6
D) El grupo aldehído de la posición 1 y el OH del Carbono 5
E) El grupo aldehído de la posición 1 y el OH del Carbono 3
Guía didáctica para el profesor 57
QUIM4M Prof01-92 MINIST_2010.indd 57 20/10/09 10:52:18
Unidad 1
Material fotocopiable
5. La molécula de azúcar que forma parte de los ácidos nucleicos:
A) Es cualquier D-aldopentosa
B) Es D-ribosa ó D-2-desoxirribosa
C) Se une a la posición 1 de las purinas
D) Está en forma furanósica
E) Ninguna de las anteriores
6. La desoxirribosa:
A) Se encuentra en las moléculas de ARN
B) Es la D-3-desoxirribosa
C) Se encuentra en la forma furanósica
D) Es la L-2desoxirribosa
E) Se encuentra en la forma piranósica
7. En la estructura de los polinucleótidos (ácidos nucleicos) el grupo fosfato
hace de puente entre:
A) el C1 de una pentosa con el C3 de otra pentosa.
B) el C3’ de una pentosa con el C3’ de otra pentosa.
C) el C3’ de una pentosa con el C5’ de otra pentosa.
D) el N9 de una pentosa con el C1’ de otra pentosa.
E) el C3 de una pentosa con el N9 de otra pentosa.
Solucionario de la evaluación 1. Polímeros naturales.
1. b); 2. d); 3. d); 4. d); 5. b); 6. c); 7. c)
58 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 58 20/10/09 10:52:18
5.1.6 Bibliografía de la Unidad
1. R. K, Murray, P. A. Mayes, D. K. Granner, V. W. Rodwell. Bioquímica de Harper.
14ª edición. Editorial Manual Moderno S.A. de C.V., 1997.
2. J. Mc Murry. Química Orgánica. 6ª Edición. Thomson (2004).
3. H. Hart, D. J. Hart, y L. E. Craine. Química Orgánica. 9ª Edición. McGraw-Hill
S.A. de C.V. (1995).
4. J. W. Hill y K. D. Kolb. Química para el nuevo milenio. 8ª Edición. Pearson,
Prentice Hall Hispanoamericana, S.A. (1999).
5. R. Chang. Química. 9ª Ed. Española. McGraw Hill, 2007
6. M. A. Fox, y J. K. Whitesell. Química Orgánica. 2ª Edición, Pearson Education,
Prentice Hall (2000).
7. T. L. Brown, H. E. LeMay y B. E. Bursten. Química. La ciencia central. 9ª Edición
Española. Pearson Educación, 2004.
Guía didáctica para el profesor 59
QUIM4M Prof01-92 MINIST_2010.indd 59 20/10/09 10:52:18
Unidad 2
5.2 Segunda Unidad: Fenómenos nucleares y sus aplicaciones
Mapa conceptual de la Unidad
Radioactividad
Ecuación nuclear: forma Decaimiento radiactivo: Pérdida de partículas α,
desintegración espontánea de se produce β– o β+
gráfica que describe la transfor- mediante
mación de reactantes a productos. un núcleo, generando núcleos o bien, captura de β–.
de menor masa, partículas
pequeñas y energía. se detecta
mediante un Detector Geiger
se representa de la radiactividad.
se expresa
por una mediante una se relaciona
con la
Reacción nuclear: conversión
de elementos en otros, mediante
reacción con algún tipo de partícula, Cinética del decaimiento Vida media: tiempo que
fragmentación nuclear en núcleos radiactivo: velocidad con se toma en desintegrase a la
caracteriza
más livianos, liberación de partículas que ocurre la desintegración por mitad una muestra de un
subatómicas, absorción o liberación nuclear. radioisótopo específico.
de radiación electromagnética
altamente energética.
es importante
de utilidad en
Permite la
Series radiactivas
naturales: sucesión Serie del
Transmutación nuclear: con- de reacciones nuclea- uranio-238: que decae e
versión inducida de un núcleo en res que experimentan ejemplo con una vida media de
otro de un elemento diferente medi- núcleos inestables con 4,51 ⋅ 109 años
ante bombardeo con partículas. Z > 83 hasta convertirse
en un núcleo estable
Permite la obtención de
Aplicaciones de radio- Datación con C-14:
isótopos: en datación, como de materiales de origen
Elementos transuránicos: trazador y seguimiento de orgánico vegetal o animal.
elementos que se encuentran más rutas de reacciones, irradia-
allá del uranio y se obtienen sinté- ción de alimentos, en cursos ejemplos
ticamente mediante transmutación de aguas y medicina nuclear.
nuclear. Datación con U-238:
de rocas que contengan
produce este isótopo.
ejemplos
Efectos de la radiación
en los seres vivos: daño, Usos en la medicina:
tolerancia y beneficios oca- como medio de diagnóstico
sionados por radiación. y terapéuticos
60 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 60 20/10/09 10:52:19
5.2.1 Planificación de la Unidad 2
Tiempo
Capítulo Aprendizajes Recursos didácticos Destrezas científicas
(semanas)
Exploremos (1) Observar, describir
Actividad indagatoria(1) predecir, verificar,
1.
Distinguir emisiones Concepto clave (2) formular objetivos, concluir,
Propiedades del 2
radiactivas y sus propiedades Para tener en cuenta (11) medir ordenar y clasificar,
núcleo
Actividades (3) tabular, registrar datos, graficar,
Síntesis (1) comparar, calcular, relacionar
• Identificar factores de la
estabilidad nuclear Exploremos (1) Observar, describir
Actividad indagatoria (1) predecir, verificar,
2. • Reconocer y evaluar los
Concepto clave ( ) formular objetivos, concluir,
Radiactividad riesgos de emisiones y su 7
Para tener en cuenta (10) medir ordenar y clasificar,
protección.
Actividades (7) tabular, registrar datos, graficar,
• Reconocer beneficios de Síntesis (1) comparar, calcular, relacionar
tecnologías nucleares
• Reconocer y evaluar los Exploremos (1) Observar, describir
riesgos de emisiones y su Actividad indagatoria(1) predecir, verificar,
3.
protección. Concepto clave (3) formular objetivos, concluir,
Fisión y fusión 2
Para tener en cuenta ( 8) medir ordenar y clasificar,
nuclear • Reconocer beneficios de Actividades (3) tabular, registrar datos, graficar,
tecnologías nucleares Síntesis (1) comparar, calcular, relacionar
Habilidades de pensamiento Recursos tecnológicos
Reflexionar, comprender información,
Páginas web adicionales sobre fenómenos nucleares
discutir y debatir. • http://www2.tandar.cnea.gov.ar/~scoccola/teaching/nuclear/cap3
Comprender, interpretar, aplicar, inferir, • http://www.ing.una.py/DIREC_PPAL/ACADEMICO/APOYO/Fisica_III/PDF/clase_11.pdf
analizar y sintetizar.
Reflexionar, comprender información, • http://www.textoscientificos.com/fisica/radiactividad/riesgos-medioambientales
discutir y debatir. • http://www.nodo50.org/ciencia_popular/articulos/Universo.htm
Comprender, interpretar, aplicar, inferir, • http://nucleardata.nuclear.lu.se/nucleardata/toi/perchart.htm
analizar y sintetizar. • http://www.ii.udc.es/areas/inuclear/trabajos/radioisotopos.pdf
Sobre reactor nuclear
•http://www.angelfire.com/sc/energianuclear/tipos.html
Reflexionar, comprender información, ¿Cómo se formaron los elementos en el universo?
discutir y debatir. • http://www.usal.es/~geozona/planetas/conferencias2003/Daniel%20Galaviz.pdf
Comprender, interpretar, aplicar, inferir, Bomba atómica y de hidrógeno
analizar y sintetizar. • http://www.arrakis.es/~lallave/nuclear/prac.htm
Formación de elementos http://ciencia.astroseti.org/nasa/articulo.php?num=3628&nobar=1
• http://desacad.ita.mx/contec/num_17/rev17-4.pdf
Guía didáctica para el profesor 61
QUIM4M Prof01-92 MINIST_2010.indd 61 20/10/09 10:52:19
Unidad 2
5.2.2. Orientaciones didácticas de la Unidad 2
UNIDAD 2
Procesos nucleares y sus aplicaciones
Los temas de la presente unidad generalmente han sido parte de la asignatura de Física y, en menor escala,
en Química. Dada esta diferencia, es probable que esta unidad aparezca sobredimensionada. Sin embargo,
los docentes deben tener presente que estamos educando para el futuro y no es lejana la posibilidad que
en Chile se desarrolle la energía nuclear, considerando las limitaciones energéticas actuales. El país requiere
de ciudadanos informados que sean capaces de tomar decisiones sobre una base mínima de conocimientos
adquiridos en la Enseñanza Media. Esa es la pretensión de esta unidad. De todas maneras el o la docente,
según el tiempo de clases disponible, podrá seleccionar lo que considere más importante.
Propiedades del núcleo
1 Páginas 68 a 85
En esta unidad se comentan principalmente las actividades propuestas en cada
capítulo.
Actividad exploratoria:
¿Qué sabes de los fenómenos nucleares?
(Página 69)
Es una revisión de preconceptos que puede tener el estudiante. La mayoría de
las preguntas están respondidas en las páginas siguientes del texto.
En la actualidad han sido detectados sobre 2.000 isótopos.
1. Introducción a las propiedades del núcleo (Página 70)
Actividad indagatoria: Isótopos y su abundancia
(Página 70)
Objetivo: Averiguar las composiciones nucleares de 10 elementos.
La información se puede
obtener de En esta actividad el (la) profesor(a) le pueden asignar a cada alumno uno o dos
http://nuclear.fis.ucm.es/ elementos en particular.
webgrupo/archivos/guiones/ Llama la atención la gran variedad de isótopos posibles en cada elemento. Si
consulta_tabla_isotopos.pdf se consideran los elementos desde hidrógeno hasta uranio, en promedio cada
http://nucleardata.nuclear.lu.se/ elemento posee 3 isótopos estables. Sin embargo, hay 19 elementos que poseen
nucleardata/toi/perchart.htm un solo isótopo estable. Entre ellos están: F-19, Na-23, Al-27, P-31, Co-59 y Au-
197. En el otro extremo llama la atención la gran cantidad de isótopos estables
de Sn (10), Te (8) y Xe (9). En la medida que aumenta Z crece enormemente
la relación entre isótopos estables e inestables. Por ejemplo, el plomo posee 4
isótopos estables y 24 inestables.
62 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 62 20/10/09 10:52:19
Actividad indagatoria: Tamaño y densidad nuclear
(Página 73)
Objetivo: Estimar dimensiones del núcleo atómico.
Se le pide al estudiante que escoja un elemento liviano y otro pesado en el que deben
estimar el diámetro y densidad de sus núcleos, suponiendo que son cúbicos.
Previo a comenzar la resolución del ejercicio es conveniente que aclare los
siguientes conceptos a sus estudiantes:
1. Si consideramos a los núcleos de los átomos son cúbicos, entonces debemos
tener en cuenta:
• El radio nuclear ha sido determinado en el orden de 10–15 m, resultando
ser proporcional al número másico A: R = R0 A1/3
• R0 es un valor constante para todos los núcleos conocidos como constante
de proporcionalidad y es aproximadamente igual a 1,33.10–13 cm.
Para conocer entonces el volumen de este cubo debemos tener presente que R = R0 A1/3
el radio de un átomo esférico es R = R0 A1/3, luego la arista de un cubo que
contiene en su interior a una esfera de radio = R será 2R; es decir:
R
a = 2R0 A1/3
a)
2. La masa de un protón (p+) es igual a 1,6606 • 10–24g
Entonces, para un núcleo de número másico A se tiene que: su radio es R= R0A1/3, Arista = a = 2 • R
donde R0 es una constante que determina las dimensiones de la región que
ocupa el núcleo, que es indicada como 1,33 • 10–13 cm. La masa del neutrón
y del protón es 1,6606 • 10–24g; por lo que la masa del núcleo (MN) queda re-
presentada por: M N = A • 1,6606 • 10–24.
Cuando pensamos que una esfera nuclear que se transforma en un cubo, debemos
tomar en cuenta, las datos empíricos dados de la esfera, para luego, calcular el vo-
lumen de este cubo. Así, como el radio de esta esfera se representa como R0 A1/3,
por lo que la arista del cubo es 2 R0 A1/3. Si a es la arista, el volumen del cubo
es V = a3, que es lo mismo que: Vcubo = (2 R0 A1/3)3 = 8 R03A.
Al reemplazar R0 en 8R03 queda: Vcubo = 1,88 • 10–38 cm3 A b)
Entonces, la densidad será calculada como:
La figura a) muestra un cubo
M N A ⋅ 1,6606 ⋅ 10 g−24 con vista superior, y la figura b)
dN = = −38 3
= 8,82 ⋅ 1013 g / cm 3 una vista tridimencional de un
VN A ⋅ 1,88 ⋅ 10 cm cubo conteniendo una esfera,
en donde se aprecia el radio de
Si la masa de la esfera se distrubuye en el volumen de un cubo, la densidad es la esfera y la arista de un cubo,
algo menor que la expresada para un núcleo esférico, debido a que el volumen que es igual al doble del radio
de un cubo es algo mayor que la esfera inscrita en él. de la esfera que contiene.
Si se selecciona el carbono-12, el volumen del núcleo sería:
VC =12 • 1,88 • 10–38 cm3 y su diámetro 6,1 • 10 –13 cm
Nº núcleos de C-12 en 1 cm3 = 4,4 • 1036, cantidad mucho mayor que el nú-
mero de Avogadro.
Masa de l cm3 = 12 • 4,4 • 1036 • 1,6606 • 10–24 g = 8,8 • 1013 g = 8,8 • 107
toneladas.
Guía didáctica para el profesor 63
QUIM4M Prof01-92 MINIST_2010.indd 63 20/10/09 10:52:19
Unidad 2
Cada una de estas cifras son especulativas, pero serían cantidades posibles, si
los átomos colapsaran hasta condensar el tamaño de los núcleos, proceso que
puede ocurrir en los “agujeros negros”.
Actividad indagatoria:
Isótopos, abundancias, núclidos y espín
(Página 74)
Objetivo: Averiguar la cantidad de isótopos de neón y sodio.
Se hace la salvedad que en algunos textos se utiliza el vocablo “nucleido” en
vez de núclido.
1. Del neón se conocen 8 isótopos con A comprendidos entre 17 y 24. Son
estables los isótopos Ne-20 (90,92 %) Ne-21 (0,257 % y Ne-22 (8,82 %).
De sodio se conocen 7 isótopos, con A entre 20 y 26. Es estable solo el Na-23
(100 %).
2. Algunos valores de espín: Con I =1/2, H, T-3, C-13, F-19.
Con I = 1, D-2, Li-6, N-14. Con I = 3/2, Li-7, B-11, Na-23.
2. Estabilidad nuclear (Página 74)
Actividad de aplicación:
Determinación de núclidos estables e inestables
(Página 77)
Objetivo: Construir un cinturón de estabilidad a partir de algunos núcleos
estables.
La idea básica de esta actividad es trazar una curva a través de los valores de
N/Z de núcleos estables y luego trazar un par de curvas paralelas con 0,1 uni-
dad hacia arriba y hacia abajo para delimitar aproximadamente un cinturón de
estabilidad nuclear. Se podrá establecer de los núclidos considerados que Si-25,
Cr-52, Zn-64 y Au-197 caen dentro de la zona estable. Las especies Na-33 y
Ca-50 son inestables.
Actividad indagatoria:
Núclidos estables
(Página 78)
Objetivo: Ubicar en una tabla de isótopos núcleos que posean los números Z (número
de protones) o N (número de neutrones) igual a: 2, 8, 20, 28, 50, 82 y 126.
Los núcleos que poseen números mágicos Z o N son de gran estabilidad.
En la siguiente tabla están en negritas los números mágicos que tienen relación
con núclidos estables.
Elemento He O Ca Si Sn Pb
Z 2 8 20 28 50 82
N 2 8 20 30 68 126
N/Z 1 1 1 1,07 1,36 1,54
Si se relacionan los valores de N/Z con los de la página 76 se observará una
gran coincidencia.
64 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 64 20/10/09 10:52:19
Actividad de cálculo:
Energía nuclear de enlace
(Página 81)
Objetivo: Determinar la energía nuclear de enlace por nucleón para el deuterio
y para el hierro.
Masas y equivalencias de unidades importantes
Partícula Masa
Electrón 5,486 • 10–4 u
Protón 1,00728 u
Neutrón 1,00866 u
Equivalencias
Velocidad de la luz : c = 2,998 • 108 m/s
Unidad de masa atómica: 1 u = 1,66054 • 10–27 kg
Constante de Avogadro: NA = 6,022 • 1023 mol–1
Conversión de energía: 1 eV = 1,602 • 10–19 J
1 millón de electrón-voltios: 1 MeV = 1 • 106 eV = 1,602 • 10–13 J
Equivalencia masa-energía: 1 u = 931,5 MeV
El cálculo de la energía nuclear de enlace se basa en establecer la diferencia de
masa entre un núcleo y la cantidad de protones y neutrones que contiene.
El principio general es manejar las masas en unidades de masa atómica:
Masa del núcleo = masa del átomo – masa de los electrones
El defecto de masa es la diferencia de masa que existe entre un núcleo y las
sumas de sus partes individuales, y se indica como ∆m.
∆m = masa núcleo - masa (P protones + N neutrones), donde P protones es la
masa que tendrían todos los protones P si estuvieran sueltos fuera del núcleo
y la masa de N neutrones es la masa de los N neutrones si estuvieran sueltos
fuera de él.
El valor de Δm es negativo, lo que significa que en la formación del núcleo
se libera energía equivalente al defecto de masa. Finalmente, la conversión a
energía es:
ΔE = Δm • 931,5 MeV/u
Para deuterio se obtiene 2,22 MeV, siendo su energía de enlace por nucleón
Eb = 1,11 MeV.
Para Fe-56 que tiene 26 electrones, 26 protones y 30 neutrones, se obtiene un
defecto de masa Δm = 0,52840 u, los que en unidades de energía corresponden
a ΔE = 492,2 MeV. Para la energía de enlace por nucleón se obtiene Eb = 8,79
MeV, que corresponde al valor máximo observado en la curva de energías de
enlaces nucleares.
Guía didáctica para el profesor 65
QUIM4M Prof01-92 MINIST_2010.indd 65 20/10/09 10:52:19
Unidad 2
Radiactividad
2 Páginas 86 a 109
1. Reacciones nucleares (Página 88)
Las reacciones nucleares son procesos de conversión de unos elementos en
otros, mediante reacción con algún tipo de partícula, fragmentación nuclear en
núcleos más livianos, liberación de partículas subatómicas, absorción o liberación
de radiación electromagnética altamente energética.
Actividad exploratoria:
Comparación de las reacciones químicas con las reacciones nucleares
Se destacan las características fundamentales que diferencian las reacciones
químicas de las nucleares. ¿Cómo son comparativamente las velocidades de
reacción?
Tanto en lo químico como en lo nuclear, hay reacciones lentas y rápidas.
Destacan las características fundamentales que diferencian estos dos tipos de
reacciones.
En cada tipo de reacción:
• ¿Qué se conserva de reactante a producto?
• ¿Cómo es la naturaleza del reactante y del producto en ambos tipos de
reacciones?
• ¿Qué caracteriza a un compuesto y a un núclido?
• ¿En qué consiste un cambio químico y un cambio nuclear?
• ¿Hay liberación o absorción de energía?
• ¿Cómo influyen la presión, temperatura, concentración, la presencia de cata-
lizadores en ambos casos?
• ¿Cómo son comparativamente las velocidades de reacción?
66 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 66 20/10/09 10:52:19
Reacciones químicas Reacciones nucleares
Naturaleza
química de los Una sustancia se convierte en otra, pero sus Los átomos de un elemento se convierten en
reactantes y de átomos no pierden su identidad. átomos de otros elementos.
los productos
Conservación Hay un leve cambio en la masa en reacciones
La masa se conserva de reactantes a productos
de la masa altamente energéticas
En el cambio nuclear pueden participar
El cambio químico se produce por la ruptura y
¿Qué se rompe protones, neutrones, electrones y otras
formación de enlaces en los que participan sólo
y qué se forma? partículas elementales. Los electrones orbitales
los electrones.
raramente participan.
La reacciones van acompañadas por la
Las reacciones van acompañadas por
Magnitud del absorción o liberación de cantidades de energía
absorción o liberación de grandes cantidades
cambio energético relativamente pequeñas y cambios de masa no
de energía y cambios de masa medibles.
detectables.
Velocidad de la Las velocidades de reacción se ven influidas Las velocidades de reacción se ven afectadas
reacción. por la temperatura, presión, concentración, por la cantidad de núcleos presentes, pero
¿De qué presencia de catalizadores y por el tipo de no por la temperatura, presión o uso de
depende? compuesto. catalizadores.
2. Decaimiento radiactivo (Página 89)
Actividad de aplicación:
Estimación de la razón N/Z
(Página 93)
Objetivo: Determinar N/Z del núcleo-padre y del núcleo-hijo en diferentes tipos
de decaimientos radiactivos.
Las reacciones nucleares anteriores a la actividad son un buen ejemplo para
ilustrar los diferentes tipos de decaimientos. Cada caso hay que confrontarlo con
un cinturón de estabilidad relativamente detallado, para percibir que el núcleo
en su decaimiento poco a poco se acerca al sector de estabilidad.
a) Núcleos a la izquierda del cinturón de estabilidad
Los núcleos que se encuentran a la izquierda del cinturón de estabilidad poseen un
exceso de neutrones y al emitir una partícula b– reducen el valor de N/Z acercán-
dose a la zona estable. El Protactinio-234 resultante es una especie radiactiva que
continúa en decaimiento, no así con el nitrógeno-14 que es un núcleo estable.
Reacción (N/Z)Padre (N/Z)Hijo
234 234 0
90 Th → 91 Pa + −1 e (234 – 90)/90 = 1,60 (234 – 91)/91 = 1,57
14
6C
→ 147 N + 0 (14 – 6)/6 = 1,33 (14 – 7)/7 = 1
−1 e
Guía didáctica para el profesor 67
QUIM4M Prof01-92 MINIST_2010.indd 67 20/10/09 10:52:19
Unidad 2
b) Núcleos por debajo del cinturón de estabilidad
Emisión positrónica (b+)
Los núcleos por debajo del cinturón de estabilidad poseen un exceso de proto-
nes, que se reduce por la vía de emisión de una partícula b+, o bien, por captura
electrónica. De esta manera aumentan el valor de N/Z.
Reacción (N/Z)Padre (N/Z)Hijo
22 22
11 Na
→ 10 Ne + 01 e (22–11)/11 = 1 (22–10)/10 = 1,2
11 11
6 C → 5 B + 01 e (11–6)/6 = 0,83 (11–5)/5 = 1,2
• Captura electrónica
Reacción (N/Z)Padre (N/Z)Hijo
37 0 37
18 Ar + −1 e → 17 Cl (37–18)/18 = 1,05 (37–17)/17 = 1,18
c) Núcleos con número atómico igual o superior a 84
La emisión de partículas alfa produce leves incrementos en la razón N/Z, llegando
solo a un núcleo estable en plomo-206.
Reacción (N/Z)Padre (N/Z)Hijo
238 234
92 U → 90 Th + 42 He (238 – 92)/92 = 1,59 (234 – 90)/90 = 1,60
210 206
84 Po → 82 Pb + 2 He
He (210 – 84)/84 = 1,50 (206 – 82)/82 = 1,51
4
Cinética del decaimiento radiactivo
(Páginas 93 a 94)
Sin duda alguna, lo más conocido en este tipo de fenómenos es la vida media
del decaimiento radiactivo, especialmente el caso del carbono-14.
Sugerencias al o la docente:
a) El decaimiento radiactivo es un proceso estadístico de una muestra macros-
cópica. Lo que se sabe es que después de una vida media decae la mitad de
los núcleos radiactivos. Por ejemplo, un átomo de C-14 no necesita esperar
5.730 años para decaer. Si el tiempo de vida media es muy largo, un núcleo
en particular de la muestra puede decaer de inmediato o decaer en 100
mil años. Sólo se sabe que estadísticamente en 5.730 años decae la mitad
de los núcleos de C-14.
68 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 68 20/10/09 10:52:20
b) Los núcleos en general en forma libre casi no existen, forman parte de un
átomo, y además el átomo es parte de una molécula de un compuesto. Por
ejemplo, si ocurre la reacción nuclear
14 0
−1 e
14
6C 7N
y el carbono se encuentra en la forma de dióxido de carbono, suponiendo que
estas moléculas no participan en ningún proceso en más de 10 mil años, lo que
estaría ocurriendo en realidad es la transformación o transmutación.
0
−1 e
CO2 NO2 +
Lo más probable es que las moléculas de CO2 sean absorbida por las plantas,
pero igual seguiría ocurriendo el decaimiento del carbono en las moléculas
donde se encuentre.
c) En el caso específico de carbono-14 se debe tener presente que todo ser vivo
posee corporalmente una cantidad de estos átomos. Mientras está vivo, a tra-
vés del proceso metabólico, incorpora y elimina moléculas con carbono-14,
manteniendo un equilibrio. Normalmente emite electrones por la transforma-
ción de C-14 a N-14. Se estima que en 1 gramo de C-14 ocurren alrededor
de 15 desintegraciones por segundo. Estas desintegraciones ocurren con esta
velocidad, mientras el ser permanece vivo. Una vez que muere, se interrumpe
el ciclo metabólico y comienza poco a poco a reducirse la velocidad de desin-
tegraciones en el tiempo. Como el decaimiento es exponencial, teóricamente
es impredecible cuando se desintegra el último núcleo de C-14 remanente.
Actividad de aplicación:
Desintegración del Mo-99
(Página 95)
Objetivo: Confeccionar un gráfico de masa versus tiempo en unidades de vida
media.
Se dispone de 1 mg del isótopo que posee una vida media de 66 días.
A partir del grafico se puede deducir que después de 5 vidas media se ha des-
integrado sobre 0,97 mg del molibdeno inicial. Después de 2 vidas media (132
días) aún queda 0,25 mg sin desintegrar. La última pregunta es más compleja, la
cual requiere del uso de las ecuaciones indicadas en el texto del estudiante:
N 0,693
N == N
N00ee − λ t t1 / 2 =
y λ
Si se sustituye una en otra y luego se toma logaritmo natural se obtiene:
t1/ 2 N
− ln =t
0,693 N0
donde N0 es la cantidad de núcleos o masa de la muestra original y N lo que
queda después de transcurrir un tiempo t. Los tiempos transcurridos para 40 %,
60% y 80% son 48,6 días, 87,3 días y 153,3 días, respectivamente.
Guía didáctica para el profesor 69
QUIM4M Prof01-92 MINIST_2010.indd 69 20/10/09 10:52:20
Unidad 2
Actividad de aplicación: Datación con C-14
(Página 96)
Objetivo: Averiguar la edad de vestigios de carbón.
R: La cantidad de desintegraciones por minuto y por gramo de carbono es
proporcional a N indicado en una fórmula anterior. El valor actual es N0 = 15,3
desint/s g y el observado en una muestra del pasado es 3,1 desint/s g. Mediante
aplicación de la fórmula indicada en la actividad anterior se obtiene un tiempo
de 13.200 años.
3. Series radiactivas naturales (Página 77)
Actividad de aplicación: Serie radiactiva del Uranio-238
(Página 98)
Objetivo: Analizar la serie de desintegración del uranio-238
La siguiente tabla resume todas las desintegraciones que ocurren a partir de U-238,
de la cual se pueden responder todas las preguntas. Un aspecto interesante es
que donde hay U-238, se encuentran todos los elementos que se indican en la
tabla en diferentes proporciones y con distintas vidas media. Como la primera
desintegración es la más larga, es, entonces, la más lenta y, por lo tanto, determina
la velocidad del todo el proceso radiactivo.
Reacción de decaimiento Vida media
238
92 U → 23490 Th + 42 He 4,51×109 años
234 234
90 Th → 91 Pa + 0
−1 β
24,1 días
234
91 Pa → 234
92 U +
0
−1 β 6,75 horas
234
92 U → 23090 Th + 42 He 2,48×105 años
230 226
90 Th → 88 Ra + 42 He 8,0×104 años
226
88 Ra → 222 4
86 Rn + 2 He 1,62×103 años
222 218
86 Rn → 84 Po + 42 He 3,82 días
218
84 Po → 214 4
82 Pb + 2 He 3,1 minutos
214
82 Pb → 214
83 Bi +
0
−1 β 26,8 minutos
214
83 Bi → 214 0
84 Po + −1 β 19,7 minutos
214
84 Po → 210 4
82 Pb + 2 He 1,6×10–4 años
210
82 Pb → 210
83 Bi +
0
−1 β
20,4 años
210
83 Bi → 210
84 Po +
0
−1 β 5,0 días
210
84 Po → 206 4
82 Pb + 2 He 138,4 días
206
82 Pb Estable
70 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 70 20/10/09 10:52:20
4. Transmutación nuclear (Página 99) En red: En la siguiente página
encuentras suficiente infor-
Aunque son muchas las transmutaciones posibles, una de las más importantes mación
es la reacción http://nucleardata.nuclear.
12 lu.se/nucleardata/toi/
4
2 He
+ 94 Be 6C + 0n
1
perchart.htm
que llevó al descubrimiento del neutrón. James Chadwick, en 1932, al bom-
bardear Be-9 con partículas a, obtuvo C-12 y un neutrón, el que no había sido
descubierto hasta ese momento por carecer de carga y de no disponerse la
metodología apropiada.
Aceleradores de partículas (Página 100)
Sobre este tipo de aceleradores se encuentra información relativamente básica en las páginas:
http://www.cchen.cl/index.php?option=com_content&task=view&id=245&Itemid=84
http://alojamientos.us.es/cna/Ciclotron.htm
http://fisica.ciencias.uchile.cl/nuclear/instalaciones/historia.html
http://aula2.elmundo.es/aula/laminas/lamina1134988431.pdf
5. Aplicaciones de radioisótopos
(Página 101)
En el texto del estudiante se mencionan los usos más tradicionales. Es un área
muy interesante que se aplica en nuestro país a la que no se le da mucha
difusión, probablemente para no influir negativamente en usos pacíficos de
radioisótopos.
En la agricultura tiene enormes aplicaciones que se citan de manera resumida:
• En eficacia de aprovechamiento de fertilizantes fosfatados se usa P-32 y en
nitrogenados se usa N-15. El P-32 permite estimar cuánto fertilizante se le
puede suministrar a una plantación a fin de no excederse en el consumo,
ya que en exceso contamina el agua. Permite aminorar el daño al medio
ambiente y rebaja los costos de la producción agrícola.
• El uso de ciertos isótopos permite realizar mutaciones genéticas de semillas y
fortalecer la resistencia a enfermedades, provocadas por plagas e insectos.
• El uso de radioisótopos prolonga la vida de conservación de alimentos me-
diante irradiación g, la que mata a organismos patógenos, insectos como la
mosca de la fruta y polillas. La lucha contra algunos insectos opera vía de
esterilización de machos para interrumpir la cadena descendencia.
Guía didáctica para el profesor 71
QUIM4M Prof01-92 MINIST_2010.indd 71 20/10/09 10:52:20
Unidad 2
Las siguientes páginas web
• En suma, la radiación evita riesgos a la salud provenientes de alimentos,
proporcionan informaciones los que se pueden almacenar por períodos más largos, se desinfectan gra-
muy claras sobre usos de la nos, legumbres, frutas, pescado desecado y, en general, productos del mar
radioterapia congelados.
http://www.ii.udc.es/areas/
inuclear/trabajos/radioisoto- Un aspecto muy importante es destacar que los alimentos irradiados con radiación
pos.pdf g , no producen isótopos radiactivos que pueden afectar a las personas. Todos
los alimentos irradiados incluyen el logotipo internacional llamado radura.
Funciones de la Comisión
Chilena de Energía Nuclear
(CHEN)
http://www.cchen.cl/index.
php?option=com_content&ta Profundización de contenidos
sk=view&id=165&Itemid=84
Actividad de aplicación: Uso del isótopo I-131
(Página 103)
Objetivo: Establecer la permanencia del isótopo I-131 en el organismo.
Para el desarrollo de la actividad se considera la tabla de la página 104.
El I-131 se utiliza en el diagnóstico de funcionamiento de las glándulas tiroides.
Supone que a una persona se le suministra una muestra que contiene 1 mg de
yodo en la forma de NaI.
¿Qué cantidad de la muestra original permanece en el organismo de la persona
después de 1, 5, 10 y 100 días?
Tiempo (días) 1 5 10 100
Porcentaje de lo que aún 91,8 % 65,2 % 4,25 % 0,02 %
queda en el organismo
¿Cuándo termina el decaimiento completo del yodo suministrado?
R: El suministro a un paciente de yoduro de sodio, dopado con I-131 de una vida
media de 8,1 días, garantiza que en poco tiempo disminuye la emisión (la que
permite un estudio controlado de la tiroides). Se sugiere utilizar la fórmula de
desintegración nuclear para estimar la cantidad de la muestra radiactiva remanen-
te. En forma teórica la muestra decae totalmente en un tiempo excesivamente
largo. Al cabo de un año prácticamente no queda nada.
72 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 72 20/10/09 10:52:20
Fisión y fusión nuclear
3 Páginas 110 a 123
Actividad Exploratoria: Energía nuclear
(Página 111)
La actividad tiene por objetivo informarse de los Centros de Energía Nuclear en
el mundo, ya sea para obtener energía o para investigación.
Los alumnos pueden encontrar información en internet anotando reactores
nucleares en el mundo, por ejemplo,
www.cchen.cl/
http://www.cnea.gov.ar/xxi/
http://www.foronuclear.org/
http://www.greenpeace.org/espana/campaigns/energ-a-nuclear
A modo de resumen, en aproximadamente 35 países existen 440 reactores
funcionando para producir energía. A su vez, hay alrededor de 40 reactores en
construcción. Estados Unidos posee 104 reactores, Francia 59, Japón 56, Rusia
31. En Latinoamérica, Brasil y Argentina tienen 2 cada uno. La mayor parte de
los países poseen reactores de investigación y para producir isótopos que surten
necesidades en medicina, agricultura y la investigación básica. Chile posee 2
plantas de esta naturaleza: uno en La Reina y otro en Lo Aguirre (RM).
1. Fisión nuclear (Página 101)
Fisión nuclear en un reactor de U-235
(Página 112)
En el texto se indican solo 4 reacciones
de la fisión del uranio, pero la producción
es mayor con diferentes rendimientos.
Se señala que la fisión de uranio-235
da lugar a unos 200 isótopos diferentes
de unos 35 elementos, cuyos números
atómicos Z están comprendidos entre 30
y 65. Esto es equivalente a un rango de
números másicos comprendidos entre
70 y 160. La figura adjunta muestra
los porcentajes de rendimiento de los
diferentes isótopos que se producen en
la fisión. Claramente el rendimiento es
mayor en isótopos en torno a
A = 90 y A = 140.
Guía didáctica para el profesor 73
QUIM4M Prof01-92 MINIST_2010.indd 73 20/10/09 10:52:21
Unidad 2
Bomba de hidrógeno
En el texto del alumno en la página 116 se hace referencia solo a la bomba
atómica que opera vía fisión nuclear.
La bomba H es un artefacto explosivo; también llamado bomba termonuclear
es muy superior a la bomba atómica en un factor de unas mil veces superior.
Utiliza deuteriuro de litio-6 (LiD) como combustible. La detonación de la bomba
ocurre en dos etapas: reacción de fisión (usa uranio o plutonio) seguida de una
fusión nuclear. La primera produce una temperatura tan alta, que es aprovechada
por la segunda, que libera una enorme cantidad de energía.
Algunas de las reacciones importantes son:
2
1 D + 31T → 42 He + 01 n
6
3 Li + 21 D → 2 42 He
2
1 D + 21 D → 31T + 11 H
La primera bomba H de carácter experimental fue ensayada en 1952 por EE.UU.
en un atolón de las Islas Marshall con un poder de 10,4 Mt (megatones).
Actividad experimental:
Simulación de la fisión nuclear
(Página 114)
La experiencia trata de simular una fisión, colocando una gota de aceite co-
mestible suspendida en una mezcla agua-alcohol. Colocar una cucharadita de
aceite en la mezcla con sumo cuidado, porque de lo contrario se divide antes.
Lo importante es tratar de colocarla en el centro de la mezcla. Todo está en el
control de la densidad de la mezcla. Si se agrega agua o alcohol adicional, debe
ser prácticamente con un gotario; de lo contrario, con mucha facilidad se va
al fondo o queda en la superficie. Una vez colocada la gota en el centro de la
mezcla, basta tocarla con un lápiz o cuchillo y se secciona.
Actividad indagatoria:
Debate sobre la energía nuclear
En red (Página 116)
http://www.atinachile.cl/ El profesor o profesora debe promover el debate de manera que se planteen las
node/2503 diversas opiniones que existen en nuestra sociedad. Los que estén a favor o los
http://www.cchen.cl/ que estén en contra del desarrollo nuclear deben fundamentar su posición.
74 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 74 20/10/09 10:52:21
2. Fusión nuclear (Página 117)
Actividad de aplicación:
Nucleosíntesis especulativa
(Página 121) En red:
En esta actividad el estudiante debe proponer la síntesis de deuterio, tritio, helio-3, sobre el origen de los elementos
berilo-7, litio-7, nitrógeno-13, carbono-13 y nitrógeno-14. Cada núcleo producto http://www.textoscientificos.
debe provenir de un núcleo cualquiera que sea impactado por protones, neutrones com/quimica/inorganica/
origen-elementos
o núcleos de helio. Puede incluir la liberación de neutrones, protones, partículas
http://www.geologia.unam.
b– o b+,
mx/academia/temas/
Algunas de las reacciones posibles son: nucleosintesis.html
b+ = +10e b– = -10e
1H + 0n 1D + g
1 1 2
+
H + H 1D + b + neutrino
1 1 2
1 1
1D + 1H 2He + g
2 1 3
2He + 2He 2He + 2 1H
3 3 4 1
2He + 2He 4Be + g
3 4 7
4Be + -1e 3Li + neutrino
7 0 7
6C + 1 H 7N + g
12 1 13
7N 6 C + +1 e + neutrino
13 13 0
6C + 1 H 7N
13 1 14
Proyecto de científico
Riesgos y beneficios del uso de la energía nuclear
(Página 125)
Para el desarrollo de este proyecto se sugieren páginas web como las siguientes:
http://www.textoscientificos.com/fisica/radiactividad/riesgos-medioambientales
http://www.textoscientificos.com/fisica/radiactividad/riesgos-problemas
http://www.textoscientificos.com/fisica/radiactividad/desechos-radiactivos
http://www.textoscientificos.com/fisica/radiactividad/disposicion-residuos-
radiactivos
5.2.5.1. Actividades complementarias para la Unidad
Actividades de investigación
El profesor o la profesora podría hacer con su curso las actividades de investigación que
se proponen aquí, de modo de ver aplicaciones de la radioactividad en la actualidad y
muchos de sus usos, así como también investigar sobre los inicios de la misma desde
el punto de vista histórico.
1. Marie Curie (1867-1934) Premio Nobel de Física en 1903 y Premio Nobel
de Química en 1911. Se podría considerar como una de las pioneras de la
Guía didáctica para el profesor 75
QUIM4M Prof01-92 MINIST_2010.indd 75 20/10/09 10:52:21
Unidad 2
radioactividad. Su historia es muy fascinante. Su sacrificio por la ciencia ha
inspirado novelas y realizado películas de largometraje sobre su extraordina-
ria vida. El profesor podría proponer al curso investigar sobre Marie Curie,
sobre su vida, sobre sus importantes premios y descubrimientos. Incluso,
podía hacerse una pequeña representación sobre algún pasaje importante
de su vida o ver alguna de las películas que se han hecho sobre ella. Los
siguientes enlaces pueden ser de gran ayuda:
http://www.aip.org/history/curie/contents.htm, http://www.quimicaweb.net/
webquests/marie_curie/marie_curie_y_la_radiactividad.htm, http://www.
astrocosmo.cl/biografi/b-m_curie.htm, http://www.geocities.com/fcueto/
Ciencia/Curie.htm,
2. Investigar sobre el nacimiento, vida y muerte de las estrellas, cómo producen
su energía, cuál es su combustible, relacionarlo con la “fusión fría”, averiguar
si es posible realizar este tipo de reacción nuclear en nuestro planeta como
fuente de energía, los pro y los contra, etc. Los siguientes enlaces pueden
ser de gran ayuda:
http://www.astrocosmo.cl/h-foton/h-foton-03_02.htm, http://www.tayabeixo.
org/articulos/energia_estrellas.htm,
http://www.nasa.gov/, http://erenovable.com/2006/06/01/fision-nuclear/.
3. En la arqueología es de vital importancia establecer la fecha aproximada
de restos de interés y verificar la veracidad de los mismos. Un caso emble-
mático de mito y realidad ha sido la datación del “Santo sudario de Turín”
o la autentificación de algunas momias egipcias y precolombinas, debido a
falsificaciones de reliquias arqueológicas. Investigar en qué consiste la da-
tación radiactiva, cuáles son sus principales usos y dónde y cuándo ha sido
de vital importancia para la autentificación de tesoros arqueológicos. Los
siguientes enlaces pueden ser de gran utilidad:
http://es.geocities.com/guijuelo10/datacion_c14.htm, http://oldearth.wor-
dpress.com/2008/05/21/datacion-por-carbono-14-la-ciencia-y-la-religion-
se-dan-la-mano/,
http://sabanasanta.bitacoras.com/archivos/2006/02/07/la-prueba-del-carbono-
14, http://www.answersingenesis.org/Espanol/docs/FRACASO.asp .
4. Investigar los pro y los contra de utilizar la energía nuclear como fuente de
energía. Investigar el funcionamiento de un reactor nuclear y sus problemas.
Hacer preguntas como: ¿Qué pasó en Chernobil? ¿Podrá Chernobil volver
a ser lo que fue? Los siguientes enlaces pueden ser de gran utilidad:
http://www.din.upm.es/trabajos/cherno/chernobil.html, http://archivo.
greenpeace.org/chernobil/chernobil.htm,
http://waste.ideal.es/chernobil.htm, http://www.who.int/mediacentre/news/
releases/2005/pr38/es/index.html,
76 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 76 20/10/09 10:52:21
http://estaticos01.cache.el-mundo.net/elmundo/2001/graficos/abril/sema-
na3/cherno.swf.
5.2.3. Solucionarios
Evaluación del capítulo 1
Propiedades del núcleo (Página 85)
1. ¿Qué investigadores descubrieron el electrón, protón y neutrón?
R: J. J. Thomson, E. Rutherford, J. Chadwick.
2. ¿Por qué un núcleo con A par puede tener espín I = 0, 1, 2, etc. y uno con
A impar puede tener espín 1/2, 3/2, 5,2, etc.?
R: El espín de un núcleo es la suma vectorial de los espines de los protones
(I = 1/2) y neutrones (I = 1/2). Se pueden sumar o restar. En deuterio-2
(2 nucleones)es I = 1/2 + 1/2. En carbono-12 (12 nucleones I = 6 1/2 – 6
1/2 = 0, en litio-7 (7 nucleones)) I = 5 1/2 – 2 1/2 = 3/2.
3. Entre los siguientes núclidos, ¿cuáles son entre si: isótopos, isótonos o isóba-
64 76 72 76 73 76
ros? 30 Zn 34 Se 30 Zn 36 Kr 31 Ga 32 Ge
64 72 76 76 76 72
R: Isótopos: 30 Zn y ; 30 Zn Isóbaros: 34 Se y 32 Ge ; Isótonos: 34 Se , 30 Zn
73
y 31 Ga
4. La energía total de enlace nuclear para los núcleos 126 C y 238
92 U son 92,15
MeV y 1804 MeV, respectivamente. ¿Cuál es la energía nuclear de enlace
por nucleon en cada caso? Comparar con el gráfico de la página 82.
R: 7,68 MeV y 7,58 MeV.
5. La Tierra recibe en promedio desde el Sol 1,5 • 1019 kJ de radiación en un
día. ¿A qué masa equivale esta radiación?
R: 167 ton.
6. En las ecuaciones siguientes, ¿qué núclidos o partículas faltan?
a) 11 H + 11 H x + −01 β ; x = 21 D
2
b) 11 H + 11 H 1D, + x ; x = 01 β
0
c) 4 11 H
4
2 He + x ; x = 2 1 β
7. Demostrar que en la reacción nuclear
Guía didáctica para el profesor 77
QUIM4M Prof01-92 MINIST_2010.indd 77 20/10/09 10:52:21
Unidad 2
2
1D + 21 D 3 1
1T + 1 H
se liberan aproximadamente 4 MeV. La masa de un átomo de tritio es
3,01605 u.
Sugerencia: Estimar primero por separado los defectos de masa de deuterio
y de tritio, y luego estimar la energía liberada de manera similar como se
calcula en una reacción química, es decir, energía del producto menos la
energía de los reactantes.
R: Descontada la masa de los electrones: Defecto de masa= masa productos
- masa reactantes,
(3,01550+1,00728) – 2( 2,01355= 0,00432 u = 4,024 Mev
Evaluación del capítulo 2
Radiactividad (Página 109)
1. ¿Qué significado tiene que un material radiactivo tenga 2 o 3 vidas media?
R: Significa que de la muestra original en 2 y 3 vidas media ha decaído el
75% y 87,5%, respectivamente.
2. ¿Qué dificultades tiene el uso de carbono-14 para datar materiales con más
de 4 vidas media?
R: Cuando han transcurrido 4 vidas media (aprox. 23 mil años) del C-14
ha decaído más del 93% del material orgánico inicial, lo que, a su vez im-
plica una disminución de la sensibilidad acompañada de una imprecisión
del método.
3. El isótopo del hidrógeno 31 H , tritio, es radiactivo y emite una partícula b
con una vida media de 12,5 años. ¿Qué porcentaje de una muestra original
de tritio quede después de 25 años.
R: Después de 25 años queda el 25% de la muestra original.
4. El isótopo del helio 23 He es estable, pero 22 He nunca ha sido detectado, es
decir, no existe. ¿Por qué?
R: El He-2 no existe, porque es insostenible un núcleo con solo 2 protones
y carente de neutrones. La presencia de un número moderado de neutrones
otorga estabilidad a los núcleos.
78 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 78 20/10/09 10:52:21
5. Los núcleos 148 O y 198 O son inestables. Observando la figura del cinturón de
estabilidad, ¿qué tipos de partículas emiten para alcanzar un núcleo estable?
R: O-14: Está bajo del cinturón de estabilidad, emite un electrón y forma N-14.
O-19, bajo el cinturón de estabilidad, emite un positrón y forma F-19.
6. ¿Cómo decaen los radioisótopos que tienen neutrones o protones en exceso?
Piensa en el cinturón de estabilidad.
R: Un núcleo con exceso de neutrones tiene N/Z alto, decae por emisión
de electrones.
Con exceso de protones, N/Z es bajo y el núcleo emite un positrón o captura
un electrón.
7. Según la actividad de la página 77. ¿Cuáles de los siguientes núclidos pueden
ser estables?
20
8O y 93 Li
R: Ambos núcleos están a la izquierda del cinturón de estabilidad. Son
inestables y decaen por emisión de electrones.
8. El radio-226 experimenta un decaimiento espontáneo, formando los gases
radón y helio. Discute la validez de la afirmación: “El radio es un compuesto
químico formado por radón y helio”.
R: La afirmación es falsa. Un núcleo de un átomo de radio no es un com-
puesto químico. Además, un átomo no es una mezcla de 2 átomos.
9. Discute la validez de la afirmación: “La radiactividad es una propiedad del
núcleo de un átomo de un elemento y no del compuesto en que se en-
cuentra el elemento”.
R: Un elemento radiactivo puede estar presente en más de un compuesto quí-
mico y decae de la misma manera, independiente del tipo de compuesto.
10. Determina qué tipo de núclido se forma en los siguientes casos. Escribe las
respectivas ecuaciones.
a) Neptunio-232 captura un electrón. Forma U-232.
12
b) 7 N emite un positrón y da lugar a C-12.
26
c) 11 Na emite un electrón y da lugar a Mg-26.
212
d) 83 Bi emite una partícula alfa y da lugar a Tl-208.
9
e) 3 Li emite un neutrón y da lugar a Li-8.
11. Una roca tiene 2,7 • 10-4mol de U-238 (vida media 4,51 • 10 9 años) y
1,1 • 10-4 mol de Pb-206. Suponiendo que el plomo proviene de la des-
integración del uranio, ¿cuál es la edad de la roca?
Guía didáctica para el profesor 79
QUIM4M Prof01-92 MINIST_2010.indd 79 20/10/09 10:52:21
Unidad 2
R: De U-239 queda 0,00027 mol, pero en un comienzo era (0,00027 +
0,00011) mol. Permanece como U-238 el 71% del uranio original. Con la
ecuación cinética se estima una edad de 2,2 • 109 años.
12. El 27 30
13 Al se puede convertir en 15 P . ¿Qué tipo de partícula interviene en
la transmutación?
R: Al-27 absorbe He-3 y forma P-30.
Evaluación del capítulo 3
Fisión y Fusión nuclear (Página 123)
1. Complete las siguientes reacciones nucleares
10 257
(a) 249
98 Cf + 5 B 103 Lr + x (x = 2 neutrones)
263
(b) 249
98 Cf + x 106 Sg + 4 01 n (x = Oxígeno –18)
12
(c) 238
92 U+ 6 C x + 6 01 n (x = Californio-244)
(d) x + 42 He 243
97 Bk + 01 n (x = Américio-240)
2. Entre la fisión y fusión nuclear
a) ¿Qué clase de proceso da lugar a la formación de núcleos más
pesados?
b) ¿Cuál produce núcleos más livianos?
R: La fusión produce núcleos más pesados mediante choques entre partículas
o núcleos más livianos. La fisión origina núcleos más livianos.
3. ¿Cómo explicas que la fisión del uranio-235 puede llegar a una reacción
en cadena?
R: La fisión produce más neutrones que los que se emplean inicialmente. Los
neutrones excedentes quedan disponibles para fusionar un mayor número
de núcleos de uranio. De no existir barras de control la reacción en cadena
es imparable.
4. En relación al material fisionable. ¿Qué significa masa crítica, masa subcrítica
y masa supercrítica? ¿Cuáles son los riesgos?
R: Masa crítica corresponde al mínimo de masa de material fisionable, tal
que tras cada fisión produzca al menos un neutrón capaz de producir otra
fisión. La masa subcrítica está bajo la capacidad del reactor para sustentar
una reacción en cadena, ya que produce menos que un neutrón proyectil
por fisión. La masa supercrítica genera demasiados neutrones, siendo difícil
detener las reacciones. El sistema está en el estado subcrítico, el reactor
80 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 80 20/10/09 10:52:21
termina apagándose. En el estado supercrítico sin control se produce una
enorme explosión (bomba atómica).
5. Un reactor consta de las siguientes partes: núcleo del reactor, barras de
control, material fisionable, generador de vapor, turbina de vapor, generador
eléctrico, condensador de vapor, torres de enfriamiento. ¿Qué papel cumple
cada una de estas partes?
R: El núcleo del reactor contiene el material fisionable que es bombardeado
por neutrones. Las barras de control regulan la reacción en cadena y evitan
un sobrecalentamiento del sistema. El agua que circula por el núcleo a alta
presión y alta temperatura y sirve para hacer hervir agua en el generador
de vapor. El vapor generado hace funcionar una turbina que induce la pro-
ducción de electricidad en un generador. El condensador de vapor utilizado
permite bajar la temperatura con sistemas de flujos de agua. Las torres de
enfriamiento externo reducen la temperatura del agua circulante y reducen
la contaminación térmica ambiental.
6. La fusión de 1 átomo de uranio-235 libera 218 MeV de energía; en cambio,
un mol de carbono libera 393,5 kJ. ¿Cómo es comparativamente la energía
liberada por un átomo de uranio con la energía liberada en la combustión
química de un átomo de carbono?
R: Usando las conversiones de energía a Joule, un átomo de uranio libera
3,49 • 10-11 J. La energía correspondiente a la combustión de 1 átomo
de carbono es 6,5 • 10-19 J. Un cociente entre ambas cantidades indica
que 1 átomo de uranio libera 53 millones más energía que un átomo de
carbono en la combustión química.
7. En estos momentos no se disponen de reactores de fusión en etapas pro-
ductivas. ¿Qué dificultades prácticas existen?
R: El fin de un reactor de fusión es generar energía eléctrica, aprovechando
las altas temperaturas del proceso. Aún no se llega a esto, porque la reacción
debe ocurrir confinada en un campo magnético que evite el contacto con
paredes que no pueden soportar las elevadas temperaturas del medio. El
proceso aún no es sustentable, ya que es difícil mantener la continuidad.
Lo favorable es que no se producen núcleos radiactivos contaminantes.
8. En las estrellas se puede formar un núcleo de 126 C, a partir de 3 partículas a.
¿Cuánta energía en MeV se produce en esta reacción?
R: Si a cada átomo de helio se le restan 2 electrones, la masa del núcleo
de helio es 4,0015 u. En caso del carbono-12, se le restan 6 electrones y se
obtiene una masa de 11,9967 u. Por lo tanto, el defecto de masa es 0,00779
u, que corresponde a 7,26 MeV.
Guía didáctica para el profesor 81
QUIM4M Prof01-92 MINIST_2010.indd 81 20/10/09 10:52:22
Unidad 2
9. Cuando se bombardean núcleos con protones y con neutrones, con los
protones se requiere una mayor cantidad de energía. ¿Por qué?
R: Si se bombardea un núcleo con protones se les debe imprimir mayor
energía capaz de vencer la repulsión. Los neutrones ingresan al núcleo con
menor energía, ya que no son repelidos por el núcleo.
10. ¿Por qué es más recomendable la activación neutrónica para el análisis de
objetos históricos, pinturas famosas y en criminalística?
R: La captura de neutrones no genera elementos diferentes y el producto
no es radiactivo.
Evaluación de la Unidad 2
Fenómenos nucleares y sus aplicaciones
Respuestas de preguntas de selección múltiple
1B 2B 3B 4C 5A 6D 7A 8C 9B 10E 11D 12B
Preguntas abiertas
13. Escribir ecuaciones nucleares balanceadas para los siguientes casos:
a) ¿Qué núclido capturó un electrón y formó Ag-107? (Cd-107).
b) ¿A partir de que núclido se formó I-129 por decaimiento b– (Te - 129).
c) ¿Qué núclido emitió un positrón y se formó Ti-48? (V-48).
d) ¿Qué núclido se forma si N-12 emite un positrón. (C-12).
e) ¿Qué núclido se forma si Ac-225 emite una partícula alfa? (Fr -221).
14. Explica las diferencias entre los términos: núcleo, nucleón, núclido.
R: Núcleo: parte central del átomo; nucleón: protón o neutrón nuclear;
núclido: núcleo con A y Z específicos.
15. Entre las partículas a y b y la radiación g , ¿cómo es su poder ionizante y
su poder penetrante?
R: El poder penetrante aumenta en el orden: a < b < g.
El poder ionizante aumenta en el orden: g < b < a .
16. ¿Puede ser estable un núcleo pesado con Z < 92, si el número de neutrones
es igual al número de protones? Si no es estable, ¿cuál es el posible decai-
miento radiactivo?
R: Un núcleo con Z mayor a 92, en el que el número de protones sea igual
al de neutrones, no puede existir. Si existiera liberaría partículas a.
17. Considera que tienes un compuesto de molibdeno que contiene 1 mg de
Mo-99. Para este isótopo la constante de decaimiento es de 0,0105 días–1.
82 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 82 20/10/09 10:52:22
Calcula cuánto Mo-99 va quedando después de 2, 4, 6, 8, 10, 12, 14, 16, 18
y 20 días.
a) Confecciona un gráfico masa de Mo-99 versus tiempo en días.
b) Marca en el gráfico cuando ha transcurrido una vida media y luego dos
vidas media.
c) Toma el logaritmo natural de cada una de las masas estimadas en a) y
grafica ln (masa) vs. tiempo. Estima la pendiente de la línea trazada. ¿A
qué es igual la pendiente?
R: Este ejercicio es una extensión de la actividad de la página 95. En el gráfico
se obtiene una recta de pendiente λ (constante de velocidad del decaimiento
radiactivo).
18. ¿En qué principio se basa un detector Geiger?
R: Toda partícula emitida por un material radiactivo impacta el gas argón del
detector, formando iones Ar+, el que libera electrones que son detectados
por el ánodo.
19. ¿A qué hecho atribuye que la masa de un núcleo de un elemento sea menor
que la suma de las masas de los nucleones constituyentes?
R: La constitución de un núcleo a partir de las masas de sus nucleones es
un proceso que ocurre bajo condiciones extremas, que se explica por la
liberación de energía correspondiente a una diferencia o defecto de masa,
según la ecuación de Einstein.
20. ¿Qué utilidad tiene conocer la energía de enlace o ligadura por nucleón en
un núclido determinado?
R: El conocimiento de la energía de enlace por nucleón da cuenta de la
estabilidad nuclear de un núcleo en particular.
21. Considera la masa de oxígeno-16 y determina la energía de enlace nuclear
del átomo y por nucleón.
R: El defecto de masa es 0,137 u; la energía total del núcleo es 127,61 MeV
y la energía de enlace por nucleón es 7,9758 MeV.
22. ¿Qué riesgos existen, si una radiación ionizante produce una especie quí-
mica radical?
R: Si una especie radical ataca el agua corporal, puede generar finalmente
radicales •OH, especie muy reactiva que, al alcanzar cierto nivel de concen-
tración, podría causar un daño somático o genético.
23. ¿Por qué no reviste peligro el consumo de alimentos irradiados con radiación
provenientes de una fuente de cobalto-60?
R: La radiación g afecta a los potenciales microorganismos presentes en un
alimento y no altera la composición nuclear de los átomos a un nivel de
producir un material radiactivo.
24. La radiación ionizante es más peligrosa en un niño que en un adulto. ¿Por qué?
Guía didáctica para el profesor 83
QUIM4M Prof01-92 MINIST_2010.indd 83 20/10/09 10:52:22
Unidad 2
R: El niño se encuentra en una etapa de crecimiento. La radiación podría
alterar su normal desarrollo al ocasionar un daño somático o genético.
25. ¿Por qué se utiliza activación neutrónica para el análisis de obras pictóricas
de gran valor?
R: La activación neutrónica ingresa neutrones a los átomos de la pintura, sin
modificar el elemento químico, produciendo un isótopo radiactivo de corta
vida (generalmente emite radiación g), en un intervalo de tiempo suficiente
para un estudio analítico, obteniéndose un espectro de radiación g. El es-
pectro permite reconocer la composición química de la pintura usada.
26. Si se desea estudiar el flujo de aguas subterráneas, ¿qué características debiera
tener el radioisótopo que se utiliza?
R: Es fundamental que sea un radioisótopo de corta vida y que no produzca
elementos tóxicos.
27. En medicina nuclear, ¿cuál es la diferencia entre radioterapia interna y ra-
dioterapia externa?
R: En la radioterapia interna se introduce en el interior del cuerpo del pa-
ciente una dosis de material radiactivo. En la radioterapia externa el paciente
es sometido a irradiación desde una fuente que emite radiación g o b.
28. ¿Cuál es el denominador común en los isótopos utilizados en medicina
nuclear?
R: Son de corta vida media.
29. Diferencia el daño somático del daño genético por acción de radiaciones.
R: El daño somático altera el funcionamiento celular de un tejido y puede
causar una enfermedad. El daño genético altera la secuencia de ADN y produ-
ce malformación en el tejido que puede transmitirse a un descendiente.
30. ¿Por qué una estrella supernova termina su vida estallando?
R: Cuando en el interior de una estrella se agota el combustible nuclear y ha
llegado a formar hierro, se produce una implosión (reducción del corazón
de la estrella) seguido de un colapso gravitacional que termina en una gran
explosión.
31. ¿Por qué la formación de elementos en algunas estrellas termina con la
formación de Fe-56?
84 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 84 20/10/09 10:52:22
R: Termina en la formación de Fe-56, porque es el núcleo más estable.
32. ¿Cuál es el primer núcleo estable que se forma al interior de una estrella?
R: El primero es D-2 y le siguen He-3 y He-4.
33. ¿Cuáles son las cantidades mínimas y máximas de neutrones que se pueden
producir por fisión nuclear de U-235?
R: Se emiten entre 1 y 4 neutrones, según la reacción que ocurra. En general,
el U-235 emite en promedio 2,5 neutrones por reacción.
5.2.4. Errores y dificultades más frecuentes
Esta área de la química posiblemente es una de las “más difíciles” de enseñar, ya
que no es posible hacer experimentos a nivel de laboratorio en este capítulo. Las
prácticas de laboratorio son de vital importancia porque permiten que el alumno a
través de trabajos prácticos comprenda las materias que está estudiando en forma
teórica en las clases expositivas. De este modo, el alumno ve que la química es
una ciencia experimental y que está al alcance de todos. Sin embargo, en este
capítulo de Química Nuclear, la experimentación a nivel de laboratorio no es
posible. Por lo tanto, es importante que el profesor o la profesora fomenten los
trabajos de investigación; hacer clases expositivas, donde se vean aplicaciones de
la química nuclear, que el alumno haga un clase expositivas sobre algún tema
propuesto en las Actividades complementarias de la unidad, etc. En fin, hacer
comprender al alumno los pro y contra de la química nuclear y de cómo se
encuentra presente en nuestros días.
5.2.5. Anexos
5.2.5.1. Instrumentos de evaluación fotocopiables
Páginas web relacionadas con el capítulo Propiedades del núcleo
• http://www.profisica.cl/comofuncionan/como.php?id=17
• http://nucleardata.nuclear.lu.se/nucleardata/toi/perchart.htm
• http://ciencia.astroseti.org/nasa/articulo.php?num=3628&nobar=1
• http://www.angelfire.com/sc/energianuclear/tipos.html
Guía didáctica para el profesor 85
QUIM4M Prof01-92 MINIST_2010.indd 85 20/10/09 10:52:22
Unidad 2
Material fotocopiable
Páginas web adicionales sobre Fenómenos nucleares
• http://www.ing.una.py/DIREC_PPAL/ACADEMICO/APOYO/Fisica_III/
PDF/clase_11.pdf
• http://www.nodo50.org/ciencia_popular/articulos/Universo.htm
• http://www.usal.es/~geozona/planetas/conferencias2003/Daniel%20Galaviz.pdf
• http://ciencia.astroseti.org/nasa/articulo.php?num=3628&nobar=1
• http://desacad.ita.mx/contec/num_17/rev17-4.pdf
• http://www.arrakis.es/~lallave/nuclear/prac.htm
• http://www.profisica.cl/comofuncionan/como.php?id=17
• http://www.angelfire.com/sc/energianuclear/tipos.html
Nombre del alumno(a):_____________________________________
Tema: Evaluación 1 Procesos nucleares
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. ¿Cuál es el orden de descubrimiento de los protones, neutrones y electrones
del átomo, desde el más antiguo al más reciente?
A) protón - electrón - neutrón
B) electrón - protón - neutrón
C) electrón - neutrón - protón
D) protón - neutrón - electrón
E) neutrón - protón - electrón
2. ¿Qué significa que una partícula tenga espín?
I) Que solo hay un número limitado de giros.
II) Que giran en cualquier dirección.
III) Es una interconversión entre partículas.
A) Solo I
B) Solo II
C) Solo III
D) Solo I y III
E) Solo II y III
15
3. El núcleo de un átomo X representado por 7 X tiene:
A) 8 protones y 7 neutrones.
B) 7 protones y 15 neutrones.
C) 7 protones y 8 neutrones.
86 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 86 20/10/09 10:52:22
Material fotocopiable
D) 15 protones y 8 neutrones.
E) 8 protones y 15 neutrones.
4. Al comparar los isótopos 11 H , 21 D y 31T se establece que:
A) corresponden a tres elementos diferentes.
B) tienen la misma cantidad de neutrones.
C) tienen la misma cantidad de protones.
D) tienen más protones que neutrones.
E) la masa desciende de izquierda a derecha.
5. ¿En qué se parecen los isótopos 21 D , 63 Li , 105 B y 14
7 N?
I) Tienen números másicos pares.
II) Poseen un número impar de protones.
III) Poseen un número impar de neutrones.
Es (son) correcta(s)
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y II.
E) I, II y III.
6. Respecto del cinturón de estabilidad nuclear se afirma que:
A) todos los núcleos con Z < 20 son estables.
B) todos los núcleos con Z > 20 son inestables.
Guía didáctica para el profesor 87
QUIM4M Prof01-92 MINIST_2010.indd 87 20/10/09 10:52:22
Unidad 2
Material fotocopiable
C) la estabilidad es independiente de la cantidad de protones y neutrones
que posea un núcleo.
D) sobre Z > 20 tienen estabilidad los núcleos que poseen un número de
neutrones levemente superior a Z.
E) Cuando un elemento posee un solo isótopo estable, es imposible sintetizar
un isótopo inestable.
Soluciones: 1B, 2A, 3C, 4C, 5E, 6D
Nombre del alumno(a):_____________________________________
Tema: Evaluación 2 Radiactividad
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. Dos núcleos de 21 D generan un núcleo de 31T y liberan:
A) un electrón.
B) un positrón.
C) un protón.
D) dos electrones.
E) un neutrón.
2. Al formarse el núcleo de un elemento como oxígeno a partir de protones y
neutrones:
I) la masa de protones y neutrones es mayor que la del núcleo formado.
II) se libera energía.
III) se requiere una temperatura muy elevada para la fusión.
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
+
D) Solo I y III
E) I, II y III
3. ¿Cuál(es) de las siguientes reacciones está(n) correctamente escrita(s)?
I) 01 n + 0
−1 β
1
1 p
88 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 88 20/10/09 10:52:22
Material fotocopiable
0 1
II) 11 p + −1 β 0n
1 0
III) 11 p 0n + −1 β
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) Solo II y III.
4. El isótopo I-131 tiene una vida media de 8 días. Cuando ha transcurrido el
74% del decaimiento han transcurrido
I) más de 8 días.
II) más de 16 días.
III) un poco menos de 16 días.
Es (son) correcta(s)
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) Solo II y III.
5. En la serie de desintegración del U-238 en la etapa de decaimiento de 222
86 Rn
a 21884 Po se emite(n):
A) una partícula a.
B) 4 protones.
C) 2 deuterones.
D) 1 protón y un tritio.
E) 4 neutrones.
6. ¿Cuál(es) de las siguientes reacciones nucleares son de transmutación?
238
I) 92 U + 01 n 239
93 Np + 0
−1 β
239
II) 94 Pu + 42 He 242
96 Cm + 01 n
Guía didáctica para el profesor 89
QUIM4M Prof01-92 MINIST_2010.indd 89 20/10/09 10:52:22
Unidad 2
Material fotocopiable
239 239 0
III) 93 Np 94 Pu + −1 β
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III
E) I, II y III.
Soluciones: 1C, 2E, 3E, 4D, 5A, 6D.
Nombre del alumno(a):_____________________________________
Tema: Evaluación 3 Fisión y fusión nuclear
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. El isótopo 187 N cuando decae libera una partícula b- y se transforma en:
18
A) 6 C
17
B) 7 N
19
C) 7 N
18
D) 8 O
17
E) 8 O
2. Para producir una reacción en cadena sustentable, es suficiente que el núcleo
fisionado
I) libere de 4 o más neutrones por núcleo.
II) que la cantidad de material corresponda a la masa crítica.
III) que las barras de control absorban los neutrones en exceso.
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) Solo II y III.
90 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 90 20/10/09 10:52:22
Material fotocopiable
3. El agua que circula por el corazón de un reactor nuclear normalmente:
I) hierve a 100 ºC.
II) se calienta a más de 300 ºC y se le mantiene a una elevada presión.
III) fluye directamente hacia una turbina para producir electricidad.
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) Solo II y III.
4. En relación a la fisión y fusión nuclear:
A) Ambos procesos pueden generar grandes cantidades de energía.
B) Para iniciar la fisión nuclear se requiere de una fuente que alcance, por
lo menos, 106 ºC.
C) La fusión solo se inicia con un bombardeo de neutrones.
D) La fisión produce energía, utilizando combustible nuclear de baja masa
atómica.
E) La fusión ocurre normalmente entre núcleos de elevada masa atómica.
5. Para realizar la fusión nuclear,
I) se requiere una fuente de muy elevada temperatura.
II) se debe someter el material fusionable a una alta presión.
III) es fundamental confinar el material mediante un campo magnético.
Es (son) correcta(s):
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) I, II y III.
6. Una estrella como nuestro Sol
I) está compuesta principalmente por hidrógeno.
II) la energía radiante proviene de fisiones nucleares.
Guía didáctica para el profesor 91
QUIM4M Prof01-92 MINIST_2010.indd 91 20/10/09 10:52:22
Unidad 2
5.2.6. Bibliografía de la Unidad
1. R. Chang . Química. 9ª Ed. Española. McGraw -Hill, 2007.
2. J.W.Moore, J.C.Kotz, C. L. Staniski, M.D.Joesten, J.L. Wood.
El mundo de la Química. 2º Ed Española, 2000, Pearson Educación.
3. M. S. Silberberg, Química General. McGraw Hill, 2002.
4. S.S. Zumdahl. Chemistry. D.C. Heath and Company, 1986
5. A. Beiser. Conceptos de Física Moderna. McGraw Hill, 1965.
6. T. L. Brown, H.E. LeMay y B.E. Bursten. Química. La Ciencia Central. 9ª Ed.
Española. Pearson Educación, 2004.
7. M.R. Wehr, J.A. Richards. Physics of the Atom. Addison Wesley Publishing
Company, 1964.
8. G. Friedlander, I.W. Kennedy, E.S. Macias, J. M. Miller. Nuclear and Radiochemistry.
John Wiley & Sons, 1981.
92 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof01-92 MINIST_2010.indd 92 20/10/09 10:52:22
5.3 Tercera Unidad: Procesos de la industria química
Mapa conceptual de la Unidad
Estado físico Lixiviación
Metalurgia de reactantes Flotación Cu
de Cu y productos Fundición
Electrólisis
Extracción,
Metalurgia molienda,
Alto horno Fe Acero
de Fe concentración
magnética
Salmueras
Procesos Evaporación Li2CO3
de Li Carbonatación
NaNO3
Procesos KNO3
Caliche. Extracción de
de Nitratos Molienda. Cristalización
y Yodo I2
Proceso del S volcánico Chancao SO2, SO3 y S H2SO4
azufre
Calizas CaCO3 Calcinación CaO
Mezclas de óxidos de Cemento
Si, Ca, Al y Fe
Cemento
Cerámicas Arcillas Cerámicas
y vidrios
Arena, Caliza
soda y óxidos Vidrios
metálicos
Guía didáctica para el profesor 93
QUIM4M Prof93-152 MINIST_2010.indd 93 20/10/09 10:53:32
Unidad 3
5.3.1 Planificación de la Unidad 3
Tiempo
Capítulo Aprendizajes (sema- Recursos didácticos Destrezas científicas
nas)
Exploremos (1) Observar, describir
Reconocer las principales materias
Actividad indagatoria (1) predecir, verificar,
primas de la industria química
1. Minerales Concepto clave (3) formular objetivos, concluir,
nacional.
metálicos en Vocabulario (3) medir ordenar y clasificar,
Describir procesos moderno de 2
Chile y su Para tener en cuenta (7) tabular, registrar datos,
obtención de metales
metalurgia Tablas (11) graficar, comparar, calcular,
Comprender y analizar aspectos Actividades (7) relacionar
básicos estequiométricos. Síntesis (1)
Reconocer las principales materias
primas de la industria química Observar, describir
nacional. Exploremos (1)
predecir, verificar,
Actividad indagatoria (1)
Describir procesos moderno de formular objetivos, concluir,
2. Minerales no obtención de no metales. Para tener en cuenta (16)
7 medir ordenar y clasificar,
metálicos Tablas (13)
Comprender y analizar aspectos tabular, registrar datos,
Actividades (11)
básicos estequiométricos. graficar, comparar, calcular,
Síntesis (1)
Comprender y analizar los apectos relacionar
básicos del ácido sulfúrico.
Observar, describir
Exploremos (1) predecir, verificar,
Actividad indagatoria (1)
3. Vidrios Mostrar conocimiento de materiales formular objetivos, concluir,
Para tener en cuenta (16)
cerámicas y de uso masivo: vidrio, cemento y 2 medir ordenar y clasificar,
Tablas (13)
cemento cerámica tabular, registrar datos,
Actividades (11)
Síntesis (1) graficar, comparar, calcular,
relacionar
Habilidades de
Recursos tecnológicos
pensamiento
Reflexionar, comprender http://www.creces.cl/new/index.asp?imat=%20%20%3E%20%2078&tc=3&nc=5&art=286
información, discutir y debatir. http://www.codelco.com/coleccion/index.htm
Comprender, interpretar, aplicar,
inferir, analizar y sintetizar.
http://www.piedrasdecorativas.cl/litio_lithium_chile2.htm
http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/gonzaleza01/
http://www.minmineria.cl/574/propertyvalue-1986.html
http://www.sqm.com/aspx/AcercaDe/ProcesoProduccion.aspx
Reflexionar, comprender
http://www.textoscientificos.com/quimica/nitrato-potasico
información, discutir y debatir.
http://www.unap.cl/museomin/basededatos/salitre_antiguo.htm
Comprender, interpretar, aplicar,
http://www.quiminet.com.mx/ar1/ar_%25E1%258C%25C4%2582%25D7%2582%2599%25
inferir, analizar y sintetizar.
EA.htm
http://www.textoscientificos.com/sulfurico/produccion
http://html.rincondelvago.com/acido-sulfurico.html
http://www.cochilco.cl/productos/otros_no_metalicos_tabla.asp
Reflexionar, comprender
http://www.monografias.com/trabajos11/vidrio/vidrio.shtml
información, discutir y debatir.
http://www.educa.madrid.org/portal/c/portal/layout?p_l_id=32603.23
Comprender, interpretar, aplicar,
http://www.holcim.com/CL/ESC/id/38286/mod/gnm20/page/editorial.html
inferir, analizar y sintetizar.
94 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 94 20/10/09 10:53:32
5.3.2. Orientaciones didácticas de la Unidad 3
UNIDAD 3
Procesos químicos industriales
Los y las docentes en Química conocen bien la importancia de los procesos químicos en la industria chilena.
No obstante, por ser la última unidad del texto de 4º Medio es probable que muchos de los temas sean
obviados en el proceso de enseñanza, privilegiando algunos aspectos químicos en desmedro de procesos
industriales que se realizan a gran escala en nuestro país. El texto contiene interpretaciones químicas, datos
importantes de sustancias específicas y también datos estadísticos sobre producción. Desde luego esto último
son solo referencias para generar conocimiento cualitativo en los estudiantes.
En esta guía se comentan los aspectos más relevantes de las actividades propuestas.
Minerales metálicos
1 Páginas 132 a 135
Actividad exploratoria: Metales en Chile
(Página 133)
Esta primera actividad tiene como objetivo motivar a los estudiantes en el estudio
de los elementos metálicos. Hace referencia a sus preconceptos sobre los metales
en Chile, tema que ha sido tratado en la asignatura de Historia y en la Unidad de
Materiales en la asignatura de Química en Primer Año de Enseñanza Media.
1. Metalurgia (Página 134)
La tabla de minerales puede ser ocupada por el profesor o profesora, realizando
alguna actividad anexa, como clasificar los minerales por elementos, por ejemplo,
los que son de cobre o de hierro, para evaluar posteriormente la composición
de los más importantes.
Minerales matálicos oxidados y sulfurados
Minerales oxidados Fórmula Minerales sulfurados Fórmula
Cuprita Cu2O Galena PbS
Sílice SiO2 Calcosina Cu2S
Hematita Fe2O3 Molibdenita MoS2
Magnetita Fe3O4 Pirita FeS2
Bauxita Al2O3 Blenda ZnS
Limonita 2Fe2O•3H2O Calcopirita CuFeS2
Caolinita Al2O3•2SiO2•2H2O Alumbre KAl(SO4)2
Guía didáctica para el profesor 95
QUIM4M Prof93-152 MINIST_2010.indd 95 20/10/09 10:53:32
Unidad 3
Procesos físicos y químicos aplicados a la industria metalúrgica
Utilizando los conceptos de procesos físicos y químicos de la industria metalúr-
gica, se puede pedir al estudiante, como actividad anexa, que diseñe un mapa
conceptual, que sea revisado por la profesora o profesor, en forma individual o
grupal. Es bueno recordar que los mapas conceptuales son una manera eficaz de
sintetizar conocimiento, algo que a los estudiantes se les hace bastante difícil.
2. El cobre (Página 138)
Conociendo el cobre
Dado que, el cobre, el principal mineral de importancia económica en nuestro
país, se ha dado bastanten información con respecto a los procesos químicos
industriales relacionados con su metalurgia.
Actividad experimental: Propiedades del cobre
(Página 140)
Se pretende que los estudiantes experimenten con algunas propiedades de este
metal. El profesor o profesora deberá tomar las precauciones necesarias espe-
cialmente en las reacciones con ácidos.
En el calentamiento de una lámina de cobre con el mechero se observa que la
zona de mayor calentamiento se tornará color negro (CuO) y en otras zonas se
verá rojizo (Cu2O).
En los ensayos con ácidos se propone una tabulación como la siguiente:
Reacciona Reacciona Desprende Color de la Reacción
Cu reacciona con en frío en caliente gases disolución exotérmica
HCl no no no incolora –
HNO3 sí sí sí, NO azul sí
H2SO4 no sí, lentamente sí, SO2 azul sí
H2O no no no no no
Solución de NaCl no no no no no
Ecuaciones de las reacciones:
1) Cu + H2SO4 CuSO4 + SO2 + 2H2O
2) 3Cu + 8 HNO3 3Cu(NO3)2 + 2NO + 4H2O
Metalurgia del cobre
Se recomienda al profesor o profesora que los estudiantes reconozcan algunos
minerales de cobre por sus fórmulas, por ejemplo, los marcados con asterisco
en la tabla que posteriormente pueden ser evaluados.
96 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 96 20/10/09 10:53:32
Minerales de cobre oxidados y sulfurados más comunes
Minerales de cobre oxidados
Minerales de cobre oxidado
Minerales de cobre Fórmula Mineral Fórmula
Azurita 2CuCO3•Cu(OH)2 Atacamina CuCl2•3Cu(OH)2
Malaquita CuCO3•Cu(OH)2 Crisocola CuSiO3•2H2O
Brocanita CuSO4•3Cu(OH)2 Cuprita Cu2O
Calcantita CuSO4•5H2O Tenorita CuO
Minerales de cobre sulfurados
Minerales de cobre sulfurado
Mineral Fórmula Mineral Fórmula
Calcopirita FeCuS2 Calcosina Cu2S
Covelina CuS Enargita 3CuS3•As2S3
Bornita 2Cu2S•CuS•FeS
Actividad experimental:
Separando el cobre de una sal
(Página 142)
Esta trabajo, como todos los experimentales, es una excelente oportunidad para
reforzar habilidades científicas, cognitivas y sociales.
Precaución: El sulfato de cobre es una sustancia tóxica. Debe evitarse el con-
tacto con la piel e ingestión. La profesora o profesor deben tomar las medidas
pertinentes de precaución al trabajar con este reactivo.
1. En la reacción con papel aluminio se observa una coloración rojiza. Es una
reacción exotérmica en la que después de unos 5 minutos la temperatura
puede alcanzar alrededor de 50 ºC.
2. Cuando se somete el papel de aluminio a una disolución que contiene sulfato
de cobre y cloruro de sodio se observa la liberación de un gas y la aparición
de agujeros en la lámina de aluminio con bordes de color cobrizo, debido a
que se oxida el aluminio (Al3+) y los restos de cobre se debe a su reducción
(Cu2+).
Cu2+ + 2e– Cu(s); y Al(s) Al3+ + 3e–
El gas que se desprende es hidrógeno debido a las reacciones:
2H+ + 2e– H2(g); y Al(s) Al3+ + 3e–
Guía didáctica para el profesor 97
QUIM4M Prof93-152 MINIST_2010.indd 97 20/10/09 10:53:32
Unidad 3
El aluminio no suele reaccionar en agua debido a la capa superficial protec-
tora de óxido de aluminio, en este caso sí lo hace, ya que al oxidarse por
la acción del cobre quedan descubiertos nuevos átomos de aluminio que
reaccionan inmediatamente con el agua.
3. Con la acción de metales como Fe, Mg y Zn. también se puede obtener
cobre metálico desde una solución de sulfato de cobre.
4. Como actividades anexas, se pueden realizar las reacciones entre CuSO4
e hidróxido de sodio, lo que formara un precipitado de color azul que co-
rresponde al Cu(OH)2.
2NaOH + CuSO4 Na2SO4 + Cu(OH)2
Si se sigue agregando hidróxido de sodio, se disuelve el precipitado y aparece
un azul más intenso correspondiente al ion cuprato CuO22–.
También, se puede hacer reaccionar CuSO4 con amoníaco, con lo que se forma un
sal básica de cobre Cu2SO4(OH)2 de color verde azulado, que al agregar más amo-
níaco se disuelve, generando el complejo Cu(NH3)42+, de color azul intenso.
2Cu2++ SO42– + 2NH3 + 2H2O Cu2SO4(OH)2 + 2NH4+
Cu2SO4(OH)2 + 8NH3 2Cu(NH3)42+ + SO42– + 2OH–
Procesos específicos de la metalurgia del cobre (Página 142)
Actividad experimental:
Obtención de cobre por electrólisis
(Página 144)
La actividad de obtención de cobre electrolítico es interesante realizarla, ya que
muestra uno de los procesos de refinación del cobre que se practican en la in-
dustria metalúrgica de este metal. El profesor debe hacer reflexionar a los alum-
nos que esta técnica electroquímica tiene un gran valor agregado comercial en
nuestro país. También se puede señalar a los estudiantes que la galvanoplastia
utiliza la electrólisis para recubrir metales, para evitar la corrosión o darle otra
tonalidad al metal receptor.
Como actividad anexa, se podría colocar como cátodo un clip y observar como
se deposita cobre sobre él.
Si el establecimiento cuenta con una balanza de precisión, se podrían medir las
masas de las láminas antes y después de la experiencia. Si se conocen los valores
de las masas, la intensidad de la corriente aplicada y el tiempo de la electrolisis,
se podrían aplica la Leyes de Faraday .
Primera Ley: La masa depositada por electrólisis de una sustancia es directa-
mente proporcional a la corriente que circula.
Segunda Ley: Si por varias celdas electrolíticas conectadas en serie y provistas
de electrodos inertes, pasa la misma cantidad de corriente eléctrica, las canti-
98 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 98 20/10/09 10:53:32
dades de sustancias depositadas en cada electrodo son proporcionales a los
equivalentes-gramo de las sustancias depositadas.
Masa = M • I • t / (96500 • n)
donde:
m: masa en gramos que se deposita.
M: masa molar del elemento
I: Intensidad de la corriente en amperios
t: tiempo en segundos de la electrolisis
n: número de electrones intercambiados en la reacción
96500: factor de equivalencia 1F = 96500 Coulomb
No se ha considerado una actividad de esta naturaleza en el texto del alumno,
debido a la poca probabilidad de contar con balanzas de precisión en los es-
tablecimientos educacionales fiscales. Si el establecimiento tiene estos medios,
podría realizarse la experiencia.
Lixiviación bacteriana
Este tema se ha tratado en forma somera, dada la complejidad del mismo. De
acuerdo al tipo de curso, el profesor o profesora podrían profundizar en este
tema.
En la red
En las siguientes páginas se encuentra información sobre la lixiviación
bacteriana
http://www.creces.cl/new/index.asp?imat=%20%20%3E%20%2078&tc=3&
nc=5&art=286
http://www.codelco.com/coleccion/index.htm
3. El hierro (Página 147)
Conociendo al hierro
(Página 147)
El hierro es un metal que ocupa el segundo lugar de importancia en producción a
nivel nacional. En la siguiente actividad, se pretende que el estudiante reconozca
las características más importantes de este metal.
Actividad de indagación: El hierro en Chile y el mundo
(Página 147)
En esta actividad el profesor o profesora puede sugerir a los estudiantes que
muestren en un mapa de Chile los yacimientos de hierro. Hacer alusión a la
Edad del Hierro, conectando la Química con la Historia y hacer reflexionar a
los estudiantes sobre la importancia que ha tenido este metal a lo largo de la
historia humana.
Guía didáctica para el profesor 99
QUIM4M Prof93-152 MINIST_2010.indd 99 20/10/09 10:53:32
Unidad 3
Hierro en la naturaleza
El profesor o profesora puede pedir a los estudiantes que reconozcan la com-
posición y nombres de los minerales de hierro propuestos en la tabla.
Mineral de hierro Fórmula
Pirita FeS2
Magnetita Fe3O4
Siderita FeCO3
Hematita Fe2O3
Actividad experimental:
Propiedades del hierro
(Página 148)
Se proponen principalmente reacciones de un clavo con ácidos.
El profesor o profesora puede sugerir a los estudiantes que tabulen las reacciones
de hierro con las distintas disoluciones propuestas, en forma similar a lo realizado
para el cobre. El hierro reacciona con HCl, H2SO4 diluidos y en frío, produciendo
soluciones verdosas que implican la presencia de iones ferrosos. Sin embargo, el
hierro no reacciona con H2SO4 concentrado y en frío, esta propiedad se cons-
tata en el hecho que se utilizan recipientes de acero para el transporte del ácido
sulfúrico. En cuanto al HNO3, si está diluido y en frío, hay reacción formándose
NO2 y el ion férrico. Si el HNO3 está concentrado, no habrá reacción, ya que
el hierro pierde su capacidad reductora y se vuelve pasivo. Luego, puede hacer
un paralelo entre las propiedades del cobre y del hierro, haciendo reflexionar al
estudiante sobre sus diferencias y sus usos.
Pirometalurgia del hierro. Proceso de alto horno
El profesor o profesora debe aprovechar las reacciones ocurridas en alto horno
para recordar y reforzar conceptos de ácido-base y óxido-reducción.
En la actualidad, el proceso de alto horno utiliza un mineral de hierro, carbón
coque, piedra cáliza (carbonato de calcio) como fundente, principalmente. El
proceso en sí comprende reacciones de óxido-reducción y de ácido-base; también
se puede observar algo de nomenclatura básica.
En la red: Algo más sobre el hierro.
http://www.edicionesespeciales.elmercurio.com/destacadas/detalle/index.asp?i
dnoticia=0129082007021X0020016&idcuerpo=614
100 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 100 20/10/09 10:53:32
Otros metales de importancia nacional
(Página 151)
Se sugiere al profesor o profesora utilizar la Tabla de Propiedades físicas y quí-
micas de los metales Mn, Zn, Mo, Ag, Au y Pb, que aportan significativamente
a la economía nacional. Algunas preguntas que se pueden proponer a los es-
tudiantes son:
a) Investigar sobre el uso de cada uno de estos metales.
b) Comparar conductividades eléctricas de estos metales entre ellos, con el
cobre y con el hierro.
c) Reflexionar sobre las características de cada metal en relación con sus pro-
piedades físicas.
Mn Zn Mo Ag Au Pb
Z 25 30 42 47 79 82
Masa atómica 54,94 65,39 95,94 1,44 197,0 207,2
Radio atómico (Å) 1,24 1,33 1,36 1,44 1,44 1,75
Configuración electrónica 3d54s2 3d104s2 4d55s1 4d105s1 6s1 6s26p2
+2, + 3, +2, +3,
Estados de oxidación +2 +1 +1, +3 +2, +4
+ 4, +5 +4, +5, +6
Punto de fusión (oC) 1244 419 2617 962 1064 327
Densidad g/cm3 7,43 7,13 10,2 10,5 19,3 11,3
Conductividad eléctrica* 2 27 30 100 72 8
*Conductividad comparada con valor arbitrario 100 para la plata.
Esta tabla también puede ser utilizada por el profesor o profesora para una
actividad de reflexión con los alumnos, comparando las propiedades de estos
metales con las del cobre y el hierro.
Metal Producción en miles de TM
Cu 5.381.761
Fe 5.234.651
Mo 43.158
Zn 36.238
Mn 9.771
Ag 1.607
Pb 672
Au 42
TM: Toneladas métricas
Fuente: Ministerio de Minería de Chile
Guía didáctica para el profesor 101
QUIM4M Prof93-152 MINIST_2010.indd 101 20/10/09 10:53:32
Unidad 3
Minerales no metálicos
2 Páginas 156 a 177
Este Segundo Capítulo tiene como objetivo que el estudiante conozca y comprenda
los procesos químicos industriales relacionados con la extracción de minerales no
metálicos, que también forman parte de la riqueza mineral de nuestro país. Es
importante que el profesor o profesora tenga claro que el concepto de mineral
no metálico es más bien de índole operacional, ya que los alumnos pueden
entrar en confusión al ver que muchos de ellos tienen en su estructura metales
como el sodio, el litio, el calcio, el potasio, entre otros.
Actividad exploratoria:
Minerales no metálicos
(Página 157)
El docente puede proponer a los estudiantes el diseño de una tabla para indicar
las fórmulas de los minerales no metálicos de la actividad exploratoria y luego
revisarlo en conjunto con el curso en la pizarra.
Escribe las fórmulas de los minerales no metálicos nombrados anteriormente.
Compuesto Fórmula química
Carbonato de calcio
Nitrato de sodio
Nitrato de potasio
Yodato de sodio
Borato de sodio
Cloruro de sodio
Sulfato de calcio (yeso) CaSO4•2H2O
Azufre
Talco (Mg3Si4O11•2H2O)
Silicato de sodio
a) ¿Qué es la “halita”, el yeso y el cuarzo?
R: Halita: NaCl; Yeso: CaSO4 • 2H2O; Cuarzo: SiO2
b) Selecciona unos 5 minerales no metálicos y averigua en qué se utilizan.
c) ¿A qué se llama “caliche”? ¿Cuál fue su importancia a nivel nacional?
R: Mineral que contiene altas concentraciones de nitratos de sodio, de po-
tasio y de yodo. Fue el soporte de la economía nacional en el primer tercio
del siglo XX.
102 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 102 20/10/09 10:53:32
d) Hecho histórico importante de nuestro país relacionado con el caliche.
R: La Guerra del Pacífico.
e) Relación de la crisis económica del salitre con la síntesis del amoníaco.
R: En 1909, el químico alemán Fritz Haber sintetizó el amoníaco a partir
del nitrógeno atmosférico. El amoníaco fue oxidado hasta nitrato, el que
fue utilizado para obtener el salitre sintético.
1. El litio (Página 158)
Química del litio
Es importante que el docente explique a los estudiantes por qué el litio no se
encuentra en estado nativo en la naturaleza. En los salares del norte de nuestro
país el litio se extrae como cloruro de litio desde salmueras, el cual es tratado
hasta obtener el carbonato de litio, que es el producto comercial.
Actividad indagatoria: Conociendo el litio
(Página 159)
En esta actividad, el estudiante debe indagar en qué zona se extrae el salitre,
cómo se le encuentra y cómo se le conserva al estado metálico. Además, debería
lograr conocer y comprender algunas propiedades del litio.
El o la docente deben hacer hincapié en que el litio, así como el sodio, debe
guardarse bajo hidrocarburos, como éter de petróleo, por su gran reactividad
con el oxígeno del aire y la humedad. Por otro lado, recalcar la importancia es-
tratégica del litio, por sus usos en energía nuclear, específicamente en la fusión
nuclear y en la fabricación de pilas o celdas voltaicas.
Actividad indagatoria: Baterías de litio
(Página 160)
El profesor o profesora pueden utilizar esta actividad para incentivar al estudiante
en el estudio del litio, ya que la información que recolectará es actual y los usos
de las baterías de litio están relacionados con muchos aparatos electrónicos que
son de uso común.
a) La composición de las baterías de litio.
R: LiCoO2, electrolitos poliméricos y ánodos de grafito.
b) Usos de este tipo de baterías:
R: Calculadoras, teléfonos inalámbricos, celulares, máquinas fotográficas y
notebooks.
c) Ventajas e inconvenientes que presentan estas baterías.
R: Ventajas: Son de bajo mantenimiento, alta carga de energía por unidad de
masa, la autodescarga es menor que en otras baterías. Causan menos daño
que las baterías de cadmio o plomo, las que contaminan el ambiente por su
Guía didáctica para el profesor 103
QUIM4M Prof93-152 MINIST_2010.indd 103 20/10/09 10:53:32
Unidad 3
toxicidad. No tienen efecto memoria, que implica la formación de cristales
que reducen la capacidad del la batería, por lo tanto, no es necesario que
la batería esté descargada para volver a cargarla.
Inconvenientes: Requiere de un circuito de protección para mantenerse
operando de forma segura, fabricación cara comparada con otras baterías
(alrededor de un 40% más).
d) La producción de automóviles eléctricos con baterías de litio.
Ver http://www.electricdrive.org/
Carga específica para distintos ánodos Masa necesaria para producir
1 Amperio durante 1 hora
4000
Carga específica
3000
2000
1000 3.85 g 2.13 g 0.26 g
0
Pb Cd Li
Plomo (Pb) Cadmio (Cd) Litio (Li)
Reacciones del carbonato de litio
Es importante que el estudiante tenga claridad en qué forma se encuentra el
litio en la naturaleza (LiCl) y cuál es el producto que se comercializa (Li2CO3).
También, que conozca algunas reacciones químicas de formación de otros com-
puestos del litio, que también tienen alguna utilidad para el ser humano.
Procesos de extracción del litio (Página 159)
El mapa conceptual en el texto del alumno resume las etapas básicas de la
extracción del litio.
El esquema debe ser tratado por el docente para explicar a los estudiantes los
procesos de obtención del litio.
Como actividad anexa el docente puede pedir a los estudiantes que diseñen un
mapa conceptual con los usos del litio, en sus diversos compuestos, usando las
tablas que se presentan en el texto del alumno y otras fuentes de información
que el estudiante encuentre en internet u otro medio.
En la red
Sobre el litio
http://www.cienciateca.com/ctslibat.html
http://www.piedrasdecorativas.cl/litio_lithium_chile2.htm
104 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 104 20/10/09 10:53:33
2. Los nitratos (Página 162)
El nitrógeno y los nitratos
(Página 162)
En este tema el estudiante debe observar la gran cantidad de compuestos
de nitrógeno que existen y valorar los usos del nitrógeno puro y de algunos
compuestos.
El docente puede resaltar el Proceso de Ostwald en la obtención de ácido nítrico,
reforzando nuevamente la importancia de la química en la sociedad.
La actividad de análisis de la tabla de propiedades de los nitratos es útil para que los
estudiantes apliquen sus preconceptos de las propiedades de una sustancia. Entonces,
es importante que el profesor o profesora revisen dicha actividad, reforzando o
explicando aquellas propiedades que el estudiante demuestre no dominar.
El docente puede hacer reflexionar a los estudiantes sobre la utilidad que pueda
tener la diferencia de solubilidad del nitrato de sodio y el de potasio con la tem-
peratura. Los valores se pueden graficar y prestarse para presentar situaciones
problemáticas.
Salitre
(Página 163)
El salitre ha sido uno de los importantes recursos de la minería no metálica en
nuestro país. Esta es una instancia para relacionar la Química con la Historia
de nuestro país. Se puede pedir como actividad anexa que los estudiantes
averigüen algo más de la historia del salitre en la página que se menciona más
abajo. Luego, puede servir para una reflexión del profesor o profesora con los
estudiantes, rescatando algunos objetivos transversales como valorar la historia
de nuestro país y sus riquezas.
La cronología de la historia del salitre se encuentra en: http://www.albumde-
sierto.cl/historia.htm
Actividad indagatoria:
Procesamiento del salitre
(Página 166)
Es importante que el profesor revise con sus alumnos o alumnas las respuestas a
las interrogantes que aparecen en el texto y contraste sus respuestas para luego
tener un resumen en común. Por otra parte, que los haga reflexionar sobre los
métodos de obtención de nitratos, comparando los que se hacía en los tiempos
del auge del salitre en Chile y los métodos actuales.
Método que se empleaba para extraer el salitre en los años del auge de este
mineral en Chile.
R. Después de triturar el caliche se colocaba en unos recipientes de cobre con
agua y se sometía a ebullición: A medida que disminuía el agua se concentraba
la solución, precipitando el cloruro de sodio obteniéndose una solución saturada
en nitratos. El cloruro de sodio es menos soluble que los nitratos. Posteriormente,
esta solución, llamada “agua madre”, era separada y se sometía a secado hasta
obtener un sólido cristalizado.
Guía didáctica para el profesor 105
QUIM4M Prof93-152 MINIST_2010.indd 105 20/10/09 10:53:33
Unidad 3
En la red:
En las siguientes páginas puedes encontrar suficiente información sobre el pro-
cesamiento del salitre,
http://www.sqm.com/aspx/AcercaDe/ProcesoProduccion.aspx
http://www.textoscientificos.com/quimica/nitrato-potasico
http://www.unap.cl/museomin/basededatos/salitre_antiguo.htm
3. La caliza (Página 168)
Actividad indagatoria: La caliza
(Página 168)
Esta actividad crea un nexo con materias tratadas en Primer Año de enseñanza
media. Es importante que el docente promueva ese nexo y diagnostique el lo-
gro de los objetivos de estos temas en ese curso y los refuerce, si es necesario.
Conceptos a reforzar: agua dura, dureza permanente, dureza transitoria, proce-
dimientos para ablandar el agua.
Actividad experimental:
Experimentando con caliza
(Página 169)
El o la estudiante experimenta con la acción de un ácido sobre carbonato de
calcio, sarro de tetera y cáscaras de huevos.
En esta experiencia se refuerzan habilidades y competencias propias de las prác-
ticas experimentales (cognitivas, sociales y de responsabilidad frente al trabajo
en equipo). El estudiante debe concluir que el sarro de tetera y la cáscara de
huevo son carbonato de calcio.
106 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 106 20/10/09 10:53:33
4. El yodo (Página 170)
El yodo es otro no metal que aporta beneficios a la economía nacional. El do-
cente puede reforzar el objetivo de valorar la minería nacional y la importancia
de la Química como herramienta para la extracción y procesamientos de estos
recursos.
Descubrimiento del yodo
Es importante que el docente haga reflexionar a los estudiantes sobre la relación
de la Química con la Historia. Como la investigación científica que se realiza
para cubrir alguna necesidad da origen, muchas veces en forma casual, al des-
cubrimiento de nuevos materiales que pueden ser utilizados por el ser humano
para su bienestar.
Solubilidad del Yodo en: Agua Etanol Benceno Tetracloruro de carbono
Poco
Soluble Soluble Soluble
soluble
Actividad experimental:
Propiedades del yodo
(Página 171)
El o la estudiante calienta yodo bajo campana y los recoge en un embudo frío,
prueba la solubilidad en diferentes solventes, reconoce el yodo con una disolu-
ción de almidón.
El docente debe hacer hincapié en la precaución que deben tomar los estudiantes
en la realización de esta experiencia, reforzando así el objetivo de responsabilidad
el uso de reactivos químicos.
Para resumir las reacciones del yodo, el estudiante puede tabular la información.
El profesor o profesora puede hacer referencia a las interacciones intermoleculares
del yodo con los diversos solventes, para explicar la solubilidad.
La reacción entre el yoduro de sodio y yodato de sodio produce yodo, según:
R: 5NaI + NaIO3 + 3H2SO4 3I2 + 3Na2SO4 + 3H2O
Realiza esta actividad en presencia del profesor o profesora, tomando todas las
precauciones necesarias.
Como experiencia anexa, puede pedirse a los estudiantes que preparen una
mezcla de arena con yodo metálico, caliente con precaución sublimando el
yodo y cristalizándolo en un embudo de vidrio frío. Este sería un método de
separación del yodo. Precisamente la sublimación seguida de deposición es el
método de purificación de este elemento.
Guía didáctica para el profesor 107
QUIM4M Prof93-152 MINIST_2010.indd 107 20/10/09 10:53:33
Unidad 3
Actividad indagatoria: Yacimientos y minerales
(Página 172)
a) ¿Cuáles son los yacimientos de yodo en Chile? ¿Dónde están ubicados?
R: Los yacimientos de yodo en Chile están ubicados principalmente en
la región de Antofagasta. En la primera región, Tarapacá, se encuentran:
Lagunas y Granjas.
http://mapasdechile.com/economia_region02/map.htm
b) Minerales de yodo que se encuentran en la naturaleza.
R: En Chile el yodo se encuentra como yodato de sodio en los salares de
caliche.
c) ¿Por qué es necesario que la sal comestible contenga una sal de yodo?
¿Cuál?
R: El yodo es esencial para el buen funcionamiento de la glándula tiroides
y, por lo tanto, importante para prevenir enfermedades como el bocio. El
yodo en la sal comestible se encuentra como yodato de potasio.
5. El azufre (Página 173)
Actividad indagatoria: Propiedades del azufre
(Página 173)
Al inicio del tema del azufre se tabulan las características de este elemento. El
o la docente puede detectar a través de estas preguntas cuánto saben los estu-
diantes del azufre. Con respecto al Método Frasch se indica una página donde
el profesor o profesora puede investigar sobre el tema, para luego tratarlo con
los estudiantes al nivel que consideren pertinente. El estudiante debería ser capaz
de explicar el papel del azufre en la vulcanización, ya que es un tema visto en la
unidad de polímeros, lo mismo con respecto a los aminoácidos que contienen
azufre (cisteína: no esencial y metionina esencial). El profesor o profesora puede
hacer referencia de la importancia del azufre en el organismo, para la piel, el
cabello, ligamentos y tendones, ya que el azufre es necesario para la formación
del colágeno y otras proteínas estructurales.
a) Características físicas del azufre.
R: Sólido, de color amarillo, de olor característico.
b) Usos del azufre como elemento puro.
R: En agricultura, desinfección de algunos árboles como los nogales.
c) El método Frasch de extracción de azufre.
Se recomienda la página:
http://www.textoscientificos.com/quimica/azufre/proceso-azufre-frasch
d) Papel del azufre en la vulcanización del caucho.
R: Enlaza cadenas del caucho, dándole mayor rigidez a la estructura mole-
cular que se traduce en una mayor dureza y resistencia a la tracción.
108 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 108 20/10/09 10:53:33
Actividad experimental anexa:
El o la docente puede realizar la siguiente práctica:
Materiales: azufre, cuchara de combustión, matraz con agua y tapón, mechero,
papel pH universal.
Procedimiento: Colocar un trozo de papel pH en el agua, anotar color y clasifi-
car cualitativamente como ácido, base o neutro. Colocar una muestra de azufre
en la cuchara de combustión y calentar hasta observar vapores. Precaución: no
inhalar. Colocar rápidamente la cuchara dentro del matraz con agua, intentan-
do que quede algo de los vapores desprendidos dentro de él. Mantener unos
segundos, sacar la cuchara y tapar. Agitar el matraz y luego colocar un papel pH
en la solución. Describir el cambio. Explicar con ecuaciones.
Ácido sulfúrico, H2SO4
El profesor o profesora debería destacar que el compuesto más importante del
azufre en la industria química mundial es el ácido sulfúrico, por sus múltiples
aplicaciones. Según el nivel del curso, el o la docente deberá decidir con que
profundidad trata los procesos de obtención de este ácido que se presentan en
el texto: el método de contacto y el método de las cámaras de plomo.
En la red
En la siguiente cita web encuentras los detalles del proceso de las cámaras de
plomo
http://www.textoscientificos.com/sulfurico/produccion
En la red
Páginas web generales sobre minerales no metálicos
http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/
gonzaleza01/
http://www.minmineria.cl/574/propertyvalue-1986.html
http://www.sqm.com/aspx/AcercaDe/ProcesoProduccion.aspx
http://www.cochilco.cl/productos/otros_no_metalicos_tabla.asp
Guía didáctica para el profesor 109
QUIM4M Prof93-152 MINIST_2010.indd 109 20/10/09 10:53:33
Unidad 3
Vidrios, cerámicas y cemento
3 Páginas 178 a 193
Este capítulo tiene como objetivo que los estudiantes conozcan los procesos
químicos industriales utilizados en la fabricación de tres materiales, como lo son:
el vidrio, las cerámicas y el cemento. Estos temas, como muchos de los anteriores
generalmente, son trabajados por los docentes como disertaciones. Si bien esta
forma de evaluar es pertinente, la mayoría de las veces el tema sólo queda claro
para el grupo que lo trabajó, en parte por la idiosincrasia de los estudiantes chi-
lenos. El texto se ha diseñado, pensando en que todos los estudiantes aprendan
de estos temas mediante la aplicación del Método indagatorio. Por lo que se
recomienda al profesor o profesora desarrollar y analizar las actividades de cada
tema, sin caer excesivamente en la disertación.
Las primeras interrogantes del Capítulo intentan motivar la curiosidad de los
o las estudiantes por materiales que están a su alrededor con preguntas que
quizás nunca se han hecho, como: ¿Por qué el vidrio es transparente? ¿Por qué
las cerámicas y el cemento se endurecen?
Actividad exploratoria:
¿Cuánto conoces sobre el vidrio, cerámica y cemento?
(Página 179)
Con esta primera actividad las o los estudiantes se darán cuenta que si bien
tienen claros los usos en la vida cotidiana y las características físicas de estos
tres materiales, no saben o saben poco sobre la composición química, materias
primas y obtención de aquellos. La tabla que deben completar es otro medio
de despertar la curiosidad de los o las estudiantes por saber un poco más acerca
de cosas con las que conviven a diario. Se recomienda al profesor o profesora
revisar la actividad con sus alumnos o alumnas antes de comenzar con el vidrio
para así diagnosticar los preconceptos.
1. El vidrio (Página 180)
El o la docente pueden hacer una pequeña reseña histórica del vidrio, pidiendo
a sus alumnos o alumnas que investiguen y luego discutan al respecto en el
inicio de una clase.
Como sabemos, el silicio es el elemento común de los tres materiales tratados en
este capítulo. Entonces como un primer acercamiento a su estudio es necesario
que los o las estudiantes conozcan las principales características de este elemento;
para ello se presenta una tabla con sus principales características.
110 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 110 20/10/09 10:53:33
Sólido amorfo
En esta parte el profesor o profesora debe hacer notar las diferencias entre las
estructuras de un sólido cristalino, como el cuarzo y el vidrio, que no posee
una estructura definida, pero con semejanzas a un líquido, por ello a veces se le
considera como un líquido sobreenfriado. Un sólido amorfo como el vidrio no
tiene punto de fusión. Cuando se calienta “no funde” sólo pasa por un ablan-
damiento progresivo hasta transformarse en un líquido. El profesor o profesora
debe hacer notar la diferencia entre un sólido que tiene punto de fusión (tem-
peratura constante a presión constante), con un sólido que no lo tiene, como
el vidrio o PVC. El o la estudiante debe ser capaz de reconocer las diferencias
entre un sólido cristalino y un sólido amorfo.
Composición química de vidrios comerciales (Página 182)
Como varios de los temas relativos a la unidad, no se espera que el o la estu-
diante memorice la composición de los diversos tipos de vidrio que se muestran
en la tabla incluida en el texto. No obstante, es pertinente que tenga una idea
sobre dicha composición, observando las propiedades más comunes como su
coloración, su transparencia, dureza y resistencia a altas temperaturas.
Se sugiere al o la docente analizar el esquema de procesos involucrados en la
fabricación del vidrio a nivel del curso, para aclarar eventuales dudas y evaluar
formativamente el proceso general.
Actividad exploración: El vidrio
(Página 183)
Esta actividad sirve para que el estudiante indague sobre algunos tipos de vidrio,
como también para acercarlo al tema del reciclaje del vidrio. Si el docente pudiera
llevar al curso a una empresa de reciclaje, sería muy beneficioso para el alum-
nado, ya que podrían ver en directo el proceso y valorar el aporte de la química
desde el punto de vista ambiental. Se puede hacer reflexionar a los estudiantes
sobre el uso del vidrio en comparación con los plásticos como receptáculos de
diversa sustancias de uso cotidiano. Por otro lado, el diseño de un proyecto de
recolección de envases de vidrio en el Establecimiento conlleva la integración de
múltiples competencias y objetivos transversales frente al medio ambiente.
a) Propiedades y usos del vidrio Pyrex®.
R: El vidrio Pyrex® llamado también vidrio de borosilicato, por la presencia
de óxido de boro en su composición, se caracteriza por su alta resistencia
química y resistencia a las altas temperaturas sin deformarse. Sus usos son
especialmente en materiales de laboratorio y de cocina.
b) Tipo de vidrio que se usa para fabricar: botellas de bebidas, vasos y
ventanales.
R: Vidrio cal-soda silicato.
c) Sobre reciclaje en Chile, se puede encontrar información en la siguiente página:
http://www.yoreciclo.cl
En la red:
En las páginas siguientes encuentras valiosa información sobre el vidrio.
http://www.educa.madrid.org/portal/c/portal/layout?p_l_id=32603.23
Guía didáctica para el profesor 111
QUIM4M Prof93-152 MINIST_2010.indd 111 20/10/09 10:53:33
Unidad 3
Anteojos con vidrios fotocromáticos (Página 184)
Este tema constituye una curiosidad para los estudiantes y, por lo tanto, es otra
manera en que el o la docente puede motivarlos positivamente hacia el estudio
de la Química y a valorar el trabajo científico.
2. Las cerámicas (Página 185)
Las cerámicas tienen como constituyentes a las arcillas, por lo que se sugiere al
profesor o profesora revisar la composición (Al2O3• 2SiO2 • 2H2O) y principales
características de este material: plasticidad, dureza, refractariedad, alta capacidad
de absorción y adsorción, haciendo referencia al uso que le ha dado el hombre
a través de la historia.
3. El cemento (Página 187)
Cemento Portland
Se hace referencia al cemento Portland que es el más utilizado por sus propieda-
des mecánicas de alta resistencia. El profesor o profesora debe hacer reflexionar
al estudiante que la calcinación es un proceso químico que está presente en la
obtención del cemento. También es importante una integración del diagrama
que muestra la fabricación del cemento para aclarar dudas.
Actividad indagatoria: ¿Qué conoces del cemento?
(Página 187)
Esta actividad estimula la indagación acerca del cemento como material de
construcción conocido por los estudiantes sólo en términos de su uso.
En la red
Para ver el proceso productivo del cemento, visita la página:
http://www.lafarge.cl/index_cemento.php
Se recomienda al o la docente revisar la página (*) de cementos Bío-Bío S.A.
donde aparece una animación bastante didáctica de los procesos productivos
del cemento. Sería ideal que los estudiantes también tuvieran acceso a ella.
(*)http://www.cbb.cl/Cementos/proceso_productivo.aspx?Id=1&DetalleId=3
http://www.holcim.com/CL/ESC/id/38286/mod/gnm20/page/editorial.html
112 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 112 20/10/09 10:53:33
Actividad de experimentación:
Investigando el cemento
(Página 191)
En esta actividad se recomienda usar una cantidad suficiente de cemento para
mezclar con agua; de lo contrario, no se hace tan evidente el cambio de tem-
peratura. Es importante hacer una integración con las respuestas de cada grupo
para concluir finalmente respecto a las características del cemento y de sus usos.
El profesor o la profesora pueden hacer el paralelo entre el endurecimiento de
las arcillas, que es calentando, y el del cemento que es en frio.
a) Cambios físicos observados en el cemento cuando se mezcla con agua.
¿Cómo se llama esta reacción?
R: Se transforma en una pasta consistente, que cada vez se hace más viscosa.
La reacción se llama fraguado.
b) Comparación de la temperatura del agua con la de la mezcla.
R: La temperatura aumenta. Si hay un cambio en la temperatura, significa
que el proceso es de carácter químico. La energía liberada da cuenta que
el sistema va hacia un estado más estable.
c) A medida que pasa el tiempo, la mezcla adquiere mayor consistencia hasta
endurecer.
d) Cuando se coloca cemento entre dos palos de helado, ambos palos se
adhieren. El cemento es un conglomerante, que es la propiedad de adherir
otros materiales.
Guía didáctica para el profesor 113
QUIM4M Prof93-152 MINIST_2010.indd 113 20/10/09 10:53:33
Unidad 3
5.3.3 Solucionarios
Evaluación del capítulo 1
Minerales químicos industriales (Página 155)
Responde en tu cuaderno las siguientes preguntas:
1. Define brevemente los siguientes conceptos:
a) Metalurgia: Conjunto de procesos para extraer metales de un
mineral.
b) Tostación: Proceso de calentamiento en presencia de oxígeno para
reducir metales.
c) Calcinación: Proceso en que se calienta fuertemente hasta la descom-
posición del mineral.
d) Hidrometalurgia: Técnica que extrae metales desde soluciones acuosas
concentradas.
e) Pirometalurgia: Toda aquella técnica que aplica altas temperaturas a
una mena para obtener un metal.
2. Describe en qué consiste la lixiviación, lixiviación bacteriana y la flotación.
R: Lixiviación: Es un proceso de concentración de minerales oxidados.
Lixiviación bacteriana: Es un proceso hidrometalúrgico que se utiliza
para extraer metales desde minerales de baja ley. Se utilizan bacterias como
el Ferrooxidans, el Thiobacillus thiooxidans y Sulfolobus.
Flotación: Es un proceso de concentración de minerales sulfurados, utiliza agua,
aceite y un espumante. Se extrae el mineral por rebalse adherido a la espuma.
3. ¿Cuál es la diferencia entre la mena y la ganga de un mineral?
R: La mena es el mineral de importancia económica de un yacimiento. La ganga
es todo el material que acompaña a la mena y pueden ser otros minerales.
4. Entre los ejemplos dados en la tostación y calcinación, ¿cuáles son de óxido-
reducción?
R: La tostación es un proceso redox. La calcinación en rigor es un proceso
no-redox.
5. Analiza el proceso de alto horno para el hierro y destaca cuáles son procesos
redox.
R: A 200 ºC: Reducción parcial el hierro
3 Fe2O3(s) + CO(g) 2 Fe3O4(s) + CO2(g)
Fe3O4(s) + CO(g) 3 FeO(s) + CO2(g)
CaCO3(s) CaO(s) + CO2(g)
A 700 ºC: Reducción final
C(s) + CO2(g) 2CO(g)
FeO(s) + CO(g) Fe(l) + CO2(g)
A 1700 ºC:
2C(s) + O2(g) 2CO(g)
114 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 114 20/10/09 10:53:33
6. ¿Es posible obtener metales a partir de minerales utilizando sólo proceso de
ácido base?
R: No
7. ¿En qué consiste la electrometalurgia del cobre?
R: Aplicar electrólisis a una solución acidulada de sulfato de cobre.
8. ¿En qué se diferencia el cobre electrolítico del cobre RAF y el Blister?
R: Es sus purezas, el orden de menor a mayor pureza es:
Blister < RAF < electrolítico
9. ¿Qué contiene el barro anódico resultante en el proceso electrolítico del
cobre?
R: Es un concentrado de metales preciosos: Ag, Au, Pt y Pd, que se deposita
en el fondo de las cubetas durante la refinación electrolítica del cobre.
10. Ordena los metales Ag, Cu, Fe y Zn, según su poder reductor.
R: Ag < Cu < Fe < Zn
11. Ordena los iones Ag+, Cu2+, Fe3+ Zn2+, según su poder oxidante.
R: Ag+ > Fe3+ > Cu2+ > Zn2+
12. Estudia comparativamente los metales Mn, Fe, Cu, Zn, Mo, Ag, Au y Pb.
¿Cuáles dan origen a compuestos con mayor número de estados de oxida-
ción? Ordena estos metales de mayor a menor punto de fusión.
R: El Mn y Mo dan origen a mayor número de compuestos.
PF decrecientes: Mo > Mn > Au > Ag > Zn > Pb
13. ¿Qué ácidos disuelven el cobre, el hierro, la plata y el oro?
R: Cobre: HNO3, en frío, concentrado y diluido. H2SO4 en caliente y
concentrado.
Hierro: es atacado por HCl diluido y en frío. HNO3, diluido en frío. H2SO4
diluido y en frío
Plata: solo el HNO3.
Oro: solo una mezcla de HCl con HNO3 en una proporción 3:1(agua
regia)
Guía didáctica para el profesor 115
QUIM4M Prof93-152 MINIST_2010.indd 115 20/10/09 10:53:33
Unidad 3
Evaluación del capítulo 2
Minerales no metálicos (Página 177)
1. ¿Por qué razón química el litio no se encuentra en estado nativo en la
naturaleza?
R: Porque es un metal muy reactivo y se oxida en el aire.
2. ¿De qué manera se puede obtener litio metálico y cómo se puede
almacenar?
R: El litio metálico se puede obtener por electrolisis de sus sales, especialmen-
te LiCl. Para almacenarlo en estado metálico debe usarse un hidrocarburo
parafínico.
3. ¿Cuáles son los compuestos de litio de mayor importancia económica?
R: Li2CO3 y LiOH
4. Indica al menos cuatro usos del litio.
R: Medicamentos, en fusión nuclear, en baterías eléctricas y en producción
de cemento.
5. ¿Qué tipo de sales están en mayor proporción en el Salar de Atacama?
R: Nitratos y yodatos.
6. ¿Qué utilidad tiene el nitrógeno líquido.
R: En criopreservación, refrigerante industrial y en cirugías dermatológicas.
7. ¿De dónde se extrae el yodo en Chile?
R: De salares en el norte.
8. ¿De dónde se obtiene la cal y cuál es su utilidad tanto en la vida cotidiana
como en procesos industriales?
R: La cal se obtiene por calcinación de las calizas.
9. ¿Por qué se forma sarro en las cañerías y teteras?
R: Por la precipitación de carbonatos de calcio y magnesio que son de baja
solubilidad.
10. ¿Cuál es el origen geológico de las estalactitas y estalagmitas?
R: Estructuras formadas en cavernas por corrientes de agua en rocas de
calizas.
11. ¿En qué lugares marinos hay presencia de carbonato de calcio?
R: Corales y conchas de mariscos.
12. Nombra algunos usos del yodo.
R: Medio de contraste para rayos X, desinfectante.
13. ¿Qué colores presenta el yodo disuelto en solventes como el agua, alcohol
y benceno?
R: En solventes dadores de electrones como el agua (poco soluble), alcohol,
éteres, la solución es de color pardo. En solventes que son incapaces de
116 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 116 20/10/09 10:53:33
actuar como dadores electrónicos, como tetracloruro de carbono, hexano
o benceno, toma color violeta.
14. ¿Para que sirve la tintura de yodo en una casa?
R: Se usa como desinfectante
15. ¿Qué problemas se pueden producir si en el tratamiento de minerales sul-
furados se libera el dióxido de azufre a la atmósfera?
R: El dióxido de azufre es un contaminante atmosférico, es uno de los gases
que contribuye a la formación de la lluvia ácida.
16. ¿Qué importancia tiene el ácido sulfúrico en la industria química?
R: Es importante en muchos procesos industriales como, por ejemplo, en
la metalurgia del cobre, en la fabricación de explosivos, en la fabricación de
fertilizantes, fabricación de baterías eléctricas, industria textil, etc.
17. Describe los procesos de obtención de ácido sulfúrico.
R: Están descritos en el texto.
Evaluación del capítulo 3
Vidrios, cerámicas y cemento (Página 193)
1. ¿Describe qué papel importante cumple el silicio en la electrónica actual?
R: Es un semiconductor.
2. ¿Qué es el vidrio químicamente?
R: El vidrio es una mezcla de óxidos inorgánicos.
3. El cuarzo es un material muy duro, ¿cómo es estructuralmente?
R: El cuarzo es un sólido cristalino, por lo tanto, tiene una estructura
ordenada.
4. ¿Qué tienen en común la arena, el cuarzo y la arcilla?
R: La presencia de óxido de silicio.
5. ¿Qué tipo de características debe poseer un material con estructura
cristalina?
R: Las estructuras cristalinas poseen un punto de fusión, a diferencia del
vidrio que en el calentamiento poco a poco disminuye su viscosidad sin
haber fundido. Una sustancia funde cuando su temperatura permanece
constante a una presión dada.
6. Explica brevemente la fabricación del vidrio.
R: Se funde una mezcla de arena, calizas y soda, en proporciones adecuadas,
luego en caliente es moldeado o laminado, según el uso que se le quiera dar.
Guía didáctica para el profesor 117
QUIM4M Prof93-152 MINIST_2010.indd 117 20/10/09 10:53:33
Unidad 3
7. ¿Qué características básicas debe cumplir el material utilizado en el soplado
de vidrio?
R: Debe ser poco viscoso y moldeable.
8. ¿A qué corresponden químicamente las arcillas?
R: A silicatos de aluminio hidratado (Al2O3 • 2SiO2 • 2H2O).
9. ¿Qué características importantes tiene la arcilla?
R: Plasticidad, dureza, refractariedad, alta capacidad de absorción y
adsorción.
10. Menciona al menos 5 características de los materiales cerámicos.
R: Se le puede dar cualquier forma, son duros, resisten altas temperaturas, no
se disuelven en agua, ni le atacan los ácidos como el clorhídrico o nítrico.
11. Las arcillas se usan en la elaboración de múltiples objetos y materiales ¿de
qué procesos industriales son materia prima?
R: Fabricación de lozas y porcelanas, jarrones, cerámicas, soquetes y piezas
aislantes eléctricas.
12. ¿Qué tipo de compuesto aportan al cemento la caliza y la arcilla?
R: El óxido de silicio.
13. ¿Qué tipo de materiales se usan en la fabricación de lozas y porcelanas?
R: Arcillas.
14. ¿En qué procesos industriales la caliza es materia prima?
R: La caliza es materia prima en la fabricación del vidrio y del cemento
15. ¿Cuál es la diferencia entre absorción y adsorción?
R: Absorción: Proceso físico de retención por capilaridad.
Adsorción: Proceso espontáneo, generalmente exotérmico, donde la super-
ficie de un material sólido es capaz de retener o atrapar átomos, moléculas
o iones de un gas o líquido.
118 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 118 20/10/09 10:53:33
Evaluación de la Unidad 3
Procesos químicos industriales (página 197)
1A 2B 3C 4B 5C 6D
7C 8D 9B 10B 11E 12D
13A 14E 15C 16E 17A 18D
19A 20D 21E 22C 23A 24E
1. Corresponden a procesos físicos de la metalurgia:
I) Molienda
II) Lixiviación
III) Tostación
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
2. El proceso por el cual se obtiene el metal de una solución acuosa es la:
A) Molienda
B) Hidrometalurgia
C) Tostación
D) Pirometalurgia
E) Calcinación
3. Los minerales de cobre oxidados se separan del resto del mineral principal-
mente a través del proceso llamado:
A) Tostación
B) Lixiviación bacteriana
C) Lixiviación
D) Flotación
E) Calcinación
Guía didáctica para el profesor 119
QUIM4M Prof93-152 MINIST_2010.indd 119 20/10/09 10:53:33
Unidad 3
4. ¿Cuáles de los siguientes minerales corresponden a minerales del cobre?
I) Pirita
II) Magnetita
III) Malaquita
IV) Azurita
A) Solo I y II
B) Solo III y IV
C) Solo II y III
D) Solo I, II y III
E) I, II, III y IV
5. El molibdeno es un metal de importancia en la fabricación de aceros resis-
tentes a la oxidación. En Chile se extrae como subproducto del cobre en
forma de molibdenita, que corresponde a MoS2. ¿Qué proceso se utiliza
para su separación de los minerales de cobre?
A) Pirometalurgia
B) Tostación
C) Flotación
D) Calcinación
E) Lixiviación
6. Los metales se caracterizan por su buena conductividad eléctrica. Al com-
parar cobre, oro y plata, el orden creciente de conductividad es:
A) oro < plata < cobre
B) plata < oro < cobre
C) cobre < oro < plata
D) oro < cobre < plata
E) cobre < plata = oro
7. Existen diversos tipos de cobre comercial que se diferencia en su pureza,
entre el cobre Blister, el cobre electrolítico y el cobre RAF. El orden de menor
a mayor pureza es:
A) cobre Blister < cobre electrolítico < cobre RAF
B) cobre electrolítico < cobre Blister < cobre RAF
C) cobre Blister < cobre RAF < cobre electrolítico
D) cobre RAF < cobre electrolítico < cobre Blister
E) cobre electrolítico < cobre RAF < cobre Blister
120 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 120 20/10/09 10:53:33
8. En la metalurgia del hierro, se produce una gran cantidad de reacciones
químicas. Estas reacciones se pueden clasificar en:
I) ácido-base
II) oxidaciones
III) reducciones
IV) electrólisis
A) Solo I
B) Solo II
C) Solo I y II
D) Solo I, II y III
E) I, II, III y IV
9. ¿Cuál de los siguientes minerales contiene cobre y hierro?
A) Pirita
B) Calcopirita
C) Malaquita
D) Atacamita
E) Siderita
10. ¿Cuál proceso es común en la obtención del cobre y del litio al estado
metálico?
A) Pirólisis
B) Electrólisis
C) Calcinación
D) Lixiviación
E) Flotación
11. Son considerados minerales no metálicos:
I) Carbonato de litio
II) Sulfato de cobre (II)
III) Sulfato de calcio
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo I y III
Guía didáctica para el profesor 121
QUIM4M Prof93-152 MINIST_2010.indd 121 20/10/09 10:53:33
Unidad 3
12. El salitre puede ser clasificado como un:
I) mineral metálico
II) mineral no metálico
III) sulfato
IV) nitrato
Es (son) correcta(s):
A) Solo I y III
B) Solo II y III
C) Solo I y IV
D) Solo II y IV
E) Solo IV
13. Se encuentra un mineral en el norte con las siguientes características: blanco,
soluble en agua y conductor de electricidad en solución acuosa. De esta
información se puede deducir que puede ser un:
I) tipo de salitre
II) caliza
III) yodo
IV) azufre
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo II y III
E) I, II, III y IV
14. Los compuestos de litio tienen múltiples aplicaciones en nuestra vida coti-
diana. Entre ellas se pueden nombrar:
I) medicamentos
II) fertilizantes
III) absorbentes de CO2
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo I y III
122 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 122 20/10/09 10:53:33
15. El yodo, aparece como subproducto en la extracción del:
A) cobre
B) hierro
C) salitre
D) azufre
E) litio
16. ¿A cuál(es) compuesto(s) corresponde el salitre?:
I) Li2CO3
II) NaNO3
III) KNO3
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo II y III
17. ¿Qué caracteriza mejor al vidrio?
I) Es un sólido amorfo.
II) Es un sólido cristalino.
III) Se encuentra en estado natural de algunos minerales en la naturaleza
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo I y III
18. Las materias primas del vidrio son:
I) Arcillas
II) Carbonato de sodio
III) Arena
IV) Carbonato de calcio
A) Solo I
B) Solo II
C) Solo II y III
D) Solo II, III y IV
E) I, II, III y IV
Guía didáctica para el profesor 123
QUIM4M Prof93-152 MINIST_2010.indd 123 20/10/09 10:53:34
Unidad 3
19. El vidrio llamado pyrex, utilizado ampliamente en materiales de laboratorio y
en recipientes para hornos de cocina, se diferencia de los otros tipos de vidrio
por su alta resistencia al calor. Esta característica se debe a la presencia de:
A) Alto porcentaje de B2O3
B) Alto porcentaje de sodio
C) Bajo porcentaje de SiO2
D) Bajo porcentaje de calizas
E) Alto porcentaje de metales
20. El cemento y las cerámicas tienen en común:
I) Ser materiales de construcción.
II) Tener arcillas como una de sus materias prima.
III) Seguir el mismo proceso químico en su obtención.
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
21. ¿Cuál opción representa correctamente a la arena, a la caliza y a la soda
cáustica?
Soda
Arena Caliza cáustica
a) SiO2 NaOH CaCO3
b) NaOH CaCO3 SiO2
c) CaCO3 NaOH SiO2
d) NaOH SiO2 CaCO3
e) SiO2 CaCO3 NaOH
22. El concepto “clinquer” está relacionado con:
A) La fabricación del vidrio.
B) La calcinación de sílice.
C) Calcinación de caliza y arcillas en el cemento.
D) Producción de cerámicas.
E) Producción de baldosas para piso.
124 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 124 20/10/09 10:53:34
23. El proceso químico industrial utilizado en la obtención de cerámicas es:
A) Calcinación.
B) Fusión.
C) Sublimación.
D) Molienda.
E) Calentamiento a altas temperaturas.
24. El endurecimiento del cemento se puede clasificar como un proceso:
I) Físico
II) Químico
III) Exotérmico
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Solo II y III
Preguntas abiertas
1. Indica qué procesos usarías para separar las siguientes mezclas y clasifícalos
como físicos o químicos:
a) hierro de arena: magnetismo
b) yodo de arena: sublimación
c) NaCl de arena: disolución, filtración y cristalización
d) salitre de arena: disolución, filtración y cristalización
Todos procesos físicos
2. Indica los principales usos de los siguientes minerales no metálicos:
a) NaCl: sal de cocina, reactivo de laboratorio
b) SiO2: fabricación del vidrio
c) KNO3: fertilizante
d) CaCO3: fabricación del vidrio, cerámicas y cemento.
3. Investiga el proceso de obtención del coke o coque, tipo de carbón utilizado
en la reducción del hierro.
R: El coque se obtiene por calcinación de carbón de 90% a 95% de carbono,
en ausencia de aire.
Guía didáctica para el profesor 125
QUIM4M Prof93-152 MINIST_2010.indd 125 20/10/09 10:53:34
Unidad 3
4. Clasifica los siguientes minerales como óxidos y sulfuros:
a) hematina: óxidos
b) azurita: óxidos
c) calcopirita: sulfuros
d) cuprita: óxidos
e) calcosina: sulfuros
f) pirita: sulfuros
g) magnetita: óxidos
5. En el año 1869 se encontró en el norte de nuestro país, hoy sector de
Chuquicamata, el cuerpo perteneciente a un hombre probablemente ataca-
meño que se presume fue víctima de un derrumbe en una mina de cobre.
Estudios posteriores con carbono 14 indican que “el hombre de cobre” murió
en el año 550 d. C. El cuerpo original permanece hasta hoy preservado
en el Museo de Historia Natural de Nueva York. En Chile se expone una
réplica en el Museo de Historia Natural en Santiago.
Investiga qué propiedad del cobre preservó este cuerpo y la historia de
hallazgo.
R: El cobre conservó este cuerpo por su acción bactericida.
6. Indica la propiedad del cobre que lo hace utilizable en la fabricación de los
siguientes implementos:
a) Cascos de embarcaciones: resistencia a la corrosión y antialgas.
b) Telefonía: conductividad eléctrica
c) Paneles solares: conductividad eléctrica
d) Alambres: maleabilidad
e) Agricultura: sales fungicidas
f) Jaulas en la salmonicultura: propiedades bactericidas y resistencia a la
corrosión
126 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 126 20/10/09 10:53:34
5.3.4. Errores y dificultades más frecuentes
Los contenidos de esta unidad corresponden en cierto modo a la cultura química
que debieran tener los estudiantes, teniendo presente que nuestro país es rico en
minerales y además son recursos de gran importancia en la economía nacional.
En general, los docentes se refieren muy poco a los temas de esta unidad y si lo
hacen, es a través de disertaciones, que no siempre son la mejor estrategia de
aprendizaje. Esto ocurre, en muchos casos porque estos contenidos se encuentran
al término del curso, cuando los estudiantes están más preocupados de preparar
las pruebas de ingreso a la universidad. Por lo general, los estudiantes saben cuáles
son los principales recursos mineros del país, pero no distinguen con claridad,
dónde se encuentran los yacimientos, pero no distinguen con claridad los proce-
dimientos utilizados en su extracción, y lo que es más grave tienen escaso manejo
de la nomenclatura química. Esto último debido a que la nomenclatura como
contenido de aprendizaje no se encuentra en forma explícita en los programas
de estudio y solo aparece en algunos temas de manera tangencial.
5.3.5. Anexos
5.3.5.1 Actividades complementarias para la Unidad
Una de las principales dificultades de esta unidad es no tener pasos prácticos
accesibles como procesos industriales. Sin embargo, es posible realizar prácticas
de laboratorio sencillas y accesibles, como las indicadas en el libro del alumno
y del apoyo docente. Es importante que el profesor o la profesora muestren la
Química como una ciencia aplicada a la industria; que esta es una de las mejores
formas de mostrar las ciencias químicas. Así también, el profesor o la profesora
podrían incentivar el uso de la Química aplicada en el mundo de hoy, los procesos
químicos industriales, y como un medio de no agotar los recursos no renovables
de nuestro planeta, y el uso del reciclaje como un medio ecológico óptimo para
preservar los recursos no renovables.
Hombre de cobre:
http://www.sonami.cl/cgi-bin/procesa.pl?plantilla=/boletinmensual_detalle.
html&id_art=924
h t t p : / / w w w. l a n a c i o n . c l / p r o n t u s _ n o t i c i a s / s i t e / a r t i c / 2 0 0 5 0 819 /
pags/20050819220058.html
Guía didáctica para el profesor 127
QUIM4M Prof93-152 MINIST_2010.indd 127 20/10/09 10:53:34
Unidad 3
Proyecto de Unidad
El cobre
El Proyecto que se plantea a los estudiantes está relacionado con el cobre. ¿Por
qué el cobre? Nos parece importante que los y las estudiantes reconozcan las
riquezas minerales de su país y qué mejor opción que este metal tan importante
para Chile. Por un lado, tiene una importancia de tipo económico que hemos visto
incrementada en los últimos años, debido a sus múltiples aplicaciones industriales
en el mundo. Por otra parte, las proyecciones a futuro son prometedoras, tanto por
las aplicaciones tradicionales como por las que se vislumbran en la parte médica,
especialmente por su acción bactericida. El o la docente debe, motivar, entonces, a
sus alumnos o alumnas a trabajar sobre este proyecto no solo por el conocimiento
químico que puedan obtener, sino también por los objetivos transversales que se
desprenden del trabajo; por ejemplo, valorar el país donde viven.
En esta guía no se responden las situaciones planteadas, porque son varias las
alternativas que pueden tomar los estudiantes en su desarrollo y en gran parte
están descritas en el texto.
Actividad de aplicación:
Producción de yodo en Chile
En esta actividad el o la estudiante, utilizando la tabla del texto, tienen la posibi-
lidad de graficar, extrapolar y predecir con respecto a la producción de yodo en
los próximos años. Como ejercicio de predicción puede ser bastante bueno.
En la red
http://www.sqm.com/aspx/AcercaDe/ProcesoProduccion.aspx
Actividad indagatoria:
Usos del litio en medicina
El profesor o profesora podrá hacerle ver a sus alumnos que hay otros usos para
este metal, más allá de las baterías de litio. Podría hacer aquí una investigación
interdisciplinaria con el área de biología.
Nuestro país es uno de los principales productores de litio del mundo, como
carbonato de litio. Este metal, además de ser utilizado en baterías de litio, tiene
un uso en medicina psiquiátrica para el tratamiento del trastorno bipolar. Que
los alumnos investiguen sobre este trastorno psiquiátrico y su tratamiento. ¿Por
que se utilizan sales de litio? ¿Debería el litio ser incorporado en nuestra dieta?
¿Qué pasaría si una persona sana ingiere sales de litio en su dieta?
128 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 128 20/10/09 10:53:34
Actividad indagatoria:
La industria minera del cobre en Chile
En esta actividad el profesor o la profesora podrá profundizar un poco más
sobre los distintos procesos de obtención del cobre en Chile, según el tipo de
mineral y sus principales agentes contaminantes, y cómo evitarlos para cuidar
nuestro planeta.
Un porcentaje de los minerales de cobre en nuestro país son minerales sulfurados,
tales como la calcopirita y la bornita, con una ley no superior al 3 o 4 % en la
mayoría de los casos. Este mineral después de varios procesos de chancado se
concentra mediante procesos de flotación. El cobre concentrado, con una ley
promedio del 30%, se somete a procesos de pirometalurgia mediante los cuales el
cobre del concentrado es transformado en cobre metálico. Uno de los principales
subproductos en este proceso es ácido sulfúrico. El profesor o profesora podrá
incentivar a sus alumnos a investigar sobre los procesos de obtención de cobre
en nuestro país, los tipos de minerales y yacimientos. También, por ejemplo,
podrían hacer las siguientes preguntas para profundizar sobre el tema: ¿Qué es
un proceso de flotación? ¿Cuándo y dónde se utiliza este proceso? ¿Cómo se
produce y almacena el ácido sulfúrico proveniente del proceso pirometalúrgico?
Proponga usos para el ácido sulfúrico generado.
http://www.codelco.cl
http://www.quepasa.cl/medio/articulo/0,0,38035857_157519512_2205554
48,00.html
http://www.mind-surf.net/drogas/litio.htm
Guía didáctica para el profesor 129
QUIM4M Prof93-152 MINIST_2010.indd 129 20/10/09 10:53:34
Unidad 3
Material fotocopiable
5.3.5.2 Instrumento de evaluación
Capítulo1. Metalurgia de metales
Nombre del alumno(a):_____________________________________
Tema: Evaluación 1. Metalurgia
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. Se dice que el cobre podría ser útil para fabricar las barandas de las camas
de hospitales y materiales médicos. ¿Qué propiedad del cobre se está
aplicando?
I) Conductividad
II) Bactericida
III) Ductilidad
IV) Maleabilidad
A) Solo I
B) Solo II
C) Solo I y III
D) Solo I, II y IV
E) I, II, III y IV
2. Para evitar la corrosión del hierro, se puede mezclar con:
I) carbono
II) arcillas
III) cal
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
130 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 130 20/10/09 10:53:34
Material fotocopiable
3. En la naturaleza hay metales que no se encuentran en estado nativo por su
alta reactividad, ese es el caso de:
I) Na
II) Li
III) Au
IV) Ag
A) Solo I
B) Solo II
C) Solo I y II
D) Solo III y IV
E) I, II, III y IV
4. ¿Cuál (es) de los siguientes metales no podrían ser usados como ánodo en
la refinación electrolítica?
I) Cobre RAF
II) Cobre Blister
III) Plata
IV) Oro
A) Solo I
B) Solo II
C) Solo I, II, III
D) Solo I y IV
E) Solo III y IV
5. El orden creciente de producción nacional de oro (1), hierro (2), cobre (3)
y molibdeno (4) es:
A) 1 - 2 - 3 - 4
B) 2 - 3 - 4 - 1
C) 1 - 4 - 2 - 3
D) 1 - 2 - 4 - 3
E) 4 - 3 - 2 - 1
6. El molibdeno es un subproducto extraído de las minas de cobre. Su impor-
tancia industrial está referida a que:
A) con él se fabrican cementos de alta dureza.
B) es materia prima de cerámicas.
C) posee una alta conductividad eléctrica.
D) participa en la elaboración de aceros especiales.
E) en unos años más reemplazará al cobre.
Respuestas 1B, 2A, 3C, 4E, 5C, 6D
Guía didáctica para el profesor 131
QUIM4M Prof93-152 MINIST_2010.indd 131 20/10/09 10:53:34
Unidad 3
Material fotocopiable
Capítulo 2. Procesos en no metales
Nombre del alumno(a):_____________________________________
Tema: Evaluación 1. Procesos en no metales
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. Para el litio metálico, el proceso de obtención es:
A) Cristalización
B) Electrólisis
C) Fusión
D) Calcinación
E) Oxidación
2. La calcinación es un proceso
I) químico
II) físico
III) ácido-base
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y III
E) Solo II y III
3. El proceso de sublimación puede ser utilizado en la obtención y purificación
de:
A) yodo
B) hierro
C) litio
D) cobre
E) manganeso
132 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 132 20/10/09 10:53:34
Material fotocopiable
4. Se encuentra un yacimiento de caliche en el norte, ¿qué proceso utilizarías
para extraerlo?:
I) Flotación y evaporación
II) Lixiviación en bateas y cristalización
III) Sublimación y electrólisis
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) I, II y III
5. En los yacimientos de caliche en el norte chileno las sales más abundantes
son:
A) NaNO3 y KNO3
B) KNO3 y CaSO4
C) NaNO3 y NaCl
D) NaCl y Na IO3
E) KNO3 y MgSO4
6. El carbonato se calcio se encuentra en:
I) la cáscara de los huevos.
II) el mármol.
III) conchas marinas.
Es (son) correcta(s):
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y II
E) I, II y III.
Respuestas 1B, 2D, 3A, 4B, 5C, 6E
Guía didáctica para el profesor 133
QUIM4M Prof93-152 MINIST_2010.indd 133 20/10/09 10:53:34
Unidad 3
Material fotocopiable
Capítulo 3. Vidrio, cerámica y cemento
Nombre del alumno(a):_____________________________________
Tema: Evaluación 1. Vidrio, cerámica cemento.
Fecha: ____________________________________________________
Puntaje total: ______________________________________________
Nota: _____________________________________________________
1. La obsidiana corresponde a un(a):
A) sólido cristalino
B) tipo de arcilla
C) sólido amorfo
D) borato
E) cerámica
2. El cemento es un producto que implica la adición de yeso en una de sus
etapas del proceso de obtención. El yeso cumple la función de:
A) un aglomerante.
B) favorece del fraguado.
C) es un conglomerante.
D) favorece la reacción exotérmica.
E) estabiliza al cemento.
3. Cuando al material que forma el vidrio se agregan óxidos de hierro, cromo
o cobalto se logra:
A) un menor punto de ebullición del vidrio.
B) una mayor densidad del vidrio.
C) fabricar un vidrio laminado
D) disminuir la corrosión del vidrio.
E) colorear el vidrio
4. La calcinación se diferencia de la fusión porque es:
I) un cambio químico
II) es un cambio físico
III) produce nuevas sustancias
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y III
E) Solo II y III
134 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 134 20/10/09 10:53:34
Material fotocopiable
5. En el proceso industrial de fabricación del cemento, se verifican los siguientes
procesos:
I) Fusión de arcillas.
II) Calcinación de arcilla.
III) Lixiviación de arcillas.
Es (son) correcta(s):
A) Solo I
B) Solo II
C) Solo III
D) Solo I y III
E) I, II y III
6. Para obtener azufre desde el yeso, se utiliza una:
A) Reducción con carbono.
B) Fusión.
C) Lixiviación.
D) Flotación.
E) Sublimación.
Respuestas 1C, 2A, 3E, 4D, 5B, 6A
Guía didáctica para el profesor 135
QUIM4M Prof93-152 MINIST_2010.indd 135 20/10/09 10:53:34
Unidad 3
5.3.6. Bibliografía de la Unidad
1. R. Chang. Química. 9ª Ed. Española. McGraw -Hill, 2007.
2. T. L. Brown. H.E. LeMay y B.E. Bursten. Química. La Ciencia Central.
9ª Ed. Española. Pearson Educación, 2004.
3. M.S. Silberberg. Química General. McGraw Hill, 2002.
4. J.W. Moore, J.C. Kotz, C.L. Stanitski, M.D. Joesten, J.L.Wood.
El Mundo de la Química. 2ª Ed. Española, Pearson Educación, 2000.
5. A. González. Riquezas minerales de Chile a nivel mundial. Ed. U. de Chile,
2000.
6. J. C. Vega, R. Gana. Recursos naturales de Chile: Una Visión desde la Química.
Publicación del Programa MECE, 1998.
136 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 136 20/10/09 10:53:34
Material fotocopiable
6. Anexos
6.1. Instrumentos de evaluación fotocopiable
1. Ejemplos de pautas para evaluar diversas modalidades de trabajo
colaborativo:
Nombre del alumno(a): _____________________________________
Fecha: _____________________________________________________
S: Siempre; F: Frecuentemente; A: Algunas Veces; P: Pocas Veces; N: Nunca
AUTO- CONCEPTO VALORACION
CRITERIOS
VALORACION PROFESOR CONJUNTA
Busco alternativas, pregunto,
para la solución de problemas.
Busco el porqué de las cosas.
Manejo diferentes fuentes de información.
Asumo actitud crítica
preguntándome cuán confiable
o seria es la información de que dispongo.
Hago buen uso de los materiales
e implementos de que dispongo.
Participo aportando ideas y me intereso por
que se logre el objetivo del trabajo propuesto.
Tengo conciencia que al trabajar debo
hacer esfuerzos por comprender, relacionar
y aplicar los conceptos tratados en el trabajo
a mi vida cotidiana. ¿Me pregunto dónde
los he visto?, por ejemplo.
Estoy consciente que debo revisar el
trabajo antes de entregarlo para
detectar y corregir posibles errores.
Trato de pensar, siguiendo una forma
coherente para razonar y cuando no se
me ocurre pregunto a mi profesor(a).
Soy innovador, le pongo algo de mí,
evito la copia en el desarrollo de mis
trabajos o en los que participo.
Generalmente pregunto sobre los
temas a otras personas
para entender mejor y ver su aplicación
en mi vida cotidiana.
Guía didáctica para el profesor 137
QUIM4M Prof93-152 MINIST_2010.indd 137 20/10/09 10:53:34
Material fotocopiable
2. Pauta para evaluar habilidades de aprendizaje colaborativo1.
Indicaciones: De acuerdo a lo observado por ustedes, señalen su apreciación, escribiendo frente a ca-
da aspecto la letra de uno de los siguientes concepto valorativo: E = Excelente; S = Satisfactorio; N =
Necesita Trabajo (ayuda); I = Insatisfactorio; N/O = No Observado.
Nombre Alumno__________________________________________________________________
Tipo de habilidad Nombre de los participantes
Habilidades observadas durante el trabajo cooperativo. 1 2 3 4 yo
Permanece en su tarea.
Termina sus tareas.
Sigue las instrucciones.
Comprende las ideas
Permanece en grupos.
Comparte materiales.
Se preocupa por el tiempo.
Da evidencias de investigación.
Habilidades sociales 1 2 3 4 yo
Escucha a otros.
Usa tono de voz adecuado.
Respeta los turnos.
Hace preguntas.
Comparte sus ideas.
Informa sus ideas.
Solicita ayuda.
Ayuda a otros.
Logra consenso grupal.
Habilidades de trabajo 1 2 3 4 yo
Automotivado.
Independiente.
Dispuesto a correr riesgos.
Piensa creativamente.
Piensa con coherencia.
Muestra confianza.
Dedicación horaria.
Puntualidad.
Perseverancia.
Cumplimiento de tareas organizadas.
Aporte material 1 2 3 4 yo
Monetario (cuando es necesario).
Utensilios.
Manualidades (dactilografía, copiado, etc.).
138 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 138 20/10/09 10:53:34
Material fotocopiable
Nombre Alumno: _________________________________________________________
Instrucciones: Marca sobre las letras M.V.: (Muchas Veces); A.V.: (Algunas Veces) o P.V.: (Pocas
Veces), según la percepción que tú y tus compañeros tengan sobre lo consultado más abajo:
¿Cómo lo hicimos en grupo? M. V A. V. P. V. ¿Cómo lo hice yo?
Cada uno de nosotros
M. V A. V. P. V. Yo contribuí con mis ideas.
contribuyó con ideas.
Nos escuchamos entre nosotros. M. V A. V. P. V. Yo escucho a mis compañeros.
Nos dimos ánimo mutuamente M. V A. V. P. V. Yo di ánimo a mis compañeros
Creamos a partir Elaboré mis ideas a partir
M. V A. V. P. V.
de las ideas de todos de las ideas de todos.
Respetamos los turnos para
Respeté los turnos para cumplir
hacer cumplir con nuestras M. V A. V. P. V.
con mis responsabilidades.
responsabilidades.
Para mejorar nuestro trabajo Para mejorar mi trabajo puedo:
podríamos:
Guía didáctica para el profesor 139
QUIM4M Prof93-152 MINIST_2010.indd 139 20/10/09 10:53:34
Material fotocopiable
3. Ejemplos de modelos para diseñar protocolos experimentales, pautas de
entrevista, fichas, encuestas.
• Informes de laboratorio:
ACCIONES A REALIZAR
ANTES Escoger el libro contextualizado del informe.
Identificar el problema principal que se quiere resolver.
Plantear la hipótesis (posible respuesta al problema y que se debe verificar).
Indicar los materiales que se van a utilizar.
DURANTE Describir el procedimiento seguido para realizar la actividad (pasos principales y en
orden temporal).
Transcribir observaciones y datos relevantes.
Comunicar los datos en esquemas/gráficos, según corresponda.
Redactar las conclusiones (afirmaciones que emergen de las observaciones y se
relacionan con la hipótesis).
Revisión del texto del informe elaborado.
DESPUÉS En qué otros contextos se podría estudiar el tema de la investigación.
¿Qué preguntas haría a sus alumnos(as) para cerciorarse que han comprendido el
trabajo experimental/práctico.
Otras ideas que usted puede incluir y que se refieran a ciencia escolar.
INFORME DE LABORATORIO
Nombre del experimento: .....................................................................................
Nombres: ................................................................................................................
Fecha: ......................................................... Curso: .....................
INTRODUCCIÓN
• ¿Cuál es el problema a resolver?
• ¿Cuál es la posible respuesta al problema (hipótesis)?
• ¿Qué razones podría dar y en qué fundamenta su hipótesis?
• Razón 1:
• Razón 2:
CUERPO DE LA GUÍA
• Observaciones referidas a la actividad 1:
• Observaciones referidas a la actividad 2:
• Observaciones referidas a la actividad 3:
• Observaciones referidas a la actividad 4:
• Observaciones referidas a la actividad 5:
CONCLUSIONES
• Resumen de las ideas que se deducen de las actividades realizadas.
• Respuesta a la hipótesis.
140 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 140 20/10/09 10:53:35
Material fotocopiable
INFORME DE LABORATORIO
Nombres: ....................................................................................... Fecha: ......................
Título del experimento: ..........................................................................................................
Propósito (dé una razón de por qué está haciendo este experimento):
................................................................................................................................................
Nombre aparatos y materiales que utilizó: .............................................................................
Hipótesis (su mejor explicación de lo que cree que va a pasar):
................................................................................................................................................
Precauciones (en qué hay que tener cuidado): .....................................................................
Procedimiento (los pasos que realizó en orden adecuado):
................................................................................................................................................
Observaciones y resultados (de lo observado y medido):
................................................................................................................................................
Conclusión(es) (¿Era correcta su hipótesis? ¿Por qué? ¿Por qué sí, no?):
................................................................................................................................................
Comentarios o discusión (¿Cómo mejoraría este experimento?):
................................................................................................................................................
INFORME DE LABORATORIO
V de Gowin
Conceptos Metodologías o procedimientos
(que se identifican de seguidos
la actividad práctica)
Aquí se escribe:
Aquí se escribe el Problema o Pregunta Aquí se escriben:
listado de conceptos central a resolver. Observaciones
que se deducen de la relevantes realizadas.
experiencia realizada.
Aquí se escriben:
Conclusiones o
afirmaciones de lo
observado.
Respuesta a la pregunta central
Materiales utilizados
Guía didáctica para el profesor 141
QUIM4M Prof93-152 MINIST_2010.indd 141 20/10/09 10:53:35
Material fotocopiable
Lista de Cotejo
Objeto a evaluar: Informe de Práctica de Laboratorio
Grupo: ................................................................. Nota: .....................................
Integrantes: ......................................................... Fecha: ...................................
Aspectos observados Presencia Ausencia
1. Los cuadros están correctamente elaborados.
2. Los gráficos son adecuados para el análisis de la
investigación.
3. Los pasos de la técnica empleada son explicitados con
detalles.
4. Los dibujos representan, lo mejor posible, las
observaciones realizadas.
5. Las interpretaciones y conclusiones son fundamentadas.
6. Se citan fuentes bibliográficas.
7. El informe se presenta ordenado y limpio.
8. El informe se entrega en la fecha señalada.
142 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 142 20/10/09 10:53:35
Material fotocopiable
4. Ejemplos de fichas de autoevaluación:
a) Descriptivas
¿Cómo fue tu desempeño durante el trabajo desarrollado en clase?
Gustavo responde:
“Cumplí con los trabajos encargados, como los mapas conceptuales; cuando puedo participo
en clase, aún me cuesta”.
“Creo que he cumplido con las actividades y tareas que se han realizado hasta la fecha”. “He
fallado en una tarea, me quedó mal”.
“He aprendido a realizar un mapa conceptual”. “No presenté mi carpeta”. “Nunca he faltado
a clase”. “Solo una vez me llamaron la atención”.
b) Con escala
Nombre alumno: ......................................................... Fecha: ...................................
Casi Raras
Indicadores Siempre A veces Nunca
siempre veces
1. Participo activamente en las
actividades de la clase.
2. Cumplo con las tareas asignadas
por mi profesor(a) o mis
compañeros.
3. Comprendo el significado de los
contenidos desarrollados.
4. Puedo aplicar los contenidos
aprendidos a nuevas situaciones.
5. Reconozco la importancia y valoro
los conocimientos adquiridos.
c) Metacognitiva
Nombre alumno: ......................................................... Fecha: ...................................
¿Qué sabía yo ¿Qué sé yo ¿Cómo lo he
Contenidos del tema
antes? ahora? aprendido?
Guía didáctica para el profesor 143
QUIM4M Prof93-152 MINIST_2010.indd 143 20/10/09 10:53:35
Material fotocopiable
5. Escala para la valoración de dibujos de ciencias
Este instrumento supone la consideración de una serie de indicadores acordes a los
criterios establecidos para la elaboración de los dibujos seguidos de tres columnas
que habrán de determinar:
• La puntuación máxima otorgada previamente por el docente.
• La valoración del mismo estudiante.
• La del docente.
Una vez concluido el proceso de asignación de puntuaciones, se pretende obtener
un promedio que derive en una calificación.
Puntuación Valoración Valoración
Indicadores
máxima del alumno del docente
1. Contiene los criterios o características determinadas
con anterioridad.
2. Emplea una escala apropiada.
3. El uso de colores es adecuado al contexto o tema
estudiado.
4. El dibujo representa realmente el contenido de estudio
en toda su concepción.
5. Emplea, si corresponde, nomenclatura para cada uno
de los elementos que lo conforman.
6. Expresa relación entre la estructura y función que
quiere representar.
7. Incluye texto que aclara la representación visual.
(Adaptada de Lewin y Shoemaker, Great Performances Creating Classroom - Based Assessment Task, 2000, p. 36).
144 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 144 20/10/09 10:53:35
Material fotocopiable
6. Pauta para evaluar el cuaderno de ciencias
Debe mejorar
Indicadores Muy bien Bien Regular
en
Presentación:
• Titula adecuadamente cada unidad.
• Anota la fecha del día.
• Deja un margen adecuado a derecha e
izquierda.
• Escribe con buena letra con tachaduras y
correcciones.
• Escribe con buena letra y sin tachaduras.
Organización:
• Diferencia entre Unidades, dejando una página
en blanco, por ejemplo.
• Diferencia adecuadamente los apartados de
cada Unidad de alguna forma visible.
• Diferencia contenidos y actividades titulando
adecuadamente.
Técnicas de aprendizaje:
• Anota las explicaciones del profesor(a) sobre el
tema como si fueran dictados.
• Copia sin elaborar los contenidos que necesita
aprender.
• Anota explicaciones con sus propias palabras.
• Utiliza esquemas para tomar los apuntes.
• Inserta esquemas y gráficos ya elaborados.
• Elabora esquemas y gráficos por sí mismo.
Actividades:
• Copia los enunciados de cada actividad.
• Realiza las actividades que le resultan más
fáciles.
• Intenta realizar todas las actividades
propuestas.
• Realiza todas las actividades, aunque pida
ayuda.
Guía didáctica para el profesor 145
QUIM4M Prof93-152 MINIST_2010.indd 145 20/10/09 10:53:35
Material fotocopiable
7. Pauta para evaluación de lectura de textos científicos en parejas
Instrucciones:
a) Elige un compañero(a) para revisar los textos mutuamente.
• Tu tarea será leer el texto en voz alta.
• La tarea de tu compañero(a) será escuchar atentamente la lectura.
• La del docente.
b) A continuación, juntos contesten las preguntas siguientes:
Nombre del texto por evaluar: ..............................................................
Página en que se encuentra en el libro: ............................................
Nombre de ustedes: ..........................................................................
Fecha: ...............................................................................................
Preguntas Respuestas breves y claras
1. ¿Creen que el texto es interesante?
¿Atractivo?
2. ¿Creen que le falta algo? ¿Qué?
3. ¿Hay algo poco claro o mal expresado?
¿Cuál?
4. ¿Pueden sugerir algunas palabras o
expresiones para mejorarlo? Háganlo.
5. ¿Podrían encontrar una mejor manera de
empezar o acabar el texto?
6. ¿Es demasiado largo o corto? ¿Por qué?
7. ¿Se puede suprimir algo? Por ejemplo:
8. ¿El texto corresponde a lo que decía en el
título o a lo que se proponía el autor?
146 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 146 20/10/09 10:53:35
Material fotocopiable
8. Pauta de seguimiento del desarrollo de habilidades científicas
(Para el docente)
Fecha: Fecha: Fecha: Fecha Fecha:
Habilidades
Observaciones Observaciones Observaciones Observaciones Observaciones
• Exponen
ideas usando
“términos
científicos”.
• Relatan ideas en
forma coherente.
• Explican con
claridad lo
solicitado.
• Debaten sus
ideas en forma
mesurada.
• Ilustran, hacen
tablas y gráficos
respetando
convenciones.
• Manipulan con
cuidado y bien
los instrumentos
del laboratorio.
• Montan
experimentos,
según
instrucciones
dadas.
• Se organizan al
interior del grupo
con autonomía.
• Diseñan
experimentos
sencillos.
• Elaboran informes
de laboratorio,
según
instrucciones
dadas.
• Otros que
Ud. quiera
considerar.
Guía didáctica para el profesor 147
QUIM4M Prof93-152 MINIST_2010.indd 147 20/10/09 10:53:35
Material fotocopiable
9. Breve guía metodológica para orientar el trabajo grupal
Como metodología para realizar las actividades grupales, especialmente en el
desarrollo de las actividades, se sugiere al profesor o profesora usar el Método
Colaborativo. El método consiste en conformar grupos de trabajo de 4 inte-
grantes, en el que al menos haya un estudiante de buen rendimiento, para darle
consistencia al grupo.
Metodología para el trabajo colaborativo
El trabajo colaborativo es muy interesante como metodología de trabajo, ya
que a través de él se puede lograr en los alumnos o alumnas la incorporación
de habilidades tanto intelectivas como sociales. Este tipo de trabajo en equipo
es hoy en día muy utilizado a todo nivel y, por lo tanto, las habilidades que el
alumno pueda desarrollar con este método le serán útiles a posteriori, incluso
en su vida laboral.
Para el trabajo colaborativo en grupos, se sugiere al docente que induzca a
cada grupo la asignación de roles diferentes; por ejemplo, si el grupo es de 4
integrantes debería haber:
1. Jefe(a) de grupo: Alumno o alumna encargado(a) de dirigir y organizar las
actividades a realizar por el grupo.
2. Secretario(a): Alumno o alumna encargado(a) de tomar apuntes en forma
ordenada de las observaciones y los resultados obtenidos en el trabajo.
3. Encargado(a) del material: Alumno o alumna que pide y devuelve los
materiales necesarios para desarrollar las experiencias.
4. Expositor(a): Alumno o alumna que se encarga de exponer los resultados
o conclusiones del grupo al curso.
148 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 148 20/10/09 10:53:35
Mapas de Progreso:
algunas ideas para su uso como apoyo al mejoramiento
continuo del aprendizaje
Los Textos Escolares son una importante herramienta para la implementación del
currículum en la sala de clases. En conjunto con los Programas de Estudio y los Mapas de
Progreso, buscan apoyar el trabajo que se realiza en los establecimientos educacionales
para que los estudiantes logren mayores aprendizajes, en base a las definiciones que
establece el Marco Curricular nacional.
En el siguiente esquema se presenta la pregunta orientadora que busca responder cada
uno de los instrumentos curriculares:
Los Mapas de Progreso describen resumidamente los conocimientos, habilidades
y comprensiones que caracterizan cada uno de los 7 niveles en que se desarrolla el
aprendizaje de una determinada competencia o dominio clave. Son una herramienta
curricular no obligatoria, que complementa a los Programas de Estudio y los Textos
Escolares, y pueden ser utilizados de diversas formas.
A continuación se describen dos de ellas, que pueden ser de utilidad para apoyar el
desarrollo del aprendizaje que promueve este texto de estudio:
Guía didáctica para el profesor 149
QUIM4M Prof93-152 MINIST_2010.indd 149 20/10/09 10:53:35
1.- Reflexión conjunta sobre la progresión de los aprendizajes que promueve el
currículum para mejorar la articulación entre profesores del sector.
Si se hace una lectura de los siete niveles de los Mapas ya pueden ser un interesante
aporte, debido a que muestran una visión sintética de lo que se espera se logre como
aprendizaje en los 12 años de escolaridad. Su estructura concisa describe una panorámica
de todo el trayecto escolar, aportando una mirada longitudinal, que favorece la reflexión
pedagógica entre profesores de distintos cursos.
Por ejemplo, a partir de la revisión de un Mapa de Progreso, puede hacerse una reflexión
conjunta respecto de la manera en que progresa el aprendizaje, estableciendo un análisis
general, entre profesores del sector y la jefatura técnica, en relación a ¿cómo estamos
entendiendo la progresión del aprendizaje respecto de este referente? Los profesores
y profesoras pueden revisar y analizar en conjunto los aprendizajes constitutivos de
una determinada competencia, y definir acciones a seguir que sean coherentes con
el logro de dichos aprendizajes, en base a preguntas como: ¿de qué forma estamos
ordenando el trabajo y organizándonos en conjunto para ir progresando en el logro de
estos aprendizajes de nuestros alumnos y alumnas?
Los Mapas favorecen la articulación dentro y entre los ciclos de enseñanza de un
establecimiento educacional, promoviendo una comprensión común respecto al
aprendizaje y aportando claves para observar su progresión. Ello propicia la responsabilidad
compartida entre docentes y el trabajo en equipo dentro del establecimiento.
2. Reflexión conjunta sobre los trabajos de alumnos y alumnas, para monitorear el
progreso de su aprendizaje en relación a la expectativa que describe el Mapa.
Los Mapas de Progreso definen el crecimiento del aprendizaje de los estudiantes, a
través de descripciones de sus distintas etapas y de trabajos de alumnos en cada una de
estas. Con el fin de apoyar la observación del aprendizaje, los Mapas presentan tareas,
estímulos o motivaciones que se utilizaron para recoger evidencias del aprendizaje,
buscando observar el desempeño de los alumnos en la competencia descrita en el
Mapa.
El docente puede aplicar estas tareas, las que puede encontrar en los anexos de cada
uno de los Mapas (www.curriculum-mineduc.cl) u otras que el equipo docente puede
desarrollar, para luego analizar la evidencia del desempeño de sus estudiantes e inferir
el nivel de aprendizaje en relación a las descripciones realizadas por el Mapa.
Es importante que esta observación y análisis de los trabajos de los alumnos sea
desarrollado en conjunto por los profesores del sector, de modo de reflexionar entre
pares y desarrollar una visión compartida respecto a cómo progresa el aprendizaje de
sus alumnos en las distintas competencias claves.
150 QUÍMICA 4 • Guía didáctica para el profesor
QUIM4M Prof93-152 MINIST_2010.indd 150 20/10/09 10:53:36
Potrebbero piacerti anche
- Unidad 3 MatematicaDocumento87 pagineUnidad 3 MatematicaErika Dayana Herrera100% (1)
- Susan E. Hinton - Rebeldes PDFDocumento102 pagineSusan E. Hinton - Rebeldes PDFDreamscape Wu60% (5)
- Fifa Futbol JuvenilDocumento257 pagineFifa Futbol JuvenilEsteban Brigante100% (2)
- Guia PodologicaDocumento140 pagineGuia PodologicaJesus Gomez PayeNessuna valutazione finora
- Tema 2 La Electricidad IDocumento11 pagineTema 2 La Electricidad IPedro Rosales Gutierrez100% (1)
- Unidad 3 MatematicaDocumento87 pagineUnidad 3 MatematicaErika Dayana Herrera100% (1)
- Susan E. Hinton - Rebeldes PDFDocumento102 pagineSusan E. Hinton - Rebeldes PDFDreamscape Wu60% (5)
- Texto Quimica Iii y Iv em PDFDocumento450 pagineTexto Quimica Iii y Iv em PDFPaola3434Nessuna valutazione finora
- Publicacion18 (02092010)Documento8 paginePublicacion18 (02092010)claudiatoled3369Nessuna valutazione finora
- AkemDocumento46 pagineAkemMileto ThaNessuna valutazione finora
- Publicacion02 (30052013)Documento16 paginePublicacion02 (30052013)Mauricio JullianNessuna valutazione finora
- 4 Biología Electivo Guía Inmunidad PDFDocumento13 pagine4 Biología Electivo Guía Inmunidad PDFcamilo_jeraldo_1Nessuna valutazione finora
- Problemas Resueltos Cap 31 Fisica SerwayDocumento12 pagineProblemas Resueltos Cap 31 Fisica SerwayKarina AR67% (3)
- Prueba 4º Inmunidad CorregidaDocumento7 paginePrueba 4º Inmunidad CorregidaVerónica Isabel Fonseca Villagrán73% (11)
- Ejercicios Resueltos Inducción Electromagnética PDFDocumento8 pagineEjercicios Resueltos Inducción Electromagnética PDFDorluys Evans Perea HernandezNessuna valutazione finora
- Ciencias Fisica 03Documento3 pagineCiencias Fisica 03Cuc CucNessuna valutazione finora
- 4 Biología Electivo Guía Inmunidad PDFDocumento13 pagine4 Biología Electivo Guía Inmunidad PDFcamilo_jeraldo_1Nessuna valutazione finora
- Texto Quimica Iii y Iv em PDFDocumento450 pagineTexto Quimica Iii y Iv em PDFPaola3434Nessuna valutazione finora
- Crisis de ValoresDocumento5 pagineCrisis de ValoresBecky Martel HuatucoNessuna valutazione finora
- Ciencias Fisica 03Documento3 pagineCiencias Fisica 03Cuc CucNessuna valutazione finora
- Modelos para Hacer proyectosTICsDocumento22 pagineModelos para Hacer proyectosTICssidan100% (4)
- Problemas Resueltos Cap 31 Fisica SerwayDocumento12 pagineProblemas Resueltos Cap 31 Fisica SerwayKarina AR67% (3)
- Wada 2019 Spanish Prohibited ListDocumento10 pagineWada 2019 Spanish Prohibited Listcarlos bassanteNessuna valutazione finora
- 18 Reuslt SolinoideDocumento9 pagine18 Reuslt SolinoideFrox RokNessuna valutazione finora
- Psu 2015Documento49 paginePsu 2015Tamara Rilling LealNessuna valutazione finora
- 03 FM BienValorDocumento16 pagine03 FM BienValorjuanNessuna valutazione finora
- Crisis de ValoresDocumento5 pagineCrisis de ValoresBecky Martel HuatucoNessuna valutazione finora
- Modelo Psu Matematicas 2015Documento36 pagineModelo Psu Matematicas 2015Anibal Lagos ParedesNessuna valutazione finora
- 4 Biología Electivo Guía Inmunidad PDFDocumento13 pagine4 Biología Electivo Guía Inmunidad PDFcamilo_jeraldo_1Nessuna valutazione finora
- Estructura de Los PolimerosDocumento17 pagineEstructura de Los PolimerosBrayan NovoaNessuna valutazione finora
- Diseño de Asfalto - Polimero EvaDocumento134 pagineDiseño de Asfalto - Polimero EvaJOSE LUNANessuna valutazione finora
- NUEVAS TENDENCIAS EN PAVIMENTOS ASFÀLTICOS MODIFICdo Con PolímerosDocumento23 pagineNUEVAS TENDENCIAS EN PAVIMENTOS ASFÀLTICOS MODIFICdo Con PolímerosNatalyLightsTNessuna valutazione finora
- MaterialesDocumento78 pagineMaterialesCarlos RoblesNessuna valutazione finora
- Cuestionario 1Documento2 pagineCuestionario 1Santiago MorenoNessuna valutazione finora
- Arbol PetroquimicoDocumento3 pagineArbol PetroquimicoJosue Villa SaireNessuna valutazione finora
- Clasificación y Procesos de Manufactura de Los Materiales Polímeros, Compuestos y CeramicosDocumento15 pagineClasificación y Procesos de Manufactura de Los Materiales Polímeros, Compuestos y CeramicosyareliNessuna valutazione finora
- Materiales Adhesivos y RellenosDocumento7 pagineMateriales Adhesivos y RellenosgmrgodoyNessuna valutazione finora
- PG 8272Documento137 paginePG 8272Edgar ChoqueNessuna valutazione finora
- Compatibilidad Química Seko SpanishDocumento6 pagineCompatibilidad Química Seko SpanishFranco YnquillaNessuna valutazione finora
- Tesis Analisis Reologico de SangreDocumento164 pagineTesis Analisis Reologico de SangreisraelNessuna valutazione finora
- Proyecto de Gas NaturalDocumento30 pagineProyecto de Gas NaturalGreison Ribeiro da SilvaNessuna valutazione finora
- Zincado PDFDocumento24 pagineZincado PDFJose CortezNessuna valutazione finora
- Cuestionario Final Practica 6Documento2 pagineCuestionario Final Practica 6Fer NLNessuna valutazione finora
- Introducción A Los Materiales ModernosDocumento15 pagineIntroducción A Los Materiales ModernosLuis MartinNessuna valutazione finora
- Tipo de Envases para AlimentosDocumento5 pagineTipo de Envases para AlimentosCan MichaelNessuna valutazione finora
- Pi365 - Práctica Calificada 3 - 2021-1Documento3 paginePi365 - Práctica Calificada 3 - 2021-1Jordancito Pa K MasNessuna valutazione finora
- Epoxico para ConcretoDocumento17 pagineEpoxico para ConcretoLuis David Díaz MontenegroNessuna valutazione finora
- Cera de Cavidades Plus 3MDocumento17 pagineCera de Cavidades Plus 3MAna KarenNessuna valutazione finora
- Justificación de La Elección Del ProductoDocumento1 paginaJustificación de La Elección Del ProductoSusana CNessuna valutazione finora
- Tipos de Envase de EuropaaaDocumento48 pagineTipos de Envase de EuropaaaRaquel MorrugaresNessuna valutazione finora
- Practica 3Documento8 paginePractica 3Tony Maron PilcoNessuna valutazione finora
- Pirolisis 123Documento20 paginePirolisis 123ronald moralesNessuna valutazione finora
- Retardante Plasticos Fuego 2010 Encrip PDFDocumento66 pagineRetardante Plasticos Fuego 2010 Encrip PDFJohn Erick Bustos GaticaNessuna valutazione finora
- Lamparas de FotocuradoDocumento4 pagineLamparas de FotocuradoJohao GarciaNessuna valutazione finora
- Informe Resinas de Neopreno 2Documento41 pagineInforme Resinas de Neopreno 2Rafael PunchinNessuna valutazione finora
- Tesis Tintas Flexo PDFDocumento139 pagineTesis Tintas Flexo PDFSary Vazquez RomeroNessuna valutazione finora
- Estudio Técnico Económico para La Fabricación de Postes de Poliester Reforzado en Fibra de VidrioDocumento96 pagineEstudio Técnico Económico para La Fabricación de Postes de Poliester Reforzado en Fibra de VidrioJuan Carlos VillegasNessuna valutazione finora
- Los Materiales Compuestos. Dinamismo e Innovación PDFDocumento4 pagineLos Materiales Compuestos. Dinamismo e Innovación PDFGarcia AlexedNessuna valutazione finora