Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Propiedades Coligativas PDF
Caricato da
Gabriela MiteTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Propiedades Coligativas PDF
Caricato da
Gabriela MiteCopyright:
Formati disponibili
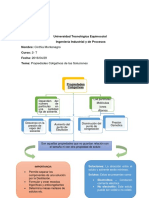
Universidad Tecnológica Equinoccial
Ingeniería Industrial y de Procesos
Nombre: Cinthia Montenegro
Curso: 2- T
Fecha: 2016/04/29
Tema: Propiedades Coligativas de las Soluciones
Propiedades
Coligativas
Las partículas :
Dependen del
número de Moléculas
partículas en Iones
una cantidad
Átomos
fija de solvente.
Descenso en la Disminución del Presión
presión de Aumento del Osmotica
punto de punto de
vapor del congelación
solvente Ebullición
Son aquellas propiedades que no guardan relación con
el tamaño ni con otra propiedad de soluto
IMPORTANCIA Soluciones: La atracción entre el
soluto y solvente serán mínimas.
Permite separar los
componentes de una solución Solutos: Estas se presentan como
por la Destilación.
Electrolitos .- Conducen
Formular y crear mezclas
corriente eléctrica
frigoríficas y anticongelantes
No electrolito: Este soluto
Determina masas molares de
puede ser volátil o no volátil.
solutos etc.
Importancia
fuerzas de atracción
intermoleculares
Capacidad para débiles , mayor
evaporarse cantidad de
moléculas podrán
escapar a la fase
Disminución de gaseosa.
presión de vapor
No todas las Equilibrio Dinámico
partículas de líquido Dos procesos
tienen la misma opuestos se efectúan
Energía Cinética simultaneamente.
FACTORES QUE AFECTAN Para un líquido la presión de vapor aumenta
A LA PRESIÓN DE VAPOR a medida que aumenta la temperatura
Líquidos diferentes a la misma temperatura
presentan presiones de vapor diferentes.
Soluto no
Volátil
Si el soluto que se agrega al solvente es no
volátil, está producirá un DESENSO DE LA
PRESIÓN DE VAPOR
Soluto
Volátil
Cuando una solución ideal está en
equilibrio con su vapor, el componente más
VOLÁTIL será mayoritario en el vapor.
FACTORES QUE AFECTAN
* Está depende de la presión en la cual
esté sometida
La temperatura la cual la presión de * Si la presión atmosférica es baja , se
vapor iguala a la presión enterna o necesita poca energía para que la presión
atmosférica del vapor del líquido iguale a la externa ,
por lo que su punto de ebullición es baja.
Y en caso de ser alta la energía , su
ebullición será alta
Aumento del
punto de
ebullición
*Mientras más concentradas sean las
soluciones mayor son los puntos de
ebullición de estas. El ascenso del punto de ebullición es
*El punto de ebullición es proporcional al proporcional a la molalidad
número de partículas de soluto disueltas
en el solvente .
Descenso del punto de congelación
Transformaciòn de líquido a sólido (
Congelación) , y el inverso se llama
Fusión.
Esto se da por la agrupación de
moléculas, las cuales se acercan
disminuyendo el espacio
intermolecular
El acercamiento de estas disminuye la
temperatura por lo que la energía
cinética de las moléculas sea menor
El punto de congelación de
Podemos decir que las Una consecuencia es la la solución de la presión de
soluciones se congelan a disminución de la presión vapor del sólido debe ser
temperaturas inferiores a de vapor ocasionado por igual a la presión de vapor
las del solvente puro. dicho soluto del líquido con la que está
en equilibrio.
El descenso del punto
de congelación es
Dato
proporcional a la
Curioso
concentración molal del
soluto
Permite el paso de
algunas moléculas
(Agua) , pero de otras no
Son semipermeables
Bloquean el paso de
iones o moléculas de
Presión Osmótica soluto de mayor tamaño.
Presencia de pequeños
Carácter Semipermeable poros en su estructura
de membranosa.
SOLUCIÓN MÁS SOLCIÓN MENOS
CONCENTRADA CONCENTRADA
La concentración de solvente es La concentración de solvente más
menor a la solución que tiene elevada en la solución que tiene
menos soluto menos soluto.
OSMOSIS
Movimiento neto de solvente
desde la solución menos
concentrada hacia la solución
más concentrada.
A temperatura constante la presión osmótica solo depende de la
concentración de partículas y no de la naturaleza del soluto, de ahí
que la presión osmótica es una propiedad Coligativas de una
solución.
BIBLIOGRAFÍA
López. Propiedades Coligativas de las Soluciones. Recuperado de
http://quimica2medio.blogspot.com/p/propiedades-coligativas.html
Anónimo. Propiedades Coligativas de las Soluciones. Recuperado de
file:///C:/Users/Admin/Downloads/Propiedades-Coligativas-de-Soluciones.pdf
Potrebbero piacerti anche
- Propiedades ColigativasDocumento6 paginePropiedades ColigativasCinthia MontenegroNessuna valutazione finora
- Propiedades ColigativasDocumento1 paginaPropiedades ColigativasJesus DiazNessuna valutazione finora
- Clase Propiedades Coligativas de Las SolucionesDocumento13 pagineClase Propiedades Coligativas de Las SolucionesCarolina andaur castilloNessuna valutazione finora
- Practica 10. - Propiedades Coligativas OkDocumento18 paginePractica 10. - Propiedades Coligativas OkEDWIN PAUL MONTAÑEZ CALACHUANessuna valutazione finora
- Unidad 4 - Propiedades ColigativasDocumento15 pagineUnidad 4 - Propiedades ColigativasTomas AmeriNessuna valutazione finora
- Propiedades de Las SolucionesDocumento68 paginePropiedades de Las SolucionesWinsel PerezNessuna valutazione finora
- TEMA 2 Entero-1Documento53 pagineTEMA 2 Entero-1Salva AlborésNessuna valutazione finora
- Factores Que Influyen en La Disolución. Propiedades Coligativas. Soluciones de Electrolitos PDFDocumento1 paginaFactores Que Influyen en La Disolución. Propiedades Coligativas. Soluciones de Electrolitos PDFCRISTIAN LOPEZ GUALTEROSNessuna valutazione finora
- Propiedades ColigativasDocumento12 paginePropiedades ColigativasCesar PerezNessuna valutazione finora
- Informe ColigativasDocumento7 pagineInforme ColigativasYaner Marmolejo OchoaNessuna valutazione finora
- Tipos de Mezclas, PropiedadesDocumento11 pagineTipos de Mezclas, Propiedadesl.q.nan.vNessuna valutazione finora
- Propiedades ColigativasDocumento10 paginePropiedades ColigativasIvan ViteNessuna valutazione finora
- Universidad Nacional de IngenieríaDocumento13 pagineUniversidad Nacional de IngenieríaDanielito Chilin TolentinoNessuna valutazione finora
- Propiedades ColigativasDocumento5 paginePropiedades ColigativasMaría BelénLoyaNessuna valutazione finora
- Teoria Las 4 Propiedades ColigativasDocumento4 pagineTeoria Las 4 Propiedades ColigativasJhosselyn ApazaNessuna valutazione finora
- "PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES ACUOSAS" - Lab-7 PDFDocumento8 pagine"PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES ACUOSAS" - Lab-7 PDFperesNessuna valutazione finora
- Clase 28 - Propiedades ColigativasDocumento25 pagineClase 28 - Propiedades ColigativasMatewsZhingreNessuna valutazione finora
- Estado Liquido y SolidoDocumento42 pagineEstado Liquido y Solidomilva naufamerNessuna valutazione finora
- Propiedades ColigativasDocumento4 paginePropiedades ColigativasXi FernandezNessuna valutazione finora
- Prop. Soluciones (Quimica)Documento40 pagineProp. Soluciones (Quimica)Erika MoralesNessuna valutazione finora
- Módulo 04 Química IIDocumento41 pagineMódulo 04 Química IIRocuo pyropeNessuna valutazione finora
- Previo P6Documento2 paginePrevio P6Jorge BucioNessuna valutazione finora
- Soluciones Diluidas-coligativas.V13Documento41 pagineSoluciones Diluidas-coligativas.V13Ezequiel PastranaNessuna valutazione finora
- Práctica 4 Propiedades ColigativasDocumento7 paginePráctica 4 Propiedades ColigativasKarina AlfonzoNessuna valutazione finora
- Propiedades ColigativasyesDocumento11 paginePropiedades ColigativasyesMarisol BravoNessuna valutazione finora
- Practica 8Documento6 paginePractica 8Serena MontenegroNessuna valutazione finora
- Soluciones ColigativasDocumento19 pagineSoluciones ColigativasmadefernanNessuna valutazione finora
- 7 - Soluciones, Cinetica Quimica y EquilibrioDocumento22 pagine7 - Soluciones, Cinetica Quimica y EquilibrioAlanP123Nessuna valutazione finora
- Propiedades Coligativas de Las DisolucionesDocumento12 paginePropiedades Coligativas de Las DisolucionesMarcelo Orlando Sanaguano MartinezNessuna valutazione finora
- Soluciones Químicas: Paes Ciencias Química Común y MenciónDocumento49 pagineSoluciones Químicas: Paes Ciencias Química Común y Menciónsofia andrea ponce de león MoralesNessuna valutazione finora
- Capitulo 2 - Propiedades ColigativasDocumento22 pagineCapitulo 2 - Propiedades ColigativasCRISTHIAN ANDREY PINZON ESTEVEZNessuna valutazione finora
- Unidad N°9 Propiedades ColigativasDocumento24 pagineUnidad N°9 Propiedades ColigativasPablo Santillán LopezNessuna valutazione finora
- Ap2 - Química General y OrgánicaDocumento5 pagineAp2 - Química General y OrgánicaGabi ErburúNessuna valutazione finora
- Informe Propiedades Coligativas2Documento5 pagineInforme Propiedades Coligativas2Carlos MartinezNessuna valutazione finora
- Las Propiedades ColigativasDocumento12 pagineLas Propiedades ColigativasBetzy Valery Poma PerezNessuna valutazione finora
- Cap 07 1 DisolucionesDocumento29 pagineCap 07 1 DisolucionesPiero Herrera SolierNessuna valutazione finora
- 8.2 Prop. ColigativasDocumento37 pagine8.2 Prop. ColigativasVal MorasNessuna valutazione finora
- 7 - Propiedades ColigativasDocumento18 pagine7 - Propiedades ColigativasEmma SarliNessuna valutazione finora
- Tema 2 Disoluciones - RemovedDocumento8 pagineTema 2 Disoluciones - RemovedraquelNessuna valutazione finora
- Curva de Solubilidad (Autoguardado)Documento5 pagineCurva de Solubilidad (Autoguardado)Cguti612Nessuna valutazione finora
- Investigación Previa 3Documento5 pagineInvestigación Previa 3Oscar Palacios HuicocheaNessuna valutazione finora
- Propiedades Coligativas y Su Uso en La Ingeniería AmbientalDocumento10 paginePropiedades Coligativas y Su Uso en La Ingeniería AmbientalJaila Rosalía MitiapNessuna valutazione finora
- Marco Teórico de La Practica 3Documento7 pagineMarco Teórico de La Practica 3Ramon Roque PaulinoNessuna valutazione finora
- Propiedades CualitativasDocumento39 paginePropiedades CualitativasBRiAnKo AlKaTrAzNessuna valutazione finora
- Solís Steve - GR4 - Propiedades ColigativasDocumento7 pagineSolís Steve - GR4 - Propiedades ColigativasSteve SolisNessuna valutazione finora
- 4.1 Informe Alban - Propiedades Fisicas de Las DisolucionesDocumento11 pagine4.1 Informe Alban - Propiedades Fisicas de Las Disolucioneska24daniiNessuna valutazione finora
- Unidad 8Documento21 pagineUnidad 8Chantal EspinalNessuna valutazione finora
- Propiedades Coligativas de Las DisolucionesDocumento20 paginePropiedades Coligativas de Las DisolucionesLuis RuizNessuna valutazione finora
- Disoluciones en Química Parte 2Documento7 pagineDisoluciones en Química Parte 2Sofía Luna DelgadilloNessuna valutazione finora
- Informe QMC025 # 1Documento11 pagineInforme QMC025 # 1Carlos CondoriNessuna valutazione finora
- Propiedades ColigativasDocumento12 paginePropiedades ColigativasRodolfo Hiram Lopez MoralesNessuna valutazione finora
- Propiedades ColigativasDocumento5 paginePropiedades ColigativasAlexis CushicondorNessuna valutazione finora
- Soluciones 2022 Parte A 2022Documento45 pagineSoluciones 2022 Parte A 2022Facundo ArraigadaNessuna valutazione finora
- Unidad 6.3. Propiedades Coligativas de Las Soluciones y de Los ColoidesDocumento5 pagineUnidad 6.3. Propiedades Coligativas de Las Soluciones y de Los ColoidesFRANCISCO ALEJANDRO CULMA GONZALEZNessuna valutazione finora
- Cuestionario Sobre Propiedades ColigativasDocumento10 pagineCuestionario Sobre Propiedades ColigativasKarla Ortega100% (1)
- Propiedades Termicas de La Materia: R1AnestesiologíaDocumento14 paginePropiedades Termicas de La Materia: R1AnestesiologíaGeovani Amaya100% (2)
- Dispositivas QuimicaDocumento32 pagineDispositivas QuimicaJose Eduardo Becerra BazanNessuna valutazione finora
- Bioquímica 1Documento74 pagineBioquímica 1Abril MerinoNessuna valutazione finora
- Unidad 7 SolucionesDocumento51 pagineUnidad 7 SolucionesFederico Daniel SarliNessuna valutazione finora
- Caso Farmacias Fybeca y Sana Sana-1Documento3 pagineCaso Farmacias Fybeca y Sana Sana-1Gabriela MiteNessuna valutazione finora
- Manual para Escoger Tu CámaraDocumento24 pagineManual para Escoger Tu CámaraBruno Lazaro SatanNessuna valutazione finora
- Syllabus QO2Documento6 pagineSyllabus QO2Gabriela MiteNessuna valutazione finora
- Tarea 1Documento1 paginaTarea 1Gabriela MiteNessuna valutazione finora
- Tema 4. Ecuaciones Diferenciales Ordinar PDFDocumento67 pagineTema 4. Ecuaciones Diferenciales Ordinar PDFGabriela MiteNessuna valutazione finora
- Sistema de Produccion ToyotaDocumento6 pagineSistema de Produccion ToyotaGabriela MiteNessuna valutazione finora
- Capítulo 23 EnergíaDocumento37 pagineCapítulo 23 EnergíaGabriela MiteNessuna valutazione finora
- Estearificacion PDFDocumento6 pagineEstearificacion PDFDavid R. ParejaNessuna valutazione finora
- Lab 6 FQ 2 Equilibrio Fenol-AguaDocumento1 paginaLab 6 FQ 2 Equilibrio Fenol-AguaGabriela MiteNessuna valutazione finora
- Problema CapacitorDocumento3 pagineProblema CapacitorGabriela MiteNessuna valutazione finora
- Formato de InformeDocumento10 pagineFormato de InformeGabriela MiteNessuna valutazione finora
- Cercado de JericoDocumento12 pagineCercado de JericoAngry JulietNessuna valutazione finora
- Análisis de Datos ExperimentalesDocumento3 pagineAnálisis de Datos ExperimentalesJazminSaicoNessuna valutazione finora
- Gases Problemas ResueltosDocumento39 pagineGases Problemas ResueltosPulseras Lima55% (20)
- Examen Final CatequesisDocumento2 pagineExamen Final CatequesisGabriela Mite100% (1)
- Villancico Altozano + Café Quijano 2017Documento1 paginaVillancico Altozano + Café Quijano 2017Gabriela Mite83% (6)
- Villancico Altozano 2016Documento1 paginaVillancico Altozano 2016Gabriela Mite40% (5)
- Santo Tomas de Aquino Oración Después de La ComuniónDocumento1 paginaSanto Tomas de Aquino Oración Después de La ComuniónGabriela MiteNessuna valutazione finora
- Regina Coeli (Para Imprimir)Documento1 paginaRegina Coeli (Para Imprimir)Gabriela MiteNessuna valutazione finora
- Rúbrica Informes QaDocumento4 pagineRúbrica Informes QaElizabeth González DíazNessuna valutazione finora
- Gases Problemas ResueltosDocumento39 pagineGases Problemas ResueltosPulseras Lima55% (20)
- InterpolacionDocumento7 pagineInterpolacionGabriela MiteNessuna valutazione finora
- Salmo 25Documento1 paginaSalmo 25Gabriela MiteNessuna valutazione finora
- Calculo Diferencial Cap10 PDFDocumento82 pagineCalculo Diferencial Cap10 PDFPatrick IoNessuna valutazione finora
- Menas de HierroDocumento4 pagineMenas de HierroJosesito MosqueiraNessuna valutazione finora
- 589 Practica%2B1%2BMetales%2Ben%2Bllamas PDFDocumento3 pagine589 Practica%2B1%2BMetales%2Ben%2Bllamas PDFWinckels WidulskiNessuna valutazione finora
- Examen1S by Paul SanchezDocumento3 pagineExamen1S by Paul SanchezHenry Fernandez BedoyaNessuna valutazione finora
- Virgen Del CarmenDocumento2 pagineVirgen Del CarmennazbolNessuna valutazione finora
- Examen Final de Fisica A Termino XX 200XDocumento5 pagineExamen Final de Fisica A Termino XX 200XGabriela MiteNessuna valutazione finora
- Coligativas UTNDocumento12 pagineColigativas UTNAnonymous ZAr1RKNessuna valutazione finora
- Aire Acondicionado para Un Taller Mecánico1Documento19 pagineAire Acondicionado para Un Taller Mecánico1Roger Sánchez DehneNessuna valutazione finora
- Cero KelvinDocumento3 pagineCero KelvinKevin CiaparaNessuna valutazione finora
- GIMTT U1 FisicoquimicaDocumento44 pagineGIMTT U1 FisicoquimicaBeto VelazquezNessuna valutazione finora
- Prediccic 3 B 3 NsecadoDocumento69 paginePrediccic 3 B 3 NsecadoMindy MunozNessuna valutazione finora
- Octava Práctica - Problemas de La Primera Ley de La TermodinámicaDocumento2 pagineOctava Práctica - Problemas de La Primera Ley de La TermodinámicaMelisa Thiara Paz LauraNessuna valutazione finora
- 2 - 2 - 2 Ejercicios Compresores Evaporadores y Condensadores BDocumento16 pagine2 - 2 - 2 Ejercicios Compresores Evaporadores y Condensadores BChaVa Pool0% (1)
- Exa Opiii Pi Sept2023 ADocumento2 pagineExa Opiii Pi Sept2023 ACharly StarNessuna valutazione finora
- Problemario TermoDocumento2 pagineProblemario TermoEdgar Eduardo Mora ReyesNessuna valutazione finora
- Aplicaciones de La TermodinámicaDocumento5 pagineAplicaciones de La TermodinámicaAnaisabela GuevaraNessuna valutazione finora
- Trane Residencial Sistema SplitDocumento4 pagineTrane Residencial Sistema SplitSoulblade25Nessuna valutazione finora
- Metodologia para La Evaluacion de Sistemas de RefrigeracionDocumento3 pagineMetodologia para La Evaluacion de Sistemas de RefrigeracionDario Vamos DosNessuna valutazione finora
- Patologias EdiliciasDocumento30 paginePatologias EdiliciasJack SuquitaNessuna valutazione finora
- Ejercicios de Transferencia de CalorDocumento7 pagineEjercicios de Transferencia de CalorAngelica SuarezNessuna valutazione finora
- Ficha Seguridad R32 2Documento6 pagineFicha Seguridad R32 2B Carlos OrfilaNessuna valutazione finora
- Balance de EnergíaDocumento2 pagineBalance de EnergíaMaria Celeste DelgadoNessuna valutazione finora
- Secciones de Metales PDFDocumento20 pagineSecciones de Metales PDFJeyson GuerraNessuna valutazione finora
- MatriceriaDocumento2 pagineMatriceriajulian colinaNessuna valutazione finora
- Eter1-Act - 1 CerpDocumento9 pagineEter1-Act - 1 CerpElizabeth Trejo MoralesNessuna valutazione finora
- Tecnicas de AspersionDocumento57 pagineTecnicas de AspersionDAIRO FABIAN REYNessuna valutazione finora
- Codigo Final de Propiedades Termodinamicas Del AcetilenoDocumento15 pagineCodigo Final de Propiedades Termodinamicas Del AcetilenoAdal SandovalNessuna valutazione finora
- Gas IdealDocumento3 pagineGas IdealWilguens Edouard Gustave AntoineNessuna valutazione finora
- OPUNT I - Analisis CriticoDocumento21 pagineOPUNT I - Analisis CriticoJuan Antonio PirelaNessuna valutazione finora
- Practica No.1 Calor de Disolucion y NeutralizacionDocumento9 paginePractica No.1 Calor de Disolucion y NeutralizacionAlejandra GallegoNessuna valutazione finora
- NC 220-4-2006 Eficienc Energ EdificacDocumento11 pagineNC 220-4-2006 Eficienc Energ EdificacDescargar scribdNessuna valutazione finora
- Diagrama Ternario Ingenieria Urrego PDFDocumento3 pagineDiagrama Ternario Ingenieria Urrego PDFLUIS FABIAN URREGO SANCHEZNessuna valutazione finora
- Clase 2-Mi-461Documento81 pagineClase 2-Mi-461Aldair PANessuna valutazione finora
- Examen 3 Trimestre 23-I (Termodinámica Aplicada)Documento7 pagineExamen 3 Trimestre 23-I (Termodinámica Aplicada)al2222005818Nessuna valutazione finora
- La Constante de Acidez:: Ionización Ácida) Es Una Medida de La Fuerza de Un Ácido Débil (Que No Se DisociaDocumento3 pagineLa Constante de Acidez:: Ionización Ácida) Es Una Medida de La Fuerza de Un Ácido Débil (Que No Se Disociajuan fuentesNessuna valutazione finora
- 08-Tema IVDocumento6 pagine08-Tema IVDani MestreNessuna valutazione finora