Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
10ano Q 2 1 1 1 Ligacao Quimica Ligacoes Metalica Ionica e Covalente PDF
Caricato da
Angela CarvalhoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
10ano Q 2 1 1 1 Ligacao Quimica Ligacoes Metalica Ionica e Covalente PDF
Caricato da
Angela CarvalhoCopyright:
Formati disponibili
Ligação química
Ligações metálica, iónica e covalente
Miguel Neta, dezembro de 2018 [Imagem: www.antidopingresearch.org]
Ligação química
A ligação química é o que permite que:
Átomos se liguem a outros átomos,
em moléculas;
em agregados de átomos;
Iões se liguem a outros iões;
Moléculas se organizem em estruturas maiores.
São as interações eletrostáticas que definem quando é que uma ligação acontece, e que tipo de ligação
acontece.
Ligação química - Ligações metálica, iónica e covalente 2
Ligação química
Interações eletrostáticas
Numa ligação há um equilíbrio entre diversas forças:
Repulsivas, entre as cargas de sinal igual;
Atrativas, entre as cargas de sinal contrário.
Quando as forças atrativas igualam as forças repulsivas é estabelecida uma ligação.
Ligação química - Ligações metálica, iónica e covalente 3
Ligação química
Tipos de ligação química
Existem diversos tipos de ligação entre átomos e entre moléculas:
Ligações entre átomos: Ligações intermoleculares (entre moléculas):
Ligação metálica; Forças de van der Waals;
Ligação iónica; Ligações de hidrogénio.
Ligação covalente.
Ligação química - Ligações metálica, iónica e covalente 4
Ligações químicas
Entre moléculas
Entre átomos
(intermoleculares)
Ligações de Forças de van der
Ligação metálica
hidrogénio Walls
Ligação iónica Dipolo - dipolo
Ligação covalente Dipolo - dipolo induzido
Dipolo instantâneo - dipolo induzido
(Forças de London)
Ligação química - Ligações metálica, iónica e covalente 5
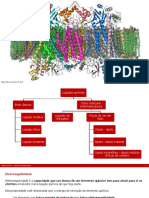
Ligação metálica
Esta ligação acontece quando os átomos envolvidos
partilham eletrões de valência entre todos, sem
que haja uma orientação espacial nessa partilha.
Baixas energias de ionização permitem que sejam
facilmente criados eletrões deslocalizados.
Há um mar de eletrões que pertencem a todo o Eletrões deslocalizados
metal, não apenas a alguns átomos.
Ião carregado
positivamente
Eletrões
deslocalizados
[Imagem: www.rsc.org]
[Imagem: www.materials.unsw.edu.au]
Ligação química - Ligações metálica, iónica e covalente 6
Ligação metálica
Os metais, devido à facilidade de movimento destes
eletrões deslocalizados, são:
Bons condutores elétricos;
Bons condutores de calor.
Ligação química - Ligações metálica, iónica e covalente 7
Ligação iónica
É um tipo de ligação que acontece entre
elementos Metálicos e Não metálicos.
As ligações iónicas são estabelecidas
por forças atrativas eletrostáticas
entre iões de carga diferente
após a troca de eletrões entre átomos:
Átomo perde eletrões → Catião;
Átomo ganha eletrões → Anião.
Exemplo:
11Na – 1s2 2s2 2p6 3s1 → perde um eletrão → 11Na
+1 – 1s2 2s2 2p6 3s0
NaCl
17Cl – 1s2 2s2 2p6 3s2 3p5 → ganha um eletrão → 17Cl
-1 – 1s2 2s2 2p6 3s2 3p5+1
+ - +
As substâncias resultantes são conhecidas por sais.
- + -
Ligação química - Ligações metálica, iónica e covalente 8
Ligação iónica
Nível atómico
Nível macroscópico
Ligação química - Ligações metálica, iónica e covalente 9
[Imagem: disciplinas.ist.utl.pt]
Ligação iónica
A rede cristalina/rede iónica final é eletricamente neutra.
2D 3D
As redes cristalinas são bastantes fortes, tendo como consequência altos valores do ponto de fusão.
Ligação química - Ligações metálica, iónica e covalente 10
Corrente elétrica é
Ligação iónica o movimento
ordenado de
No estado sólido: cargas elétricas.
Iões estão fortemente agarrados uns aos outros;
⇓
Não há liberdade de movimento de cargas
Estrutura cristalina sólida
elétricas;
⇓
Substâncias más condutoras elétricas.
Ligação química - Ligações metálica, iónica e covalente 11
[Imagem: socratic.org]
Ligação iónica
No estado sólido:
São substâncias quebradiças.
Força Forças de
externa repulsão
Quebra do
cristal
Ligação química - Ligações metálica, iónica e covalente 12
[Imagem: www.slideshare.net]
Ligação iónica
Nos estados líquido ou aquoso:
Há total liberdade de movimento dos iões
Iões em solução aquosa
que formavam a rede cristalina (agora
dissolvidos);
⇓
Substâncias boas condutoras elétricas.
Ligação química - Ligações metálica, iónica e covalente 13
[Imagem: socratic.org]
Ligação covalente
As ligações covalentes acontecem entre átomos de
uma molécula (ligações intramoleculares).
Este tipo de ligação acontece normalmente entre
átomos de elementos Não metálicos.
Ligação química - Ligações metálica, iónica e covalente 14
Ligação covalente
Numa ligação covalente há um equilíbrio entre forças:
Repulsivas, entre os núcleos dos átomos, que
têm ambos cargas positivas;
Repulsivas, entre os eletrões das nuvens
eletrónicas, que têm cargas negativas;
Atrativas, entre os eletrões e os núcleos, de
cargas contrárias.
Ligação química - Ligações metálica, iónica e covalente 15
Ligação covalente
Quando existir um equilíbrio entre as forças atrativas e
as forças repulsivas é estabelecida uma ligação
covalente entre átomos (formação de uma
molécula).
Há eletrões que são partilhados entre diferentes
átomos, fazendo parte de mais do que uma nuvem
eletrónica. São eletrões ligantes.
Ligação química - Ligações metálica, iónica e covalente 16
Ligação covalente
Esta estrutura dos átomos ligados (molécula) é mais
estável que os dois átomos isolados.
A energia total dos átomos separados é maior que a
energia da molécula resultante.
Como varia a relação entre a distância
internuclear e a energia total de dois átomos
numa ligação covalente é?
Ligação química - Ligações metálica, iónica e covalente 17
Ligação covalente
Variação da energia potencial
Situação 1
Dois átomos afastados um do outro.
Ainda não há atração entre eles.
A energia potencial total da molécula é zero.
(ainda não existe molécula!)
Ligação química - Ligações metálica, iónica e covalente 18
Ligação covalente
Variação da energia potencial
Situação 2
Há atração entre os dois átomos.
A energia total dos dois átomos diminui
relativamente à situação 1.
Ligação química - Ligações metálica, iónica e covalente 19
Ligação covalente
Variação da energia potencial
Situação 3
É estabelecida a ligação covalente.
As atrações igualam as repulsões.
A energia potencial da molécula atinge o seu
valor mínimo.
A distância entre os dois núcleos dos átomos é
chamada comprimento médio da ligação.
Ligação química - Ligações metálica, iónica e covalente 20
Ligação covalente
Variação da energia potencial
Situação 4
Se os átomos se aproximarem ainda mais as
repulsões entre os núcleos começam a ser
maiores que as atrações eletrões-núcleos.
Aumenta a instabilidade da molécula e a sua
energia potencial.
Ligação química - Ligações metálica, iónica e covalente 21
Ligação covalente
Variação da energia potencial
A energia de ligação (energia que se liberta
aquando da formação da ligação)
e a energia de dissociação (energia
necessária para quebrar a ligação – separar os
átomos)
têm valores iguais.
As energias de ligação são normalmente expressas em
kJ/mol.
Ligação química - Ligações metálica, iónica e covalente 22
Ligação covalente
Notação de Lewis
Esta notação é usada para descrever um átomo evidenciando os seus eletrões de valência.
1H – 1s1 1 eletrão de valência H•
11Na – 1s2 2s2 2p6 3s1 1 eletrão de valência Na• Gilbert Newton Lewis (1875-1946).
••
– 1s2 2s2 2p6 3s2 3p5 7 eletrões de valência • Cl•
17Cl • ••
Ligação química - Ligações metálica, iónica e covalente 23
Ligação covalente
Regra do octeto
Cada átomo de uma molécula partilha eletrões de modo a que fique rodeado por oito eletrões
de valência..
Com esta configuração de valência os átomos ficam com uma configuração eletrónica semelhante a um
elemento do grupo 18 (gases nobres).
Esta regra aplica-se com facilidade a átomos representativos do 2º período da Tabela Periódica, mas para além
destes elementos apresenta muitas exceções.
No caso do átomo de hidrogénio este fica rodeado por apenas dois eletrões de valência.
Ligação química - Ligações metálica, iónica e covalente 24
Ligação covalente
Eletrões ligantes
São os eletrões que participam na ligação.
Eletrões não ligantes
Estes eletrões de valência não vão participar na ligação.
Ligação química - Ligações metálica, iónica e covalente 25
Ligação covalente
Ligação simples, dupla e tripla
Consoante o número de eletrões ligantes entre dois átomos:
2 eletrões ligantes (1 par) Ligação covalente simples (ordem 1) X–Y
H2 H–H
4 eletrões ligantes (dois pares) Ligação covalente dupla (ordem 2) X=Y
O2 O=O
6 eletrões ligantes (três pares) Ligação covalente tripla (ordem 3) X≡Y
N2 N≡N
–
–
Ligação química - Ligações metálica, iónica e covalente 26
Ligação covalente
Comprimento de ligação vs Energia de ligação
Maior energia de ligação ⇒ Ligação mais forte
Maior energia de ligação ⇒ Menor comprimento de ligação
Este tipo de comparação só deve ser realizado entre moléculas com algum tipo de semelhança!
Ligação química - Ligações metálica, iónica e covalente 27
Bibliografia
▪ J. Paiva, A. J. Ferreira, C. Fiolhais, “Novo 10Q”, Texto Editores, Lisboa, 2015.
▪ D. Reger, S. Goode, E. Mercer, “Química: Princípios e Aplicações”, Fundação Calouste Gulbenkian, Lisboa, 2010.
Ligação química - Ligações metálica, iónica e covalente 28
Potrebbero piacerti anche
- Tipos de Ligações QuímicasDocumento21 pagineTipos de Ligações Químicasincorrect gurlNessuna valutazione finora
- Selecione Uma Chave para Cada Par de Afirmações Meiose BiologiaDocumento18 pagineSelecione Uma Chave para Cada Par de Afirmações Meiose BiologiaAfonso CanelhoNessuna valutazione finora
- Ligações Químicas QG 2016Documento86 pagineLigações Químicas QG 2016Marco Túlio Pimenta100% (1)
- Aula 2 - Ciência Dos MateriasDocumento22 pagineAula 2 - Ciência Dos MateriasViniciosNessuna valutazione finora
- Ligações QuímicasDocumento9 pagineLigações QuímicasGonçalo Rilhas100% (1)
- 2.1.1 Ligação Química Entre Átomos e IõesDocumento18 pagine2.1.1 Ligação Química Entre Átomos e IõesMarta AguiarNessuna valutazione finora
- Enlace Químico - Cepre Uni - Rev2Documento4 pagineEnlace Químico - Cepre Uni - Rev2Jean PaúlNessuna valutazione finora
- Ligações Interatômicas - Aula 03Documento24 pagineLigações Interatômicas - Aula 03Mateus GarciaNessuna valutazione finora
- Ligações Químicas e Interações Intermoleculares.: Prof Dra. Francisca de Assiz CarvalhoDocumento41 pagineLigações Químicas e Interações Intermoleculares.: Prof Dra. Francisca de Assiz CarvalhoIsadora FerreiraNessuna valutazione finora
- 2.1.ligação QuímicaDocumento184 pagine2.1.ligação Químicaflavionogueira960Nessuna valutazione finora
- Física e Química 10.º AnoDocumento18 pagineFísica e Química 10.º AnoRodrigoNessuna valutazione finora
- 10ano Q 2 1 1 2 Ligacao Quimica Ligacoes IntermolecularesDocumento17 pagine10ano Q 2 1 1 2 Ligacao Quimica Ligacoes IntermolecularesAngela Carvalho0% (1)
- Aula 013 Ligacoes Quimicas Parte 01Documento20 pagineAula 013 Ligacoes Quimicas Parte 01Gabriel SimãoNessuna valutazione finora
- 10ano Q 2 1 1 2 Ligacao Quimica Ligacoes IntermolecularesDocumento17 pagine10ano Q 2 1 1 2 Ligacao Quimica Ligacoes IntermolecularesSandra RodriguesNessuna valutazione finora
- Ligações PrimáriasDocumento50 pagineLigações PrimáriasHenry MorenoNessuna valutazione finora
- Aula 03 Ligações Químicas e Materias CerâmicosDocumento63 pagineAula 03 Ligações Químicas e Materias CerâmicosJunior LopesNessuna valutazione finora
- Aula 3 - LigaçãoquimicaDocumento65 pagineAula 3 - LigaçãoquimicaLeonardo MacielNessuna valutazione finora
- 8 - Ligação Iónica e Ligação MetálicaDocumento7 pagine8 - Ligação Iónica e Ligação MetálicaAnabela MachadoNessuna valutazione finora
- 1.4 Ligações Químicas (Iônica e Metálica)Documento14 pagine1.4 Ligações Químicas (Iônica e Metálica)Leonardo FadulNessuna valutazione finora
- Ligações Químicas GrafiteDocumento15 pagineLigações Químicas GrafiteRodolfo FariasNessuna valutazione finora
- Ligações QuímicasDocumento30 pagineLigações QuímicasAnimes BackupNessuna valutazione finora
- Ligações Parte01Documento83 pagineLigações Parte01Isadora MartinsNessuna valutazione finora
- QuímicaDocumento9 pagineQuímicaItalo Rafael Machado SantosNessuna valutazione finora
- CAP II-LIGAÇÕES QUÍMICAS SlidesDocumento14 pagineCAP II-LIGAÇÕES QUÍMICAS SlidesMario GomesNessuna valutazione finora
- Ciencias Dos Materiais - Cap II-ligações Químicas SlidesDocumento14 pagineCiencias Dos Materiais - Cap II-ligações Químicas SlidesLeonardo SilveiraNessuna valutazione finora
- Cap3 Elem Quim CristalinaDocumento15 pagineCap3 Elem Quim CristalinaDercioNessuna valutazione finora
- INTRODUÇAODocumento75 pagineINTRODUÇAODanielly Gripa de PaulaNessuna valutazione finora
- Ligações Químicas em Moléculas Poliatómica1Documento2 pagineLigações Químicas em Moléculas Poliatómica1Francisco Bernardo Bernardo75% (4)
- Ligações QuímicasDocumento16 pagineLigações QuímicasAmandaNessuna valutazione finora
- Ligações Químicas - Química GeralDocumento29 pagineLigações Químicas - Química GeralJean Carlos CarlosNessuna valutazione finora
- LigaçõesCovalentes Parte4 PDFDocumento12 pagineLigaçõesCovalentes Parte4 PDFMarcus FariasNessuna valutazione finora
- Aula6 Estadosolido1Documento31 pagineAula6 Estadosolido1Jack JokerNessuna valutazione finora
- Ligações QuímicasDocumento27 pagineLigações QuímicasBruno LeiteNessuna valutazione finora
- 1EM Ligações QuímicasDocumento17 pagine1EM Ligações QuímicastiagooyarzabalpNessuna valutazione finora
- Apostila 7 - Subst Ncias MolecularesDocumento24 pagineApostila 7 - Subst Ncias MolecularesPaulo SérgioNessuna valutazione finora
- Apostila 7 - Substâncias MolecularesDocumento36 pagineApostila 7 - Substâncias MolecularesGustavo MarinhoNessuna valutazione finora
- Ligações Químicas - Frente A - 1VDocumento13 pagineLigações Químicas - Frente A - 1VFabio FerrazNessuna valutazione finora
- Ligações Químicas22Documento14 pagineLigações Químicas22renatamarques93fourNessuna valutazione finora
- Ligacoes Ionica e Metalica AulaDocumento7 pagineLigacoes Ionica e Metalica Aularita machadoNessuna valutazione finora
- Aula3EstruturaAtmica Ligaes 20150315195006Documento48 pagineAula3EstruturaAtmica Ligaes 20150315195006Carlos AlvesNessuna valutazione finora
- Ligacoes QuimicasDocumento121 pagineLigacoes QuimicasmanudaoNessuna valutazione finora
- Aula 08 - CN 2023Documento4 pagineAula 08 - CN 2023Henrique Nardiê Corrêa Da SilvaNessuna valutazione finora
- 02.2.CTM-Ligações AtomicasDocumento19 pagine02.2.CTM-Ligações AtomicasMiguel QueirosNessuna valutazione finora
- Des e Aplicações Dos Metais e LigasDocumento42 pagineDes e Aplicações Dos Metais e Ligassocramsilva100% (10)
- Lista 2Documento8 pagineLista 2ThallesAlmeidaNessuna valutazione finora
- 00 - Introdução Disciplina e Ligações Químicas - Estudo Da Estabilidade e Comportamento de Sistemas CerâmicosDocumento16 pagine00 - Introdução Disciplina e Ligações Químicas - Estudo Da Estabilidade e Comportamento de Sistemas CerâmicosLuciana Boaventura PalharesNessuna valutazione finora
- Ligações QuímicasDocumento35 pagineLigações QuímicasLorena DiasNessuna valutazione finora
- Ligações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalenteDocumento15 pagineLigações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalentePedroNessuna valutazione finora
- Aula 06 - Ligacoes QuimicasDocumento15 pagineAula 06 - Ligacoes QuimicasMel ValdicleideNessuna valutazione finora
- Unidade 2Documento1 paginaUnidade 2mariaclaragomess8Nessuna valutazione finora
- Química - 9 Classe - Prof. PagaraDocumento9 pagineQuímica - 9 Classe - Prof. PagaraPaulino Jequecene ManuelNessuna valutazione finora
- Aula 01 - Introdução A Ciencia Dos MateriaisDocumento18 pagineAula 01 - Introdução A Ciencia Dos MateriaisMichele SilvaNessuna valutazione finora
- Ligações AtômicasDocumento20 pagineLigações AtômicasRubens SantosNessuna valutazione finora
- SD1 - Ligação QuímicaDocumento130 pagineSD1 - Ligação Químicaa6361Nessuna valutazione finora
- 9º Ano - Ligação IônicaDocumento15 pagine9º Ano - Ligação IônicaMichelle OliveiraNessuna valutazione finora
- Apostila IVDocumento12 pagineApostila IVFco SouzaNessuna valutazione finora
- Química - Pré-Vestibular Impacto - Forças Intermoleculares e Ligaçao MetálicaDocumento2 pagineQuímica - Pré-Vestibular Impacto - Forças Intermoleculares e Ligaçao MetálicaQuímica Qui100% (3)
- 3 - Estrutura Atomica PDFDocumento26 pagine3 - Estrutura Atomica PDFrenanNessuna valutazione finora
- False Friends: English and PortugueseDocumento5 pagineFalse Friends: English and Portuguesewillem rabbeljee100% (13)
- Fome e SustentabilidadeDocumento2 pagineFome e SustentabilidadeAngela CarvalhoNessuna valutazione finora
- Lev VygotskyDocumento26 pagineLev VygotskyAngela CarvalhoNessuna valutazione finora
- Apresentação OralDocumento7 pagineApresentação OralAngela CarvalhoNessuna valutazione finora
- Snews PDFDocumento8 pagineSnews PDFfaustino_cristinaNessuna valutazione finora
- RascunhoDocumento7 pagineRascunhoAngela CarvalhoNessuna valutazione finora
- Mat 2Documento6 pagineMat 2Diogo NunesNessuna valutazione finora
- Prob CondicionadaDocumento25 pagineProb CondicionadaSónia AmaralNessuna valutazione finora
- Mma12 Res CF 1Documento20 pagineMma12 Res CF 1Anonymous pbNbZngmNessuna valutazione finora
- Limite HeineDocumento6 pagineLimite HeineAngela CarvalhoNessuna valutazione finora
- Limites ContinuidadeDocumento14 pagineLimites ContinuidadeAngela CarvalhoNessuna valutazione finora
- A Importância Da Música - TópicosDocumento1 paginaA Importância Da Música - TópicosAngela CarvalhoNessuna valutazione finora
- Teorema de BolzanoDocumento7 pagineTeorema de BolzanoAngela CarvalhoNessuna valutazione finora
- Mat4 PDFDocumento3 pagineMat4 PDFDiogo NunesNessuna valutazione finora
- Métodos ContracetivosDocumento4 pagineMétodos ContracetivosAngela CarvalhoNessuna valutazione finora
- Conjuntos TeoremasDocumento11 pagineConjuntos TeoremasMorgana RebeloNessuna valutazione finora
- Mat 1Documento4 pagineMat 1Diogo NunesNessuna valutazione finora
- Binomio NewtonDocumento2 pagineBinomio Newtonmelissa riquelmeNessuna valutazione finora
- Combinatoria ProbDocumento21 pagineCombinatoria ProbBeatriz NevesNessuna valutazione finora
- Exponenciais LogaritmosDocumento30 pagineExponenciais LogaritmosAngela CarvalhoNessuna valutazione finora
- E Há Poetas Que São ArtistasDocumento11 pagineE Há Poetas Que São ArtistasAngela Carvalho100% (1)
- Os Ricos Dividem o MundoDocumento13 pagineOs Ricos Dividem o MundoAngela CarvalhoNessuna valutazione finora
- A PerguntaDocumento4 pagineA PerguntaAngela CarvalhoNessuna valutazione finora
- Func TrigonometricasDocumento43 pagineFunc TrigonometricasAngela CarvalhoNessuna valutazione finora
- Crianças Selvagens ReflexãoDocumento2 pagineCrianças Selvagens ReflexãoAngela CarvalhoNessuna valutazione finora
- Ficha DocumentárioDocumento2 pagineFicha DocumentárioAngela CarvalhoNessuna valutazione finora
- E Há Poetas Que São ArtistasDocumento3 pagineE Há Poetas Que São ArtistasAngela CarvalhoNessuna valutazione finora
- Hemisférios CerebraisDocumento1 paginaHemisférios CerebraisAngela CarvalhoNessuna valutazione finora
- Um Cérebro BrilhanteDocumento1 paginaUm Cérebro BrilhanteAngela CarvalhoNessuna valutazione finora
- Relação CérebroDocumento2 pagineRelação CérebroAngela CarvalhoNessuna valutazione finora
- Asquini e Os Perfis Da EmpresaDocumento4 pagineAsquini e Os Perfis Da EmpresaFrederico RamosNessuna valutazione finora
- 2 - Aspectos Fisiológicos e Bioquímicos Do Processo de DestreinamentoDocumento6 pagine2 - Aspectos Fisiológicos e Bioquímicos Do Processo de DestreinamentoPablo HenriqueNessuna valutazione finora
- Resumo PpiiDocumento9 pagineResumo PpiiJanderson SmithNessuna valutazione finora
- A Arte Do Tantra Arcano AZFDocumento15 pagineA Arte Do Tantra Arcano AZFLuis Carlos AlmeidaNessuna valutazione finora
- Lista OndulatóriaDocumento9 pagineLista OndulatóriambenencaseNessuna valutazione finora
- 235 - 191 Tubo de Raios CatodicosDocumento1 pagina235 - 191 Tubo de Raios Catodicosericajoanamocumbe4Nessuna valutazione finora
- Amperímetro e Voltímetro - ExercíciosDocumento8 pagineAmperímetro e Voltímetro - ExercíciosDaniela AlmeidaNessuna valutazione finora
- Lista 1Documento3 pagineLista 1Lucas RibeiroNessuna valutazione finora
- Estudo Do Comportamento Da Radiação Solar Na Cidade deDocumento26 pagineEstudo Do Comportamento Da Radiação Solar Na Cidade deFrancisco Jose NorisNessuna valutazione finora
- C9 4bim Aluno 2015Documento40 pagineC9 4bim Aluno 2015Felipe BrazNessuna valutazione finora
- Saiba Mais - Start&StopDocumento20 pagineSaiba Mais - Start&StopcledivanNessuna valutazione finora
- PlanoDeAula 540205Documento4 paginePlanoDeAula 540205Rogéria BrancoNessuna valutazione finora
- Métodos para o Cálculo Da Carga TérmicaDocumento10 pagineMétodos para o Cálculo Da Carga TérmicaDaniel HenriqueNessuna valutazione finora
- Aula 04 - Sistema de AlavancasDocumento13 pagineAula 04 - Sistema de AlavancasFelipe ParkerNessuna valutazione finora
- Aula de Mecaninica Rudney TorqueDocumento36 pagineAula de Mecaninica Rudney TorqueDREZZYOFCNessuna valutazione finora
- NTC 906600 Temporária PDFDocumento3 pagineNTC 906600 Temporária PDFElber SoaresNessuna valutazione finora
- Conhecimento e Formação Humana No Pensamento de AristótelesDocumento12 pagineConhecimento e Formação Humana No Pensamento de AristótelesAnna KarolineNessuna valutazione finora
- Teste 4 Fisico Quimica 9 Global Tipos de Movimentos Rapidez Velocidade e Aceleracao Medias Limites de Velocidade e Distancia de SegurancaDocumento2 pagineTeste 4 Fisico Quimica 9 Global Tipos de Movimentos Rapidez Velocidade e Aceleracao Medias Limites de Velocidade e Distancia de SegurancaLiliana LaranjeiraNessuna valutazione finora
- Relatório Mundial Sobre Violencia e SaúdeDocumento380 pagineRelatório Mundial Sobre Violencia e SaúdeAna_Paula_Sant_2985100% (1)
- Resistencia I EM 09 Cisalhamento ConvencionalDocumento17 pagineResistencia I EM 09 Cisalhamento ConvencionalandrezsantosNessuna valutazione finora
- Topico 4 MF - Cinematica Dos Fluidos Parte 1 PDFDocumento47 pagineTopico 4 MF - Cinematica Dos Fluidos Parte 1 PDFFelipe FrizonNessuna valutazione finora
- Materiais e Orientacoes de Estudo 1o Trimestre 2023 Avaliacoes PAS 2a Serie Ensino Medio PDFDocumento5 pagineMateriais e Orientacoes de Estudo 1o Trimestre 2023 Avaliacoes PAS 2a Serie Ensino Medio PDFShrek IVNessuna valutazione finora
- Grau de Proteção IP PDFDocumento7 pagineGrau de Proteção IP PDFFelipe GodinhoNessuna valutazione finora
- SimuladoDocumento8 pagineSimuladoCarlinhosCostaNessuna valutazione finora
- O Guia Definitivo para Aprender Arduino Na Pratica 1Documento58 pagineO Guia Definitivo para Aprender Arduino Na Pratica 1Pedro Miguel100% (4)
- Galileu GalileiDocumento13 pagineGalileu GalileiTchissola Wuague MônicaNessuna valutazione finora
- Aula 7 Mecanismo Came-SeguidorDocumento20 pagineAula 7 Mecanismo Came-SeguidorAlexandre CorsoNessuna valutazione finora
- Retificadores de Meia Onda Com Carga RLDocumento10 pagineRetificadores de Meia Onda Com Carga RLEdson SimoesNessuna valutazione finora
- Resumo de Física 10ºanoDocumento27 pagineResumo de Física 10ºanoMicaelaeuNessuna valutazione finora