Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Hipopituitarismo Panhipopituitarismo 2012 Medicine Programa de Formaci N M Dica Continuada Acreditado
Caricato da
Gerardo N. Pabón GallinoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Hipopituitarismo Panhipopituitarismo 2012 Medicine Programa de Formaci N M Dica Continuada Acreditado
Caricato da
Gerardo N. Pabón GallinoCopyright:
Formati disponibili
ACTUALIZACIÓN
Hipopituitarismo.
Panhipopituitarismo
E. Fernández-Rodríguez, I. Bernabeu y F.F. Casanueva
Servicio de Endocrinología y Nutrición. Complejo Hospitalario Universitario de Santiago de Compostela. Santiago de
Compostela. A Coruña. España.
Palabras Clave: Resumen
- Hipopituitarismo El hipopituitarismo se define como la pérdida de función hormonal hipofisaria. Puede estar afecta-
- Panhipopituitarismo do uno, varios o todos los ejes hormonales hipofisarios, en cuyo caso se conoce como panhipopi-
tuitarismo. Las manifestaciones clínicas que asocia son a menudo inespecíficas y dependen de la
- Adenomas hipofisarios
rapidez y la edad a la que se instaura el déficit hormonal. La mayor importancia clínica del hipopi-
tuitarismo radica en el aumento de morbimortalidad que conlleva respecto a la población general
sana. Se han descrito en los pacientes con hipopituitarismo cambios en la composición corporal,
alteraciones en el perfil lipídico, hipertensión arterial, intolerancia a la glucosa y aumento del esta-
do proinflamatorio implicados en el proceso de la aterosclerosis. Además, la tasa de mortalidad en
estos pacientes dobla a la de la población general de igual edad y sexo.
Keywords: Abstract
- Hypopituitarism Hypopituitarism. Panhypopituitarism
- Panhypopituitarism
Hypopituitarism is defined as the partial or complete loss of pituitary function. The associated
- Pituitary tumours clinical manifestations are often nonspecific and depend on the severity and age at instauration.
The major clinical importance of hypopituitarism is that it associates increased morbidity and
mortality compared to general population. Changes in body composition, altered lipid profile,
hypertension, glucose intolerance and increased pro-inflammatory state involved in the process of
atherosclerosis have been described in these patients. In addition, mortality rate is two-fold
increased in these patients compared to healthy subjects.
Introducción Se ha descrito una prevalencia del hipopituitarismo en la
población general adulta de 45,5 casos por 100.000 habitan-
El hipopituitarismo se define como el síndrome clínico resul- tes y una incidencia de 4,05 casos por 100.000 habitantes y
tante de la pérdida de la función hormonal hipofisaria, ya sea año1.
parcial o total, en cuyo caso se conoce como panhipopituita-
rismo. En el hipopituitarismo puede estar afectada la secre-
ción de cualquiera de las hormonas sintetizadas en la hipófisis Etiopatogenia
anterior: tirotropina (TSH), adrenocorticotropina (ACTH),
hormona de crecimiento (GH), prolactina, hormona luteini- El hipopituitarismo puede ser de origen primario, cuando el
zante (LH) y hormona estimulante del folículo (FSH). Tam- fallo en la secreción hormonal está originado en la propia
bién puede afectarse la hipófisis posterior y ocasionar diabe- glándula, o secundario, cuando es debido a ausencia de estimu-
tes insípida por déficit de hormona antidiurética o ADH. lación de los factores hipotalámicos sobre la hipófisis, bien sea
Medicine. 2012;11(13):773-81 773
ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS
TABLA 1 Adenomas hipofisarios
Etiología del hipopituitarismo
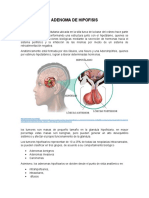
Los adenomas hipofisarios, en su mayoría tumores no fun-
Tumores cionantes, constituyen la causa más frecuente, representando
Hipofisarios: adenomas hipofisarios, otros tumores no adenomas aproximadamente el 60% de los casos de hipopituitarismo
Paraselares: craneofaringiomas, meningiomas, cordomas, gliomas, otros en adultos1. El tamaño del adenoma es determinante en la
Metástasis aparición del hipopituitarismo. Los microadenomas hipofi-
Genéticas
sarios (tumores menores de 1 cm) no suelen producir clínica
Defectos en el desarrollo congénito: holoprosencefalia, anencefalia,…
local ni hipopituitarismo. Por el contrario, los macroadeno-
Síndromes genéticos hereditarios: síndrome de Kallman, Prader-Willi, Laurence- mas (tumores mayores de 1 cm) suelen presentar síntomas
Moon-Bield compresivos, fundamentalmente déficit visual, y se asocian
Mutaciones en genes que codifican factores de transcripción: Pit-1, Prop-1, Hesx-1, con un déficit de al menos un eje hormonal hipofisario en el
Lhx3, Lhx4, Sox,…
Mutaciones en receptores (GHRH, GnRH, TSH,..) o subunidad beta de LH, FSH y/o
30% de los casos2. Los ejes hormonales más frecuentemente
TSH afectados son el eje somatotropo, seguido del gonadotropo,
Cirugía y/o radioterapia hipofisaria tirotropo y, por último, el corticotropo, siendo además esta
la secuencia cronológica típica que aparece en los hipopitui-
Traumatismo craneoencefálico
tarismos por destrucción del tejido hipofisario.
Silla turca vacía Los mecanismos por los que los adenomas hipofisarios
Enfermedades inflamatorias/infecciosas de la hipófisis ocasionan hipopituitarismo incluyen: a) compresión mecáni-
Hipofisitis: linfocítica, granulomatosa, xantomatosa ca, desestructuración y/o destrucción de las células hipofisa-
Tuberculosis, sífilis,… rias por la masa tumoral, b) compromiso de la vasculariza-
ción hipofisaria con la consiguiente necrosis isquémica de la
Enfermedades infiltrativas
hipófisis y c) aumento de la presión intraselar con deterioro
Sarcoidosis, hemocromatosis, amiloidosis
Histiocitosis de células de Langerhans o X
del flujo sanguíneo portal y alteración de la regulación hipo-
talámica sobre la hipófisis.
Vasculares
Apoplejía hipofisaria/síndrome de Sheehan
Lesiones y/o tumores de la región selar y paraselar
Hemorragia subaracnoidea
El quiste de la bolsa de Rathke que asocia hipopituitarismo
Aneurisma de la arteria carótida
y/o diabetes insípida en hasta el 80% de los casos es la lesión
FSH: hormona foliculoestimulante; GHRH: hormona liberadora de la hormona del
crecimiento; LH: hormona luteinizante; TSH: hormona tirotropa. paraselar más frecuente. Los craneofaringiomas son las neo-
plasias paraselares más frecuentes, aunque su incidencia es
baja. Habitualmente son tumores de gran tamaño e invasivos
por alteración del propio hipotálamo o del tallo hipofisario. que cursan con sintomatología local desde el diagnóstico. En
Las causas de hipopituitarismo (tabla 1) pueden clasificarse en el 95% de los casos se ha descrito al menos un déficit hor-
tres grupos: adquiridas, genéticas o idiopáticas. monal hipofisario.
Tratamiento con cirugía y radioterapia
Causas adquiridas La cirugía hipofisaria puede empeorar o mejorar la funcio-
nalidad hipofisaria dependiendo del tamaño tumoral, el
Las causas adquiridas, ya sean transitorias o permanentes, tiempo de evolución de la lesión y de la destreza del neuro-
son más frecuentes que las genéticas, especialmente en aque- cirujano. En un 5% de los pacientes intervenidos se desarro-
llos casos que comienzan en la edad adulta (fig. 1). llan nuevos déficits hormonales tras la cirugía, siendo este
A B C
Fig. 1. Resonancia magnética nuclear del área hipotálamo-hipofisaria, mostrando distintas patologías causantes de hipopituitarismo. Macroadenoma hipofisario (A); silla
turca vacía (B) y disgenesia de tallo hipofisario (C).
774 Medicine. 2012;11(13):773-81
HIPOPITUITARISMO. PANHIPOPITUITARISMO
hecho más frecuente cuanto mayor es el tamaño del tumor. Vasculares
Del mismo modo, la funcionalidad hipofisaria puede recupe- Los episodios vasculares intrahipofisarios agudos pueden
rarse en hasta un 50% de los casos tras la misma3. ocurrir de forma espontánea en un adenoma preexistente, en
La radioterapia craneal puede inducir hipopituitarismo el período postparto (síndrome de Sheehan) o en asociación
precozmente por daño hipotalámico al ser esta estructura con enfermedades sistémicas como la diabetes, la hiperten-
más sensible a la radiación. También puede causar alteracio- sión o determinadas enfermedades hematológicas. El hipopi-
nes a largo plazo, especialmente en niños y adolescentes, por tuitarismo posterior a los cuadros de apoplejía hipofisaria es
daño hipofisario directo y atrofia glandular4. El riesgo de de- muy habitual.
sarrollar hipopituitarismo está íntimamente relacionado con
la dosis de radiación y el tiempo transcurrido desde la radio-
terapia. Una dosis de 50 Gy provoca algún grado de hipopi- Causas genéticas
tuitarismo en hasta el 65% de los pacientes, en la mayoría de
los casos (más del 75%) en los primeros 10 años tras la radio- Las causas genéticas son globalmente menos frecuentes que
terapia. No obstante, pueden aparecen déficits hormonales las adquiridas, y pueden afectar a distintas etapas del desarro-
hasta 25 años después de la misma, por lo que es necesario llo del hipotálamo o de la hipófisis. Suelen acompañarse de
un seguimiento muy prolongado. El eje somatotropo es el hipopituitarismo de inicio en la infancia.
más sensible a los efectos de la radiación.
Síndromes genéticos hereditarios
Causas traumáticas El síndrome de Kallman, el de Prader-Willi y el de Lauren-
En los últimos años, se ha visto un interés creciente en la ce-Moon-Bield que asocian hipogonadismo hipogonadotro-
relación entre los traumatismos craneoencefálicos (TCE) y po entre otras manifestaciones.
la probabilidad de desarrollar insuficiencia hipofisaria. La
prevalencia de hipopituitarismo tras un TCE es muy variable Defectos en el desarrollo craneofacial y de la línea media
en los trabajos publicados, oscilando entre el 15 y el 90%5-7, Los defectos en el desarrollo de la línea media pueden
probablemente por la heterogeneidad en la metodología de ocasionalmente dar lugar a graves malformaciones como la
los estudios publicados. Los mecanismos por los que un trau- anencefalia, la holoprosencefalia, el encefalocele basal con-
matismo craneal causa hipopituitarismo no son del todo bien génito o bien a otras anomalías menos graves entre las que se
conocidos, y podrían estar en relación con: a) daño vascular, incluyen los defectos de desarrollo de la región selar. En al-
tanto por hipoperfusión por sección del tallo hipofisario gunos casos, los defectos en el desarrollo anátomo-funcional
como por daño directo sobre la hipófisis con necrosis o des- hipotálamo hipofisario pueden deberse a la presencia de mu-
trucción de la misma, el tallo hipofisario o los núcleos hipo- taciones en los genes que codifican los factores de transcrip-
talámicos y b) causa autoinmune debida a la demostración de ción necesarios para el desarrollo hipofisario. Aquellas muta-
la existencia de anticuerpos antihipofisarios, incluso hasta ciones que afectan a los factores de transcripción de expresión
tres años después del evento traumático8. más precoz durante el desarrollo hipofisario como Lhx3,
Lhx4 y Hesx1, se asocian a alteraciones anatómicas hipofisa-
Silla turca vacía rias con disfunción hormonal y con frecuencia a otros niveles
Suele ser un hallazgo radiológico sin gran repercusión clíni- del sistema nervioso central. Por el contrario, las mutaciones
ca, aunque puede cursar con hipopituitarismo si existe atrofia en los genes que codifican los factores de transcripción de
o compresión de más del 90% del tejido hipofisario. Puede expresión más tardía como PROP-1, Pit-1 y T-Pit, implicados
ser de origen primario por una debilidad congénita del dia- en la diferenciación celular, se asocian fundamentalmente
fragma selar sin otra causa evidente, o bien de origen secun- con hipopituitarismo sin alteración anatómica.
dario a un infarto o necrosis silente de un tumor hipofisario
previamente no diagnosticado. Mutaciones en genes que codifican receptores
y/u hormonas hipofisarias
Enfermedades inflamatorias o infiltrativas Son cuadros que cursan habitualmente con afectación de un
de la hipófisis sólo eje hormonal. Así, la mutación en el receptor de la hor-
La hipófisis también puede verse afectada por trastornos in- mona liberadora de la hormona del crecimiento (GHRH) o
flamatorios de origen autoinmunitario9. Más de la mitad de en el receptor de GH dará lugar respectivamente a un déficit
los pacientes presenta hipopituitarismo, siendo lo más fre- de GH o a una resistencia a la GH. Las mutaciones en el
cuente el hipoadrenalismo, seguido del hipotiroidismo, défi- receptor de GnRH provocarán déficit de FSH y LH e hipo-
cit de gonadotropinas y, por último, el déficit de GH y de gonadismo. Las mutaciones inactivadoras del receptor de
prolactina, a diferencia de lo que suele ocurrir en los tumores TSH ocasionan un hipotiroidismo por resistencia a la TSH.
hipofisarios. El 20% de los casos presenta diabetes insípida Se han descrito también mutaciones en la subunidades β de
por infiltración de la neurohipófisis o del tallo hipofisario. las moléculas de TSH, LH o FSH con el déficit hormonal
Inflamaciones crónicas como la tuberculosis o la sífilis tercia- consiguiente.
ria o infiltrativas como la sarcoidosis, la histiocitosis de célu-
las de Langerhans o histiocitosis X o las metástasis hipofisa- Disgenesia de tallo hipofisario
rias pueden producir grados variables de hipopituitarismo La disgenesia de tallo hipofisario es un hipopituitarismo
anterior y diabetes insípida. congénito de grado variable asociado con alteraciones del
Medicine. 2012;11(13):773-81 775
ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS
TABLA 2
Síntomas y signos asociados a cada déficit hormonal hipofisario
Déficit hormonal Síntomas Signos clínicos/laboratorio
Agudo Debilidad, mareo, cefalea, fiebre, shock, náuseas, vómitos Hipoglucemia, hipotensión, hiponatremia, anemia normocítica,
linfocitosis, eosinofilia
ACTH Crónico Fatiga, pérdida de peso, anorexia
Niños Retraso de crecimiento, pubertad retrasada
Adultos Cansancio, intolerancia al frío, caída de pelo, piel seca, pérdida de atención, Ganancia de peso, bradicardia, hipotensión, hiperreflexia, hiponatremia
TSH hinchazón
Niños Retraso de crecimiento
Mujeres Amenorrea, dispareunia, pérdida de libido, infertilidad Osteoporosis
FSH/LH Hombres Pérdida de libido, cambio de humor, impotencia, atrofia testicular Pérdida de masa muscular, osteoporosis, anemia
Niños Retraso puberal
Adultos Pérdida de masa muscular y fuerza, obesidad visceral, fatiga, pérdida de Dislipidemia, aterosclerosis prematura, hipoglucemia
GH atención
Niños Retraso de crecimiento
ADH Poliuria, polidipsia Hipoosmolaridad urinaria, hipernatremia, poliuria
ACTH: hormona corticotropa; ADH: vasopresina; FSH: hormona foliculoestimulante; GH: hormona del crecimiento; LH: hormona luteinizante; TSH: hormona tirotropa.
Adaptada de: Schneider HJ, et al35.
desarrollo del área selar, que típicamente incluyen el adelga- frío, pérdida de apetito y peso- y variables en función de las
zamiento o la ausencia completa del tallo hipofisario, asocia- hormonas deficitarias (tabla 2).
do o no con aplasia o hipoplasia de la hipófisis anterior y/o
con neurohipófisis localizada de forma ectópica, pudiendo
estar situada en cualquier punto del trayecto del tallo hipofi- Déficit de hormona de crecimiento
sario, habitualmente en la base del hipotálamo. En una serie
de hipopituitarismo en adultos, representó el 11,2% de los El déficit de GH en el período postnatal suele cursar con
casos de hipopituitarismo10. hipoglucemias graves en las primeras horas de vida, asociada
La etiopatogenia de la disgenesia de tallo hipofisario no a veces a convulsiones, hiperbilirrubinemia prolongada e hi-
se conoce, aunque se ha relacionado con traumatismos en potermia. La longitud en el momento del nacimiento suele
período neonatal y con defectos en el desarrollo prenatal, estar dentro de lo normal. A partir de los 12 meses de edad,
asociado a mutaciones en los genes Hesx1, Lhx4, Lhx3 y la clínica de presentación habitual es la talla baja (por debajo
OTX2 y, en menor medida, T-Pit, PROP-1 y Pit-1. A nivel del percentil 3), la disminución en la velocidad del creci-
clínico se asocian fundamentalmente con déficits hipofisarios miento y el retraso en la dentición. Los casos más graves
múltiples o incluso panhipopituitarismo, aunque también tienen un fenotipo característico, con una facies redondeada,
pueden asociar un déficit hormonal aislado. frente amplia y acumulación de grasa abdominal.
Por el contrario, en el déficit de GH en los adultos no
existe un único síntoma o signo patognomónico. Se ha des-
Causas idiopáticas crito una alteración de la composición corporal con aumen-
to de la masa grasa (un 7-10% superior al esperado por la
edad, sexo y altura), especialmente de la grasa visceral; dis-
Las causas idiopáticas son cada vez menos frecuentes gracias
minución de la masa libre de grasa o la masa muscular, y
al desarrollo y utilización de estudios de imagen más sensibles
reducción del agua corporal total, probablemente por reduc-
y a la identificación por técnicas de biología molecular de
ción del volumen extracelular, plasmático y de sangre total.
nuevas mutaciones relacionadas con el hipopituitarismo. Aun
Disminuye la densidad mineral ósea y aumenta la incidencia
así, entre un 10 y un 16% de los hipopituitarismos, ya sean
de fracturas. Además, se acompaña de cambios metabólicos,
con déficit hormonal aislado o múltiple, siguen siendo iden-
con resistencia a la insulina e intolerancia a la glucosa y dis-
tificados como idiopáticos.
lipidemia11. Además, en los adultos con déficit de GH se han
visto cambios estructurales como arterioesclerosis prematu-
ra, aumento en el grosor de la capa íntima de las arterias
Formas clínicas carótidas y alteraciones estructurales a nivel cardiaco con
reducción del grosor de la pared posterior del ventrículo iz-
La clínica del hipopituitarismo está condicionada por varios quierdo y del septo interventricular, así como alteración de
factores como la causa subyacente, la rapidez de instauración la función ventricular12. Es frecuente la existencia de una dis-
del déficit, la magnitud del déficit hormonal y la edad de minución de su capacidad de esfuerzo al asociar debilidad
aparición del mismo, siendo, por lo general, más graves los muscular y fatiga, así como una afectación global de su cali-
cuadros que comienzan a edades más precoces. dad de vida con disminución del bienestar psicológico, falta
Los síntomas suelen desarrollarse de forma insidiosa, in- de concentración, pérdida de memoria, mayor labilidad
cluso varios años antes del diagnóstico. Suelen ser inespecí- emocional y deterioro de las relaciones físicas, sociales y
ficos -sensación de malestar, cansancio, letargia, sensación de sexuales en comparación con la población general13.
776 Medicine. 2012;11(13):773-81
HIPOPITUITARISMO. PANHIPOPITUITARISMO
Déficit de hormona corticotropa Otras manifestaciones clínicas que pueden
acompañar al hipopituitarismo
Los síntomas y signos del déficit de ACTH pueden ser gra-
ves y amenazar la vida del paciente. En los casos de insufi- En ocasiones, acompañando a los síntomas de hipopituita-
ciencia suprarrenal aguda, los pacientes pueden presentar rismo, existen síntomas derivados de la causa subyacente.
náuseas, vómitos, dolor abdominal, cefalea, fatiga intensa, Este es el caso de los tumores hipofisarios que pueden pre-
hipotensión ortostática, hipoglucemia, hiponatremia dilucio- sentarse con síntomas visuales como defectos campimétri-
nal y shock. cos (por compresión quiasmática) o diplopía (por invasión
Por el contrario, cuando el déficit se establece de una del seno cavernoso y afectación de pares craneales) o bien
manera más gradual, las manifestaciones clínicas son más in- con cefalea, rinolicuorrea y en casos más graves incluso
sidiosas, incluyendo pérdida de peso, astenia, debilidad, fati- crisis uncinadas por afectación del lóbulo temporal. Ade-
ga, náuseas e hiponatremia. En los casos de insuficiencia más, en el caso de tumores hipofisarios funcionantes, pue-
adrenal secundaria a un déficit de ACTH es característica la den coexistir síntomas derivados de la hiperfunción hor-
falta de hiperpigmentación, típica del fallo adrenal primario, monal, variables según la hormona que sea producida en
y la presencia de normocaliemia, ya que el eje renina-angio- exceso.
tensina-aldosterona permanece intacto.
Complicaciones
Déficit de hormona tirotropa
Se ha descrito en los pacientes con hipopituitarismo un au-
Dada la larga vida media de la hormona tiroidea, sus sínto- mento en la morbilidad y mortalidad respecto a la población
mas no son evidentes hasta varias semanas después de esta- general, con una razón de mortalidad estandarizada entre 1,2
blecido el déficit de TSH. La magnitud del cuadro clínico es y 4,54 respecto a población sana14-18, sobre todo por causa
variable, y suele cursar con astenia, debilidad, intolerancia al cardiovascular14,16. Las mujeres14-18 y los pacientes diagnosti-
frío, ganancia ponderal no intencionada, estreñimiento y se- cados de hipopituitarismo a una edad más temprana16,18 pre-
quedad cutánea. En los niños, el hipotiroidismo central no sentan un peor pronóstico.
diagnosticado puede asociarse con retraso de crecimiento y Varios factores se han relacionado con una mayor inci-
retraso mental y de la maduración ósea. dencia de mortalidad en los pacientes con hipopituitarismo.
En la exploración física podemos detectar bradicardia, De este modo, los pacientes con acromegalia19, enfermedad
hiporreflexia y edema palpebral, en los casos más evolucio- de Cushing20 y craneofaringiomas21 como etiologías subya-
nados. Suele acompañarse de hiponatremia y anemia normo- centes de hipopituitarismo se han relacionado con un peor
cítica y normocrómica. pronóstico y más mortalidad. El déficit de GH no sustitui-
do también se asocia a un incremento de la morbimortali-
dad, al presentar un perfil lipídico más desfavorable, hiper-
Déficit de gonadotropinas (hormona tensión arterial y cambios en la composición corporal11, y
foliculoestimulante/hormona luteinizante) un aumento del estado pro-inflamatorio22,23. El tratamiento
del déficit de GH en el adulto corrige, al menos parcial-
mente, estos cambios del perfil lipídico y de la composición
En las mujeres, en la infancia y en la adolescencia el déficit
corporal24. Además, mejora la hipertensión arterial, dismi-
de FSH/LH se caracteriza por la ausencia de desarrollo pu-
nuye el grosor de la íntima media de la arteria carótida25 y
beral: amenorrea primaria y ausencia de desarrollo primario.
reduce el estado pro-inflamatorio, reduciendo los niveles
Tras la pubertad, se caracteriza por alteraciones premestrua-
de marcadores de inflamación como la proteína C reactiva
les (oligomenorrea o amenorrea), infertilidad, atrofia mama-
ultrasensible (PCR-us), la interleucina 6 (IL-6) y el factor
ria, sofocos, sequedad vaginal y dispareunia.
de necrosis tumoral alfa (TNF-α)22,23. Todos estos efectos
En los varones, si el déficit ocurre antes de la pubertad
podrían potencialmente reducir el exceso de mortalidad
se caracterizará por ausencia de desarrollo puberal: micro-
asociado al déficit de GH, aunque todavía no se ha demos-
pene, testes de tamaño inferior a 4 ml o 2,5 cm o propor-
trado. El tratamiento con corticoides en pacientes deficita-
ción eunucoide). Tras la pubertad, el déficit de gonadotro-
rios, especialmente con dosis diarias superiores a 20 mg de
pinas se asocia con disminución del tamaño testicular,
hidrocortisona o su equivalente, se asocia con cambios me-
disminución de la libido e impotencia, infertilidad, dismi-
tabólicos que confieren un mayor riesgo cardiovascular,
nución del vello corporal y frecuencia de afeitado y gine-
como perfil lipídico desfavorable, aumento en la circunfe-
comastia.
rencia de la cintura y empeoramiento de la hemoglobina
glucosilada (HbA1c)26, por lo que aunque tampoco ha podi-
do demostrarse, podría contribuir a la mayor morbi-morta-
Déficit de prolactina lidad.
Por el contrario, el grado de hipopituitarismo y el tiempo
Es muy infrecuente. Se caracteriza por imposibilidad para la de evolución del mismo14,16,18 no parecen influir en el pro-
lactancia en el período postparto. nóstico en estos pacientes.
Medicine. 2012;11(13):773-81 777
ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS
Diagnóstico ción, bien la TTI o el test de estímulo con 250 μg de ACTH
(Synacthen)32, y se ha propuesto también la estimulación con
dosis bajas de ACTH (1 μg). Una respuesta normal es un
El diagnóstico del hipopituitarismo incluye la evaluación
pico de cortisol superior a 20 μg/dl.
hormonal y el diagnóstico etiológico de la causa subyacente.
Otros test que podrían utilizarse son el de la metopirona
Para la evaluación de la integridad de los ejes tiroideo,
(bloquea la síntesis de cortisol, induciendo aumento de
gonadotropo y lactotropo son, en general, suficientes las de-
ACTH) y el de la hormona liberadora de hormona cortico-
terminaciones hormonales basales, mientras que para la eva-
tropa (CRH) (estimula la secreción de ACTH) aunque no
luación del eje adrenal y somatotropo suele precisarse de test
presenta mayor valor predictivo que las concentraciones ba-
de estimulación o dinámicos.
sales de cortisol plasmático.
Las pruebas hormonales basales deben incluir la deter-
minación de TSH y T4 libre, prolactina, FSH/LH y testos-
terona o estradiol, GH y factor de crecimiento similar a la
insulina tipo 1 (IGF-1) y ACTH y cortisol.
Déficit de hormona tirotropa
El diagnóstico de déficit de TSH se establece ante la presen-
cia de concentración sérica de T4 libre inferior al rango nor-
Déficit de hormona de crecimiento mal con niveles de TSH bajos o inapropiadamente norma-
les33. La T3 libre habitualmente es normal y no es necesaria
El diagnóstico del déficit de GH requiere de la realización de para el diagnóstico. El test de estimulación con TRH discri-
test de estimulación, debido a que la secreción de la GH es mina el origen hipotalámico o hipofisario del déficit, aunque
pulsátil y pueden observarse niveles indetectables de GH carece de utilidad práctica.
en individuos sanos. El test de tolerancia insulínica o hipo-
glucemia insulínica (TTI) es el de elección para el diagnós-
tico. El TTI se caracteriza por la administración intravenosa Déficit de hormona foliculoestimulante/
de 0,05-0,15 UI/kg de peso de insulina, y medición de la hormona luteinizante
respuesta de GH cada 30 minutos hasta completar 2 horas.
El déficit de GH se confirma con un pico de respuesta in
Para el diagnóstico del déficit de gonadotropinas basta con la
ferior a 3 ng/ml en los adultos e inferior a 10 ng/ml y a
determinación basal de FSH, LH y testosterona o estradiol,
5 ng/ml en los niños y en la etapa de transición tras la pu
careciendo prácticamente de utilidad clínica los test de esti-
bertad, en presencia de hipoglucemia (glucemia inferior a
mulación con GnRH. En ambos casos, debe excluirse siem-
40 mg/dl)27. En los adultos con enfermedad hipotalámica co-
pre la presencia de hiperprolactinemia.
nocida y al menos otra deficiencia hormonal hipofisaria exis-
En las mujeres premenopáusicas que presentan ciclos
te consenso en que un sólo test es válido para el diagnóstico.
menstruales regulares puede excluirse la presencia de un hi-
Otros test empleados, cuando el de TTI está contraindi-
pogonadismo. Los hallazgos de laboratorio típicos son nive-
cado (pacientes ancianos y con antecedentes de cardiopatía
les disminuidos de estradiol, en presencia de concentraciones
isquémica y epilepsia) son el de GHRH + GHRP-6 (diag-
normales o bajas de FSH y LH. En edad menopáusica se
nóstico del déficit si la GH es inferior a 10 ng/ml)28, el de
consideró igualmente indicativo de déficit de FSH/LH la
GHRH + arginina (punto de corte en 11,5 ng/ml en sujetos
presencia de niveles normales o bajos de gonadotropinas.
delgados y 4,1 ng/ml en obesos) o el de glucagón (punto de
En los varones, el diagnóstico se estable mediante la de-
corte 3 ng/ml)29,30.
mostración de niveles bajos de testosterona (inferiores a 250
En pacientes con alteración anatómica de la línea media,
ng/dl) y niveles normales o bajos de FSH y LH. La testoste-
puede establecerse el diagnóstico de déficit de GH mediante
rona debe determinarse por la mañana debido a su ritmo
la demostración de niveles de IGF-1 inferiores al rango nor-
circadiano. Valores límite (250-350 ng/dl) deben ser confir-
mal para la edad, junto a la presencia de otros déficits hor-
mados.
monales adenohipofisarios31.
Déficit de hormona corticotropa Déficit de prolactina
El diagnóstico del déficit viene dado por la presencia de ni-
La secreción de cortisol presenta un ritmo circadiano con ni-
veles de prolactina por debajo del rango normal, y por la
veles de cortisol máximos por la mañana y mínimos a media-
ausencia de respuesta tras la administración de TRH.
noche. El diagnóstico de déficit de ACTH se establece me-
diante la demostración de niveles de cortisol (entre las 8:00 y
8:30 de la mañana) inferiores a 3 μg/dl (100 nmol/l) junto a
niveles simultáneos de ACTH bajos o normales de la mañana Tratamiento
y se excluye o descarta si el nivel es superior a 20 μg/dl
(500 nmol/l). El tratamiento del hipopituitarismo34 se realiza mediante la
Los casos intermedios, con niveles de cortisol entre 3 y reposición de las hormonas sintetizadas en los órganos diana
20 μg/dl precisan de la realización de un test de estimula- de las hormonas hipofisarias, con excepción del eje somato-
778 Medicine. 2012;11(13):773-81
HIPOPITUITARISMO. PANHIPOPITUITARISMO
tropo en que la hormona sustituida es la GH y en tratamien- En casos de cirugía o estrés mayor se debe emplear la vía
tos para inducir la ovulación, en los que se sustituye con go- parenteral, con una dosis inicial de carga de 100 mg de Acto-
nadotropinas. Cuando existen varios déficits hormonales es cortina®, y posteriormente 100 mg cada 6-8 horas.
fundamental el orden de reposición, teniendo que ser el eje La indicación de la sustitución de andrógenos adrenales
adrenal el primero que se sustituye, seguido del tiroideo y en mujeres con disfunción sexual no está del todo estableci-
finalmente gonadal y GH. La reposición con levotiroxina da, y su uso es poco frecuente. Se recomienda dehidroepian-
previa a la corticoidea puede desencadenar una crisis supra- drosterona (DHEA) en una dosis de 25-50 mg/día, en una
rrenal. forma única matinal por vía oral. Está pendiente de valorar
sus resultados a largo plazo. Por el contrario, la sustitución
mineralocorticoide no es necesaria, ya que la secreción de
Déficit de hormona del crecimiento aldosterona está regulada por el sistema renina-angiotensina.
Desde los años 80, disponemos de GH recombinante huma-
na para el tratamiento del déficit de GH. En los adultos, la Déficit de hormona tirotropa
dosis inicial es muy baja (0,1-0,3 mg/día) por vía subcutánea,
siendo la dosis mayor en pacientes jóvenes y en mujeres. El El tratamiento se realiza con levotiroxina, siendo la dosis
incremento de dosis se realiza en intervalos de 0,1 mg al día media necesaria de 1,4-1,6 μg/kg al día (entre 100 y 150 μg
cada 2-3 meses, hasta que los niveles de IGF-1 se encuentren al día), en una sola toma diaria, por la mañana. Por el contra-
en el rango superior de la normalidad. La dosis habitual de rio, en niños la dosis puede alcanzar los 4 μg/kg al día.
mantenimiento oscila entre 0,2 y 1 mg al día (0,5-3 UI/día). La dosis de inicio habitual es 50 μg/día, aunque en los
Los efectos adversos más frecuentes son la cefalea, artralgias, ancianos y pacientes con enfermedad cardiaca se recomienda
mialgias y retención hídrica, y responden a la reducción de comenzar con una dosis inferior (12,5 y 50 μg al día). Poste-
dosis. riormente, la monitorización del tratamiento se realiza me-
En los niños, la dosis necesaria es mayor, entre 0,025- diante la determinación de T4 libre, incrementando progre-
0,035 mg/kg al día, ajustándola posteriormente en función sivamente la dosis de levotiroxina cada 8 semanas, hasta
de los niveles de IGF-1. Los efectos adversos en los niños mantener el nivel de T4 libre en el punto medio del rango
aparecen con menos frecuencia que en los adultos. normal.
Nunca debe iniciarse el tratamiento con levotiroxina
hasta descartar la existencia de un déficit de ACTH, pues
Déficit de hormona corticotropa podría desencadenar una crisis suprarrenal.
Es el primer déficit que debe ser sustituido y ha de ser urgen-
te ante su sospecha, ya que puede comprometerse la vida del Déficit de hormona foliculoestimulante/
paciente. El glucocorticoide más utilizado es la hidrocortiso- hormona luteinizante
na (Hidroaltesona®, en comprimidos de 20 mg), que es un
preparado de vida media corta, que administrado en 2 o 3 Mujeres
dosis diarias permite imitar el ritmo circadiano del cortisol. En la inducción de la pubertad, el tratamiento suele iniciarse
Preparados de vida media más prolongada como la predniso- a los 11-12 años de edad. El tratamiento se realiza con estró-
na, prednisolona o dexametasona son utilizados con poca genos conjugados (dosis 0,15 mg al día), etinilestradiol (2,5-5
frecuencia. μg/día) o 17 beta estradiol (5 μg/día). La dosis debe ser in-
La dosis de hidrocortisona que se debe emplear en los crementada hasta la dosis utilizada en las mujeres adultas
adultos es de 15 a 25 mg al día por vía oral (5-10 mg/m2) y la cada 6-12 meses durante los 3 años siguientes (0,6-1,25 mg
pauta habitual es dos tercios de la dosis por la mañana y un de estrógenos conjugados, 10-20 μg/día de etinilestradiol o
tercio en la merienda. Otra pauta utilizada es administrar la 1-2 mg de 17 beta estradiol. Debe administrarse de forma
mitad de la dosis por la mañana, un cuarto a mediodía y un conjunta progestágenos de forma cíclica, los últimos 12 días
cuarto en la merienda. La monitorización del tratamiento se del ciclo para conseguir una hemorragia por deprivación y
realiza con datos clínicos y analíticos, ya que no existe nin- proteger frente al cáncer de endometrio.
gún marcador hormonal que nos permita evaluar si la dosis La sustitución en el hipogonadismo secundario en la mu-
es adecuada. Es fundamental tener en cuenta la posible inte- jer premenopáusica se realizará por combinados de estróge-
racción con otros fármacos (por ejemplo, fenitoína) que obli- nos y progestágenos. Los estrógenos por vía oral se han re-
gan al reajuste de la dosis. lacionado con un empeoramiento del perfil metabólico de la
En caso de estrés leve o moderado por proceso intercu- paciente, así como la composición corporal, por lo que son
rrente (fiebre, infecciones, cirugía menor, etc.) el paciente de preferencia los preparados transdérmicos. Además, los es-
debe doblar la dosis habitual, ya que sus requerimientos son trógenos por vía oral bloquean la síntesis hepática de IGF-1,
mayores, para lo que debe ser instruido. Cuando presente lo que puede contribuir a una menor masa magra, además de
vómitos o náuseas que impidan la toma del tratamiento vía ser un factor a tener en cuenta en las pacientes que reciban
oral, habrá que recurrir a la vía intramuscular o intravenosa tratamiento sustitutivo con GH recombinante. Cuando se
(Actocortina® 50-100 mg por vía parenteral y repetir a las utilice la vía oral, debe administrarse la dosis mínima de es-
8-12 horas en función de la evolución clínica). trógenos posible (20 o 30 μg).
Medicine. 2012;11(13):773-81 779
ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS
En las mujeres histerectomizadas, el tratamiento se reali- Bibliografía
zará con estrógenos para aliviar los síntomas del hipoestro-
genismo. Tras la menopausia existe controversia sobre la se- • Importante •• Muy importante
guridad cardiovascular y en cáncer de mama de los estrógenos
a largo plazo. ✔ Metaanálisis ✔ Artículo de revisión
Cuando se desea la inducción de la ovulación el trata- ✔ Ensayo clínico controlado ✔ Guía de práctica clínica
miento se realiza con gonadotropinas: FSH recombinante ✔ Epidemiología
(75-100 UI diarias) hasta que los folículos presenten un
tamaño de 16-18 mm. En ese momento, se administrará ✔1. Regal M, Paramo C, Sierra SM, García-Mayor RV. Prevalence and inci-
dence of hypopituitarism in an adult Caucasian population in northwes-
hCG (5.000 UI) para inducir la ovulación en 36 horas. La tern Spain. Clin Endocrinol (Oxf). 2001;55(6):735-40.
monitorización ecográfica es fundamental para el trata- ✔
2. Vance ML. Hypopituitarism. N Engl J Med. 1994;330(23):1651-62.
miento.
✔
3. Fatemi N, Dusick JR, Mattozo C, McArthur DL, Cohan P, Boscardin J,
et al. Pituitary hormonal loss and recovery after transsphenoidal adenoma
removal. Neurosurgery. 2008;63(4):709-18; discussion 18-9.
Varones ✔
4. Darzy KH, Pezzoli SS, Thorner MO, Shalet SM. Cranial irradiation and
growth hormone neurosecretory dysfunction: a critical appraisal. J Clin
En los varones, la sustitución se realiza con derivados de la Endocrinol Metab. 2007;92(5):1666-72.
testosterona. Los preparados utilizados hoy en día son de ✔
5. Leal-Cerro A, Flores JM, Rincon M, Murillo F, Pujol M, García-Pesque-
ra F, et al. Prevalence of hypopituitarism and growth hormone deficiency
administración parenteral o transdérmica. in adults long-term after severe traumatic brain injury. Clin Endocrinol
(Oxf). 2005;62(5):525-32.
En la vía transdérmica contamos con parches (presenta- ✔
6. Popovic V, Pekic S, Pavlovic D, Maric N, Jasovic-Gasic M, Djurovic B,
ciones de 5 y 10 mg) y geles transdérmicos (presentaciones et al. Hypopituitarism as a consequence of traumatic brain injury (TBI)
and its possible relation with cognitive disabilities and mental distress.
de 25 y 50 mg en geles de 5 g, en ambos tipos de aplicación J Endocrinol Invest. 2004;27(11):1048-54.
diaria). Dentro de los preparados para la administración pa- 7. •
✔ Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK,
Agha A. Hypothalamopituitary dysfunction following traumatic bra-
renteral disponemos de enantato y cipionato de testostorena in injury and aneurysmal subarachnoid hemorrhage: a systematic
(presentaciones de 100 y 250 mg) y de undecanato de testos- review. JAMA. 2007;298(12):1429-38.
terona (presentación de 1.000 mg), que es un preparado de ✔
8. Tanriverdi F, De Bellis A, Battaglia M, Bellastella G, Bizzarro A, Sinisi AA,
et al. Investigation of antihypothalamus and antipituitary antibodies in
vida media larga que proporciona niveles estables de testos- amateur boxers: is chronic repetitive head trauma-induced pituitary dys-
function associated with autoimmunity? Eur J Endocrinol. 2010;162(5):
terona a lo largo de 12 semanas. 861-7.
En los pacientes con hipogonadismo prepuberal la dosis ✔9. Caturegli P, Newschaffer C, Olivi A, Pomper MG, Burger PC, Rose NR.
Autoimmune hypophysitis. Endocr Rev. 2005;26(5):599-614.
de inicio de tratamiento es menor (25-50 mg cada 4 sema-
nas) por vía intramuscular, para luego incrementarla pro-
✔
10. Fernández-Rodríguez E, Quinteiro C, Barreiro J, Marazuela M, Pereiro
I, Peino R, et al. Pituitary stalk dysgenesis-induced hypopituitarism in
adult patients: prevalence, evolution of hormone dysfunction and genetic
gresivamente hasta la dosis de mantenimiento (cada 6-12 analysis. Neuroendocrinology. 2011;93(3):181-8.
meses). ✔
11. Rosen T, Eden S, Larson G, Wilhelmsen L, Bengtsson BA. Cardiovascu-
En los adultos, la dosis es de 250 mg cada 2-4 semanas, si lar risk factors in adult patients with growth hormone deficiency. Acta
Endocrinol (Copenh). 1993;129(3):195-200.
se utilizan preparados parenterales de esteres de testostero- ✔
12. Markussis V, Beshyah SA, Fisher C, Sharp P, Nicolaides AN, Johnston
na. Por vía transdérmica, la dosis es de 5-10 mg/día (parches) DG. Detection of premature atherosclerosis by high-resolution ultra-
sonography in symptom-free hypopituitary adults. Lancet. 1992;
o 50 mg/día (geles). El undecanato de testosterona es el pre- 340(8829):1188-92.
parado más utilizado en la actualidad, administrándose 1.000 ✔
13. Rosen T, Wiren L, Wilhelmsen L, Wiklund I, Bengtsson BA. Decreased
psychological well-being in adult patients with growth hormone deficien-
mg (1 ampolla) cada 12 semanas. El valor de la testosterona cy. Clin Endocrinol (Oxf). 1994;40(1):111-6.
permite la monitorización del tratamiento, precisando estar ✔
14. Rosen T, Bengtsson BA. Premature mortality due to cardiovascular disea-
se in hypopituitarism. Lancet. 1990;336(8710):285-8.
próxima a la mitad del rango normal. Debe realizarse de for-
ma rutinaria el examen de próstata, cada 6-12 meses y la de-
✔
15. Bates AS, Van’t Hoff W, Jones PJ, Clayton RN. The effect of hypopitui-
tarism on life expectancy. J Clin Endocrinol Metab. 1996;81(3):1169-72.
terminación del antígeno prostático específico (PSA) cada ✔
16. Bulow B, Hagmar L, Mikoczy Z, Nordstrom CH, Erfurth EM. Increased
cerebrovascular mortality in patients with hypopituitarism. Clin Endocri-
año. El tratamiento está contraindicado en pacientes con nol (Oxf). 1997;46(1):75-81.
cáncer de próstata o mama. ✔
17. Bates AS, Bullivant B, Sheppard MC, Stewart PM. Life expectancy fo-
llowing surgery for pituitary tumours. Clin Endocrinol (Oxf). 1999;
Cuando se desea inducción de fertilidad el tratamiento 50(3):315-9.
incluye el uso de gonadotropinas con actividad LH como ✔
18. Tomlinson JW, Holden N, Hills RK, Wheatley K, Clayton RN, Bates AS,
et al. Association between premature mortality and hypopituitarism. West
HCG (1.000-2.500 UI, 2-3 veces por semana), que mejora el Midlands Prospective Hypopituitary Study Group. Lancet; 357(9254):
contenido del esperma en la mayoría de los pacientes, aun- 425-31.
que no llega a normalizarlo. En los casos en que la respuesta ✔
19. Dekkers OM, Biermasz NR, Pereira AM, Romijn JA, Vandenbroucke JP.
Mortality in acromegaly: a metaanalysis. J Clin Endocrinol Metab.
no es adecuada tras 12 semanas de tratamiento, debe añadir- 2008;93(1):61-7.
se FSH recombinante (75-100 UI 3 veces por semana). En el ✔
20. Dekkers OM, Biermasz NR, Pereira AM, Roelfsema F, van Aken MO,
Voormolen JH, et al. Mortality in patients treated for Cushing’s disease is
90% de los casos consiguen restaurar la espermatogénesis increased, compared with patients treated for nonfunctioning pituitary
macroadenoma. J Clin Endocrinol Metab. 2007;92(3):976-81.
tras 6-9 meses de tratamiento. La administración de pulsos
de GnRH no presenta ventajas frente al empleo de gonado-
✔
21. Bulow B, Attewell R, Hagmar L, Malmstrom P, Nordstrom CH, Erfurth
EM. Postoperative prognosis in craniopharyngioma with respect to car-
diovascular mortality, survival, and tumor recurrence. J Clin Endocrinol
tropinas y su coste económico es mayor. Metab. 1998;83(11):3897-904.
✔
22. Sesmilo G, Biller BM, Llevadot J, Hayden D, Hanson G, Rifai N, et al.
Effects of growth hormone administration on inflammatory and other car-
diovascular risk markers in men with growth hormone deficiency. A rando-
Conflicto de intereses mized, controlled clinical trial. Ann Intern Med. 2000;133(2):111-22.
✔
23. Serri O, St-Jacques P, Sartippour M, Renier G. Alterations of monocyte
function in patients with growth hormone (GH) deficiency: effect of
Los autores declaran no tener ningún conflicto de intereses. substitutive GH therapy. J Clin Endocrinol Metab. 1999;84(1):58-63.
780 Medicine. 2012;11(13):773-81
HIPOPITUITARISMO. PANHIPOPITUITARISMO
24. • Maison P, Griffin S, Nicoue-Beglah M, Haddad N, Balkau B,
✔ ✔
29. Gómez JM, Espadero RM, Escobar-Jiménez F, Hawkins F, Pico A, Herre-
Chanson P. Impact of growth hormone (GH) treatment on cardio- ra-Pombo JL, et al. Growth hormone release after glucagon as a reliable
vascular risk factors in GH-deficient adults: a metaanalysis of blin- test of growth hormone assessment in adults. Clin Endocrinol (Oxf).
ded, randomized, placebo-controlled trials. J Clin Endocrinol Me- 2002;56(3):329-34.
tab. 2004;89(5):2192-9. ✔
30. Qu XD, Gaw Gonzalo IT, Al Sayed MY, Cohan P, Christenson PD, Swer-
✔
25. Borson-Chazot F, Serusclat A, Kalfallah Y, Ducottet X, Sassolas G, Ber-
nard S, et al. Decrease in carotid intima-media thickness after one year
dloff RS, et al. Influence of body mass index and gender on growth hor-
mone (GH) responses to GH-releasing hormone plus arginine and insu-
growth hormone (GH) treatment in adults with GH deficiency. J Clin lin tolerance tests. J Clin Endocrinol Metab. 2005;90(3):1563-9.
Endocrinol Metab. 1999;84(4):1329-33. ✔
31. Hartman ML, Crowe BJ, Biller BM, Ho KK, Clemmons DR, Chipman
✔
26. Filipsson H, Monson JP, Koltowska-Haggstrom M, Mattsson A, Johanns-
son G. The impact of glucocorticoid replacement regimens on metabolic
JJ. Which patients do not require a GH stimulation test for the diagnosis
of adult GH deficiency? J Clin Endocrinol Metab. 2002;87(2):477-85.
outcome and comorbidity in hypopituitary patients. J Clin Endocrinol
Metab. 2006;91(10):3954-61.
✔
32. Endert E, Ouwehand A, Fliers E, Prummel MF, Wiersinga WM. Establis-
hment of reference values for endocrine tests. Part IV: Adrenal insuffi-
27. •
✔ Ho KK. Consensus guidelines for the diagnosis and treatment of ciency. Neth J Med. 2005;63(11):435-43.
adults with GH deficiency II: a statement of the GH Research So-
ciety in association with the European Society for Pediatric Endo-
✔
33. Ferretti E, Persani L, Jaffrain-Rea ML, Giambona S, Tamburrano G,
Beck-Peccoz P. Evaluation of the adequacy of levothyroxine replacement
crinology, Lawson Wilkins Society, European Society of Endocrino- therapy in patients with central hypothyroidism. J Clin Endocrinol Me-
logy, Japan Endocrine Society, and Endocrine Society of Australia. tab. 1999;84(3):924-9.
28. •
Eur J Endocrinol. 2007;157(6):695-700. ✔
34.
35. •
Ascoli P, Cavagnini F. Hypopituitarism. Pituitary. 2006;9(4):335-42.
✔ Popovic V, Leal A, Micic D, Koppeschaar HP, Torres E, Paramo C, et
al. GH-releasing hormone and GH-releasing peptide-6 for diagnostic
✔ Schneider HJ, Aimaretti G, Kreitschmann-Andermahr I,
Stalla GK, Ghigo E. Hypopituitarism. Lancet. 2007;369(9571):
testing in GH-deficient adults. Lancet. 2000;356(9236):1137-42. 1461-70.
Medicine. 2012;11(13):773-81 781
Potrebbero piacerti anche
- Hipopituitarismo PDFDocumento8 pagineHipopituitarismo PDFtonyx100% (1)
- Hipopituitarismo. PanhipopituitarismoDocumento9 pagineHipopituitarismo. PanhipopituitarismoAndrés SeguraNessuna valutazione finora
- L6 HipopituitarismoDocumento10 pagineL6 HipopituitarismoLópez Hernández Ana Lizbeth 1101Nessuna valutazione finora
- AmenorreaDocumento19 pagineAmenorreaMildred AguilarNessuna valutazione finora
- Clase 03 H-H 2017Documento74 pagineClase 03 H-H 2017Antonio SaavedraNessuna valutazione finora
- SX Endocrinos Argente PDFDocumento65 pagineSX Endocrinos Argente PDFnatasinfresasNessuna valutazione finora
- PANHIPOPITUITARISMODocumento5 paginePANHIPOPITUITARISMOCristhian Arroyo PinedoNessuna valutazione finora
- HipopituitarismoDocumento18 pagineHipopituitarismoladyhomy91Nessuna valutazione finora
- Hipopituitarismo 2022Documento53 pagineHipopituitarismo 2022Fernando MartinezNessuna valutazione finora
- Trastornos Hipofisiarios (Loreanna Prada)Documento9 pagineTrastornos Hipofisiarios (Loreanna Prada)Victor MonsalveNessuna valutazione finora
- Patología HipofisariaDocumento9 paginePatología HipofisariaAmira CZNessuna valutazione finora
- HIPOFISISDocumento4 pagineHIPOFISISDayana CoronelNessuna valutazione finora
- 10.1016@s0211 34490470111 3Documento9 pagine10.1016@s0211 34490470111 3adjma2002Nessuna valutazione finora
- Insuficiencia PituitariaDocumento32 pagineInsuficiencia Pituitariapersy dafneNessuna valutazione finora
- E-3 Hipofuncion Hipofisiaria. Dr. HerreraDocumento7 pagineE-3 Hipofuncion Hipofisiaria. Dr. HerreraJacqueline Mena RamosNessuna valutazione finora
- Lesión Terciaria: Blanco, DianaDocumento51 pagineLesión Terciaria: Blanco, DianaAlejandro QuisiverdeNessuna valutazione finora
- 9 HipopituitarismoDocumento7 pagine9 HipopituitarismoMelanie MarquezNessuna valutazione finora
- Patologia Endocrinologica I y IiDocumento12 paginePatologia Endocrinologica I y IiKarly SortoNessuna valutazione finora
- Alteraciones de Las Glándulas Endocrinas y TrastornosDocumento7 pagineAlteraciones de Las Glándulas Endocrinas y TrastornosKILAMAZUKENessuna valutazione finora
- Trastornos de Hipotalamo-HipofisisDocumento95 pagineTrastornos de Hipotalamo-HipofisisYasmina FloresNessuna valutazione finora
- 3 y 4 Enf Por Hipofunción Adenohipofisaria Tumores HipotalamohipofisarioDocumento11 pagine3 y 4 Enf Por Hipofunción Adenohipofisaria Tumores Hipotalamohipofisarioadriana cabero schulzeNessuna valutazione finora
- Patologia Del Sistema EndocrinoDocumento10 paginePatologia Del Sistema EndocrinoSALERY ANGIE SERNAQUE TORRESNessuna valutazione finora
- EndocrinoDocumento12 pagineEndocrinoLara RuizNessuna valutazione finora
- Patología EndócrinaDocumento24 paginePatología EndócrinamarianoprofessiNessuna valutazione finora
- 020 - Hipofunción HipofisiariaDocumento18 pagine020 - Hipofunción HipofisiariaJonathan Lara ArroyoNessuna valutazione finora
- Enfermedades Hipotalámicas e HipofisiariasDocumento26 pagineEnfermedades Hipotalámicas e HipofisiariasJhotavar TaboadaNessuna valutazione finora
- HipopituitarismoDocumento10 pagineHipopituitarismoGerlucmar Costero de PulgarNessuna valutazione finora
- Universidad La Salle. Facultad Mexicana de Medicina.Documento6 pagineUniversidad La Salle. Facultad Mexicana de Medicina.frik0mx100% (1)
- Resumen Semana 10 EndocrinoDocumento21 pagineResumen Semana 10 EndocrinoNAYELI NICOLE VENTURA LA TORRENessuna valutazione finora
- PanhipopituitarismoDocumento5 paginePanhipopituitarismoLuis F. SalazarNessuna valutazione finora
- Hipopituitarismo MedcapeDocumento5 pagineHipopituitarismo MedcapeAída CamperoNessuna valutazione finora
- PANHIPOPITUITARISMODocumento15 paginePANHIPOPITUITARISMOmanuel50% (2)
- Apopleia 3Documento6 pagineApopleia 3JuanJoséPaúlCuroCadenaNessuna valutazione finora
- Patologia Del HipotalamoDocumento10 paginePatologia Del HipotalamoPaola Del BarrioNessuna valutazione finora
- Anatomia Patologica EndocrinoDocumento35 pagineAnatomia Patologica EndocrinoVICTORIA100% (1)
- Trastornos HipofisariosDocumento30 pagineTrastornos HipofisariosMayory QuinteroNessuna valutazione finora
- Trastornos de La Glándula HipofisiariaDocumento12 pagineTrastornos de La Glándula Hipofisiarialuz mayra ticona ccoriNessuna valutazione finora
- Patología hipofisiaria y tiroideaDocumento41 paginePatología hipofisiaria y tiroideaMaria Yuliana Avendaño ArenasNessuna valutazione finora
- HipopituitarismoDocumento4 pagineHipopituitarismoSol CisnerosNessuna valutazione finora
- Panhipopituitarismo 140904103406 Phpapp02Documento4 paginePanhipopituitarismo 140904103406 Phpapp02Yovana Arce MontañoNessuna valutazione finora
- HIPOFISISDocumento39 pagineHIPOFISISjoha1710Nessuna valutazione finora
- Trastornos HipofisariosDocumento30 pagineTrastornos HipofisariosMayory QuinteroNessuna valutazione finora
- Tumores Hipotálamo-HipofisariosDocumento6 pagineTumores Hipotálamo-HipofisariosBryan LeonNessuna valutazione finora
- Adenomas Hipofisarios FuncionantesDocumento12 pagineAdenomas Hipofisarios FuncionantesCARLOS DANIEL GALLO VELASCONessuna valutazione finora
- Alteraciones de La AdenohipofisisDocumento30 pagineAlteraciones de La AdenohipofisisjaslosroblesNessuna valutazione finora
- Síndromes hipotalámicos: etiopatogenia y manifestacionesDocumento7 pagineSíndromes hipotalámicos: etiopatogenia y manifestacionesDaniel Alfonso Saenz GomezNessuna valutazione finora
- Adenoma de HipofisisDocumento5 pagineAdenoma de HipofisisCamilo GuerreroNessuna valutazione finora
- Endocrinología esencialDocumento206 pagineEndocrinología esencialWendy CastroNessuna valutazione finora
- 10b2550b-579a-45cb-9b79-80d1c2ef4cb6Documento80 pagine10b2550b-579a-45cb-9b79-80d1c2ef4cb6Silvana SthepanieNessuna valutazione finora
- Hipopituitarismo ADocumento49 pagineHipopituitarismo ANicol JeanNessuna valutazione finora
- RFCMVol14 1 2017 7 - 2Documento7 pagineRFCMVol14 1 2017 7 - 2Distel MoscosoNessuna valutazione finora
- GUIA ENDOCRINO HIPOTALAMO-HIPOFISISDocumento8 pagineGUIA ENDOCRINO HIPOTALAMO-HIPOFISISlucioaletseNessuna valutazione finora
- Enfermedades HipofisariasDocumento38 pagineEnfermedades HipofisariasdannykelsoNessuna valutazione finora
- Fisiopatologia Del Sistema EndocrinoDocumento45 pagineFisiopatologia Del Sistema Endocrinoelias vasquezNessuna valutazione finora
- Hipofisis alteracionesDocumento114 pagineHipofisis alteracionesPatrick Corcino RetizNessuna valutazione finora
- Fisiopatologia Enfermedades Hipofisiarias PDFDocumento68 pagineFisiopatologia Enfermedades Hipofisiarias PDFKenner Poult Santisteban MuñozNessuna valutazione finora
- Sistema endocrino: hipófisis y adenomas hipofisariosDocumento22 pagineSistema endocrino: hipófisis y adenomas hipofisariosAlejandra Aristizábal100% (1)
- Bases Anatomopatológicas De La Enfermedad Quirúrgica: Tomo IDa EverandBases Anatomopatológicas De La Enfermedad Quirúrgica: Tomo INessuna valutazione finora
- Hiperplasia Suprarrenal Congenita: Una Guia Para Los PadresDa EverandHiperplasia Suprarrenal Congenita: Una Guia Para Los PadresValutazione: 5 su 5 stelle5/5 (1)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDa EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónValutazione: 3.5 su 5 stelle3.5/5 (2)
- Mesonero 2016Documento10 pagineMesonero 2016Gerardo N. Pabón GallinoNessuna valutazione finora
- SHOCKDocumento19 pagineSHOCKGerardo Pabón GallinoNessuna valutazione finora
- Varón de 72 Años de Edad Que Acude Al Servicio de Urgencias Por Un Aumento de La Disfagia, Secuela de Un Ictus AntiguoDocumento3 pagineVarón de 72 Años de Edad Que Acude Al Servicio de Urgencias Por Un Aumento de La Disfagia, Secuela de Un Ictus AntiguoGerardo N. Pabón GallinoNessuna valutazione finora
- AguaDocumento2 pagineAguaGerardo N. Pabón GallinoNessuna valutazione finora
- Inmunologia PDFDocumento49 pagineInmunologia PDFGerardo N. Pabón GallinoNessuna valutazione finora
- Guia de Endocarditis de La Sociedad Española de Cardiologia 2015Documento49 pagineGuia de Endocarditis de La Sociedad Española de Cardiologia 2015KiaHidalgoOcandoNessuna valutazione finora
- And Jar 2012Documento6 pagineAnd Jar 2012Fernando FariasNessuna valutazione finora
- 08 EstreñimientoDocumento24 pagine08 EstreñimientoFernando XavierNessuna valutazione finora
- Alteraciones Del Metabolismo FosfocálcicoDocumento9 pagineAlteraciones Del Metabolismo FosfocálcicoGerardo N. Pabón GallinoNessuna valutazione finora
- S0300289613001178 S300 EsDocumento14 pagineS0300289613001178 S300 EsRichard Armijo GarridoNessuna valutazione finora
- SINCOPE Sociedad Española de CardiologiaDocumento11 pagineSINCOPE Sociedad Española de CardiologiaCamilo VidalNessuna valutazione finora
- Cáncer ColorrectalDocumento6 pagineCáncer ColorrectalGerardo N. Pabón GallinoNessuna valutazione finora
- Spanish Turner SyndromeDocumento44 pagineSpanish Turner SyndromeanesmeNessuna valutazione finora
- Manifestaciones Cardíacas de La Hipertensión PDFDocumento6 pagineManifestaciones Cardíacas de La Hipertensión PDFGerardo N. Pabón GallinoNessuna valutazione finora
- Fisiología de La HemostasiaDocumento17 pagineFisiología de La HemostasiaIrene Cristina100% (7)
- Material de Sutura en La Farmacia HospitalariaDocumento12 pagineMaterial de Sutura en La Farmacia HospitalariaAlejandra TorresNessuna valutazione finora
- Manual - Laboratorio de Microbiologia de Suceptibilidad A Los Nos y de BacteriasdDocumento410 pagineManual - Laboratorio de Microbiologia de Suceptibilidad A Los Nos y de Bacteriasdquimico clinico 2795% (39)
- Toxicologia Forense Sub-4Documento97 pagineToxicologia Forense Sub-4Gerardo N. Pabón GallinoNessuna valutazione finora
- Syllabus InmunologíaDocumento3 pagineSyllabus InmunologíaGerardo N. Pabón GallinoNessuna valutazione finora
- Clase 11 Lobomicosis y Rinosporidiosis Prothotecosis y Entomoftoromicosis 2016Documento85 pagineClase 11 Lobomicosis y Rinosporidiosis Prothotecosis y Entomoftoromicosis 2016Gerardo N. Pabón Gallino100% (1)
- Guia Actuacion Complicaciones DiabetesDocumento22 pagineGuia Actuacion Complicaciones DiabetesGerardo N. Pabón GallinoNessuna valutazione finora
- Lepra CLASEDocumento50 pagineLepra CLASEGerardo N. Pabón GallinoNessuna valutazione finora
- Anatomia Relaciones Del PáncreasDocumento6 pagineAnatomia Relaciones Del PáncreasGerardo N. Pabón GallinoNessuna valutazione finora
- Syllabus Bioquimica I y IIDocumento36 pagineSyllabus Bioquimica I y IIGerardo N. Pabón GallinoNessuna valutazione finora
- Anatomia FinalDocumento26 pagineAnatomia FinalRoimaMujicaNessuna valutazione finora
- Filosofia QuirurgicaDocumento271 pagineFilosofia QuirurgicaKelys R. PadillaNessuna valutazione finora
- Normas Harvard - APA EjemplosDocumento61 pagineNormas Harvard - APA EjemplosGerardo N. Pabón GallinoNessuna valutazione finora
- Literatura Del Ecuador 400 AnosDocumento336 pagineLiteratura Del Ecuador 400 AnosGerardo N. Pabón Gallino100% (1)
- La Crítica Catártica en "El Perseguidor" de Julio CortázarDocumento8 pagineLa Crítica Catártica en "El Perseguidor" de Julio Cortázarjaimevill100% (1)
- Documental Las 5 Leyes BiológicasDocumento3 pagineDocumental Las 5 Leyes BiológicaschusjuNessuna valutazione finora
- Micosis y alteraciones de las uñasDocumento3 pagineMicosis y alteraciones de las uñasInterClick100% (1)
- Solicitud de seguros de personasDocumento6 pagineSolicitud de seguros de personasfibanez69Nessuna valutazione finora
- BQ Ii Resumen Metabolismo de Lipidos y ProteinasDocumento29 pagineBQ Ii Resumen Metabolismo de Lipidos y ProteinasQUIMICO CLINICO WILLIANS SANCHEZ100% (4)
- BeneficiosUchuvaDocumento6 pagineBeneficiosUchuvawilser sanchezNessuna valutazione finora
- ExodonciaDocumento27 pagineExodonciaSandy Bojalil100% (1)
- Gota y PseudogotaDocumento20 pagineGota y PseudogotaArthur Gam CaNessuna valutazione finora
- Garcia Martinez Martha PDFDocumento1 paginaGarcia Martinez Martha PDFErick SalasNessuna valutazione finora
- 1.tolerancia InmunologicaDocumento6 pagine1.tolerancia InmunologicaOtto Junior Rodriguez LopezNessuna valutazione finora
- Cirugía UnguealDocumento14 pagineCirugía UnguealÓscar Reza Auhing100% (1)
- Examen Parcial - 2021-1Documento7 pagineExamen Parcial - 2021-1Clementina Lozano ArceNessuna valutazione finora
- Patologías Digestivas 2 ListoDocumento57 paginePatologías Digestivas 2 ListoBastian GonzalezNessuna valutazione finora
- La Condicion Fisica Es Un Componente Import Ante de La Salud para Los Adultos de Hoy y Del MañanaDocumento7 pagineLa Condicion Fisica Es Un Componente Import Ante de La Salud para Los Adultos de Hoy y Del Mañanasanhueza889133100% (1)
- Tumor - Wikipedia, La Enciclopedia LibreDocumento4 pagineTumor - Wikipedia, La Enciclopedia LibreMiguel ContrerasNessuna valutazione finora
- Seminario Mama Modificado PDFDocumento33 pagineSeminario Mama Modificado PDFFelix Ferrer100% (1)
- Informe de La I Rotación Clinica Cientifica Del SurDocumento16 pagineInforme de La I Rotación Clinica Cientifica Del SurLilivet Leslie Ciquero BanateNessuna valutazione finora
- Bioestadistica - Informe GRUPALDocumento12 pagineBioestadistica - Informe GRUPALVictoriaJamancaAstoNessuna valutazione finora
- Colangiocarcinoma (Autoguardado)Documento70 pagineColangiocarcinoma (Autoguardado)silviahuesosNessuna valutazione finora
- Instrumental QuirurgicoDocumento6 pagineInstrumental Quirurgicoss501100% (1)
- Oligopoliposis intestinales: guía de diagnóstico y manejoDocumento17 pagineOligopoliposis intestinales: guía de diagnóstico y manejoAlberto SilvaNessuna valutazione finora
- Manual de Quimioterapia Del CáncerDocumento994 pagineManual de Quimioterapia Del CáncerEduard RomeroNessuna valutazione finora
- Masas PelvicasDocumento28 pagineMasas PelvicasAady Meli FernándezNessuna valutazione finora
- Cáncer de Mama InvestigaciónDocumento2 pagineCáncer de Mama Investigaciónjose alberto montasNessuna valutazione finora
- La CarrageninaDocumento2 pagineLa CarrageninaGianpierre de la CruzNessuna valutazione finora
- Manual Prevencion PDFDocumento267 pagineManual Prevencion PDFInternado 55Nessuna valutazione finora
- Cervical Cancer DYNAMEDDocumento153 pagineCervical Cancer DYNAMEDMedipackNessuna valutazione finora
- CaraDocumento22 pagineCaraMarianella Saravia LopezNessuna valutazione finora
- Título: Ficha de Identificación de Estudio de Caso Clínico Nombres y Apellidos Código de EstudiantesDocumento17 pagineTítulo: Ficha de Identificación de Estudio de Caso Clínico Nombres y Apellidos Código de EstudiantesAlex SerrudoNessuna valutazione finora
- Casos Cancer InfantilDocumento15 pagineCasos Cancer InfantilMarisol Jurado VascoNessuna valutazione finora
- Cancer LaboralDocumento18 pagineCancer LaboralRoberto Emmanuel Ibarra DominguezNessuna valutazione finora