Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Pracica 2 QA3
Caricato da
Areli CervantesTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Pracica 2 QA3
Caricato da
Areli CervantesCopyright:
Formati disponibili
Punto1
La reacción llevada a cabo fue la siguiente:
La reacción entre el bismuto y la tiourea en medio nítrico diluido
𝐵𝑖 3+ + 6(𝐻2 𝑁𝐶𝑆𝑁𝐻2 ) → 𝐵𝑖(𝑇𝑖𝑜)3+
6
Entre ambas especies se forma un complejo de color amarillo. Por si solo el Bismuto
no presenta ninguna coloración, volviéndolo no apto para ser cuantificado por
espectrofotometría UV-visible.
Es por esta razón que el complejo se utiliza en una cuantificación por método
indirecto; es decir, el analito (Bismuto) de interés no se cuantifica de forma directa,
sino acompañado de un cromóforo (reactivo cromogénico que forma complejo con
coloración) que absorba, en este caso la tiourea.
Punto 2
Long onda Absorbancia
(nm)
350 0.76447155
360 0.70774393
370 0.64589156 Espectro de absorción de Bi-Tio
380 0.60205999
0.9
390 0.537602 0.8
400 0.50307035 0.7
410 0.4609239 0.6
420 0.4225082 0.5
Absorbancia
430 0.3705904 0.4
440 0.31695296 0.3
450 0.25806092 0.2
460 0.20901152 0.1
470 0.1511953 0
480 0.10347378 320 370 420 470 520
490 0.06048075 longitud de onda (nm)
500 0.0259491
510 0.01412464
520 0.00612309
Curva de calibracion de patron externo
Punto 3
0.9
Sistema C (M) A y = 6904x + 0.0384
0.8
1 2.18E-05 0.1857524 R² = 0.9971
0.7
2 4.36E-05 0.35457773 0.6
Absorbancia
3 6.53E-05 0.47886192 0.5
0.4
4 8.71E-05 0.627088
0.3
5 1.09E-04 0.80134291 0.2
Muestra problema 0.69464863 0.1
0
0.00E+00 2.00E-05 4.00E-05 6.00E-05 8.00E-05 1.00E-04 1.20E-04
C (M)
Contenido de subsalicilato
Curva de calibracion por Adi. Patron
Punto 4
1.2
y = 5754x + 0.438
Sistema C (M) A
1 R² = 0.9905
0 0 0.446116973
0.8
1 2.18E-05 0.528708289
2 4.36E-05 0.716698771 0.6
A
3 6.53E-05 0.829738285 0.4
4 8.71E-05 0.920818754
0.2
5 1.09E-04 1.065501549
0
0 0.00002 0.00004 0.00006 0.00008 0.0001 0.00012
C (M)
Contenido de subsalicilato
Después, realizando una regresión lineal obtenemos los valores de ẋ, la cual
gráficamente, representa la concentración del bismuto.
[𝑋]𝑝𝑟𝑜𝑏 = ẋ = 7.6113x10−5 𝑀 𝑑𝑒 𝐵𝑖
Método de sustitución de la ecuación de Lambert-Beer.
Por la ecuación de Lambert-Beer sabemos que la Absorbancia total es igual a:
𝐴𝑇 = 𝜀ℓ[𝑋]𝑝𝑟𝑜𝑏 + 𝜀ℓ[𝑋]𝑆𝑡𝑑
Donde:
AT = Absorbancia total
ԑ = Coeficiente de absortividad [M-1 cm-1]
ℓ = Longitud de la celda [cm]
[X]prob: Concentración de la solución problema [M]
[X]Std : Concentración de la solución estándar [M]
De la regresión lineal de la gráfica se obtiene la siguiente ecuación:
𝑦 = 5354𝑥 + 0.438
Donde:
Pendiente (m)= 5354
Ordenada al origen (b) = 0.438
Ahora suponiendo que:
𝑏 = 𝜀ℓ[𝑋]𝑝𝑟𝑜𝑏 𝑦 𝑚 = 𝜀ℓ
Sustituyendo e igualando a cero:
0.438 + 5354[𝑋]𝑝𝑟𝑜𝑏 = 0
Despejando [X]prob:
0.438
[𝑋]𝑝𝑟𝑜𝑏 = = 7.6113𝑥10−5 𝑀 𝑑𝑒 𝐵𝑖
5354
Contenido de subsalicilato de Bismuto por cada tableta.
De la gráfica
b = 0.438
m = 5354
R2= 0.9905
Cantidad de principio activo
𝑝𝑜𝑟 𝑡𝑎𝑏𝑙𝑒𝑡𝑎 = 1.005 𝑔 → 262 𝑚𝑔 subsalicilato de Bismuto
Peso de la muestra= 0.16777 g a un aforo de 100ml
0.438
[𝑋]𝑝𝑟𝑜𝑏 = = 7.6113𝑥10−5 𝑀 𝑑𝑒 𝐵𝑖
5354
¿ ? 𝑚𝑙
7.6113𝑥10−5 𝑀 𝑑𝑒 𝐵𝑖 ∗ ( ) = 𝑋 𝑀 𝑑𝑒 𝐵𝑖
¿ ? 𝑚𝑙
𝑋 𝑀(0.1𝐿) =¿ ? 𝑚𝑔 𝐵𝑖
Relación para cantidad de bismuto en la tableta:
0.1709 𝑔 →¿ ? 𝑚𝑔
0.099𝑔 ↗ 𝑋
X= mg de bismuto
1𝑚𝑚𝑜𝑙 𝐵𝑖 1 𝑚𝑚𝑜𝑙 𝐶7 𝐻5 𝐵𝑖𝑂4 362.09 𝑚𝑔𝐶7 𝐻5 𝐵𝑖𝑂4
𝑋 𝑚𝑔 𝐵𝑖𝑠𝑚𝑢𝑡𝑜 ∗ ( )∗( )∗( )
208.98 𝑚𝑔 𝐵𝑖 1𝑚𝑚𝑜𝑙 𝐵𝑖 1 𝑚𝑚𝑜𝑙 𝐶7 𝐻5 𝐵𝑖𝑂4
Miligramos experimentales mg por tableta de subsalicilato de Bismuto
Porcentaje de error:
𝑚𝑔𝑡 − 𝑚𝑔𝑒
%= ∗ 100 = %
𝑚𝑔𝑡
Punto 6
En el método por curva de calibración se van a determinar propiedades que van a
ser importantes para valorar la calidad de un método. Sus principales ventajas son
que Si se obtiene una gráfica no lineal, como ocurre con frecuencia, puede usarse
equipo electrónico o programas computacionales para compensar la curvatura y
producir una salida que sea una función lineal de la concentración. En regiones no
lineales, el número de soluciones estándares analizadas debe aumentarse para
obtener la exactitud del análisis de las muestras problema.
En algunos análisis también puede alcanzarse la linealidad variando parámetros
instrumentales. En el análisis espectrofotométrico, cambiar la longitud de onda
utilizada para obtener las lecturas de absorción puede producir una gráfica de
trabajo más lineal.
Cuando es imposible suprimir interferencias físicas o químicas en la matriz de la
muestra puede usarse el método de adiciones patrón. Las lecturas pueden ser
corregidas para cualquier señal de fondo. El método de adiciones estándares es
ampliamente utilizado en la química electroanalítica, para obtener resultados más
exactos que los que resultan usando curvas de calibración. Los resultados de las
adiciones patrón también proporcionan un medio sistemático de identificar fuentes
de error en los análisis, tales como la depleción o degradación de los reactivos de
prueba, un instrumento defectuoso o soluciones estándares inexactas.
Punto 7
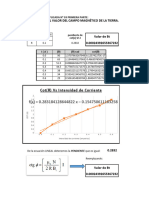
Coeficiente de absortividad
Dato reportado Curva de calibración Curva de adiciones patrón
9320 𝑴𝒄𝒎−𝟏 7308.01 𝑀𝑐𝑚−1 x 𝑀𝑐𝑚−1
En un gráfico de absorbancia frente a la longitud de onda, la absortividad molar es
independiente de la concentración y es característica de cada molécula, este valor
se determina para identificar fácilmente a un compuesto o confirmar su identidad,
es decir, esta constante muestra la fracción de la radiación electromagnética
incidente que un material absorbe dentro de un rango de frecuencias.
A partir de los datos obtenidos de la curva de calibración y la curva de adiciones
patrón estos coeficientes son totalmente diferentes, teniendo una diferencia entre
ellos de un valor |𝑥𝑀𝑐𝑚−1 | lo cual nos indica una diferencia muy grande, sin
embargo, el valor reportado en la literatura es de 9320 𝑀𝑐𝑚−1 y ambos valores
(curva de calibración y curva de adiciones patrón) se alejan significativamente , por
lo tanto el valor más aceptable es el más cercano, entonces el dato que más se
acerca es el obtenido de la curva de calibración..
Memoria de calculo
Preparación de solución Stock Bismuto
Se pesaron X g de Bi(NO3)5H2O y se disolvió con HNO3 (1 M). Posteriormente se afora a 200 mL.
Preparación de Tiourea
Se pesaron 3.0676 g de tiourea al 3% de P/V en 100 mL. Posteriormente se lleva a calentamiento
y agitación con HNO3 (1 M) durante 15 min
Preparación de HNO3
En una probeta se midieron X mL y se llevó al aforo con agua destilada para tener una
concentración de 1M en 1L.
Preparación de solución Stock Bismuto
Teórico:
𝑀𝑅𝐴 =
Real:
𝐶=
Preparación de HNO3
Preparación de solución problema
(𝐶)(362.093)(100)
0.16777 𝑔 = ∴ 𝐶 = 4,6314𝑥10−3
(100)(10)
Potrebbero piacerti anche
- Práctica 1. Determinación de Azul de Timol Por Espectrofotometría VisibleDocumento5 paginePráctica 1. Determinación de Azul de Timol Por Espectrofotometría VisibleVíctor GómezNessuna valutazione finora
- Práctica 2 de CinéticaDocumento6 paginePráctica 2 de CinéticaCarolina Caballero MedinaNessuna valutazione finora
- Quiz CurvaDocumento4 pagineQuiz CurvaKAREN TATIANA RICO CARABALINessuna valutazione finora
- Practica 3eq5Documento5 paginePractica 3eq5Jaime Velazquez EsquivelNessuna valutazione finora
- Problemas de Curva de Calibracion y Adicion EstandarDocumento16 pagineProblemas de Curva de Calibracion y Adicion EstandarLeo0% (1)
- TPN2 - Inhibición Enzimática - Catálisis Ácido Base - Delfina ComelattoDocumento12 pagineTPN2 - Inhibición Enzimática - Catálisis Ácido Base - Delfina ComelattoAdriana Guajardo RugosoNessuna valutazione finora
- Lab 03 Resolución - Bejarano Montes Marcelo AdrianhDocumento2 pagineLab 03 Resolución - Bejarano Montes Marcelo AdrianhMarselo BejaranoNessuna valutazione finora
- Resultados FiltraciónDocumento9 pagineResultados FiltraciónLeydi Patricia CuevaNessuna valutazione finora
- Ejercicio BM Petróleo SubsaturadoDocumento11 pagineEjercicio BM Petróleo SubsaturadoCleverNessuna valutazione finora
- Ejercicios LaboratorioDocumento11 pagineEjercicios LaboratorioJuan DiegoNessuna valutazione finora
- Universidad Nacional de IngenieríaDocumento9 pagineUniversidad Nacional de IngenieríaGabriel Caceres ArauzNessuna valutazione finora
- Informe 3. AnaliticaDocumento11 pagineInforme 3. AnaliticaBrenda KarenNessuna valutazione finora
- P9 Cinética de CrecimientoDocumento9 pagineP9 Cinética de Crecimientogenet2015Nessuna valutazione finora
- Formato Informe de Laboratorio BQDDocumento68 pagineFormato Informe de Laboratorio BQDCarlos CastilloNessuna valutazione finora
- Practica 2. Subsalicilato de BismutoDocumento9 paginePractica 2. Subsalicilato de BismutoHumberto SánchezNessuna valutazione finora
- Cinética de Permanganato de Potasio + Oxalato de Sodio + Ácido SulfúricoDocumento5 pagineCinética de Permanganato de Potasio + Oxalato de Sodio + Ácido SulfúricoCarlosE.QuezadaLambertinNessuna valutazione finora
- Clase 1Documento7 pagineClase 1Litzy CondoriNessuna valutazione finora
- Distribuciones Con VADocumento14 pagineDistribuciones Con VAJavier Ali Diaz S.Nessuna valutazione finora
- Energia EnzimaticaDocumento8 pagineEnergia EnzimaticaJuan Sebastian OrozcoNessuna valutazione finora
- Concentración de Glucosa Absorbancia (MM) (NM) : F (X) 0.0701428571428571 X + 0.00828571428571423 R 0.999638426625069Documento12 pagineConcentración de Glucosa Absorbancia (MM) (NM) : F (X) 0.0701428571428571 X + 0.00828571428571423 R 0.999638426625069Vannesa HernadezNessuna valutazione finora
- Ejercicio 2 Colaborativo Fase 4 Deisy VargasDocumento5 pagineEjercicio 2 Colaborativo Fase 4 Deisy VargasKaren Viviana Sierra EsparzaNessuna valutazione finora
- Sem 4 - Lab BioprocesosDocumento9 pagineSem 4 - Lab BioprocesosJENKA ALVAREZ MORENONessuna valutazione finora
- Curva LaibrDocumento2 pagineCurva LaibrDavid Alex0% (1)
- Practica #3. Reactores CSTRDocumento29 paginePractica #3. Reactores CSTRHugo MinetNessuna valutazione finora
- Reporte 3 Analitica 3 1Documento9 pagineReporte 3 Analitica 3 1VaniaL8Nessuna valutazione finora
- Practica 5 Sustrato e InhibidorDocumento7 paginePractica 5 Sustrato e InhibidorReymundo SeguraNessuna valutazione finora
- P1. Metodos de AnalisisDocumento7 pagineP1. Metodos de AnalisisJavier PinedaNessuna valutazione finora
- CalcioDocumento4 pagineCalcioMary Carmen PaezNessuna valutazione finora
- Curvas Cinética InformeDocumento7 pagineCurvas Cinética InformeYisela Escobar CortésNessuna valutazione finora
- Tarea 4 - Colaborativo 201604 - 25Documento46 pagineTarea 4 - Colaborativo 201604 - 25CARMENZANessuna valutazione finora
- Estadísticas de La RegresiónDocumento9 pagineEstadísticas de La RegresiónVannesa HernadezNessuna valutazione finora
- Problema FoglerDocumento15 pagineProblema FoglerDanielNessuna valutazione finora
- Taller Estadistica 2Documento32 pagineTaller Estadistica 2Angy Karolay Useche AtenciaNessuna valutazione finora
- Analisis InstrumentalDocumento4 pagineAnalisis InstrumentalIsrael Eduardo Aguirre OliveraNessuna valutazione finora
- Practica 18Documento6 paginePractica 18DavidRomanNessuna valutazione finora
- Problemas Rectas de CalibraciónDocumento6 pagineProblemas Rectas de CalibraciónLucia Jimenez MorenoNessuna valutazione finora
- Reporte Practica 8Documento17 pagineReporte Practica 8Verónica ChávezNessuna valutazione finora
- Ejercicios - Gases Con ImpurezasDocumento5 pagineEjercicios - Gases Con ImpurezasBrando JesusNessuna valutazione finora
- Primer Trabajo Domiciliario Termo2Documento7 paginePrimer Trabajo Domiciliario Termo2Fernanditoh Naa D ApellidosNessuna valutazione finora
- Analisis P8Documento3 pagineAnalisis P8HugoRz -BSNessuna valutazione finora
- Recubrimiento Geometrico 4.00 CMDocumento2 pagineRecubrimiento Geometrico 4.00 CMRonald AlcidesNessuna valutazione finora
- Estandar Interno 2Documento4 pagineEstandar Interno 2oscarNessuna valutazione finora
- Calculos y Conclusiones I.3Documento4 pagineCalculos y Conclusiones I.3HELEN DAYANA ZERDA RODRIGUEZNessuna valutazione finora
- Ejercicios de Análisis Químico AmbientalDocumento4 pagineEjercicios de Análisis Químico AmbientalFernando PaezNessuna valutazione finora
- Tarea 5-Rodriguez Lopez Pedro ArturoDocumento13 pagineTarea 5-Rodriguez Lopez Pedro ArturoMafer Mabel GalarzaNessuna valutazione finora
- Informe 9, Determinacion de La Actividad Enzimatica y Parametros de La Ecuacion de M-MDocumento11 pagineInforme 9, Determinacion de La Actividad Enzimatica y Parametros de La Ecuacion de M-MWendy AltamirandaNessuna valutazione finora
- Actividad 2 Completo 1Documento20 pagineActividad 2 Completo 1KATTERIN PAOLA ALVEAR MORENONessuna valutazione finora
- Determinación de NitritosDocumento7 pagineDeterminación de NitritosLaura RomeroNessuna valutazione finora
- Lixi-Caliente y FriaDocumento14 pagineLixi-Caliente y FriaDiego RoqueNessuna valutazione finora
- InterpolacinDocumento9 pagineInterpolacinJhonny IsraelNessuna valutazione finora
- Trabajo Final GAC (TCE)Documento15 pagineTrabajo Final GAC (TCE)rolando lainezNessuna valutazione finora
- Modelo 2Documento12 pagineModelo 2Richard David Chavez NajarroNessuna valutazione finora
- Paso 4 - Cinética y Superficies - Nestor - PerdomoDocumento23 paginePaso 4 - Cinética y Superficies - Nestor - Perdomojavier correaNessuna valutazione finora
- Salida Ejercicio26Documento6 pagineSalida Ejercicio26luis ayalaNessuna valutazione finora
- Taller EstadisticaDocumento31 pagineTaller EstadisticaYehison GutierrezNessuna valutazione finora
- TAREA 3.1 - 3.3 Tamizado: X RetDocumento2 pagineTAREA 3.1 - 3.3 Tamizado: X RetAnaid GarciaNessuna valutazione finora
- Calculos Indices de YodoDocumento24 pagineCalculos Indices de YodoCAROLINA RODRÍGUEZ CARDONANessuna valutazione finora
- Introducción al cálculo y al álgebra. Fundamentos del cálculoDa EverandIntroducción al cálculo y al álgebra. Fundamentos del cálculoNessuna valutazione finora
- Problemas resueltos de Hidráulica de CanalesDa EverandProblemas resueltos de Hidráulica de CanalesValutazione: 4.5 su 5 stelle4.5/5 (7)
- Evelyn Alvarez Lazaro 7Documento15 pagineEvelyn Alvarez Lazaro 7Areli CervantesNessuna valutazione finora
- Contaminantes Ciudad de Mexico .I9nteligencia Artificial 1Documento585 pagineContaminantes Ciudad de Mexico .I9nteligencia Artificial 1Areli CervantesNessuna valutazione finora
- Reporte LEM PDFDocumento6 pagineReporte LEM PDFAreli CervantesNessuna valutazione finora
- Proyecto de LEM IVDocumento2 pagineProyecto de LEM IVAreli CervantesNessuna valutazione finora
- Definición TécnicaDocumento5 pagineDefinición TécnicaAreli CervantesNessuna valutazione finora
- Recepción de La Materia V R: AlmacenamientoDocumento1 paginaRecepción de La Materia V R: AlmacenamientoAreli CervantesNessuna valutazione finora
- Banda Transportadora de PETDocumento5 pagineBanda Transportadora de PETAreli CervantesNessuna valutazione finora
- Copia de Practica1 1Documento2 pagineCopia de Practica1 1Areli CervantesNessuna valutazione finora
- Reporte 6Documento12 pagineReporte 6Areli CervantesNessuna valutazione finora
- TAREA 1 Transferencia de CalorDocumento6 pagineTAREA 1 Transferencia de CalorAreli Cervantes100% (1)
- Parcial-2-TM1.docx (Recuperado)Documento8 pagineParcial-2-TM1.docx (Recuperado)Areli CervantesNessuna valutazione finora
- ReactorwsDocumento2 pagineReactorwsAreli CervantesNessuna valutazione finora
- TAREA 1 Transferencia de CalorDocumento6 pagineTAREA 1 Transferencia de CalorAreli Cervantes100% (1)
- TAREA 1 Transferencia de CalorDocumento6 pagineTAREA 1 Transferencia de CalorAreli Cervantes100% (1)
- Universidad Nacional Autonoma de Mexico PDFDocumento1 paginaUniversidad Nacional Autonoma de Mexico PDFAreli CervantesNessuna valutazione finora
- QAIII Practica 1Documento4 pagineQAIII Practica 1Areli CervantesNessuna valutazione finora
- Eq3p9 RevDocumento9 pagineEq3p9 RevAreli CervantesNessuna valutazione finora
- Serie de Ejercicios Parcial II QAII IQ 2019-IDocumento2 pagineSerie de Ejercicios Parcial II QAII IQ 2019-IAreli CervantesNessuna valutazione finora
- Eq3p9 RevDocumento9 pagineEq3p9 RevAreli CervantesNessuna valutazione finora
- Rep 3 Equilib L V TerminadoDocumento15 pagineRep 3 Equilib L V TerminadoAreli CervantesNessuna valutazione finora
- Reporte 2Documento11 pagineReporte 2Areli CervantesNessuna valutazione finora
- Reporte AbsorcionDocumento7 pagineReporte AbsorcionAreli CervantesNessuna valutazione finora
- Pracica 2 QA3Documento6 paginePracica 2 QA3Areli CervantesNessuna valutazione finora
- Practica 6Documento3 paginePractica 6Areli CervantesNessuna valutazione finora
- Nitrato de Calcio ExcDocumento3 pagineNitrato de Calcio ExcAreli CervantesNessuna valutazione finora
- Plásticos Comerciales ImportantesDocumento55 paginePlásticos Comerciales ImportantesAreli CervantesNessuna valutazione finora
- Practica 6Documento4 paginePractica 6Leonardo Alcazar SalasNessuna valutazione finora
- Solución Al Modelo Matemático de La 2nda Ley de Fick para La Difusifidad de Vapor de Agua en Semillas de AmarantoDocumento1 paginaSolución Al Modelo Matemático de La 2nda Ley de Fick para La Difusifidad de Vapor de Agua en Semillas de AmarantoAreli CervantesNessuna valutazione finora
- Diffusion in A Sphere-180430Documento1 paginaDiffusion in A Sphere-180430Areli CervantesNessuna valutazione finora
- Guia Met Caso Mantenimiento ElectrohidráulicoDocumento5 pagineGuia Met Caso Mantenimiento ElectrohidráulicoRenato BerriosNessuna valutazione finora
- Mat Cua 3ero 1T AlumnoDocumento46 pagineMat Cua 3ero 1T AlumnoMagaza EduNessuna valutazione finora
- Qué Son Los Cuerpos RedondosDocumento7 pagineQué Son Los Cuerpos RedondosPame Olivera Reyes0% (1)
- Sistemas de Produccion e InventariosDocumento4 pagineSistemas de Produccion e InventariosJosé Antonio Rivero GómezNessuna valutazione finora
- Metodo de AndersonDocumento8 pagineMetodo de AndersonLucy Elida Sánchez mallmaNessuna valutazione finora
- Academia Amantes Del Conocimiento: Ciclo Repaso San Marcos 2023 - IDocumento11 pagineAcademia Amantes Del Conocimiento: Ciclo Repaso San Marcos 2023 - IDiego Dueñas VelardeNessuna valutazione finora
- Caracteristicas de La Industria QuimicaDocumento22 pagineCaracteristicas de La Industria Quimicaprincesslove521_4165Nessuna valutazione finora
- Sistema Nervioso CentralDocumento7 pagineSistema Nervioso CentralMondongo gokuNessuna valutazione finora
- Estatica de La Particula-1Documento10 pagineEstatica de La Particula-1jl salliNessuna valutazione finora
- Proyecto Aulico 11Documento8 pagineProyecto Aulico 11CARMEN BEATRIZ OVIEDO PACCHANessuna valutazione finora
- Acción de La Sustancia Transmisora en La Neurona PostsinápticaDocumento2 pagineAcción de La Sustancia Transmisora en La Neurona PostsinápticaJohnny Mauricio0% (1)
- Revision ValerianaDocumento53 pagineRevision ValerianaJavier Andres Camo Jimenez100% (1)
- Antologia de RelatosDocumento35 pagineAntologia de Relatosrocio hernandezNessuna valutazione finora
- Tipos de Sanciones TributariasDocumento18 pagineTipos de Sanciones TributariasAleja ToroNessuna valutazione finora
- Geometria - Tomo IDocumento35 pagineGeometria - Tomo INILSER0% (1)
- Animales PoligástricosDocumento5 pagineAnimales PoligástricosCristhian Jaico CruzNessuna valutazione finora
- Sesión 4 - Tipos de Párrafo Anexo 1Documento2 pagineSesión 4 - Tipos de Párrafo Anexo 1DeynaLeslyNessuna valutazione finora
- Loc TiteDocumento14 pagineLoc TitekelvinNessuna valutazione finora
- TFM María Soledad CidDocumento71 pagineTFM María Soledad Cidmariana gomezNessuna valutazione finora
- Examen Nombre Jorge Ivan Lozano Belmontes 2a Mi PDFDocumento7 pagineExamen Nombre Jorge Ivan Lozano Belmontes 2a Mi PDFJosé Luis-099 EspartanNessuna valutazione finora
- Grados de Viscosidad Sae para MotoresDocumento10 pagineGrados de Viscosidad Sae para MotoresDaniel Tenezaca BejaranoNessuna valutazione finora
- FAO Nutrición y Sistemas Alimentarios Cap 1Documento25 pagineFAO Nutrición y Sistemas Alimentarios Cap 1FrancoIgnacioLópezFerradaNessuna valutazione finora
- Modelo de Estilos de Aprendizaje de Felder y SilvermanDocumento7 pagineModelo de Estilos de Aprendizaje de Felder y SilvermanJeannette CañutaNessuna valutazione finora
- Zookeeper UpRunningDocumento18 pagineZookeeper UpRunningrazasuperiorNessuna valutazione finora
- Mmsperusalud Vol 1-6 Guia Rapida CD-cdsDocumento1 paginaMmsperusalud Vol 1-6 Guia Rapida CD-cdskwag100% (1)
- Paper GuajiraDocumento6 paginePaper GuajiraOttón MartínezNessuna valutazione finora
- Carta de MenusDocumento6 pagineCarta de MenusIng. Leonardo ArellanoNessuna valutazione finora
- MPRL (3) Examen Inc 4Documento26 pagineMPRL (3) Examen Inc 4fernandoNessuna valutazione finora
- 6167-BT-02 Membrana Celular y Transporte 2020Documento16 pagine6167-BT-02 Membrana Celular y Transporte 2020franciscaNessuna valutazione finora
- Lenguaje de Programacion de Visual BasicDocumento18 pagineLenguaje de Programacion de Visual BasicjaramosdNessuna valutazione finora