Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Alúmina
Caricato da
Ruben's OscarCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Alúmina
Caricato da
Ruben's OscarCopyright:
Formati disponibili
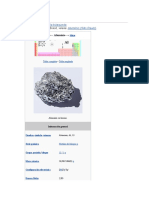
Alúmina
La alúmina es el óxido de aluminio (Al2O3). Junto con la sílice, es
el componente más importante en la constitución de las arcillas y
Alúmina
los esmaltes, confiriéndoles resistencia y aumentando su
temperatura de maduración.
El óxido de aluminio existe en la naturaleza en forma de corindón y
de esmeril.
Tiene la particularidad de ser más duro que el aluminio y el punto
de fusión de la alúmina son 2072 ℃ (2345,15 K) frente a los
660 ℃ (933,15 K) del aluminio, por lo que su soldadura debe
Nombre IUPAC
hacerse a corriente alterna.
Óxido de aluminio
General
Otros nombres Trióxido de dialuminio
Índice
Fórmula molecular Al2O3
Estructura cristalina
Identificadores
Propiedades
Número CAS 1344-28-11
Proceso de producción
ChEBI 30187
Aplicaciones
ChEMBL CHEMBL3707210
Véase también
ChemSpider 8164808
Referencias
DrugBank 11342
PubChem 9989226
Estructura cristalina UNII LMI26O6933
InChI
InChI=1S/2Al.3O/q2*+3;3*-2
Key: PNEYBMLMFCGWSK-UHFFF AOYSA-N
Propiedades físicas
Densidad 3961 kg/m3; 3,961
g/cm3
Masa molar 101,96 g/mol
Punto de fusión 2345 K (2072 ℃)
Punto de ebullición 3250 K (2977 ℃)
Corindón de Brasil, con tamaño Índice de refracción nω=1,768–1,772
alrededor de 2×3 cm. (nD) nε=1,760–1,763
Birrefringencia 0.008
La forma más común de óxido de aluminio cristalino se conoce Propiedades químicas
como corindón, que constituye la forma termodinámicamente Solubilidad en agua insoluble
estable.2 Los aniones oxígeno prácticamente forman una estructura Valores en el SI y en condiciones estándar
hexagonal compacta con cationes aluminio llenando dos tercios de (25 ℃ y 1 atm), salvo que se indique lo contrario.
los intersticios octaédricos. Cada centro de cationes Al3+ es
[editar datos en Wikidata]
octaédrico. En términos de su cristalografía, el corindón adopta una red trigonal de Bravais con un grupo espacial de R-3c (número
167 en las Tablas Internacionales). La celda primitiva contiene dos unidades de la fórmula de óxido
de aluminio.
El óxido de aluminio también existe en otras fases, incluyendo las fases γ y η, la fase monoclínica θ, la fase hexagonal χ, la fase
ortorrómbica κ y la fase δ, que puede ser tetragonal o ortorrómbica.2 3 Cada uno tiene una estructura y propiedad cristalina únicas.
La forma cúbica γ-Al2O3 tiene importantes aplicaciones técnicas. El llamado β-Al 4
2O3 resultó ser NaAl11O17.
El óxido de aluminio fundido cerca del punto de fusión es casi 2/3 tetraédrico (es decir, 2/3 de los cationes de aluminio están
rodeados por 4 aniones de oxígeno vecinos), y 1/3 5-coordinado, muy poco (<5 %) del Al-O octaédrico se encuentra presente.5
Alrededor del 80 % de los aniones de oxígeno son compartidos entre tres o más poliedros de Al-O, y la mayoría de las conexiones
interpoliédricas están compartidas en las esquinas, con el restante 10 a 20 % distribuidas en los bordes.5 El desglose de los octaedros
tras la fusión va acompañado de un aumento de volumen relativamente grande (~ 20 %); la densidad del líquido cercana al punto de
fusión es de 2,93 g/cm3.6
Propiedades
Densidad: 3,96-4,05 g/cm³.
Dureza Vickers: 1500-1650 kgf mm².
Módulo de elasticidad: 300-400 GPa.
Proceso de producción
La industria emplea el proceso Bayer para producir alúmina a partir de la bauxita. La alúmina es vital para la producción de aluminio
(se requieren aproximadamente dostoneladas de alúmina para producir una tonelada de aluminio).
En el proceso Bayer, la bauxita es lavada, pulverizada y disuelta en sosa cáustica (hidróxido de sodio) a alta presión y temperatura; el
líquido resultante contiene una disolución de aluminato de sodio y residuos de bauxita que contienen hierro, silicio, y titanio. Estos
residuos se van depositando gradualmente en el fondo del tanque y luego son eliminados. Se los conoce comúnmente como "barro
rojo".
La solución de aluminato de sodio clarificada es bombeada dentro de un enorme tanque llamado precipitador. Se añaden finas
partículas de alúmina con el fin de inducir la precipitación de partículas de alúmina puras (proceso de siembra), una vez que el
líquido se enfría. Las partículas se depositan en el fondo del tanque, se extraen y luego se someten a 1100 ℃ (1373,15 K) en un
horno o calcinador, a fin de eliminar el agua que contienen, producto de la cristalización. El resultado es un polvo blanco, alúmina
pura. La sosa cáustica es devuelta al comienzo del proceso y reutilizada.
Aplicaciones
La industria del aluminio primario utiliza la alúmina fundamentalmente como materia prima básica para la producción del aluminio.
Además, la alúmina se utiliza por sus propias cualidades como material cerámico de a en condiciones de altas temperaturas o buenas
propiedades tribológicas, como en:
Aislante térmico y eléctrico para la parte superior de las cubas electrolíticas.
Revestimiento de protección para evitar la oxidación de losánodos de carbono.
Absorción de las emisiones provenientes de las cubas.
También es utilizada para el secado del airecomprimido ya que tiene la propiedad de absorber el agua.
En el área sanitaria de las prótesis dentales, se utiliza como base de la estructura de coronas y puentes,
proporcionando gran dureza y resistencia, con bajo peso y estéticamente da buenos resultados gracias a su color
blanco.
En molinos de bolas empleados para preparar esmaltes u otros materiales cerámicos, como bolas de molienda.
En la fabricación de termita mezclada al 50 % conóxido de hierro (II).
Como aislante eléctrico en las bujías de los vehículos de gasolina.
Como abrasivo en muchos procesos industriales de acabado, pulido, mecanizado por ultrasonidos...
Su regeneración (para el caso de la absorción/desorción) es con aire seco y caliente y tiene una temperatura de punto de rocío de
-40 ℃ (233,15 K).
También protege a los elementos de aluminio de la oxidación, a pesar de que el aluminio es uno de los metales que se oxidan más
fácilmente. Esto ocurre porque en la superficie del material se forma una capa de alúmina que protege el interior de la pieza. Esta
capa no se desprenderá ni se cuarteará porque el aluminio presenta uníndice de Pilling-Bedworthligeramente superior a 1 (de 1,28).
Véase también
Corindón
Rubí
Zafiro
Referencias
1. Número CAS (http://webbook.nist.gov/cgi/cbook.cgi?ID=1344-28-1)
2. Levin, I.; Brandon, D. (1998).«Metastable alumina polymorphs: Crystal structures and transition sequnces» (http://on
linelibrary.wiley.com/doi/10.1111/j.1151-2916.1998.tb02581.x/abstract) . Journal of the American Ceramic Society 81
(8): 1995—2012. doi:10.1111/j.1151-2916.1998.tb02581.x (http://dx.doi.org/10.1111%2Fj.1151-2916.1998.tb02581.x).
3. Paglia, G. (2004). «Determination of the structure of γ-Alumina using empirical and first principles calculations
combined with supporting experiments»(http://espace.library.curtin.edu.au/R?func=search-simple-go&ADJACENT=Y
&REQUEST=adt-WCU20040621.123301) (free download). Perth, Australia: Curtin University of Technology.
Consultado el 5 de mayo de 2009.
4. Wiberg, E. and Holleman, A. F. (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5.
5. Skinner, L.B., et al. (2013). «Joint diffraction and modeling approach to the structure of liquid alumina» (http://prb.ap
s.org/abstract/PRB/v87/i2/e024201). Phys. Rev. B 87: 024201. Bibcode:2013PhRvB..87b4201S (http://adsabs.harvard.edu/ab
s/2013PhRvB..87b4201S). doi:10.1103/PhysRevB.87.024201 (http://dx.doi.org/10.1103%2FPhysRevB.87.024201).
6. Paradis, P.-F., et al.. (2004). «Non-contact thermophysical property measurements of liquid and undercooled
Alumina». Jap. J. Appl. Phys. 43 (4): 1496-1500. Bibcode:2004JaJAP..43.1496P (http://adsabs.harvard.edu/abs/2004JaJAP..43.1
496P). doi:10.1143/JJAP.43.1496 (http://dx.doi.org/10.1143%2FJJAP.43.1496).
Obtenido de «https://es.wikipedia.org/w/index.php?title=Alúmina&oldid=112465828
»
Esta página se editó por última vez el 5 dic 2018 a las 07:49.
El texto está disponible bajo laLicencia Creative Commons Atribución Compartir Igual 3.0 ; pueden aplicarse cláusulas
adicionales. Al usar este sitio, usted acepta nuestrostérminos de uso y nuestra política de privacidad.
Wikipedia® es una marca registrada de laFundación Wikimedia, Inc., una organización sin ánimo de lucro.
Potrebbero piacerti anche
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADa EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANessuna valutazione finora
- AlúminaDocumento9 pagineAlúminaFernando Acantos ValdiviesoNessuna valutazione finora
- Reparación de elementos metálicos. TMVL0309Da EverandReparación de elementos metálicos. TMVL0309Valutazione: 5 su 5 stelle5/5 (1)
- Oxidos CeramicosDocumento20 pagineOxidos CeramicosArturo Ortiz0% (1)
- Propiedades y aplicaciones de la alúminaDocumento20 paginePropiedades y aplicaciones de la alúminaDavid MNessuna valutazione finora
- Determinación Aluminio LataDocumento20 pagineDeterminación Aluminio LataGerson Aguilar OliverahNessuna valutazione finora
- Informe #1. PREPARACIÓN DEL ALUMBRE DE AMONIO A PARTIR DE DESECHOS DE ALUMINIODocumento32 pagineInforme #1. PREPARACIÓN DEL ALUMBRE DE AMONIO A PARTIR DE DESECHOS DE ALUMINIOFigo CabralesNessuna valutazione finora
- Alúmina: óxido de aluminio esencialDocumento4 pagineAlúmina: óxido de aluminio esencialLuis Che CitalanNessuna valutazione finora
- Reporte Comite TutorialDocumento11 pagineReporte Comite TutorialVictor Cristiany Rubio SanchezNessuna valutazione finora
- Aluminio MONOGRAFIADocumento31 pagineAluminio MONOGRAFIAAntonio Apaza HuamanNessuna valutazione finora
- DuraluminioDocumento44 pagineDuraluminioJeison BlancoNessuna valutazione finora
- Diagrama de fases del duraluminio enDocumento23 pagineDiagrama de fases del duraluminio enLuis Fernando Hilario Bruno100% (1)
- Aluminio y Sus DerivadosDocumento22 pagineAluminio y Sus DerivadosBrandon CorralNessuna valutazione finora
- Seminario Sobre El CarbonoDocumento12 pagineSeminario Sobre El CarbonoGavvNessuna valutazione finora
- Cuestionario de CeramicosDocumento10 pagineCuestionario de CeramicosCarlos BohorquezNessuna valutazione finora
- Aluminatos DiapositivasCurso CEramicaDocumento13 pagineAluminatos DiapositivasCurso CEramicawilber ccopa mamaniNessuna valutazione finora
- Propiedad Fisicas y Quimicas Del AluminioDocumento4 paginePropiedad Fisicas y Quimicas Del AluminioMiriam Judith100% (1)
- Proyecto de InvestigaciónDocumento12 pagineProyecto de InvestigaciónJared Vidal JoaquínNessuna valutazione finora
- Materiales refractarios y sus aplicacionesDocumento5 pagineMateriales refractarios y sus aplicacionesAlejandro Caceres HaroNessuna valutazione finora
- Práctica 3 Caracterización Metalográfica de MaterialesDocumento21 paginePráctica 3 Caracterización Metalográfica de MaterialesRené GVNessuna valutazione finora
- Probetas Aluminio Practica 1Documento9 pagineProbetas Aluminio Practica 1jhair jimenezNessuna valutazione finora
- Determinación Gravimétrica de AluminioDocumento24 pagineDeterminación Gravimétrica de Aluminioanon_8488453730% (1)
- Aluminio Que EsDocumento137 pagineAluminio Que EsedsanoceNessuna valutazione finora
- Práctica Alumbre de Amonio FinalizadoDocumento26 paginePráctica Alumbre de Amonio FinalizadoCamilo Rafael Osorio PintoNessuna valutazione finora
- Preparación de alumbre común a partir de aluminioDocumento10 paginePreparación de alumbre común a partir de aluminioMiguel Angel Roldan MartinNessuna valutazione finora
- BBBBBBBBBBBBBBBBBBBBBBDocumento21 pagineBBBBBBBBBBBBBBBBBBBBBBMicaela BustosNessuna valutazione finora
- Horacio Arregoces, Manuel Quintero.Documento11 pagineHoracio Arregoces, Manuel Quintero.Horacio Antonio Arregoces VillegasNessuna valutazione finora
- Cerámicos y vidrios: materiales cristalinos y no cristalinosDocumento19 pagineCerámicos y vidrios: materiales cristalinos y no cristalinosalexanderelrusoNessuna valutazione finora
- Materiales de Ingeniería y Sus AplicacionesDocumento20 pagineMateriales de Ingeniería y Sus Aplicacionesmariag100% (4)
- 09 Cemento - CalcinaciónDocumento20 pagine09 Cemento - CalcinaciónAnibal Muñoz CasasNessuna valutazione finora
- Tarea Consulta Elementos Grupo 13Documento6 pagineTarea Consulta Elementos Grupo 13Mateo EspinosaNessuna valutazione finora
- Tratamiento térmico de aleaciones de aluminio tipo 1xxx y 2xxxDocumento53 pagineTratamiento térmico de aleaciones de aluminio tipo 1xxx y 2xxxDavid Roly Rojas FloresNessuna valutazione finora
- Aleaciones LigerasDocumento29 pagineAleaciones LigerasStone SalazarNessuna valutazione finora
- AluminaDocumento15 pagineAluminaRodrigo MuñozNessuna valutazione finora
- Propiedades Químicas de Los Materiales de ConstrucciónDocumento18 paginePropiedades Químicas de Los Materiales de ConstrucciónJesus Felipe Escobar EscobarNessuna valutazione finora
- CerámicosIngenieríaPropiedadesPrincipalesDocumento6 pagineCerámicosIngenieríaPropiedadesPrincipalesquark_1102Nessuna valutazione finora
- Aleación Del CromoDocumento17 pagineAleación Del Cromobryan arnoldNessuna valutazione finora
- 1 Parcial Resuelto de Ciencias 2022 + Pregutnas de Años AnterioresDocumento8 pagine1 Parcial Resuelto de Ciencias 2022 + Pregutnas de Años AnterioresE-printCentrosDeCopiadoVeterinariaNessuna valutazione finora
- Procesos Electrolíticos: Obtención Al-Ca-MgDocumento14 pagineProcesos Electrolíticos: Obtención Al-Ca-MgEdizon ColquichaguaNessuna valutazione finora
- Reacciones Químicas AluminioDocumento5 pagineReacciones Químicas AluminioEusebio CostaNessuna valutazione finora
- Fundición Del AluminioDocumento10 pagineFundición Del AluminioGerardoHerreraLazurteguiNessuna valutazione finora
- Características y usos del aluminioDocumento25 pagineCaracterísticas y usos del aluminioJim AcuñaNessuna valutazione finora
- AluminioDocumento14 pagineAluminiosergioNessuna valutazione finora
- Deshidrogenación Catalítica Del IsopropanolDocumento21 pagineDeshidrogenación Catalítica Del IsopropanolSHELSEA MARY CARPIO CARPIONessuna valutazione finora
- Actividad 1Documento9 pagineActividad 1Brian ReynaNessuna valutazione finora
- Apuntes RefractariosDocumento8 pagineApuntes Refractariosapi-26360100100% (4)
- Componentes Del ClinkerDocumento27 pagineComponentes Del ClinkerCarol Delgado Lopez100% (5)
- Metalurgia Extractiva Del Aluminio 1Documento23 pagineMetalurgia Extractiva Del Aluminio 1JimmyVargas100% (1)
- Cuestionario de Metales No Ferrosos GrupoDocumento14 pagineCuestionario de Metales No Ferrosos GrupoDaniela HuancoNessuna valutazione finora
- Propiedades y aplicaciones de aleaciones Al-SiDocumento30 paginePropiedades y aplicaciones de aleaciones Al-SiElver Santos RíosNessuna valutazione finora
- Aleación MetalDocumento10 pagineAleación MetalJavier Castañon CortezNessuna valutazione finora
- Materiales cerámicos: propiedades y aplicacionesDocumento31 pagineMateriales cerámicos: propiedades y aplicacionesMario gotzeNessuna valutazione finora
- CerámicosDocumento44 pagineCerámicosLuis LozadaNessuna valutazione finora
- CLASE 7. - El Aluminio y Sus AleacionesDocumento63 pagineCLASE 7. - El Aluminio y Sus Aleacionesjosebas91Nessuna valutazione finora
- Examen Metalurgia Annette b20354Documento7 pagineExamen Metalurgia Annette b20354Gabriel ArguelloNessuna valutazione finora
- AluminaDocumento24 pagineAluminaAdolfo Dela Cruz CamayoNessuna valutazione finora
- Electro Obtención AluminioDocumento31 pagineElectro Obtención AluminioEnrique CastroNessuna valutazione finora
- Informe Inorganica UniversidadDocumento22 pagineInforme Inorganica UniversidadDanny BANessuna valutazione finora
- Módulo 14 Refractarios Nicolás PardoDocumento26 pagineMódulo 14 Refractarios Nicolás PardoMaria isabelNessuna valutazione finora
- CeramicosDocumento111 pagineCeramicosKaRlosVillaGránNessuna valutazione finora
- Sasuke UchihaDocumento9 pagineSasuke UchihaRuben's OscarNessuna valutazione finora
- KonanDocumento5 pagineKonanRuben's OscarNessuna valutazione finora
- Madara UchihaDocumento18 pagineMadara UchihaRuben's OscarNessuna valutazione finora
- Sword of The SamuraiDocumento3 pagineSword of The SamuraiRuben's OscarNessuna valutazione finora
- ZetsuDocumento5 pagineZetsuRuben's OscarNessuna valutazione finora
- Code GeassDocumento13 pagineCode GeassRuben's OscarNessuna valutazione finora
- HidanDocumento3 pagineHidanRuben's OscarNessuna valutazione finora
- DeidaraDocumento6 pagineDeidaraRuben's OscarNessuna valutazione finora
- KakuzuDocumento5 pagineKakuzuRuben's OscarNessuna valutazione finora
- Kisame HoshigakiDocumento5 pagineKisame HoshigakiRuben's OscarNessuna valutazione finora
- Itachi UchihaDocumento6 pagineItachi UchihaRuben's OscarNessuna valutazione finora
- Obito UchihaDocumento16 pagineObito UchihaRuben's OscarNessuna valutazione finora
- CometaDocumento7 pagineCometaRuben's OscarNessuna valutazione finora
- SWORD (Protocolo)Documento2 pagineSWORD (Protocolo)Ruben's OscarNessuna valutazione finora
- Winnie The PoohDocumento6 pagineWinnie The PoohRuben's Oscar100% (1)
- Asteroid eDocumento14 pagineAsteroid eRuben's OscarNessuna valutazione finora
- Care BearsDocumento4 pagineCare BearsRuben's OscarNessuna valutazione finora
- Meteorito MetálicoDocumento9 pagineMeteorito MetálicoRuben's OscarNessuna valutazione finora
- Rainbow BriteDocumento2 pagineRainbow BriteRuben's OscarNessuna valutazione finora
- NorbitDocumento5 pagineNorbitRuben's OscarNessuna valutazione finora
- E NomineDocumento3 pagineE NomineRuben's OscarNessuna valutazione finora
- Jean RenoDocumento6 pagineJean RenoRuben's OscarNessuna valutazione finora
- AviciiDocumento11 pagineAviciiRuben's OscarNessuna valutazione finora
- TritioDocumento2 pagineTritioRuben's OscarNessuna valutazione finora
- DJ SnakeDocumento8 pagineDJ SnakeRuben's OscarNessuna valutazione finora
- TornadoDocumento24 pagineTornadoRuben's OscarNessuna valutazione finora
- Tripoli (Iowa)Documento2 pagineTripoli (Iowa)Ruben's OscarNessuna valutazione finora
- Cable de SuperconductorDocumento5 pagineCable de SuperconductorRuben's OscarNessuna valutazione finora
- Salvador (Película)Documento3 pagineSalvador (Película)Ruben's OscarNessuna valutazione finora
- Los Bloques NutricionalesDocumento6 pagineLos Bloques NutricionalesKenn SantanaNessuna valutazione finora
- Specifications Arandela Plana 67060064Documento2 pagineSpecifications Arandela Plana 67060064Miguel dextreNessuna valutazione finora
- Procedimiento para Medir CaudalDocumento19 pagineProcedimiento para Medir CaudalhenrryNessuna valutazione finora
- Formato Registro de Riesgos 2016Documento37 pagineFormato Registro de Riesgos 2016Luis EscobedoNessuna valutazione finora
- Quimica Inorganica 8 InformeDocumento28 pagineQuimica Inorganica 8 InformeJuan camilo Aguirre LópezNessuna valutazione finora
- Historia de Implantologia OralDocumento5 pagineHistoria de Implantologia OralSol BaltazzarNessuna valutazione finora
- Via IntranasalDocumento18 pagineVia IntranasalTony Orozco100% (1)
- Obtencion Del VinoDocumento15 pagineObtencion Del Vinoefrain0523Nessuna valutazione finora
- Informe de Laboratorio Oficial 1Documento21 pagineInforme de Laboratorio Oficial 1Cesar pariNessuna valutazione finora
- Soldadura Electrica de Arco de C.ADocumento7 pagineSoldadura Electrica de Arco de C.AJonaGomezNessuna valutazione finora
- Tipodonto CmentadoDocumento132 pagineTipodonto CmentadoRodrigo Daniel Vela RiveraNessuna valutazione finora
- LibroDocumento52 pagineLibroJulio Carrion Gutierrez0% (3)
- Especificaciones técnicas particulares para ampliación de escuela en General San Martín, ChacoDocumento30 pagineEspecificaciones técnicas particulares para ampliación de escuela en General San Martín, ChacoFelix FunesNessuna valutazione finora
- Definición de solubilidad (USPDocumento18 pagineDefinición de solubilidad (USPLaura ReyesNessuna valutazione finora
- Catalogo Difemat 2 PDFDocumento38 pagineCatalogo Difemat 2 PDFOliver CristinichNessuna valutazione finora
- Ntc2246 Cables de Acero para AscensoresDocumento9 pagineNtc2246 Cables de Acero para Ascensoresjairo barriosNessuna valutazione finora
- Clasificación de Los Relajantes MuscularesDocumento7 pagineClasificación de Los Relajantes MuscularesPAULISA SOLARES BALTAZARNessuna valutazione finora
- Boletín - 01 - Dalbulus MaidisDocumento3 pagineBoletín - 01 - Dalbulus MaidisGiovanni GregorioNessuna valutazione finora
- Investigación Sistemas Híbridos PDFDocumento38 pagineInvestigación Sistemas Híbridos PDFLuis Jose CastañedaNessuna valutazione finora
- Actividad 12 Ducura, Lara, ParradoDocumento5 pagineActividad 12 Ducura, Lara, Parradoyamile riosNessuna valutazione finora
- Natal Branco PARTITURA 3Documento4 pagineNatal Branco PARTITURA 3Cadu BarcelosNessuna valutazione finora
- Hydromatic PucallpaDocumento2 pagineHydromatic PucallpaArnolNessuna valutazione finora
- Tarabita PlayonDocumento4 pagineTarabita PlayonGlenda_20100% (1)
- Plan Naranja INDECIDocumento90 paginePlan Naranja INDECIJerson Guinea LiviaNessuna valutazione finora
- Convección forzada en barra sólida: coeficiente de transferencia de energíaDocumento12 pagineConvección forzada en barra sólida: coeficiente de transferencia de energíaKarliita LomNessuna valutazione finora
- Sem 14 Tarea Practica 2022-IDocumento13 pagineSem 14 Tarea Practica 2022-Imaria juanaNessuna valutazione finora
- Informe 08-ConductimetriaDocumento17 pagineInforme 08-ConductimetriaKatia Yesica Tineo CanalesNessuna valutazione finora
- D031-PR-500!02!001 Guia Ergonomia Trabajo Oficina Uso PCDocumento8 pagineD031-PR-500!02!001 Guia Ergonomia Trabajo Oficina Uso PCCa MiloNessuna valutazione finora
- Procesamiento de Minerales 2019Documento194 pagineProcesamiento de Minerales 2019Cristian P OlmosNessuna valutazione finora
- III BIM - BIOLOGIA - 4TO AÑO - Guia 2 - Fotosíntesis IDocumento8 pagineIII BIM - BIOLOGIA - 4TO AÑO - Guia 2 - Fotosíntesis Iprofesormiguel241Nessuna valutazione finora