Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Efecto Del Área y Distancia en Corrosión Galvanica
Caricato da
Marco Antonio Soto SonccoDescrizione originale:
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Efecto Del Área y Distancia en Corrosión Galvanica
Caricato da
Marco Antonio Soto SonccoCopyright:
Formati disponibili
EFECTO DEL ÁREA Y DISTANCIA EN CORROSIÓN GALVANICA
CORROSION GALVANICA
Una de las corrosiones que más problemas de mantenimiento y seguridad ocasiona en
la arquitectura e ingeniería es la corrosión galvánica o por par galvánico. La
proliferación del uso de nuevos materiales aleados y con adiciones químicas provoca
cierta inseguridad sobre la durabilidad y comportamiento futuro de revestimientos,
instalaciones, fijaciones, etc.
La corrosión galvánica es un fenómeno electroquímico que se produce entre dos
metales en contacto ante la presencia de un electrolito, que puede ser simplemente el
agua contenida en la humedad ambiental. Cada uno de los metales se comportará bien
como ánodo o bien como cátodo. El metal que actúa como ánodo es el que sufre la
corrosión.
Se presenta cuando dos metales diferentes en contacto o conectados por medio de un
conductor eléctrico, son expuestos a una solución conductora (electrolito). En este caso
existe una diferencia de potencial eléctrico entre los metales “diferentes” que permite
un flujo de electrones entre ellos. Mientras más grande es la diferencia de potencial
entre los metales, mayor es la probabilidad de que se presente la corrosión galvánica
notándose que este tipo de corrosión solo causa deterioro en uno de los metales,
mientras que el otro metal del par casi no sufre daño. La corrosión galvánica es considera
una reacción electroquímica por que produce o consume electrones
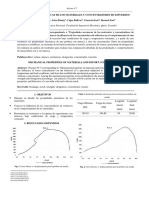
Relación de área: es el cociente entre el área de superficie ocupada por el cátodo (metal
más noble) y el área del más activo. Una relación elevada resulta desfavorable por
cuanto en estas condiciones la densidad de corriente en el ánodo se ve incrementada
conduciendo a un aumento de la corrosión en el ánodo. Esto es más crítico si la cupla
galvánica está bajo control catódico. El caso opuesto, cuando el área anódica es
comparativamente mayor a la catódica, y la cupla está bajo control catódico, produce
un efecto acelerador galvánico muy débil como consecuencia de que la densidad de
corriente catódica es la que se incrementa y que predomina la polarización del metal
más noble
EFECTO DE LA DISTANCIA.
La corrosión galvánica es usualmente grande cerca de la unión, se observa un ataque
decreciente a medida que la distancia aumente. El efecto de la corriente depende de la
conductividad de la solución. Si la resistencia es alta, el ataque puede ser una hendidura
puntiaguda. La corrosión galvánica se reconoce por la localización del ataque cerca de
la unión.
Lo que hace más probable una corrosión galvánica significativa es la distancia entre
elementos y la situación de ambos en la tabla. Es decir, mientras más arriba esté uno (o
ambos) y más distancia exista entre ellos, menor probabilidad.
Metales disímiles ubicados muy próximos entre si sufren un ataque galvánico más
severo que aquellos que están más apartados. Este efecto distancia” dependerá de la
conductibilidad del electrolito
EFECTO DEL AREA.
Una relación de área desfavorable es la constituida por un área catódica grande y una
anódica pequeña. Con la aplicación de una cierta cantidad de corriente a una pareja
metálica, por ejemplo, de electrodos de cobre y de hierro de diferentes tamaños, la
densidad de corriente es mucho mayor para el electrodo más pequeño que para el más
grande. Es por ello, que el electrodo anódico más pequeño se corroerá mucho más
rápido, por lo que debe evitarse la relación área del cátodo grande/superficie de ánodo
pequeña.
Cuanto más negativo sea el potencial de una aleación más fácilmente es atacada por
corrosión galvánica. Cuanto menor sea la diferencia de potencial de los metales que se
acoplan, menor es la velocidad de corrosión.
Ya que un área muy grande de metal noble comparada con el metal activo, acelerará la
corrosión y por el contrario una mayor área del metal activo comparada con el metal
noble disminuye el ataque del primero Para un flujo de corriente dado en la celda, la
densidad de corriente es mayor para un electrodo pequeño que para uno grande y
cuanto mayor sea la densidad de corriente, mayor será la velocidad de corrosión.
Para un proceso de corrosión controlado por la del oxidante:
p: vel. de penetración del metal activo
acoplado.
po: penetración del metal activo no acoplado.
Aa: área del metal más activo.
Ac: área del metal más noble.
Combinación: cátodo grande/ánodo pequeño → indeseable.
cátodo pequeño/ánodo grande → deseable.
También existen otros factores de influencia muy significativos que influyen en
la corrosión
– A mayor superficie de contacto mayor corrosión.
– Cuanto mayor sea el tamaño del ánodo respecto al cátodo menor será la
corrosión.
– Cuanto mayor sea el tamaño del cátodo respecto al ánodo mayor será la
corrosión.
– Si tenemos ánodos protegidos contra la corrosión, el efecto del par galvánico
se hará notar con mayor intensidad en zonas que puedan quedar expuestas (como
puede observarse que ha ocurrido en la imagen superior)
– A mayor humedad mayor corrosión galvánica.
– A mayor temperatura más posibilidad de corrosión.
– La presencia de cloruros acelera la corrosión.
El uso entre metales de elementos separadores o capas protectoras evitará la
corrosión por par galvánico.
Se ha visto que los aceros inoxidables se presentan en la tabla
como activos o pasivos. Esto se debe a que su comportamiento varía dependiendo de
la naturaleza del electrolito: Si es una solución oxidante los aceros inoxidables actúan
como cátodo (pasivos) Si la solución es reductora, el acero inoxidable se considera
activo y actuará como ánodo en contacto con otros metales como el cobre o el níquel.
Los agentes oxidantes comunes son: Oxigeno, agua, dióxido de carbono, cloro,
hipoclorito, peróxidos, flúor, etc.
Los agentes reductores comunes son: Monóxido de carbono, calcio, carbón,
celulosa, sodio, etc.
BIBLIOGRAFIA:
Corporación para la Investigación de la Corrosión y Corporación de Ciencia y
Tecnología para el Desarrollo Naval, Marítimo y Fluvial (2006). Proyecto de
cofinanciación Colciencias: “Desarrollo de una herramienta computacional.
https://www.upv.es/materiales/Fcm/Fcm12/pfcm12_4_2.html
Javaherdashti R. (2008). Microbiologically Influenced Corrosion - An
Engineering Insight. Springer London.
NOMBRE:
SURCO AMANCA SEGUNDO LEONEL 121329
Potrebbero piacerti anche
- Pasividad de MetalesDocumento11 paginePasividad de MetalesMauricioHuertaNessuna valutazione finora
- Practica No.8 (Efecto de Area)Documento4 paginePractica No.8 (Efecto de Area)Alexis MuñozNessuna valutazione finora
- YominyDocumento19 pagineYominyAnonymous 32rR19aQ9lNessuna valutazione finora
- Practica 7Documento7 paginePractica 7nicolas cardenasNessuna valutazione finora
- Practica No.7 (Corrosión Galvánica)Documento5 paginePractica No.7 (Corrosión Galvánica)Alexis MuñozNessuna valutazione finora
- Guia No 3 Corrosion Ua - Efecto de AreaDocumento2 pagineGuia No 3 Corrosion Ua - Efecto de AreaAnonymous dC0nO9qXNessuna valutazione finora
- Corrosión y El Desgaste EjercciosDocumento6 pagineCorrosión y El Desgaste EjercciosJesus Orlando Higidio MoralesNessuna valutazione finora
- Medios de TempleDocumento4 pagineMedios de TempleJohanaNessuna valutazione finora
- Tafel 2Documento13 pagineTafel 2soldadouniverNessuna valutazione finora
- Bronce Al AluminioDocumento9 pagineBronce Al AluminioWilmer DanielNessuna valutazione finora
- Teoria de Potenciales MixtosDocumento5 pagineTeoria de Potenciales Mixtoscoreano63Nessuna valutazione finora
- Examen de CorrosionDocumento6 pagineExamen de CorrosionHernandezbAngie100% (1)
- Proceso de Recubrimiento de CobreadoDocumento9 pagineProceso de Recubrimiento de CobreadoCesarSánchezNessuna valutazione finora
- Informe ADocumento9 pagineInforme AJose PintoNessuna valutazione finora
- Problemario de CorrosiónDocumento21 pagineProblemario de CorrosiónAyax OchoUno Medina100% (1)
- Electrodo Disco RotatorioDocumento4 pagineElectrodo Disco RotatorioEder RysNessuna valutazione finora
- Corrosión Selectiva o DesaleanteDocumento3 pagineCorrosión Selectiva o DesaleanteBruno MorenoNessuna valutazione finora
- FinalDocumento14 pagineFinalJean Pool Alarcon VilaNessuna valutazione finora
- Práctica #2 Conformado de Metales - LaminaciónDocumento5 paginePráctica #2 Conformado de Metales - LaminaciónGino CartagenaNessuna valutazione finora
- Resistencia A La Polarizacion LinealDocumento8 pagineResistencia A La Polarizacion Linealyurimar yedraNessuna valutazione finora
- Corrosion SelectivaDocumento24 pagineCorrosion SelectivaJonathan MontesdeocaNessuna valutazione finora
- Practica Cementación de AcerosDocumento7 paginePractica Cementación de AcerosStalyn LemaNessuna valutazione finora
- Inhibidores y Pasivadores PDFDocumento8 pagineInhibidores y Pasivadores PDFManuel FernandezNessuna valutazione finora
- Deposición Química Asistida Por LáserDocumento7 pagineDeposición Química Asistida Por LáserWilsonJavierPinedaLopezNessuna valutazione finora
- Conformabilidad de MetalesDocumento8 pagineConformabilidad de MetalesCristian GarcíaNessuna valutazione finora
- Cementado MetalografiaDocumento9 pagineCementado MetalografiarambetsNessuna valutazione finora
- EsferoidizaciónDocumento1 paginaEsferoidizaciónbebe_fionicoNessuna valutazione finora
- 02 Corrosion - Resquicio - y - FiliformeDocumento14 pagine02 Corrosion - Resquicio - y - FiliformeMonsif AhlikNessuna valutazione finora
- Características Del Acero AISI D2 y Caracteristicas Del LubricanteDocumento3 pagineCaracterísticas Del Acero AISI D2 y Caracteristicas Del LubricantearmandoNessuna valutazione finora
- Practica No.9 (Pasividad)Documento5 paginePractica No.9 (Pasividad)Alexis MuñozNessuna valutazione finora
- Electrodos de Referencia y CorrosionDocumento6 pagineElectrodos de Referencia y CorrosionMaximilianoRGNessuna valutazione finora
- Practicas TTT FinalDocumento26 paginePracticas TTT FinalJorge Adrian Reyes Calles100% (1)
- Practica4 Corrosion Proceso EspontaneoDocumento12 paginePractica4 Corrosion Proceso EspontaneoDiego Villanueva0% (1)
- Guía 1 Practica Medición de PotencialesDocumento7 pagineGuía 1 Practica Medición de PotencialesGramiNessuna valutazione finora
- Fuerza Magnetomotriz de Los DevanadosDocumento8 pagineFuerza Magnetomotriz de Los DevanadosasdjeNessuna valutazione finora
- Aleaciones FerrosasDocumento69 pagineAleaciones FerrosasGabriel Ch100% (3)
- Clase Deformacion PlasticaDocumento11 pagineClase Deformacion PlasticaGonzalo LezooNessuna valutazione finora
- Los Recubrimientos OrgánicosDocumento4 pagineLos Recubrimientos OrgánicosFrank Cuevas RodriguezNessuna valutazione finora
- FosforenoDocumento4 pagineFosforenoDvid HórusNessuna valutazione finora
- Norma Astm E3 222Documento3 pagineNorma Astm E3 222Wilder RTNessuna valutazione finora
- Moldeo en Arena VerdeDocumento7 pagineMoldeo en Arena VerdeSophie Laura PortilloNessuna valutazione finora
- Taller 1 HemisemestreDocumento3 pagineTaller 1 HemisemestreJhonatan Xavier ZulettaNessuna valutazione finora
- CAPITULO III aRENASDocumento19 pagineCAPITULO III aRENASCristian Mamani FloresNessuna valutazione finora
- Aluminio Serie 7xxxDocumento12 pagineAluminio Serie 7xxxAnonymous 23mojLPD0Nessuna valutazione finora
- Protección AnódicaDocumento8 pagineProtección AnódicaAuri Rico MartinezNessuna valutazione finora
- Ensayo Charpy PDFDocumento4 pagineEnsayo Charpy PDFguillermoNessuna valutazione finora
- GR4 P5 Chiluisa FreireDocumento3 pagineGR4 P5 Chiluisa FreireJeanMesíasNessuna valutazione finora
- Compuestos WhiskersDocumento40 pagineCompuestos WhiskersAndrés Escárraga Cuéllar0% (1)
- Corrosion Asistida Por EsfuerzoDocumento10 pagineCorrosion Asistida Por EsfuerzoDianaColomaNessuna valutazione finora
- Norma Astm E3-01Documento31 pagineNorma Astm E3-01DiegoAlejandroRamirezNessuna valutazione finora
- Celda Galvánica - Partes, Como Funciona, Aplicaciones, Ejemplos - LifederDocumento7 pagineCelda Galvánica - Partes, Como Funciona, Aplicaciones, Ejemplos - LifederAlejandro SalazarNessuna valutazione finora
- Práctica 5 Laboratorio de Desgaste y Falla - Facultad de Ingeniería Mecánica - Escuela Politécnica NacionalDocumento5 paginePráctica 5 Laboratorio de Desgaste y Falla - Facultad de Ingeniería Mecánica - Escuela Politécnica NacionalAntonio CajasNessuna valutazione finora
- Electroquimica 2019Documento27 pagineElectroquimica 2019ulises michelinNessuna valutazione finora
- El Plomo y Sus AleacionesDocumento15 pagineEl Plomo y Sus AleacionesJorge GutiérrezNessuna valutazione finora
- Capitulo 3. MaterialesDocumento59 pagineCapitulo 3. MaterialesGuillermo GutierrezNessuna valutazione finora
- Celda HullDocumento3 pagineCelda HullNancy ViridianaNessuna valutazione finora
- Influencia en Los Elementos Aleantes en Las FundicionesDocumento14 pagineInfluencia en Los Elementos Aleantes en Las FundicionesFreddy Moe Moe FelizNessuna valutazione finora
- FerroniquelDocumento16 pagineFerroniquelmariamonrroy60% (5)
- Corrosion GalvanicaDocumento11 pagineCorrosion GalvanicaFernandoiNessuna valutazione finora
- Marco Teorico Corrosion GalvanicaDocumento4 pagineMarco Teorico Corrosion GalvanicaYaneth Llasa YucraNessuna valutazione finora
- Resumen Defor PDFDocumento1 paginaResumen Defor PDFMarco Antonio Soto SonccoNessuna valutazione finora
- Formulacion de ConclusionesDocumento8 pagineFormulacion de ConclusionesMarco Antonio Soto SonccoNessuna valutazione finora
- Ingenieria Del ProyectoDocumento11 pagineIngenieria Del ProyectoMarco Antonio Soto SonccoNessuna valutazione finora
- FDDFSDocumento59 pagineFDDFSMarco Antonio Soto SonccoNessuna valutazione finora
- Gestión AmbientalDocumento25 pagineGestión AmbientalMarco Antonio Soto SonccoNessuna valutazione finora
- Termodinamica de La Fusion y Conversion de Concentrados - Termodinamica de Los Procesos de Reduccion - Fusion de OxidosDocumento20 pagineTermodinamica de La Fusion y Conversion de Concentrados - Termodinamica de Los Procesos de Reduccion - Fusion de OxidosMarco Antonio Soto SonccoNessuna valutazione finora
- CanincunucaDocumento39 pagineCanincunucaMarco Antonio Soto SonccoNessuna valutazione finora
- Junin InformacionDocumento19 pagineJunin InformacionMarco Antonio Soto SonccoNessuna valutazione finora
- Reciones Reversibles de Primer OrdenDocumento4 pagineReciones Reversibles de Primer OrdenMarco Antonio Soto SonccoNessuna valutazione finora
- TERMODINÁMICAIDocumento19 pagineTERMODINÁMICAIAndy Anibal Turpo CNessuna valutazione finora
- 300 SSP Part 3 - Cambio Auto. 09D - SPDocumento22 pagine300 SSP Part 3 - Cambio Auto. 09D - SPRoxana Elizabeth Valencia NavarrteNessuna valutazione finora
- PARAFINASDocumento30 paginePARAFINASdanicaldepetroleosNessuna valutazione finora
- Mantenimiento de Motores MarinosDocumento2 pagineMantenimiento de Motores MarinosMariano Bonet FeoNessuna valutazione finora
- AISI439Documento8 pagineAISI439RubenNessuna valutazione finora
- Bioventeo ExpoDocumento13 pagineBioventeo ExpoRoberto De La PeñaNessuna valutazione finora
- Rotrans Tambores PDFDocumento27 pagineRotrans Tambores PDFChristian Andres Pantoja100% (1)
- TRABAJO Ciclo Captura de Carbono IGCCDocumento26 pagineTRABAJO Ciclo Captura de Carbono IGCCNathaly ArciniegaNessuna valutazione finora
- UFX1604 User ManualDocumento35 pagineUFX1604 User ManualYakaNessuna valutazione finora
- Diseño de Plantas de TratamientoDocumento45 pagineDiseño de Plantas de TratamientoAndrés BonillaNessuna valutazione finora
- Homologacion de Procedimiento de SoldaduraDocumento106 pagineHomologacion de Procedimiento de SoldaduraAlvaro GapNessuna valutazione finora
- Guía Taller de Tecnología - Sexto - Periodo IIDocumento8 pagineGuía Taller de Tecnología - Sexto - Periodo IIfafimegoNessuna valutazione finora
- Mant Composteadora Rufas Cajas 2023Documento80 pagineMant Composteadora Rufas Cajas 2023Harry MedinaNessuna valutazione finora
- Practica de Laboratorio 1Documento10 paginePractica de Laboratorio 1alvaroortizcruz100% (1)
- BANCO DE PREGUNTAS 2das EXPOSICIÓNESDocumento16 pagineBANCO DE PREGUNTAS 2das EXPOSICIÓNESjessica ontiverosNessuna valutazione finora
- Estudo Concreto PesadoDocumento190 pagineEstudo Concreto PesadoChristian SantosNessuna valutazione finora
- Cambiador de Tomas AbbDocumento51 pagineCambiador de Tomas Abbcaecastellon100% (2)
- Jab OnesDocumento8 pagineJab OnesMatias MirandettiNessuna valutazione finora
- Gp-Frm-Ma-001 Examen Hombre Nuevo Medio AmbienteDocumento2 pagineGp-Frm-Ma-001 Examen Hombre Nuevo Medio AmbienteEddinson Jesus Panduro NoronhaNessuna valutazione finora
- Informe Del Plan de Trabajo - LOSA SR. de LOS MILAGROSDocumento22 pagineInforme Del Plan de Trabajo - LOSA SR. de LOS MILAGROSJazmine Herrera chaparroNessuna valutazione finora
- PDF Lubricantes Moto 2T JASO FB API TCDocumento1 paginaPDF Lubricantes Moto 2T JASO FB API TCJosé Alejandro Gómez MedinaNessuna valutazione finora
- Presupuesto Analitico Calle D 1Documento22 paginePresupuesto Analitico Calle D 1brauliohpNessuna valutazione finora
- CAPITULO 10 PandeoDocumento29 pagineCAPITULO 10 PandeoUnlockd HumaNessuna valutazione finora
- Resina Epoxica Bicomponente para Acabados Sikafloor 264Documento8 pagineResina Epoxica Bicomponente para Acabados Sikafloor 264Saul AntayhuaNessuna valutazione finora
- Tema SATE 2223Documento70 pagineTema SATE 2223esNessuna valutazione finora
- Tesis Maestria Mariela BravoDocumento146 pagineTesis Maestria Mariela BravomarielabravosNessuna valutazione finora
- Dac - Glosario de TérminosDocumento32 pagineDac - Glosario de TérminosKendrick Palma SolorzanoNessuna valutazione finora
- MartensitaDocumento8 pagineMartensitaRafael QuirosNessuna valutazione finora
- Trabajo Virtual UnidoDocumento61 pagineTrabajo Virtual UnidoPercy Salas100% (1)
- Separacion de Mezclas 2Documento3 pagineSeparacion de Mezclas 2Juan Diego Gallego TachackNessuna valutazione finora