Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Frontera Móvil
Caricato da
JuanPerezCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Frontera Móvil
Caricato da
JuanPerezCopyright:
Formati disponibili
Nombre: Liz Guamán
FRONTERA MÓVIL
QUÉ SON LOS PROCESOS POLITRÓPICOS
Se denomina proceso politrópico al proceso termodinámico, generalmente ocurrido
en gases, en el que existe, tanto una transferencia de energía al interior del sistema
que contiene el o los gases como una transferencia de energía con el medio exterior
(proceso isotérmico).
El proceso politrópico obedece a la relación:
Donde p es la presión, v es un volumen específico, n, el índice politrópico, que
puede ser cualquier número real, y C es una constante.
Diferencia entre entalpia de reacción, entalpia de formación y
entalpia de combustión
La entalpía de formación es un tipo concreto de entalpía de reacción, que recibe el
nombre de entalpía de formación estándar o entalpía normal de formación si la
reacción se lleva a cabo a 25ºC y a 1 atm, que son las condiciones estándar en
termoquímica. Así, la entalpía normal o estándar de formación (también llamada a
veces calor normal de formación), se representa por ΔHof y es la variación de
entalpía cuando se forma un mol de compuesto a partir de sus elementos en estado
normal (esto es, en el estado de agregación y forma alotrópica más estable a la que
dichos elemento se hallan en condiciones estándar).
Esta entalpía de formación podrá ser positiva, reacción endotérmica, o negativa,
reacción exotérmica. Por ejemplo, es exotérmica la reacción de formación de
peróxido de hidrógeno a partir de sus elementos, hidrógeno y oxígeno, en estado
gaseoso, que es como se encuentran en condiciones estándar:
Nombre: Liz Guamán
Mientras que la reacción de formación del eteno, C2H4, es endotérmica, es decir,
absorbe calor cuando se produce:
Como vemos, en esta última reacción hemos indicado que el carbono, además de
estar en estado sólido, está en forma de grafito. Esto se debe a que el carbono tiene
distintas formas alotrópicas, es decir, compuestas por el mismo elemento pero con
distintas estructuras, como el grafito y el diamante, pero la más estable a 25ºC y a 1
atmósfera de presión es el grafito, y por este motivo es esta la forma que debemos
escoger para plantear las reacciones de formación en las que intervenga el carbono.
Esta presentación de formas alotrópicas ocurre también en otros elementos, como el
azufre, que puede presentar estructura monoclínica y rómbica, o el fósforo, que
puede tener la llama estructura de fósforo blanco y la de fósforo rojo.
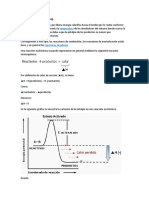
Entalpía de combustión corresponde a la energía liberada en forma de calor, en una
reacción de combustión de 1 mol de sustancia.
Puesto que las reacciones de combustión son siempre exotérmicas – como la
quema de leña o gas –, el valor de la entalpía de combustión es negativo, menos
que cero ∆H 0), pues, en razón del calor ser liberado, la energía de los productos
será menor que la de los reactantes.
Combustión completa del butano, C4H10 (g)
2 C4H10(g)+ 13O2 → 8 CO2(g) + 10 H2O ∆H0 combustión = -2878,6 kJ/mol
En la combustión del butano la variación de entalpía estándar de combustión es
igual a -2878,6 kJ/mol.
Potrebbero piacerti anche
- KMDocumento4 pagineKMAndres Felipe MozoNessuna valutazione finora
- Trabajo Práctico de Biología NM #5 - MesocosmosDocumento13 pagineTrabajo Práctico de Biología NM #5 - MesocosmosJeremy Palma82% (61)
- La CalorimetríaDocumento5 pagineLa CalorimetríaRodrigo Jose Montaño RodriguezNessuna valutazione finora
- 1.3 ENtalpíaDocumento14 pagine1.3 ENtalpíadominguezedi51Nessuna valutazione finora
- Bomba Calorimetrica.Documento5 pagineBomba Calorimetrica.javiergabriel593Nessuna valutazione finora
- La EntalpíaDocumento6 pagineLa EntalpíaStefaniaNessuna valutazione finora
- Entalpia, EntropiaDocumento19 pagineEntalpia, EntropiaDiego Javier0% (1)
- La Entalpia de FormaciónDocumento2 pagineLa Entalpia de Formaciónnoelyis camposNessuna valutazione finora
- TERMOQUIMICADocumento13 pagineTERMOQUIMICAkarla catzinNessuna valutazione finora
- Reacción ExotérmicaDocumento12 pagineReacción ExotérmicaRYUMASUNessuna valutazione finora
- Variables de EstadoDocumento10 pagineVariables de EstadoWilma Yola MamaniNessuna valutazione finora
- TermoquímicaDocumento23 pagineTermoquímicaAnibal Yarasca0% (1)
- SEMANA 11 TermoquímicaDocumento19 pagineSEMANA 11 TermoquímicayessicaNessuna valutazione finora
- Concepto de Entalpía de Reacción EstándarDocumento9 pagineConcepto de Entalpía de Reacción EstándarguiovanaNessuna valutazione finora
- U-1 Termicos 1Documento10 pagineU-1 Termicos 1Luis Silvestre H. MeloNessuna valutazione finora
- La EntalpíaDocumento8 pagineLa EntalpíaJosé AbantoNessuna valutazione finora
- Calor de Formación y ReacciónDocumento6 pagineCalor de Formación y ReacciónRobertoCarlosOrrilloMendozaNessuna valutazione finora
- TermoquimicaDocumento4 pagineTermoquimicaMarlon IlbayNessuna valutazione finora
- 5.2.1 Entalpías de CombustiónDocumento3 pagine5.2.1 Entalpías de CombustiónAnetteNessuna valutazione finora
- Entalpia de Reaccion y FormacionDocumento8 pagineEntalpia de Reaccion y Formacionmiguelav473Nessuna valutazione finora
- TERMOQUIMICADocumento6 pagineTERMOQUIMICAIsaac VeraNessuna valutazione finora
- Termoquímica y EspontaneidadDocumento13 pagineTermoquímica y EspontaneidadKarla Lizeth Bogarin RaygozaNessuna valutazione finora
- Qué Es La CombustiónDocumento9 pagineQué Es La CombustiónCriz MontezNessuna valutazione finora
- Combustión Completa e IncompletaDocumento3 pagineCombustión Completa e IncompletaJairo Tomala50% (6)
- Procesos EndotérmicosDocumento3 pagineProcesos EndotérmicosLaa ComidaaNessuna valutazione finora
- Practica TermoquimicaDocumento9 paginePractica TermoquimicaDiana MejíaNessuna valutazione finora
- Procesos de Combustión Teóricos y RealesDocumento10 pagineProcesos de Combustión Teóricos y RealesDIANA LAURA MIRANDA MUÑOZNessuna valutazione finora
- Calor de Disolucion de SolidosDocumento5 pagineCalor de Disolucion de SolidosAdrii Tirao LizecaNessuna valutazione finora
- Termoquímica EsDocumento7 pagineTermoquímica EsBrianNessuna valutazione finora
- CombustionDocumento11 pagineCombustionbarbara castilloNessuna valutazione finora
- Combustibles y CombustiónDocumento10 pagineCombustibles y CombustiónDavid AmaroNessuna valutazione finora
- Combustion Completa e IncompletaDocumento3 pagineCombustion Completa e IncompletaCatherinaAndreaNessuna valutazione finora
- Teoria de Un Proceso de CombustionDocumento28 pagineTeoria de Un Proceso de CombustionDaniel Andres Reyes LunaNessuna valutazione finora
- 1.3 Entalpia de Formación Y CombustiónDocumento27 pagine1.3 Entalpia de Formación Y CombustiónMARIA SERRANONessuna valutazione finora
- AccelDocumento2 pagineAccelxato_18_05Nessuna valutazione finora
- Termoquímica ReporteDocumento9 pagineTermoquímica ReportePaoli RuizNessuna valutazione finora
- Entalpia de CombustionDocumento5 pagineEntalpia de Combustionluis EscartinNessuna valutazione finora
- Instituto Tecnológico de México: Campus ColimaDocumento7 pagineInstituto Tecnológico de México: Campus ColimaMartin Gomez MnedozaNessuna valutazione finora
- Procesos de Entalpia yDocumento3 pagineProcesos de Entalpia yMaria Alexandra Lange Lenz100% (1)
- 1.3 Entalpia de Formación Y CombustiónDocumento27 pagine1.3 Entalpia de Formación Y CombustiónMARIA SERRANONessuna valutazione finora
- Tarea 5 PDFDocumento1 paginaTarea 5 PDFjoel joanthanNessuna valutazione finora
- Resumen Unidad 1 CengelDocumento16 pagineResumen Unidad 1 CengelEmmitaa Salas Santos100% (1)
- Tarea Clase 4Documento5 pagineTarea Clase 4Jose Luis Capistran SanchezNessuna valutazione finora
- EntalpiaDocumento3 pagineEntalpiaACH GNessuna valutazione finora
- Fisicoquimica Informe 2Documento8 pagineFisicoquimica Informe 2Alexander GUNessuna valutazione finora
- Contenido Teórico de La Practica N°4 - Laboratorio de Química IIDocumento66 pagineContenido Teórico de La Practica N°4 - Laboratorio de Química IIpartcarlaNessuna valutazione finora
- Quimica II Tercera UnidadDocumento95 pagineQuimica II Tercera UnidadLeslie OrtizNessuna valutazione finora
- Resumen 22222Documento2 pagineResumen 22222BRITHANY RIVERANessuna valutazione finora
- Energia Y Transformaciones QuimicasDocumento9 pagineEnergia Y Transformaciones Quimicasandres almagroNessuna valutazione finora
- Investigación #2 Punto Ebullicion de AlcoholesDocumento6 pagineInvestigación #2 Punto Ebullicion de AlcoholesJose ChavarriaNessuna valutazione finora
- Combustion EstequiometricaDocumento49 pagineCombustion EstequiometricaLuis Ricardo Rodriguez Vares0% (1)
- Análisis Juegos Del HambreDocumento5 pagineAnálisis Juegos Del Hambreagustinortiz754Nessuna valutazione finora
- Combustible y CombustionDocumento20 pagineCombustible y Combustionla.sabrina2806Nessuna valutazione finora
- Laboratorio 3 TecsupDocumento3 pagineLaboratorio 3 TecsupLuisEnriqueCarbajalHuisaNessuna valutazione finora
- Resumen 1 de Reacciones Químicas PDFDocumento19 pagineResumen 1 de Reacciones Químicas PDFYahaira Guerra CedeñoNessuna valutazione finora
- Oxidación Del CarbonDocumento4 pagineOxidación Del CarbonJuanjesus FerrerNessuna valutazione finora
- REACCIÓN QUÍMICA Es El Proceso en El Que Las Sustancias Se Unen para Transformarse en Otras DiferentesDocumento12 pagineREACCIÓN QUÍMICA Es El Proceso en El Que Las Sustancias Se Unen para Transformarse en Otras DiferentesMadeline Medina TorrezNessuna valutazione finora
- UNIDAD 2 Introducción A La Química - Combustion y EstequiometriaDocumento14 pagineUNIDAD 2 Introducción A La Química - Combustion y EstequiometriaMartin Crispino100% (2)
- Capitulo 4 Fisico QuimicaDocumento14 pagineCapitulo 4 Fisico QuimicaAdolfo Ortiz SolizNessuna valutazione finora
- Cuestionario TermoquímicaDocumento5 pagineCuestionario TermoquímicaEfrain CuellarNessuna valutazione finora
- Práctica 9Documento14 paginePráctica 9Isaac GuillenNessuna valutazione finora
- Diferencias Entre Los Tipos de EmpresasDocumento1 paginaDiferencias Entre Los Tipos de EmpresasJuanPerezNessuna valutazione finora
- BALONMANO y EcuaboleyDocumento4 pagineBALONMANO y EcuaboleyJuanPerezNessuna valutazione finora
- Evolución Biológico - Social HumanaDocumento2 pagineEvolución Biológico - Social HumanaJuanPerezNessuna valutazione finora
- Etapas Del Color 1Documento2 pagineEtapas Del Color 1JuanPerezNessuna valutazione finora
- EXTRANJERISMOSDocumento1 paginaEXTRANJERISMOSJuanPerezNessuna valutazione finora
- Expresiones Corporales y Formas de ExpresarseDocumento10 pagineExpresiones Corporales y Formas de ExpresarseJuanPerezNessuna valutazione finora
- PARROQUIA San Vicente Ferrer Reuniones DomesticasDocumento1 paginaPARROQUIA San Vicente Ferrer Reuniones DomesticasJuanPerezNessuna valutazione finora
- Que Es La Esperanza Una HojaaaDocumento2 pagineQue Es La Esperanza Una HojaaaJuanPerezNessuna valutazione finora
- GOTTFRIED WILHELM LEIBNIZ BiografiaaaaDocumento1 paginaGOTTFRIED WILHELM LEIBNIZ BiografiaaaaJuanPerezNessuna valutazione finora
- Planeación Estratégica Cuadro SinópticoDocumento2 paginePlaneación Estratégica Cuadro SinópticoJuanPerezNessuna valutazione finora
- Bullying Una HojaaaDocumento1 paginaBullying Una HojaaaJuanPerezNessuna valutazione finora
- Teoría Que Explica El Fundamento de La Posesión en RomaDocumento7 pagineTeoría Que Explica El Fundamento de La Posesión en RomaJuanPerezNessuna valutazione finora
- Bases de Datos DistribuidasDocumento5 pagineBases de Datos DistribuidasJuanPerezNessuna valutazione finora
- Autorización Interagua Jennifer RodríguezDocumento2 pagineAutorización Interagua Jennifer RodríguezJuanPerezNessuna valutazione finora
- Texto Descriptivo EstructuraDocumento6 pagineTexto Descriptivo EstructuraJuanPerezNessuna valutazione finora
- Reconoce Los Estados Físicos de La Materia Basándose en Las Propiedades IndividualesDocumento6 pagineReconoce Los Estados Físicos de La Materia Basándose en Las Propiedades IndividualesJuanPerezNessuna valutazione finora
- Tipos de Narrativa Una HojaaaDocumento1 paginaTipos de Narrativa Una HojaaaJuanPerezNessuna valutazione finora
- WALL STREET Academia de InglésDocumento1 paginaWALL STREET Academia de InglésJuanPerezNessuna valutazione finora
- Videos OrtegaDocumento6 pagineVideos OrtegaJuanPerezNessuna valutazione finora
- Versos Chistes Refranes Decimas A GuayaquilDocumento2 pagineVersos Chistes Refranes Decimas A GuayaquilJuanPerezNessuna valutazione finora
- Un Avance Científico o Noticia Relacionado Sobre El Rastreo de GenotecasDocumento3 pagineUn Avance Científico o Noticia Relacionado Sobre El Rastreo de GenotecasJuanPerezNessuna valutazione finora
- Trabajos de Edad de Cobre y Bronce Edad de HierroDocumento1 paginaTrabajos de Edad de Cobre y Bronce Edad de HierroJuanPerezNessuna valutazione finora
- Trágica Muerte Del Expresidente Jaime Roldos Aguilera y Funeral de EstadoDocumento2 pagineTrágica Muerte Del Expresidente Jaime Roldos Aguilera y Funeral de EstadoJuanPerezNessuna valutazione finora
- Charles Chaplin Biografia OtroDocumento14 pagineCharles Chaplin Biografia OtroJuanPerezNessuna valutazione finora
- Vías en Desarrollo para Lograr Una Igualdad de La EducaciónDocumento1 paginaVías en Desarrollo para Lograr Una Igualdad de La EducaciónJuanPerezNessuna valutazione finora
- 2 Acontecimientos Del 27 de Diciembre de 1995Documento1 pagina2 Acontecimientos Del 27 de Diciembre de 1995JuanPerezNessuna valutazione finora
- Quién Fue HammurabiDocumento1 paginaQuién Fue HammurabiJuanPerezNessuna valutazione finora
- Estructura Del Sistema Nacional de EducaciónDocumento3 pagineEstructura Del Sistema Nacional de EducaciónJuanPerezNessuna valutazione finora
- 10 BuscadoresDocumento2 pagine10 BuscadoresJuanPerezNessuna valutazione finora
- 20 AmorfinosDocumento2 pagine20 AmorfinosJuanPerez100% (3)
- Indice RiteDocumento7 pagineIndice RiteJGabriel LedezmaNessuna valutazione finora
- Factor Z para 2 Fases (Traduccion)Documento4 pagineFactor Z para 2 Fases (Traduccion)Itaty Baños100% (1)
- Práctica 3Documento2 paginePráctica 3Lizbeth CaizaNessuna valutazione finora
- Desalinización de Agua de Mar en El PerúDocumento17 pagineDesalinización de Agua de Mar en El PerúJuan Luis Cárdenas EscuderoNessuna valutazione finora
- Introduccion - Tipos de MembranaDocumento9 pagineIntroduccion - Tipos de MembranaJose Luis CTNessuna valutazione finora
- Ensayos de LabDocumento8 pagineEnsayos de LabLizeth Juliana Arenas CardenasNessuna valutazione finora
- Tarea No.6 Lanzaderas de NADH+ Y H+Documento9 pagineTarea No.6 Lanzaderas de NADH+ Y H+Rodrigo ViguerasNessuna valutazione finora
- Transferencia de CalorDocumento6 pagineTransferencia de CalorJoselyn KarinaNessuna valutazione finora
- Informe de ESTERILIDAD EN CONSERVASDocumento10 pagineInforme de ESTERILIDAD EN CONSERVASGERALDINE RAMIREZ TOVARNessuna valutazione finora
- Seminario Espumas en EorDocumento33 pagineSeminario Espumas en EorSebastian MorenoNessuna valutazione finora
- Especificaciones - Tecnicas.sanitarias ApipaDocumento15 pagineEspecificaciones - Tecnicas.sanitarias ApiparonyroNessuna valutazione finora
- Método de Reducción de Azul de MetilenoDocumento10 pagineMétodo de Reducción de Azul de MetilenoFranklin Joel Eche PoloNessuna valutazione finora
- PG - sb.001-V1-Programa de Limpieza y DesinfecciònDocumento19 paginePG - sb.001-V1-Programa de Limpieza y DesinfecciònLiliana Cobos ZambranoNessuna valutazione finora
- Ensayo de Chispa y LimaDocumento6 pagineEnsayo de Chispa y LimaJavier CasanovaNessuna valutazione finora
- Conocimiento y Uso de Los Equipos Del LaboratorioDocumento6 pagineConocimiento y Uso de Los Equipos Del LaboratorioYusaki CruzNessuna valutazione finora
- El Flujo de Energía en Los EcosistemasDocumento4 pagineEl Flujo de Energía en Los EcosistemasKevin SanchezNessuna valutazione finora
- Qué Es La Tabla Periódica de Los ElementosDocumento7 pagineQué Es La Tabla Periódica de Los ElementosJean Carlos Páez RamírezNessuna valutazione finora
- Informe 9 - Quimica - Turno-Martes 12.30 AmDocumento8 pagineInforme 9 - Quimica - Turno-Martes 12.30 Amgianella calla67% (3)
- Formato de Entrega Tarea 4Documento14 pagineFormato de Entrega Tarea 4NataliaNessuna valutazione finora
- Químico BiologicoDocumento4 pagineQuímico BiologicoIgnacio VazquezNessuna valutazione finora
- FT - Pica Epoxi FondoDocumento2 pagineFT - Pica Epoxi FondoPedro Jose Garces AlarconNessuna valutazione finora
- Val #007 - Ad Febrero 2022Documento34 pagineVal #007 - Ad Febrero 2022Jessica TatianaNessuna valutazione finora
- Investigación 2Documento17 pagineInvestigación 2Saúl Díaz ArenasNessuna valutazione finora
- Los Esteres y AminasDocumento7 pagineLos Esteres y AminasLeila MamaniNessuna valutazione finora
- Inhibidores. Enzimas Alostéricas. ZimógenosDocumento3 pagineInhibidores. Enzimas Alostéricas. ZimógenosSofia Micaela Franco ZevallosNessuna valutazione finora
- Actividad 3 - Unidad I - Simulación 1Documento3 pagineActividad 3 - Unidad I - Simulación 1Abraham FigueroaNessuna valutazione finora
- Hidratación CutaneaDocumento3 pagineHidratación Cutaneadt laboratoriosescolNessuna valutazione finora
- Examen Quimica Organica 2Documento1 paginaExamen Quimica Organica 2Anthony100% (1)