Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Determinación del punto isoeléctrico de la caseína en leche
Caricato da
ANiita GAbiiela ArriiagaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Determinación del punto isoeléctrico de la caseína en leche
Caricato da
ANiita GAbiiela ArriiagaCopyright:
Formati disponibili
PRÁCTICA No.
2 EXTRACCIÓN DE CASEÍNA Y DETERMINACIÓN DE PI
PRACTICE No. 2 CASEIN EXTRACTION AND DETERMINATION OF PI
Bioquímica
Bogotá, Colombia
24/10/2015
Resumen
En diversos compuestos conformados por macromoléculas se presentan fenómenos como la
precipitación, a partir de la cual se da lugar a diferentes productos. Este es el caso de la caseína,
la cual es la proteína que se encuentra en mayor cantidad en la leche y debido a su punto
isoeléctrico presenta la característica de precipitación. A partir de la precipitación de la caseína
por acción del ácido acético, su tratamiento químico y la preparación de 10 muestras con
diferentes ajustes de pH, se pudo medir su absorbancia mediante el método de espectrofotometría
UV/Vis y construir la curva de titulación, para luego determinar el punto isoeléctrico, el cual fue
de 4,67, presentando un porcentaje de error de 1,52, teniendo como referencia el valor de 4,6.
Palabras clave: Espectrofotometría UV/Vis, Caseína, Punto isoeléctrico.
Abstract
In various compounds formed of macromolecules such as precipitation phenomena occur, from
which it gives rise to different products. This is the case of casein, which is the protein found in
greater amounts in the milk and due to its isoelectric point has the characteristic of precipitation.
From the precipitation of casein by the action of acetic acid, the chemical treatment and
preparation of 10 samples with different pH adjustments, absorbance could be measured by the
method of UV / Vis spectrophotometry and build the titration curve for then determine the
isoelectric point, which was 4.67, showing an error rate of 1.52, with reference to the value of
4.6.
Keys words: Spectrophotometry UV/Vis, Casein, Isoelectric point.
1. Introducción número distinto de grupos ionizables que se
neutralizan a diferente pH. La caseína es una
de las fosfoproteínas de la leche que se
En las proteínas, como en los aminoácidos y
precipita a pH de 4.6 (Segal & Ortega,
en cualquier molécula anfotérica, las cargas
2005).
pueden ser neutralizadas de manera tal que
la carga neta sea igual a cero. Este proceso En la leche, la caseína se encuentra incluida
se realiza al modificar el pH del medio en el en un complejo salino en estado micelar, que
que se encuentren estas moléculas. Si en una se comporta como sustancia homogénea. La
mezcla de proteína se alcanza el punto composición de la caseína isoeléctrica varía
isoeléctrico de una de ellas, ésta se precipita, de una especie a otra. En particular, la
mientras que el resto quedan disueltas. La caseína humana es más rica en azufre, en
razón es que la composición química de cistina y en glúcidos que la caseína de vaca
cada proteína es característica y presenta un (Lacad Godina, 1985). En la presente
práctica se extrae la caseína mediante la 1 0,5mL 9,5mL -
acidificación con ácido acético y se 2 1,0mL 9,0mL -
determina su punto isoeléctrico, es decir, el 3 1,5mL 8,5mL -
pH en el cual los cuerpos químicos 4 2,0mL 8,0mL -
5 3,0mL 7,0mL -
disociados presentan una igualdad de cargas
6 4,0mL 6,0mL -
negativas y positivas. 7 6,0mL 4,0mL -
8 8,0mL 2,0mL -
2. Materiales y métodos
9 6,0mL - 4,0mL
En un vaso de precipitado de 50mL se 10 8,0mL - 2,0mL
Tabla 1. Proporciones de soluciones de análisis
adicionaron 10mL de leche, se agregó 1mL
de ácido acético para precipitar la caseína, 3. Resultados
posteriormente se inicia a filtrar. Luego se
procede a adicionar 20mL de etanol, El método que se usó en la práctica para la
agitando durante 5 minutos. Al descartar el obtención de la caseína fue mediante
etanol, se agregaron 20mL de éter etílico, acidificación, con ácido acético, a una
llevando a agitación. Al filtrar nuevamente muestra de leche. A partir de esto, se obtuvo
la caseína, se pesaron 50mg de muestra, se un precipitado blanco, esto debido a que la
adicionó agua destilada y KOH, disolviendo solubilidad de la caseína disminuye a un
totalmente la caseína. Dicha solución se valor de pH 4,6 y el pH de la leche se
transfirió cuantitativamente a un balón encuentra a un valor de 6.6; al adicionar
aforado con ácido acético, para preparar una acido las cargas de la proteína se
serie de soluciones con distintas relaciones neutralizaran y su desnaturalización produce
en volúmenes de reactivos. la precipitación tal como se observó en la
práctica (Gil Hernández, 2010).
En la Tabla 1. se observan las cantidades
necesarias para tener en cuenta en el análisis Lo anterior se logró evidenciar al realizar la
de precipitado y de obtención del punto adición de proporciones de ácido de ácido y
isoeléctrico. Dado a que cada condición va a acetato de sodio al tubo 7, dando un pH de
permitir la medición en el espectrofotómetro valor cercano a 4.6, siendo de 4,67. Este
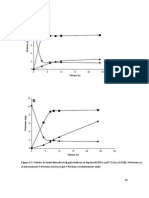
UV/Vis. Dando como resultado datos que dato se observa en la Gráfica 1, en donde se
generen una gráfica para la posterior aprecia que es el punto más alto y se infiere
determinación del pI. que es el punto isoeléctrico. Este dato se
compara con el teórico, para así calcular el
porcentaje de error, confirmando si el
método fue acertado y que tan alejado esta la
parte experimental de los datos reportados
en la literatura.
Acetato Ác. Ác. %Error = | |*100%
Tubo de sodio Acético Acético
0,1M 0,1M 0,01M %Error = | |*100%
%Error = 1,52%
Tubo A pH
Blanco 0,000
1 0,027 3,24
2 0,033 3,68
3 0,017 3,78
4 0,000 3,98
5 0,001 4,20
6 0,000 4,48
7 0,034 4,67
8 0,004 5,10
9 0,000 5,50
10 -0,001 6,16
Tabla 2. Datos para la construcción de la gráfica de A vs pH
Punto isoeléctrico experimental de la caseína
0,040
0,035 pI apróx.
4,67
0,030
0,025
Absorbancia
0,020
0,015
0,010
0,005
0,000
-0,005
0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00
pH
Gráfico 1. Determinación de punto isoeléctrico experimental de la caseína presente en leche entera.
Al seguir observando la Gráfica 1. se
observan unos picos muy bajos en los
puntos de pH entre 3,98 y 4,48. Esto se
puede deber a una inadecuada preparación
de la muestra en los tubos 4, 5 y 6, en donde
tal vez no se contó con las proporciones
correctas de los reactivos, afectando la Gil Hernández, Á. (2010). Tratado de
muestra y de esta forma llevando a una Nutrición: Composición y calidad
incorrecta lectura de la absorbancia. nutritiva de los alimentos. Madrid:
Editorial Médica Panamericana, D.L.
La absorbancia se ve afectada de manera
directa por la turbidez de las muestras, de Lacad Godina, A. (1985). Ciencia de la
esta manera, si una muestra presentaba alta leche. Principios de técnica lechera.
turbidez la lectura saldría incorrecta. De Barcelona: Editorial Reverté, S.A.
igual forma, pueden interferir diversos Segal, C., & Ortega, G. (2005). Manual de
compuestos en la muestra que absorben en el práctivas biología molecular de la
UV/Vis. célula I. México: UNAM.
Por otro lado, la adición de KOH a la Vian Otuño, Á. (2006). Introducción a la
caseína que se encontraba sólida produjo un química industrial. Barcelona:
efecto de solubilización, ya que al ser un Editorial Reverté.
compuesto básico, tiene la propiedad de
regenerar el medio hasta alcanzar las
condiciones iniciales de la muestra.
4. Conclusiones
Debido a las propiedades de precipitación
que presenta la caseína, es posible realizar
una medición de su punto isoeléctrico a
partir de una desestabilización por
acidificación.
El pI experimental, obtenido a partir de la
Gráfica 1. fue de 4,67. Mediante la
comparación con el pI reportado en la
literatura, se obtuvo un % de error de 1,52%.
Se infiere que la práctica se realiza con un
98,49% de exactitud, esto se debe a errores
comprendidos en el procedimiento de
extracción de la caseína.
5. Bibliografía
Potrebbero piacerti anche
- Determinación del punto isoeléctrico de la caseínaDocumento3 pagineDeterminación del punto isoeléctrico de la caseínaDarien Molina100% (1)
- Extraccion de CaseinaDocumento4 pagineExtraccion de CaseinaMariaFernandaAcevedoOrtizNessuna valutazione finora
- Punto IsoelectricoDocumento5 paginePunto IsoelectricoAntonio CruzNessuna valutazione finora
- AlbuminaDocumento4 pagineAlbuminaFernandoMora0% (1)
- Tema 2. Equilibrio Ácido-BaseDocumento107 pagineTema 2. Equilibrio Ácido-Baseotavo ronaldNessuna valutazione finora
- Método de BradfordDocumento2 pagineMétodo de BradfordAbril AranaNessuna valutazione finora
- Titulación de Aminoácidos Lab 1 BioquimicaDocumento10 pagineTitulación de Aminoácidos Lab 1 BioquimicaCamilo VeraNessuna valutazione finora
- Organica 3 Practica 1Documento7 pagineOrganica 3 Practica 1marielaNessuna valutazione finora
- Informe ProteinasdelalecheDocumento5 pagineInforme ProteinasdelalecheMARÍA JOSÉ JIMÉNEZ RAMÍREZNessuna valutazione finora
- Practica 5Documento8 paginePractica 5Jennifer Muñoz50% (2)
- Termodinamica Aplicada en El Cuerpo HumanoDocumento4 pagineTermodinamica Aplicada en El Cuerpo Humanomanolo sanchezNessuna valutazione finora
- AmortiguadoresDocumento4 pagineAmortiguadoresrocio_11Nessuna valutazione finora
- Catálisis enzimática: Mecanismo de acción de la quimotripsinaDocumento3 pagineCatálisis enzimática: Mecanismo de acción de la quimotripsinaconniewlgNessuna valutazione finora
- Identificación de aminoácidos y proteínasDocumento6 pagineIdentificación de aminoácidos y proteínasNayeli PeñaNessuna valutazione finora
- Laboratorio de Aminoácidos y ProteínasDocumento8 pagineLaboratorio de Aminoácidos y ProteínasKaren RestrepoNessuna valutazione finora
- Aminoácidos y péptidos: estructura, clasificación y propiedadesDocumento14 pagineAminoácidos y péptidos: estructura, clasificación y propiedadesFrancisco Alejandro Torres GarciaNessuna valutazione finora
- Aislamiento de proteínas lácteasDocumento8 pagineAislamiento de proteínas lácteasMARIANA ZAPATA ALZATENessuna valutazione finora
- Tema 8 - Cinetica Enzimatica Farmacia PDFDocumento12 pagineTema 8 - Cinetica Enzimatica Farmacia PDFMariciell Larissa Gonzales TiconaNessuna valutazione finora
- Práctica 3. PrecipitaciónDocumento3 paginePráctica 3. PrecipitaciónEli Medrano100% (1)
- Informe Bioquimica N°4Documento9 pagineInforme Bioquimica N°4ESTEBAN JAIR RODAS CASTILLONessuna valutazione finora
- Sintesis de AcetanilidaDocumento2 pagineSintesis de AcetanilidaAndy PhyNessuna valutazione finora
- Reporte PolimerizaciónDocumento6 pagineReporte PolimerizaciónMaría José Rosales RealNessuna valutazione finora
- Aislamiento de ProteínasDocumento5 pagineAislamiento de ProteínasCarlos AONessuna valutazione finora
- BiuretDocumento4 pagineBiuretMassielBGNessuna valutazione finora
- PRACTICA 6 Fosfolipi 2014 IDocumento4 paginePRACTICA 6 Fosfolipi 2014 IYvonne MillsNessuna valutazione finora
- Bioquimica Info 01 FinakDocumento34 pagineBioquimica Info 01 FinakTorresssssNessuna valutazione finora
- Laboratorio de Bioquímica2Documento12 pagineLaboratorio de Bioquímica2DDGC0% (1)
- Informe Aminoacidos y ProteinasDocumento7 pagineInforme Aminoacidos y ProteinasLyseth GómezNessuna valutazione finora
- Practica 4Documento5 paginePractica 4Luisa OrtizNessuna valutazione finora
- Reacción de FischerDocumento7 pagineReacción de FischerJairo PachecoNessuna valutazione finora
- ProteínasDocumento10 pagineProteínasJoanSalvadorRussoCabreraNessuna valutazione finora
- Determinacion de CarbohidratosDocumento8 pagineDeterminacion de CarbohidratosJoaquin José Esquivel VergaraNessuna valutazione finora
- Inf Identifcacion de AminoacidosDocumento11 pagineInf Identifcacion de AminoacidosLuis Acosta Vega100% (1)
- Saponificación caseraDocumento12 pagineSaponificación caseraDARKBLAK99Nessuna valutazione finora
- Aislamiento proteínas lecheDocumento12 pagineAislamiento proteínas lecheJuan Pa RiosNessuna valutazione finora
- Laboratorio de Bioquímica 4Documento14 pagineLaboratorio de Bioquímica 4Ivonne Moreno AguilarNessuna valutazione finora
- Practica 11. Extracción de Ácidos Nucleicos A Partir de LevaduraDocumento11 paginePractica 11. Extracción de Ácidos Nucleicos A Partir de LevaduraDanna AnguloNessuna valutazione finora
- SÍNTESIS 2-FENILINDOLDocumento11 pagineSÍNTESIS 2-FENILINDOLKmilo Morales0% (1)
- Informe Practica #01 Determinación de Azucares Reductores Por El Método DNSDocumento6 pagineInforme Practica #01 Determinación de Azucares Reductores Por El Método DNSOsiris Zuleima Algarin MorenoNessuna valutazione finora
- Cinetica LactasaDocumento122 pagineCinetica LactasaalvarezriNessuna valutazione finora
- Curvas de Titulación de Aminoácidos - PracticaDocumento1 paginaCurvas de Titulación de Aminoácidos - PracticaMonserrat Blanquel GarcíaNessuna valutazione finora
- Cromatografía de aminoácidosDocumento7 pagineCromatografía de aminoácidosAngel ZurielNessuna valutazione finora
- Inhibición EnzimáticaDocumento13 pagineInhibición EnzimáticaChristianNessuna valutazione finora
- Aislamiento de Caseína y Lactosa de LecheDocumento7 pagineAislamiento de Caseína y Lactosa de LecheJuanJimenezNessuna valutazione finora
- LIGASADocumento13 pagineLIGASAlinces 1F2021Nessuna valutazione finora
- Determinación Del Punto Isoeléctrico de Una ProteinaDocumento7 pagineDeterminación Del Punto Isoeléctrico de Una ProteinaKali Gonzalez Petro100% (1)
- Previo 4Documento4 paginePrevio 4Marco GonzalezNessuna valutazione finora
- Aminoácidos propiedades iónicasDocumento16 pagineAminoácidos propiedades iónicasMariela Cux CutzalNessuna valutazione finora
- Informe 6 Extraccion Del Eugenol EsteDocumento10 pagineInforme 6 Extraccion Del Eugenol EsteKatherine Magdalena0% (1)
- Aislamiento de La CaseinaDocumento9 pagineAislamiento de La Caseinajerson chafloque ruizNessuna valutazione finora
- Laboratorio CaseínaDocumento9 pagineLaboratorio CaseínaMaria Alejandra Diaz MejiaNessuna valutazione finora
- Practica No. 1 M Nitrobenzoato de Metilo 2007Documento7 paginePractica No. 1 M Nitrobenzoato de Metilo 2007maye33100% (1)
- Titulacion Acido-BaseDocumento12 pagineTitulacion Acido-BaseEmiliano RodríguezNessuna valutazione finora
- LABORATORIO No.4 HIDRÓLISIS ENZIMATICA DE PROTEINASDocumento10 pagineLABORATORIO No.4 HIDRÓLISIS ENZIMATICA DE PROTEINASOrlando SuarezNessuna valutazione finora
- Generalidades FEUMDocumento1 paginaGeneralidades FEUMcarlosNessuna valutazione finora
- Práctica - LIPIDOSDocumento6 paginePráctica - LIPIDOSFernando MosqueraNessuna valutazione finora
- Informe Bioquimica AminoacidosDocumento8 pagineInforme Bioquimica AminoacidosMaurita Castaño92% (12)
- Determinación del punto isoeléctrico de la caseína mediante acidificaciónDocumento3 pagineDeterminación del punto isoeléctrico de la caseína mediante acidificaciónPaola CipaconNessuna valutazione finora
- Extraccion de La Casina y Detrminacion Del Punto IsoelectricoDocumento6 pagineExtraccion de La Casina y Detrminacion Del Punto Isoelectricoanalisis quimico cualitativoNessuna valutazione finora
- Extracción de La Caseina y Determinación Del Punto IsoelectricoDocumento10 pagineExtracción de La Caseina y Determinación Del Punto Isoelectricokaren mercadoNessuna valutazione finora
- Catálisis homogénea enantioselectivaDocumento296 pagineCatálisis homogénea enantioselectivaANiita GAbiiela ArriiagaNessuna valutazione finora
- Tablas 20787Documento20 pagineTablas 20787Santiago Alexander Borges HernandezNessuna valutazione finora
- CUESTIONARIODocumento1 paginaCUESTIONARIOANiita GAbiiela ArriiagaNessuna valutazione finora
- AminasDocumento26 pagineAminasElsa Cecilia MillanNessuna valutazione finora
- Informe Final de Quimica Fisica IIDocumento5 pagineInforme Final de Quimica Fisica IIVictorR.AriasNessuna valutazione finora
- Introduccion 14681Documento11 pagineIntroduccion 14681ANiita GAbiiela ArriiagaNessuna valutazione finora
- Manual para La Elaboracion de Anteproyecto e Informe Tecnico de Residencia Profesional 1.0Documento28 pagineManual para La Elaboracion de Anteproyecto e Informe Tecnico de Residencia Profesional 1.0ANiita GAbiiela ArriiagaNessuna valutazione finora
- Tablas IRDocumento14 pagineTablas IRItzel OrtaNessuna valutazione finora
- OrbitalesMoleculares 11143Documento50 pagineOrbitalesMoleculares 11143Juan Torres PNessuna valutazione finora
- Aplicacion de Cuestionario y Caso de Alumna Con Altas Capacidades5Documento10 pagineAplicacion de Cuestionario y Caso de Alumna Con Altas Capacidades5Justo Note4Nessuna valutazione finora
- Aminas QO3 PDFDocumento34 pagineAminas QO3 PDFANiita GAbiiela ArriiagaNessuna valutazione finora
- AminasDocumento69 pagineAminasANiita GAbiiela ArriiagaNessuna valutazione finora
- Simulador EconómicoDocumento6 pagineSimulador EconómicoANiita GAbiiela ArriiagaNessuna valutazione finora
- Capitulo 10Documento19 pagineCapitulo 10dexgigiNessuna valutazione finora
- Reporte ObraDocumento1 paginaReporte ObraANiita GAbiiela ArriiagaNessuna valutazione finora
- Tema1 Catalizadores RuaDocumento43 pagineTema1 Catalizadores RuanatyrojasNessuna valutazione finora
- Lista de Servicios AuxiliaresDocumento23 pagineLista de Servicios AuxiliaresANiita GAbiiela ArriiagaNessuna valutazione finora
- Apuntes RMDocumento145 pagineApuntes RMDK Samano RamosNessuna valutazione finora
- CatalogoDocumento7 pagineCatalogoANiita GAbiiela ArriiagaNessuna valutazione finora
- Protocol oDocumento17 pagineProtocol oANiita GAbiiela ArriiagaNessuna valutazione finora
- Proceso Con ReactorDocumento4 pagineProceso Con ReactorANiita GAbiiela ArriiagaNessuna valutazione finora
- TrabajoDocumento478 pagineTrabajoMarlen NarroNessuna valutazione finora
- Fenomenos ExtranjeroDocumento69 pagineFenomenos ExtranjeroTutu Scribd0% (1)
- Hidrodesalquilacion Del Tolueno para Obtener BencenoDocumento8 pagineHidrodesalquilacion Del Tolueno para Obtener Bencenomari100% (1)
- 2.3-2.5 Equilibrio Liquido Vapor (Vle) para Mezclas BinariasDocumento10 pagine2.3-2.5 Equilibrio Liquido Vapor (Vle) para Mezclas BinariasANiita GAbiiela ArriiagaNessuna valutazione finora
- TrabajoDocumento478 pagineTrabajoMarlen NarroNessuna valutazione finora
- Diagrama de BloquesDocumento8 pagineDiagrama de BloquesLuis Martin GNessuna valutazione finora
- 2.3-2.5 Equilibrio Liquido Vapor (Vle) para Mezclas BinariasDocumento10 pagine2.3-2.5 Equilibrio Liquido Vapor (Vle) para Mezclas BinariasANiita GAbiiela ArriiagaNessuna valutazione finora
- IntroducciónDocumento92 pagineIntroducciónJose SerranoNessuna valutazione finora
- Tema 05 Estudio de MercadoDocumento46 pagineTema 05 Estudio de MercadogustavoyantalemaNessuna valutazione finora
- Calculo Por Elementos FinitosDocumento4 pagineCalculo Por Elementos FinitosAndrea AcuñaNessuna valutazione finora
- Actividades 7 Origen Del Sistema Solar-MartitaDocumento2 pagineActividades 7 Origen Del Sistema Solar-MartitaPaula Alondra López AjúNessuna valutazione finora
- Plan de Desarrollo de CochabambaDocumento44 paginePlan de Desarrollo de CochabambaRolando BarrientosNessuna valutazione finora
- IBM Guardium - SPA - ShortDocumento18 pagineIBM Guardium - SPA - ShortElmer Ronald Vargas CartagenaNessuna valutazione finora
- Semana 2: Egiptología (Egyptology)Documento182 pagineSemana 2: Egiptología (Egyptology)jeycy1002Nessuna valutazione finora
- Guía Productor Consumidor AllenBradlleyDocumento9 pagineGuía Productor Consumidor AllenBradlleyAndres CuichanNessuna valutazione finora
- Hay Que Ajustar Primero La Dureza Cálcica o La Alcalinidad en Una PiscinaDocumento2 pagineHay Que Ajustar Primero La Dureza Cálcica o La Alcalinidad en Una PiscinaNilsNessuna valutazione finora
- Ley de Ohm: Medición de resistencias y comprobación de la leyDocumento6 pagineLey de Ohm: Medición de resistencias y comprobación de la leyNgl Salvador PalaNessuna valutazione finora
- Paisaje Con Papel de Volantin. Clase 2Documento2 paginePaisaje Con Papel de Volantin. Clase 2Cynthia AndreaNessuna valutazione finora
- Maya Cartonera - 20 Poetas ChiapanecasDocumento70 pagineMaya Cartonera - 20 Poetas ChiapanecasnoirukaNessuna valutazione finora
- Guia Teorema de CosenoDocumento12 pagineGuia Teorema de Cosenojuan pablo bernal farfanNessuna valutazione finora
- Resolución Expresión BooleanaDocumento2 pagineResolución Expresión BooleanaserolfitnasNessuna valutazione finora
- Tipos de micrófonos según su construcción y captaciónDocumento4 pagineTipos de micrófonos según su construcción y captaciónKatherine HerreraNessuna valutazione finora
- MEDIDASnDEnPESOnYnVOLUMENnnCONVERSIONESn 585f356024ca41aDocumento4 pagineMEDIDASnDEnPESOnYnVOLUMENnnCONVERSIONESn 585f356024ca41aKevinCifuentes100% (1)
- El Sistema de Circulacion Del TaladroDocumento2 pagineEl Sistema de Circulacion Del TaladroRicardo J Gonzalez GNessuna valutazione finora
- Un Gato Construye Una FamiliaDocumento89 pagineUn Gato Construye Una FamiliaMika BrightNessuna valutazione finora
- Plan de vida personal y equilibrioDocumento23 paginePlan de vida personal y equilibrioMILENA HERNANDEZ AMAYANessuna valutazione finora
- Cengel Capitulo+7Documento48 pagineCengel Capitulo+7VDNessuna valutazione finora
- Automatización Industrial: Circuitos Eléctricos y AutomatismosDocumento23 pagineAutomatización Industrial: Circuitos Eléctricos y AutomatismosRonalAlcantaraHuaripataNessuna valutazione finora
- Portafolio de ServiciosDocumento5 paginePortafolio de ServiciosJuan ChaparroNessuna valutazione finora
- Radiactividad en El Proceso de Reciclado de ChatarraDocumento10 pagineRadiactividad en El Proceso de Reciclado de ChatarraSbaz22Nessuna valutazione finora
- Anexo 1. Instrumento Autoevaluación PAPE (v1)Documento64 pagineAnexo 1. Instrumento Autoevaluación PAPE (v1)Norelis Herrera CassianiNessuna valutazione finora
- La Quema de CombustiblesDocumento14 pagineLa Quema de CombustiblesLenin Yasig100% (1)
- Pitidiasis Rosada de GibertDocumento6 paginePitidiasis Rosada de GibertOdel JavierNessuna valutazione finora
- Clase N - 2 Requerimientos CaloricosDocumento19 pagineClase N - 2 Requerimientos CaloricosMijael Vega AcuñaNessuna valutazione finora
- Fracturas Del Cartílago de CrecimientoDocumento2 pagineFracturas Del Cartílago de CrecimientoArantzaNessuna valutazione finora
- Presentacion Pisos de Madera CrisDocumento108 paginePresentacion Pisos de Madera CrisGean Pierre RiosNessuna valutazione finora
- SEGI02 TareaDocumento6 pagineSEGI02 TareaKiko AcabNessuna valutazione finora
- DC-3 Invalida10Documento2 pagineDC-3 Invalida10Fabiola JuárezNessuna valutazione finora
- Capitulo 2. Teoria de SistemasDocumento9 pagineCapitulo 2. Teoria de SistemasLuis Eduardo Cogollo BaldirisNessuna valutazione finora