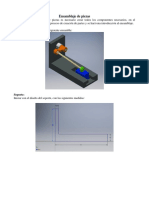
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
GLUCOSA
Caricato da
Edgar CastilloCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
GLUCOSA
Caricato da
Edgar CastilloCopyright:
Formati disponibili
GLUCOSE MR
PRESENTACION GLUCOSA MR
1129005 Glucosa MR 2 x 50 mL Método enzimático colorimétrico
REF 1129010 Glucosa MR 4 x 100 mL
1129015 Glucosa MR 4 x 250 mL PUNTO FINAL
1129020 Glucosa MR 5 x 50 mL
Sólo para uso diagnóstico in vitro
FUNDAMENTO INTERFERENCIAS
En la reacción de Trinder1,2, la glucosa es oxidada a D-gluconato − Muestras altamente ictéricas o lipémicas precisan de un
por la glucosa oxidasa (GOD), con formación de peróxido de blanco para corregirlas. Emplear el mismo volumen de muestra
hidrógeno. En presencia de peroxidasa (POD), el fenol y la 4- con solución salina en vez de reactivo.
aminoantipirina (4-AA) se condensan por acción del peróxido de − Se hallan descritas diversas sustancias interferentes.3,4
hidrógeno, formando una quinonaimina roja proporcional a la
concentración de glucosa en la muestra.
GOD
EQUIPO ADICIONAL
β-D-Glucosa + H2O + O2 D-Gluconato + H2O2
− Fotómetro o colorímetro para mediciones a 500 ± 20 nm.
− Unidad termostatizada ajustable a 37ºC.
H2O2
− Pipetas de volumen variable para reactivos y muestras.
4-AA + Fenol Quinonaimina + H2O
POD
COMPOSICION DE LOS REACTIVOS TECNICA
R1 Monoreactivo. Tampón fosfatos 100 mmol/L pH 7,5, 1. Equilibrar reactivos y muestras a temperatura ambiente.
glucosa oxidasa > 10 KU/L, peroxidasa > 2 KU/L, 4- 2. Pipetear en tubos rotulados:
aminoantipirina 0,5 mmol/L, fenol 5 mmol/L.
CAL Patrón de Glucosa. Glucosa 100 mg/dL (5,55 mmol/L). TUBOS Blanco Muestra Patrón
Patrón primario de matriz orgánica. Trazable al Material
de Referencia Certificado 914a y 909. Monoreactivo 1,0 mL 1,0 mL 1,0 mL
Muestra − 10 µL −
ALMACENAMIENTO Y ESTABILIDAD Patrón − − 10 µL
Conservar a 2-8ºC.
3. Mezclar y reposar los tubos 10 minutos a temperatura ambiente
El Monoreactivo y el Patrón son estables hasta la fecha de
ó 5 minutos a 37ºC.
caducidad indicada en la etiqueta.
4. Leer la absorbancia (A) de la muestra y el patrón a 500 nm
Desechar el reactivo cuando presente una absorbancia superior a
frente al blanco de reactivo.
0,300 a 500 nm frente agua destilada o no recupere los valores
declarados de los sueros control.
El color es estable 2 horas protegido de la luz.
PREPARACION DE LOS REACTIVOS CALCULOS
El Monoreactivo y el Patrón están listos para su uso. AMuestra
x CPatrón = mg/dL glucosa
APatrón
MUESTRAS
Muestras con concentraciones superiores a 500 mg/dL deben
Suero o plasma heparinizado libre de hemólisis. diluirse 1:4 con solución salina y repetir el ensayo. Multiplicar los
La glucosa es estable unas 24 horas a 2-8ºC, cuando el suero o el resultados por 4.
plasma se separa dentro de los 30 minutos posteriores a la Para expresar los resultados en unidades SI aplicar:
extracción. mg/dL x 0,0555 = mmol/L
5
VALORES DE REFERENCIA CARACTERISTICAS ANALITICAS
Suero, plasma (en ayunas) - Linealidad. Hasta 400 mg/dL
- Precisión
Adultos 70-105 mg/dL (3,89-5,83 mmol/L)
mg/dL Intraserial Interserial
Niños 60-110 mg/dL (3,33-6,11 mmol/L) Media 56,1 114,2 360,1 56,1 114,2 360,1
DE 0,63 0,43 2,1 0,67 0,51 2,6
Neonatos 40-60 mg/dL (2,22-3,33 mmol/L)
CV% 1,12 0,37 0,58 1,19 0,46 0,72
N 10 10 10 10 10 10
Se recomienda que cada laboratorio establezca su propio rango de
referencia. Replicados: 10 por nivel. Replicados: 10 por nivel
Instrumento: CECIL CE 2021 durante 6 días.
CONTROL DE CALIDAD - Sensibilidad. A la dilución 1:100 muestra/reactivo a 510 nm , 1 mg
de glucosa da una absorbancia aproximada de 0,004.
El empleo de un calibrador para calcular los resultados permite - Correlación. Este ensayo (y) fue comparado con un método
obtener una exactitud independiente del sistema o instrumento comercial similar (x). Los resultados fueron los siguientes:
empleado.
Para un control de calidad adecuado, se incluirán en cada serie N = 30 r = 0,995 y = 0,96x - 0,437
controles valorados (normales y elevados) que se tratarán como
muestras problema.
REFERENCIAS
REF 1980005 HUMAN MULTISERA NORMAL
Valorado. Nivel normal de glucosa.
1. Trinder, P. Ann. Clin. Biochem. 6 : 24 (1969).
REF 1985005 HUMAN MULTISERA ABNORMAL 2. Barham, D. y Trinder, P. Analyst. 97 : 142 (1972).
Valorado. Nivel elevado de glucosa. 3. Szasz, B., Hurt, K. y Busch, E.W. J. Clin. Chem. Clin.
Biochem. 12 : 256 (1974).
4. Young, D.S., Pestaner, L.G. and Gibberman, P. Clin. Chem.
SIGNIFICADO CLINICO 21, Vol. 5, 10-432D (1975).
5. Tietz. N.W. Clinical Guide to Laboratory Tests, 3rd Edition.
La glucosa es una de las mayores fuentes de energía del cuerpo W.B. Saunders Co. Philadelphia, PA. (1995).
humano derivada de la degradación de los carbohidratos,
incorporados a través de la dieta diaria y regulada a través de los
procesos de gluconeogénesis (síntesis endógena a partir de
aminoácidos y otras sustancias) y glucogenolisis (degradación del
depósito de glucógeno hepático).
El nivel en sangre se mantiene a través de la ingesta y de
hormonas reguladoras como la insulina, glucagon y epinefrina.
Un aumento anormal en la tasa de glucosa sanguínea, conocida
como hiperglucemia, puede estar asociado con la diabetes mellitus
y con la hiperactividad de las glándulas adrenales, tiroides o
pituitaria.
La hipoglucemia o disminución anormal por debajo de la tasa
hallada en ayunas, se observa en casos de sobredosis de insulina,
tumores secretores de insulina, hipopituitarismo, enfermedad de
Addison, mixedema y condiciones que interfieren con su absorción.
La determinación de glucosa en sangre, es una prueba clave para
evaluar y diagnosticar desórdenes relacionados con el
metabolismo de los carbohidratos.
NOTAS
− En muestras hemolizadas los enzimas liberados de los
hematíes originan una disminución de la tasa de glucosa
presente, obteniéndose valores bajos falsos.
− Adicionalmente, la catalasa presente compite con la peroxidasa
B1129-1/0312
por el peróxido de hidrógeno dando asimismo valores erróneos R1.cas
bajos.
Potrebbero piacerti anche
- Caracterización de defectos UT PAUTDocumento51 pagineCaracterización de defectos UT PAUTEdgar CastilloNessuna valutazione finora
- Análisis de defectos en tubería de acero mediante ultrasonidoDocumento8 pagineAnálisis de defectos en tubería de acero mediante ultrasonidoEdgar CastilloNessuna valutazione finora
- Curso de Diseño y Construcción de Recipientes de Presión (Color)Documento192 pagineCurso de Diseño y Construcción de Recipientes de Presión (Color)Edgar CastilloNessuna valutazione finora
- RuedaDocumento1 paginaRuedaEdgar CastilloNessuna valutazione finora
- Envía guía estudio con formato G#.Apellido.Apellido.Nombre.AsignaturaDocumento1 paginaEnvía guía estudio con formato G#.Apellido.Apellido.Nombre.AsignaturaCristhian AmpudiaNessuna valutazione finora
- Diseño Mecánico Presión ExternaDocumento29 pagineDiseño Mecánico Presión ExternaEdgar CastilloNessuna valutazione finora
- Tablas DinamicasDocumento36 pagineTablas DinamicasRuben Justiniano PaniaguaNessuna valutazione finora
- Manual de Mecánica BásicaDocumento15 pagineManual de Mecánica Básicajemoc261Nessuna valutazione finora
- Actividad de Aprendizaje 2Documento18 pagineActividad de Aprendizaje 2Edgar CastilloNessuna valutazione finora
- Guia Inventor 1Documento20 pagineGuia Inventor 1Edgar CastilloNessuna valutazione finora
- Actividad - Interactiva - 1 - Inventor AutodeskDocumento1 paginaActividad - Interactiva - 1 - Inventor AutodeskEdgar CastilloNessuna valutazione finora
- PFC Daniel Mora Garcia-UcedaDocumento208 paginePFC Daniel Mora Garcia-UcedaEdgar CastilloNessuna valutazione finora
- Actividades de Aseguramiento de La CalidadDocumento7 pagineActividades de Aseguramiento de La CalidadEdgar CastilloNessuna valutazione finora
- Procedimientos de FabricacionDocumento6 pagineProcedimientos de FabricacionEdgar CastilloNessuna valutazione finora
- EE - FM - 030 Prueba de EstanqueidadDocumento1 paginaEE - FM - 030 Prueba de EstanqueidadEdgar CastilloNessuna valutazione finora
- Proyecto HidraulicosDocumento3 pagineProyecto HidraulicosEdgar CastilloNessuna valutazione finora
- Resume Unidad 1 - 6Documento12 pagineResume Unidad 1 - 6Edgar CastilloNessuna valutazione finora
- Pruebas de EstanqueidadDocumento4 paginePruebas de EstanqueidadEdgar CastilloNessuna valutazione finora
- Plan de ContingenciaDocumento14 paginePlan de ContingenciaFernando Velasquez PiñeiroNessuna valutazione finora
- Comandos Autocad 2012 InglesDocumento4 pagineComandos Autocad 2012 InglesEdgar CastilloNessuna valutazione finora
- Estudio de Métodos y Tiempos en La Planta de Producción de La EmpresaDocumento54 pagineEstudio de Métodos y Tiempos en La Planta de Producción de La EmpresaJohan ValeraNessuna valutazione finora
- Parametros de EngranesDocumento2 pagineParametros de EngranesEdgar CastilloNessuna valutazione finora
- Potencia (P) Vs Altura (H) : Escuela Politécnica Del Ejército Motores de Combustion InternaDocumento2 paginePotencia (P) Vs Altura (H) : Escuela Politécnica Del Ejército Motores de Combustion InternaEdgar CastilloNessuna valutazione finora
- Apendice CDocumento6 pagineApendice CEdgar CastilloNessuna valutazione finora
- Deber AutomatizacionDocumento6 pagineDeber AutomatizacionEdgar CastilloNessuna valutazione finora
- Conveccion 2Documento1 paginaConveccion 2Edgar CastilloNessuna valutazione finora
- Plan de ContingenciasDocumento6 paginePlan de ContingenciasEdgar CastilloNessuna valutazione finora
- ProyectinstruDocumento25 pagineProyectinstruEdgar CastilloNessuna valutazione finora
- Generador EléctricoDocumento4 pagineGenerador EléctricoEdgar CastilloNessuna valutazione finora
- Linea-De-Conduccion-Abastecimiento-2016 BienDocumento18 pagineLinea-De-Conduccion-Abastecimiento-2016 BienCesar Rodriguez RodriguezNessuna valutazione finora
- Funcionamiento y aplicaciones del diodoDocumento48 pagineFuncionamiento y aplicaciones del diodoJesmil Antonio Dimas ZeñaNessuna valutazione finora
- Prac. 4 Condensación de Claisen SchmidtDocumento14 paginePrac. 4 Condensación de Claisen SchmidtFran Castrejon Pilgrim100% (1)
- Formulacion de Una Crema Hidratante A BaDocumento15 pagineFormulacion de Una Crema Hidratante A BaEdith Estrada GomezNessuna valutazione finora
- Lab 1 ROSDocumento5 pagineLab 1 ROSAndres Felipe Beltran OsorioNessuna valutazione finora
- 01-Elementos Visuales - Los Bloques de Construcción de Su PinturaDocumento12 pagine01-Elementos Visuales - Los Bloques de Construcción de Su PinturaJorge Peñaloza MendozaNessuna valutazione finora
- Mecánica de Fluidos, Definición y Aplicaciones.Documento28 pagineMecánica de Fluidos, Definición y Aplicaciones.RENATO JAIR COSTA MINGANessuna valutazione finora
- Actividad 3. - Tabla de Centroides de Áreas y LineasDocumento3 pagineActividad 3. - Tabla de Centroides de Áreas y LineasJahaziel Kib100% (1)
- Ficha Tecnica KangooDocumento1 paginaFicha Tecnica KangooMauricio Carvallo G.100% (1)
- Fosforilacion OxidativaDocumento6 pagineFosforilacion Oxidativalore05Nessuna valutazione finora
- Geodinamica 7Documento30 pagineGeodinamica 7Danan DiazNessuna valutazione finora
- Zw32-12d Interruptor de Potencia Sojo - 1Documento5 pagineZw32-12d Interruptor de Potencia Sojo - 1Luis Francisco Calderon EspinozaNessuna valutazione finora
- Estadistica Práctica Unidad IiDocumento17 pagineEstadistica Práctica Unidad IiKevin Oseda100% (1)
- PRUEBA SABER Enero-2018-1Documento11 paginePRUEBA SABER Enero-2018-1Emiliano CordobaNessuna valutazione finora
- Máxima Transferencia de PotenciaDocumento7 pagineMáxima Transferencia de PotenciaArmando IrieNessuna valutazione finora
- Cooper PracticaDocumento1 paginaCooper PracticaWILLIAM YOEL PARI CUTIPANessuna valutazione finora
- 3 Caras FracturadasDocumento5 pagine3 Caras FracturadasalexNessuna valutazione finora
- Tarea 2 Métodos para Determinar La Excavabilidad de Un Material JJTGDocumento14 pagineTarea 2 Métodos para Determinar La Excavabilidad de Un Material JJTGCARLOS GABRIEL ALBA SANCHEZ100% (1)
- Textos continuos: identifica tipos de textoDocumento4 pagineTextos continuos: identifica tipos de textoAlex MatiasNessuna valutazione finora
- Parcial 2 Des-covINGDocumento1 paginaParcial 2 Des-covINGel gatoNessuna valutazione finora
- EntalpíaDocumento39 pagineEntalpíaHernan Ponce ZamoraNessuna valutazione finora
- Cañón electroquimico DIYDocumento2 pagineCañón electroquimico DIYclonqfb50% (4)
- Especificacion Tecnica Estructuras EmpernadasDocumento5 pagineEspecificacion Tecnica Estructuras EmpernadasRommelRafaelNessuna valutazione finora
- Estilos de Aprendizaje Josue David Tabares VidesDocumento14 pagineEstilos de Aprendizaje Josue David Tabares VidesJosue TabaresNessuna valutazione finora
- TP 6 Analisis Dimensional y Semejanza 2010 Rev00Documento6 pagineTP 6 Analisis Dimensional y Semejanza 2010 Rev00Carla Fuentes GaeteNessuna valutazione finora
- Metodo de ImpedanciasDocumento14 pagineMetodo de ImpedanciasdiegoNessuna valutazione finora
- Dinámica de Desarrollo Del Rendimiento Matemático Desde Preescolar Hasta Segundo GradoDocumento15 pagineDinámica de Desarrollo Del Rendimiento Matemático Desde Preescolar Hasta Segundo GradoCamila Jorquera CatalánNessuna valutazione finora
- C00204 4 2013 C EmailDocumento112 pagineC00204 4 2013 C EmailCarlosEduardoAcostaMateusNessuna valutazione finora
- Tecnologías PMDocumento13 pagineTecnologías PMFelipe VergaraNessuna valutazione finora
- Matemáticas III: Guillermo Guerrero Tetramestre May-Ago 2020Documento60 pagineMatemáticas III: Guillermo Guerrero Tetramestre May-Ago 2020ExalcoatlNessuna valutazione finora