Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
3 Componentes
Caricato da
Renato DiazTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
3 Componentes
Caricato da
Renato DiazCopyright:
Formati disponibili
UNMSM
INFORME DE LABORATORIO
FISICOQUIMICA METALURGICA
3 COMPONENTES
Alumno: Sanchez Bautista, Rolando
Cdigo: 10160172
2012
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
INTRODUCCIN
El sistema ms simple de 3 componentes se produce cuando dos pares de
componentes son solubles (miscibles) en todas proporciones y un par de
componentes solubles parcialmente.
En esta experimentacin el par agua - in cobre y el par orgnico in cobre
son miscibles; en tanto que el par agua - orgnico es parcialmente miscible y el
soluto valioso vendra a ser el in cobre.
OBJETIVOS
El presente informe tiene por finalidad determinar el diagrama de
equilibrio para un sistema ternario a temperatura constante.
Obtener experiencia y conocimientos en la experimentacin de un
sistema de 3 componentes.
Obtener conclusiones a partir de la experimentacin y las grficas.
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
PROCEDIMIENTO EXPERIMENTAL
Para la experimentacin se prepar 200ml de solucin acuosa de sulfato de
cobre de concentracin aproximada de 2.5 gramos de cobre por litro. El peso
de CuSO4.5H2O necesario es:
(2.5g de Cu/L)*0.2L = 0.5 g de Cu
0.5g de Cu*(249.5g de CuSO4.5H2O/63.5g de Cu)
= 1.9646g de CuSO4.5H2O 2g de CuSO4.5H2O
Se pesa 2g de CuSO4.5H2O
Y se mezcla con 200 ml de agua:
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
Separamos 1ml de solucin acuosa inicial para anlisis.
Luego preparamos mezclas de orgnico acuoso segn las relaciones:
Matraz Relacin Vo /Va Orgnico (ml) Acuoso (ml)
1 2 20 10
2 1 20 20
3 0.5 20 40
4 0.25 20 80
Agitamos cada mezcla en un matraz por 20 minutos, decantar y observar dos
fases bien diferenciadas. La decoloracin relativa de la fase acuosa nos
indicar la extraccin de cobre del acuoso hacia el orgnico, hasta alcanzar el
equilibrio en cada sistema formado.
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
Separamos 1 ml de cada fase acuosa final obtenida para anlisis en tubos de
ensayo, al cual le agregamos 0,5ml de amoniaco y diluimos con 4 ml de agua
desionizada para cada muestra.
Anotamos la relacin de dilucin: volumen total/ volumen muestra.
En el espectrofotmetro obtenemos la lectura del % de transmitancia (%T) para
cada muestra preparada (longitud de onda para lectura 580 nm).
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
Deducimos la concentracin de cobre en cada sistema del experimento usando
el factor relacin de dilucin aplicada.
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
PROCESAMIENTO DE DATOS
La muestra inicial de solucin acuosa al ser analizada en el espectrofotmetro
tuvo un % de transmitancia de 55.3%
Y para cada muestra el % de transmitancia fue:
Matraz Vo/Va %T
1 2 95.7
2 1 87.6
3 0.5 84.5
4 0.25 66.9
Procedemos a calcular la absorbancia para cada muestra
A = 2 Log T
Matraz Vo/Va %T A
1 2 95.7 0.0191
2 1 87.6 0.0575
3 0.5 84.5 0.0731
4 0.25 66.9 0.1746
A cada muestra de 1 ml se diluy con 0.5ml de amoniaco y 4ml de agua des-
ionizada.
Relacin de dilucin = V total / V muestra = 5.5/1 = 5.5
Entonces:
5.5A = [Cu] g/L
0.786
[Cu]g/L = 5.5(0.0191) /0.786 = 0.1336 g/L
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
De la misma manera calculamos las concentraciones de cobre en gramos por
litro de las fases acuosas para cada sistema:
Matraz A [Cu] en el acuoso (g/L)
1 0.0191 0.1336
2 0.0575 0.4023
3 0.0731 0.5118
4 0.1746 1.2216
Y Finalmente se halla la concentracin de cobre en el orgnico:
[Cu] total = [Cu] acuoso + [Cu] orgnico *Vo/Va
[Cu] orgnico = ([Cu] total [Cu] acuoso)* Va/ Vo
Para la muestra 1:
[Cu] orgnico = (2.5 0.1336) * 0.5
[Cu] orgnico = 1.1832 g/L
De igual manera se halla el [Cu] en el orgnico para el resto de muestras:
Matraz Va/Vo [Cu] total (g/L) [Cu] acuoso (g/L) [Cu] orgnico (g/L)
1 0.5 2.5 0.1336 1.1832
2 1 2.5 0.4023 2.0977
3 2 2.5 0.5118 3.9764
4 4 2.5 1.2216 5.1136
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
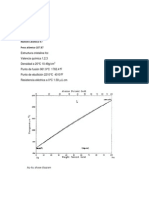
Graficamos [Cu] acuoso (g/L) en el eje de abcisas y la [Cu] orgnico (g/L)
en el eje de ordenadas:
[Cu]orgnico vs [Cu]acuoso
6
5 f(x) = 3.5x + 1.1
R = 0.84
0
0 0.2 0.4 0.6 0.8 1 1.2 1.4
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
CONCLUSIONES
Se observa que en las muestras donde hay mayor volumen de acuoso con
respecto al orgnico, la captacin de cobre ser mayor.
Despus de haber agitado las muestras durante 15 minutos se puede
observar si hubo una buena captacin del cobre debido al color claro que
presenta la solucin acuosa luego de la decantacin.
A mayor volumen de acuoso la absorbancia ser mayor pero la
transmitancia ser menor.
La transmitancia disminuye al aumentar la cantidad de acuoso, y esto es
debido a que el orgnico tiene cierta capacidad de absorcin. Es por eso
que las soluciones acuosas se decoloran menos cuando estas estn en
mayor proporcin con respecto al orgnico.
El adicionar amoniaco har que se forme una solucin amoniacal.
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
UNMSM
RECOMENDACIONES
Esperar 15 minutos luego de prender el espectrofotmetro.
Realizar una prueba en blanco antes de hallar la transmitancia de cada
muestra con la finalidad de regular la lectura del espectrofotmetro.
Hay que ser cuidadosos a la hora de pesar la cantidad necesaria de
sulfato de cobre pentahidratado y tambin al tomar las medidas de
volmenes de acuoso y orgnico en las probetas.
Se debe haber ledo previamente la gua para saber la finalidad de la
experimentacin.
Lab.de Fisicoquimica Metalrgica Escuela de Ing. Metalrgica
Potrebbero piacerti anche
- Uso de VentosasDocumento109 pagineUso de VentosasMichelleHarvey100% (6)
- Criterios de inspección visual de soldadura según ASME B31.3Documento43 pagineCriterios de inspección visual de soldadura según ASME B31.3Renato Diaz67% (3)
- Optimiza productividad mediante estudio trabajoDocumento7 pagineOptimiza productividad mediante estudio trabajoRenato DiazNessuna valutazione finora
- Minería y Pyme, Una Alianza FructíferaDocumento2 pagineMinería y Pyme, Una Alianza FructíferaRenato DiazNessuna valutazione finora
- 2 ComponentesDocumento14 pagine2 ComponentesLuciano AvilaNessuna valutazione finora
- CalidadDocumento9 pagineCalidadRenato DiazNessuna valutazione finora
- NDICACIONES Notificados de ConformidadDocumento2 pagineNDICACIONES Notificados de ConformidadRenato DiazNessuna valutazione finora
- Admin - Mi ParteDocumento2 pagineAdmin - Mi ParteRenato DiazNessuna valutazione finora
- Principios de Eficiencia de EmersonDocumento2 paginePrincipios de Eficiencia de EmersonRenato Diaz67% (3)
- Temario Interpretación RadiográficaDocumento2 pagineTemario Interpretación RadiográficaRenato DiazNessuna valutazione finora
- Practica N°06 FiolaDocumento2 paginePractica N°06 FiolaRenato DiazNessuna valutazione finora
- Temario Interpretación RadiográficaDocumento2 pagineTemario Interpretación RadiográficaRenato DiazNessuna valutazione finora
- Fi 2 CINETICADocumento11 pagineFi 2 CINETICARenato DiazNessuna valutazione finora
- Aplicaciones DRX Apuntes y EjerciciosDocumento29 pagineAplicaciones DRX Apuntes y EjerciciosLuis Felipe Medina VallejoNessuna valutazione finora
- Conform A DoDocumento14 pagineConform A DoRenato DiazNessuna valutazione finora
- Aplicaciones DRX Apuntes y EjerciciosDocumento29 pagineAplicaciones DRX Apuntes y EjerciciosLuis Felipe Medina VallejoNessuna valutazione finora
- Aleaciones de PlataDocumento6 pagineAleaciones de PlataRenato DiazNessuna valutazione finora
- ExtrDocumento11 pagineExtrRenato DiazNessuna valutazione finora
- SoldaduraeDocumento14 pagineSoldaduraeRenato DiazNessuna valutazione finora
- Rayos X MineralesDocumento29 pagineRayos X Mineralesjhon richardNessuna valutazione finora
- Eskema de Investigacion Completo. Prof. MecheDocumento40 pagineEskema de Investigacion Completo. Prof. MecheRenato DiazNessuna valutazione finora
- MOLIENDADocumento5 pagineMOLIENDARenato DiazNessuna valutazione finora
- Aplicaciones DRX Apuntes y EjerciciosDocumento29 pagineAplicaciones DRX Apuntes y EjerciciosLuis Felipe Medina VallejoNessuna valutazione finora
- Especialidad de Futbol Sesion de CLasesDocumento2 pagineEspecialidad de Futbol Sesion de CLasesRenato DiazNessuna valutazione finora
- Qué Es Una Reseña LiterariaDocumento4 pagineQué Es Una Reseña Literariavanser65Nessuna valutazione finora
- Gilberto Gimenez - La Sociología de Pierre BourdieuDocumento23 pagineGilberto Gimenez - La Sociología de Pierre Bourdieuwah0339Nessuna valutazione finora
- SoldaduraeDocumento14 pagineSoldaduraeRenato DiazNessuna valutazione finora
- Practica 2Documento6 paginePractica 2Oscar CruzNessuna valutazione finora
- AA1. Práctica de Análisis de Cu Por Absorción AtómicaDocumento1 paginaAA1. Práctica de Análisis de Cu Por Absorción AtómicaRenato DiazNessuna valutazione finora
- Espectometria de Absorcion AtomicaDocumento12 pagineEspectometria de Absorcion AtomicaRenato DiazNessuna valutazione finora
- Diseño Red Aire ComprimidoDocumento144 pagineDiseño Red Aire ComprimidoJose Vega100% (1)
- 2 Alimentos Que Causan Retención de Líquido y Proteínas en La OrinaDocumento11 pagine2 Alimentos Que Causan Retención de Líquido y Proteínas en La OrinaRAMGUGUENessuna valutazione finora
- Hydromatic PucallpaDocumento2 pagineHydromatic PucallpaArnolNessuna valutazione finora
- Buffer PBSDocumento1 paginaBuffer PBSJaqueline Stephanie Ley MartinezNessuna valutazione finora
- Cat 2002C1 PDFDocumento71 pagineCat 2002C1 PDFCezar PajaresNessuna valutazione finora
- Isiologia Del Metabolismo de La Proteinas PDFDocumento19 pagineIsiologia Del Metabolismo de La Proteinas PDFRosario Laguna100% (1)
- Dilatación volumétrica: concepto, fórmulas y ejemplosDocumento4 pagineDilatación volumétrica: concepto, fórmulas y ejemplosAnaLuciaNessuna valutazione finora
- Guía prácticas biología molecularDocumento9 pagineGuía prácticas biología molecularC_Dante33% (3)
- Clasificación Arancelaria: Conceptos y HerramientasDocumento181 pagineClasificación Arancelaria: Conceptos y HerramientasNayeli Encinas Olivera100% (1)
- Proyecto de Grado-1Documento86 pagineProyecto de Grado-1RckrLifeNessuna valutazione finora
- Leche NaturalDocumento6 pagineLeche NaturalRosario HidalgoNessuna valutazione finora
- Estudio GeomecánicoDocumento84 pagineEstudio GeomecánicoArturo Diaz Dextre100% (1)
- Guia de Nomenclatura InorganicaDocumento10 pagineGuia de Nomenclatura InorganicaMaquillaje Moda La Serena100% (1)
- Cemento Blanco. PDFDocumento2 pagineCemento Blanco. PDFAbrahan Eriquita MamaniNessuna valutazione finora
- Tesis de Descontaminación de Suelos para Titulo UniversitarioDocumento63 pagineTesis de Descontaminación de Suelos para Titulo UniversitarioJackelin ACNessuna valutazione finora
- Ciclo - Sabathè - Problema1Documento6 pagineCiclo - Sabathè - Problema1XimenaHidalgoCalleNessuna valutazione finora
- WurtzitaDocumento7 pagineWurtzitaAnonymous R4wRmP6ENessuna valutazione finora
- Hierro Fundido y Hierro DulceDocumento20 pagineHierro Fundido y Hierro DulceCapiYoloNessuna valutazione finora
- Procesamiento de Minerales 2019Documento194 pagineProcesamiento de Minerales 2019Cristian P OlmosNessuna valutazione finora
- Especificación TécnicaDocumento142 pagineEspecificación TécnicaJORGE HUARAYANessuna valutazione finora
- Que Es El MetabolismoDocumento8 pagineQue Es El MetabolismoCuevas Castillo Carlos OctavioNessuna valutazione finora
- Regulacion de La Expresion Genetica en BacteriaDocumento27 pagineRegulacion de La Expresion Genetica en BacteriaMaggie Tapia ZúñigaNessuna valutazione finora
- Diseño de mezclas asfálticas método Marshall: procedimiento, cálculos e interpretación de resultadosDocumento10 pagineDiseño de mezclas asfálticas método Marshall: procedimiento, cálculos e interpretación de resultadosgabymorga7Nessuna valutazione finora
- Natal Branco PARTITURA 3Documento4 pagineNatal Branco PARTITURA 3Cadu BarcelosNessuna valutazione finora
- La CelulaDocumento22 pagineLa CelulaMirlenis Ballestero BarriosNessuna valutazione finora
- Uso de PañosDocumento22 pagineUso de PañosMarcelo0% (1)
- Cuestionario Ciclos BiogeoquímicosDocumento6 pagineCuestionario Ciclos BiogeoquímicosjamesvalderramaNessuna valutazione finora