Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Esteril U Texto PDF
Caricato da
Philip SalcedoTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Esteril U Texto PDF
Caricato da
Philip SalcedoCopyright:
Formati disponibili
Estril U
Latinoamrica
Todos los Derechos reservados, 2015
Todos los Derechos reservados, 2015
Todos los Derechos reservados, 2015
3M a travs de su curso Estril U Latinoamrica, ha capacitado a
cientos de profesionales de la esterilizacin alrededor del mundo en los
ltimos 10 aos. Esto ha permitido contribuir activamente en las
prcticas de monitoreo y mejora de procesos de las centrales de
esterilizacin, beneficiando a millones de pacientes.
En este nuevo programa, se busca actualizar los contenidos previos,
incorporando nuevos contenidos esenciales para los profesionales de la
esterilizacin, aumentando tambin el nivel de profundidad de los temas
abordados y las estrategias educacionales.
En este programa, durante 45 horas lectivas se presentan 16 mdulos
distintos, realizados por profesionales locales e internacionales que
compartirn sus experiencias y conocimiento para seguir contribuyendo
al desarrollo de mejores prcticas, la elaboracin de nuevos estndares
y la reduccin de las infecciones intrahospitalarias; para beneficiar a
miles de pacientes de diversas condiciones.
Todos los Derechos reservados, 2015
Introduccin del Autor
El presente libro, rene tanto conocimientos tcnicos como prcticas y recomendaciones adoptadas
internacionalmente para la mejora de los procesos en Centrales de Esterilizacin y Reproceso.
Busca entregar informacin a los profesionales y tcnicos de la esterilizacin, con el objetivo de
mejorar los estndares locales, establecer planes de mejora, monitorear los parmetros crticos del
proceso y construir o mejorar los indicadores de calidad.
Estos objetivos, son abordados a travs de la entrega de los conocimientos necesarios, teniendo
como meta una disminucin de las infecciones intrahospitalarias y de sitio quirrgico y un mejor
resultado para vuestros pacientes.
Se espera que con este material, se entreguen herramientas y conocimientos que contribuyan a
mejorar los resultados de la salud en miles de ciudadanos de Latinoamrica, entendidos tanto
establecimientos pblicos como privados.
El autor les invita a continuar vuestro proceso de educacin de manera continua, teniendo siempre
en cuenta que los pacientes esperan lo mejor de ustedes en cada procedimiento quirrgico, en cada
reprocesamiento de material. Ms importante an, est en vuestras manos poder contribuir a los
resultados de estos pacientes y en el bienestar de ellos y sus familias.
William Leiva-Prez
Julio de 2015
Todos los Derechos reservados, 2015
Acerca del Autor
William Leiva-Prez, es Ingeniero Industrial de la Universidad Tcnica Federico Santa Mara;
Analista Qumico y Fsico de la Universidad de Santiago de Chile y cuenta con una Maestra en
Negocios Internacionales de la Universidad Andrs Bello.
Cuenta con una Certificacin como Ingeniero en Prevencin de la Corrosin y con las Certificaciones
CBSPD e IAHCSMM en el rea de Esterilizacin.
Actualmente se desempea como Especialista Internacional de Servicios Profesionales para la
Divisin de Prevencin de Infecciones de 3M Company, Saint Paul, Minnesota; desarrollando
programas para la regin de Latinoamrica y El Caribe.
Acerca de los Colaboradores
Bellaury Cedeo, es Tcnico en Telemedicina de la Universidad Experimental Francisco de Miranda
Coro de Falcn Venezuela, Bachiller en Ciencias de la administracin de la Universidad Internacional
del Caribe y cuenta con especializaciones en Esterilizacin y en Ingeniera Clnica. Es miembro de
la Sociedad Venezolana de Esterilizacin.
Actualmente se desempea como Especialista de Servicios Profesionales en 3M Venezuela, en el
rea de esterilizacin.
Mara Victoria Martnez, es Enfermera Universitaria de la Universidad Central de Venezuela con
experiencia en instrumentacin quirrgica y especializacin en cirugas de reemplazos articulares.
Actualmente se desempea como Especialista Internacional de Servicios Profesionales en 3M
Panam, desarrollando programas para la Regin de Centro Amrica y el Caribe.
Nancy Moya Rivera, es Enfermera Universitaria de la Universidad de Chile, cuenta con una Maestra
en Gestin de la Calidad en los Servicios de Salud de la Universidad de Murcia de Espaa y una
Maestra en Administracin y Gestin de Salud de la Universidad de los Andes de Chile.
Todos los Derechos reservados, 2015
Cuenta adems con diversos estudios relacionados con el rea de la gestin, esterilizacin y mejora de
la calidad en instituciones de la salud. Es miembro de la Sociedad Chilena de Profesionales de
Esterilizacin de Chile.
Actualmente se desempea como Especialista de Servicios Profesionales en 3M Chile.
Alvaro Pizarro, es Qumico Farmacutico con estudios de postgrado en Microbiologa, biotecnologa
y especialidad en farmacia hospitalaria. Es docente en ctedras de especializacin de la
esterilizacin en la Universidad de Buenos Aires y es miembro del colegio de Qumicos
Farmacuticos de la Provincia de Buenos Aires, de la Asociacin Argentina de Microbiologa y de la
Fundacin para el Desarrollo de la Esterilizacin.
Actualmente se desempea como Especialista de Servicios Profesionales en 3M Argentina.
Todos los Derechos reservados, 2015
Estril U Latinoamrica
Saint Paul, Minnesota, 2015
ISBN 978-0-692-49113-3
I. Introduccin al proceso de esterilizacin.
II. Introduccin al ciclo del material estril.
III. Preparacin en Punto de uso y descontaminacin.
IV. Desinfeccin de alto nivel y su monitoreo.
V. Verificacin de instrumental, armado y empaque.
VI. Procesos de esterilizacin a alta temperatura.
VII. Tecnologas de esterilizacin a baja temperatura y prcticas de monitoreo.
VIII. Tipos de monitores de proceso de esterilizacin.
IX. Validacin y verificacin de los procesos en una Central de Esterilizacin y Reproceso.
X. Almacenamiento y entrega de material estril y procesado con DAN.
XI. Trazabilidad.
XII. Fallas en el proceso de esterilizacin.
XIII. Estndares relacionados con la esterilizacin.
XIV. Liberacin paramtrica.
XV. Aseguramiento de la calidad.
XVI. Herramientas para Lderes de una Central de Esterilizacin y Reproceso.
Copyright 2015 3M Company
3M Company
3M Center, Building 275 4E
Saint Paul, Minnesota 55144
Todos los Derechos reservados, 2015
6
Todos los Derechos reservados, 2015
7
Todos los Derechos reservados, 2015
Resumen de Captulos
I. Introduccin al proceso de esterilizacin Estril U Latinoamrica.
Es una iniciativa educacional para los profesionales y trabajadores de Centrales de Esterilizacin de
toda Latinoamrica; elaborado por la Divisin de Prevencin de Infecciones de 3M.
Desde sus inicios, Estril U Latinoamrica ha permitido capacitar y mejorar las prcticas de la
esterilizacin en toda Latinoamrica, con cientos de profesionales egresados del programa en
diversos pases.
En esta, la ms reciente actualizacin del programa; se busca incorporar conceptos relacionados
con el uso de paquetes de desafo de procesos, herramientas de gestin, trazabilidad e indicadores
de calidad.
II. Introduccin al ciclo del material estril
Existen principalmente dos lugares de donde el material contaminado proviene: ciruga, con la gran
mayora del material y; otros departamentos como maternidad y endoscopia.
Si bien en muchas instituciones, el rea de ciruga esta inmediatamente contigua a la central de
esterilizacin; en otros establecimientos esto no ocurre y el material debe ser trasladado a travs
del hospital. Entender el ciclo del material estril permite establecer programas de mejora para
optimizar la preparacin en el punto de uso y el reprocesamiento.
III. Preparacin en Punto de uso y descontaminacin.
Desarrollar entendimiento de la relevancia del trabajo interdisciplinario y colaborativo entre distintas
unidades de la institucin de salud permite establecer las mejoras requeridas para un efectivo y
oportuno reprocesamiento.
IV. Desinfeccin de alto nivel y su monitoreo
La desinfeccin de alto nivel es un proceso fundamental para reprocesar dispositivos y materiales
reutilizables, que entran en contacto con vas no estriles del paciente. Comnmente utilizado como
proceso para endoscopios y materiales no crticos, se realiza diariamente en un nmero alto de
procedimientos de reproceso.
Todos los Derechos reservados, 2015
Si bien los dispositivos reprocesados utilizando desinfeccin de alto nivel utilizan desinfectantes en
su mayora adecuados, es fundamental realizar un monitoreo de la concentracin de los
desinfectantes, las condiciones de desinfeccin, la concentracin mnima efectiva y las condiciones
ambientales.
V. Verificacin de instrumental, armado y empaque
La verificacin de instrumental, el armado y empaque son procesos claves dentro de la esterilizacin.
Una adecuada verificacin permite eliminar reprocesamiento y facilitar la mantencin de instrumental.
El armado adecuado y verificado conforme las recomendaciones del fabricante permite facilitar el
uso en quirfanos.
VI. Procesos de esterilizacin a alta temperatura.
La esterilizacin es un proceso altamente sofisticado, que en general involucra variables como
tiempo, temperatura y presin de vapor; y en procesos especficos le agrega condiciones de vaco
o presin negativa, concentracin del agente esterilizante y aireacin
Para lograr el xito del proceso, se deben controlar estas variables y mantener registros del
cumplimiento.
Adicionalmente, los equipos deben ser sometidos a mantenciones y calibraciones con frecuencias
definidas, a modo de mantener el correcto funcionamiento de los equipos.
VII. Tecnologas de esterilizacin a baja temperatura y prcticas de monitoreo.
En la medida que ms materiales polimricos son incorporados a la industria; comenzando esta
tendencia en la dcada de 1950; fue necesario el desarrollo de mtodos de esterilizacin a baja
temperatura.
Esto se debe, fundamentalmente a que muchos materiales sufren deterioro en sus propiedades al
ser expuestos a condiciones de temperatura elevada, afectando su funcionamiento, reduciendo su
vida o til o en caso ms extremos; inutilizndolos por completo.
Para el reprocesamiento de este tipo de materiales, se requieren entonces otros mtodos de
esterilizacin que provean un conjunto de condiciones fsicas menos agresivas. Estos mtodos de
esterilizacin se conocen en trminos generales como esterilizacin a baja temperatura y funcionan
Todos los Derechos reservados, 2015
bajo el principio de una atmosfera controlada y el uso de esterilizantes qumicos. Estos mtodos de
esterilizacin funcionan utilizando la toxicidad de los compuestos qumicos utilizados. Esta toxicidad,
es la que permite eliminar todos los microorganismos viables en el instrumental a esterilizar.
VIII. Tipos de monitores de proceso de esterilizacin.
Cuando la poblacin de una ciudad se somete a un procedimiento que involucra el uso de
dispositivos crticos, no obstante lo riesgoso de esto; probablemente no tienen la informacin
adecuada para entender los riesgos y exigir la esterilidad del material utilizado. Es en consecuencia
responsabilidad de los profesionales de la esterilizacin poder entregar el mayor nivel de seguridad
para los pacientes.
Al referirse a los procesos de esterilizacin, esta evaluacin se refiere a una validacin tanto de los
procesos, como de los materiales, equipos y recursos humanos que afectan este proceso.
Validacin de ciclos y monitoreo continuo de la esterilizacin a travs del uso de indicadores.
IX. Validacin y verificacin de los procesos en una Central de Esterilizacin y Reproceso.
El uso de indicadores del proceso de esterilizacin es fundamental para asegurar la calidad de los
productos entregados. Esto incluye los indicadores del equipo esterilizador como tambin el uso de
indicadores externos para verificar el equipo, la carga, los paquetes y la exposicin.
X. Almacenamiento y entrega de material estril y procesado con DAN
La desinfeccin de alto nivel es un procedimiento que procesa un alto nmero de material
contaminado. Garantizar las condiciones necesarias para lograr una adecuada vida til de los
productos estriles o desinfectados, al igual que su entrega.
XI. Trazabilidad
La trazabilidad es un proceso fundamental de seguimiento del material que ingresa y sale de la
Central de Esterilizacin. Un adecuado programa de Trazabilidad, permite asegurar que el material
fue adecuadamente esterilizado/desinfectado, entregar informacin del comportamiento de la central
evaluar desempeo y establecer programas de mejora.
10
Todos los Derechos reservados, 2015
XII. Fallas en el proceso de esterilizacin
Las fallas son inherentes a los procesos, tanto debido a errores de equipo, de suministros (e.g.
electricidad o vapor), o dado a errores humanos.
Una adecuada solucin a estas fallas permite dar continuidad a la produccin de material estril,
junto con la entrega de informacin valiosa que permite entender tendencias y prevenir fallas futuras.
XIII. Estndares relacionados con la esterilizacin.
Es importante estar consciente de las distintas regulaciones existentes relacionadas con las
centrales de esterilizacin. De esta forma, existe una jerarqua donde siempre se debe respetar la
regulacin local.
En aquellos pases donde la regulacin local no ha sido actualizada recientemente, o no tienen
niveles de exigencia elevados, se pueden observar las regulaciones, normas, guas y estndares
internacionales o de organismos de inters (e.g. OPS, OMS).
XIV. Liberacin paramtrica.
El monitoreo de la esterilizacin, sigue dos estrategias sustantivamente diferentes: monitoreo de
cargas y equipo y liberacin paramtrica.
Si bien esta ltima es interesante y de amplio uso en algunos pases de Europa, la aplicacin de
esta estrategia en Centrales de Latinoamrica presenta diversos desafos.
Entender que es, como implementar, sus ventajas y desventajas es el objetivo de este captulo.
XV. Aseguramiento de la calidad.
La definicin de la calidad y la construccin de indicadores de gestin, son herramientas importantes
para el liderazgo de una Central de Esterilizacin.
11
Todos los Derechos reservados, 2015
XVI. Herramientas para Lderes de una Central de Esterilizacin y Reproceso.
La toma de decisiones diarias es parte del rol de lder de una Central de Esterilizacin. La entrega
de herramientas de priorizacin, anlisis e implementacin de cambios es fundamental en una
posicin de liderazgo.
12
Todos los Derechos reservados, 2015
13
Todos los Derechos reservados, 2015
Introduccin al
proceso de
esterilizacin
14
Todos los Derechos reservados, 2015
Estril U Versin 2015
Estril U Latinoamrica es una iniciativa
educacional para los profesionales y
trabajadores de Centrales de Esterilizacin
de toda Latinoamrica; elaborado por la
Divisin de Prevencin de Infecciones de
3M.
Desde sus inicios, Estril U Latinoamrica ha permitido capacitar y mejorar las prcticas
de la esterilizacin en toda Latinoamrica, con cientos de profesionales egresados del
programa en diversos pases.
En esta, la ms reciente actualizacin del programa; se busca incorporar conceptos
relacionados con el uso de paquetes de desafo de procesos, herramientas de gestin,
trazabilidad e indicadores de calidad.
a. El Programa
El programa consta de 16 mdulos que cubren todos los
aspectos crticos dentro de las labores que se desarrollan
en la central de esterilizacin.
Los mdulos son desarrollados por profesionales con
amplia experiencia en centrales de esterilizacin junto a
los profesionales de 3M.
El programa tiene una duracin de 40 horas pedaggicas.
b. Los objetivos.
Estril U Latinoamrica busca:
Actualizar conocimientos
15
Todos los Derechos reservados, 2015
Compartir buenas practicas
Generar vnculos entre profesionales
Mejorar procesos de monitoreo en la central de esterilizacin.
c. La metodologa
La metodologa incluye clases lectivas con material interactivo, actividades
participativas y una evaluacin final.
2. La importancia de la central de
esterilizacin.
La Central de Esterilizacin y Equipos es
parte de una estructura mdica que persigue
reducir los riesgos de infecciones
nosocomiales, cuyo impacto fundamental es
la entrega de productos estriles.
La entrega de productos estril con estndares de calidad elevados es la piedra angular de
un programa preventivo de infecciones nosocomiales y de sitio quirrgico en cualquier
institucin de salud. Esta prevencin, permite entregar mayor atencin y de mejor calidad a
todos los sectores de la poblacin.
En la actualidad, con la tecnologa y recursos disponibles, es posible proveer servicios con
un alto nivel de calidad, satisfaccin y seguridad para los pacientes; siempre que se realice
todo desde una aproximacin holstica, integrando a la organizacin hospitalaria en la
definicin de los objetivos de salud para la poblacin.
16
Todos los Derechos reservados, 2015
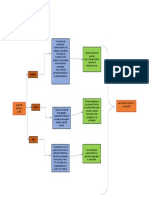
3. Flujo de trabajo en la central de esterilizacin.
Dentro de la central de esterilizacin, existe un flujo continuo de material. Este es entregado
para su uso para ser luego recibido para descontaminacin, verificacin, empaque y
esterilizacin.
Recepcin del
material para su
procesamiento
Entrega del material Limpieza y
esterilizado. Descontaminacin.
Inspeccin y
Almacenamiento.
ensamblaje
Preparacin de
Esterilizacin.
paquetes.
Ilustracin 1: Ciclo de la Esterilizacin
17
Todos los Derechos reservados, 2015
Posteriormente, se presentaran con detalle cada una de las etapas descritas previamente.
4. Condiciones ambientales en la central de esterilizacin.
Existen una serie de condiciones requeridas para lograr un ambiente adecuado para la
preparacin, descontaminacin y esterilizacin de material mdico quirrgico. Dentro de
estas se encuentran:
a. Temperatura
b. Humedad relativa
c. Presin de aire
d. Condiciones de almacenamiento
e. Diseo de las centrales.
5. Habilidades de los profesionales de la esterilizacin. Comunicacin asertiva.
Los profesionales de las centrales de esterilizacin, deben tener caractersticas especiales
que los hacen idneos para desarrollar labores sumamente crticas.
a. Comunicacin: deben tener buenas habilidades de comunicacin.
b. Trabajo en equipo: dado el nmero de trabadores, es fundamental que puedan
trabajar en equipo, en distintos turnos y distintas supervisiones.
c. Trabajo seguro: los trabajadores deben estar
conscientes y ser entrenados en los riesgos
inherentes a su trabajo para realizar este de la
manera ms segura posible, para si mismo, para
los colaboradores y para el resultado del proceso.
18
Todos los Derechos reservados, 2015
6. Regulaciones y estndares.
Es importante estar consciente de las distintas regulaciones existentes relacionadas con las
centrales de esterilizacin. De esta forma, existe una jerarqua donde siempre se debe
respetar la regulacin local.
En aquellos pases donde la regulacin local no ha sido actualizada recientemente, o no
tienen niveles de exigencia elevados, se pueden observar las regulaciones, normas, guas y
estndares internacionales o de organismos de inters (e.g. OPS, OMS).
a. Regulacin: es una ley o cuerpo legal de carcter obligatorio en un pas o regin.
b. Estndar: es un mtodo uniforme de definicin de parmetros bsicos para procesos,
productos, servicios y mediciones.
c. Estndar regulatorio: una comparacin con una situacin ideal obligatoria generada
por un cuerpo legal o agencia estatal. La ausencia de cumplimientos, puede ser
causar de sanciones penales o civiles.
d. Estndar voluntario: una comparacin con una situacin ideal que es altamente
recomendada, generada por un cuerpo legal o asociacin profesional o agencia
estatal, que provee la implementacin de mejores prcticas para el mejor cuidado
del paciente.
e. Estatuto: una documentacin escrita y promulgada como ley, que es emanada por
un cuerpo gubernamental y es de carcter obligatorio.
19
Todos los Derechos reservados, 2015
Otros organismos de
inters
Normas, guas y
estndares
Regulacin internacional
Regulacin local
Ilustracin 2: La Jerarqua de las regulaciones.
7. Eliminando lo que no se puede ver.
Uno de los mayores desafos de la esterilizacin, es la necesidad de eliminar material que
no siempre es visible a simple vista.
Este desafo se refleja fundamentalmente como la cadena de la infeccin. En esta cadena,
existen diversos eslabones que es necesario conocer y controlar a fin de evitar propagar
infecciones.
a. Agente infeccioso:
Es un microorganismo patgeno y es el primer vnculo con la infeccin.
Estas infecciones pueden ser causadas por diversos agentes, incluidas bacterias,
hongos, virus o protozoos.
La eliminacin del agente causante de la infeccin interrumpe la cadena de la
infeccin.
b. Reservorio:
Es el lugar donde el agente infeccioso puede sobrevivir y reproducirse.
20
Todos los Derechos reservados, 2015
Los reservorios ms comunes es la piel, animales y superficies inadecuadamente
desinfectadas, sin embargo en la Central de Esterilizacin, reservorios comunes son
los instrumentos mdicos inadecuadamente esterilizados o desinfectados.
c. Portal de salida:
Es el medio por el cual el agente infeccioso deja el reservorio. En el caso de los
agentes infecciosos asociados a humanos y animales, algunos portales de salida son
el tracto respiratorio y gastrointestinal, la piel y membranas mucosas y los fluidos
corporales.
d. Modo de transmisin:
Para que exista contaminacin, debe existir un modo para el agente infeccioso se
desplace y pueda contaminar a otro paciente. Dentro de los modos de transmisin
ms comunes se encuentran el contacto entre personas, el uso de vehculos
comunes (material no estril) o de contaminacin area.
e. Portal de entrada:
Es l; patrn usado por un agente infeccioso para contaminar a un nuevo paciente.
Los portales de entrada comunes son los tractos respiratorios, genitourinario,
gastrointestinal, membranas mucosas y o piel y fluidos corporales.
f. Husped:
Es necesario para el agente infeccioso encontrar un husped al cual infectar. La
infeccin puede realizarse a travs del as vas descritas previamente.
21
Todos los Derechos reservados, 2015
Agente
Huesped
infeccioso
Portal de
Reservorio
entrada
Modo de Portal de
transmisin salida
Ilustracin 3: La cadena de infeccin.
Como se puede desprender de lo anterior, existen diversos aspectos crticos a relacionados con la
central de esterilizacin, desde la descontaminacin hasta la verificacin de limpieza y esterilizacin.
8. Prevencin de infecciones
a. Que son las infecciones intrahospitalarias-nosocomiales y de sitio quirrgico
asociadas a la atencin de salud.
Las infecciones nosocomiales o intrahospitalarias, se definen como aquellas infecciones
que no se haba manifestado ni estaban en periodo de incubacin, es decir; aquellas
infecciones que son adquiridas durante la estancia de un paciente a una institucin de
salud y no son la causa de ingreso.
Las infecciones de sitio quirrgico se dividen en dos categoras bsicas:
22
Todos los Derechos reservados, 2015
i. Infecciones de Sitio Quirrgico o incisionales.
Es aquella infeccin que ocurre en el sitio de la incisin y solo involucra tejido
subcutneo. Puede ocurrir hasta 30 das posteriores a la operacin e
involucra alguna de las siguientes caractersticas:
Existe drenaje de la incisin.
Se aislaron organismos de un cultivo proveniente de las incisiones.
Zona afiebrada, enrojecida o con dolor.
El diagnstico fue realizado por un cirujano.
Las Infecciones de Sitio Quirrgico incisionales son las ms comunes de los dos
tipos.
ii. Infecciones de Sitio Quirrgico de rganos o cavidades.
Son las ms serias de tratar e involucran tejidos distintos a la piel donde se
realiz la incisin, fascia o tejidos musculares que fueron manipulados
durante la operacin e involucran parte de la anatoma de un rgano o de
cavidades de estos, e involucra alguna de las siguientes caractersticas
Drenaje purulento del rgano o cavidad.
Organismos aislados de un cultivo de tejido, rgano o cavidad.
Evidencia de infeccin durante examinacin.
Diagnstico realizado por un cirujano.
23
Todos los Derechos reservados, 2015
9. Condiciones requeridas para el trabajo en la Central de Esterilizacin
a. Prcticas de higiene en el trabajo.
Los profesionales de la central de esterilizacin deben seguir prcticas de higiene de
manos previo al ingreso al lugar de trabajo, utilizando jabn y abundante agua;
secando las manos con toallas de papel. .
Se debe prohibir el uso de joyas o anillos.
b. Elementos de proteccin personal.
Los profesionales de la central de
esterilizacin deben utilizar un
atuendo de uso exclusivo en la
central de esterilizacin. Este debe
incluir cubre cabello y cubre bello
facial y calzado antideslizante.
Dependiendo la actividad a
desarrollar, debern usar guantes adecuados, protectores faciales, gafas y
mascarillas.
24
Todos los Derechos reservados, 2015
25
Todos los Derechos reservados, 2015
Introduccin al ciclo
del material estril
26
Todos los Derechos reservados, 2015
Captulo 2: Introduccin al ciclo para el material estril
Existen principalmente dos lugares de donde el material contaminado proviene: ciruga, con la gran
mayora del material y; otros departamentos como maternidad y endoscopia.
Si bien en muchas instituciones, el rea de ciruga esta inmediatamente contigua a la Central de
Esterilizacin y Reproceso; en otros establecimientos esto no ocurre y el material debe ser
trasladado a travs del hospital.
1. Descontaminacin, preparacin en el lugar de uso y transporte.
Existen diversas razones para sostener la necesidad de realizar la preparacin del material
en el punto de uso:
La preparacin en el lugar de uso prolonga la vida de los instrumentos. La presencia
de sustancias como sangre y soluciones salines, ayudan a acelerar el desgaste de
los recubrimientos que tiene el material quirrgico; acelerando su deterioro.
La suciedad y los residuos en el instrumental, son mucho ms difciles de remover
cuando estos se encuentran seco, especialmente en instrumentos con lmenes y
superficies difciles de alcanzar.
La remocin de residuos adheridos al instrumental deben ser realizada con el uso
de detergentes y de accin mecnica (fregado del material). La accin mecnica,
genera danos en el recubrimiento protector del material y puede generar rayas que
inciden en la futura adherencia de nueva suciedad.
La remocin de suciedad adherida usualmente requiere ms tiempo, aumentando
los costos del proceso completo (considerando insumos, costo de oportunidad y
recursos humanos).
Es importante tener claridad respecto de la preparacin en el lugar de uso: esta preparacin
no reemplaza el proceso de limpieza, es solo un elemento facilitador de la limpieza.
27
Todos los Derechos reservados, 2015
La preparacin en el lugar de uso debe considerar:
Remocin de suciedad visible inmediatamente luego del uso.
Seguir las recomendaciones del fabricante. Algunos fabricantes proveen
recomendaciones de preparacin en el lugar de uso, e.g. hacer fluir agua en el
interior de endoscopios flexibles. En ausencia de informacin disponible del
fabricante, se debe establecer un procedimiento basado en instrumental de similar
caractersticas (geometra, funcin, condiciones de uso, materiales, zonas complejas)
Mantener el instrumental contaminado hmedo, esto previene que la suciedad se
seque, dificultando su remocin posterior. Esto se logra utilizando espray con
soluciones enzimticas, sumergiendo el instrumental en soluciones enzimticas o
cubriendo el material con compresas hmedas. El instrumental debe ser dispuesto
de manera ordenada en contenedores rgidos, bandejas o similares; de manera que
se encuentre expuesto al agente humectante. En el caso de sumergir completamente
los materiales, la solucin utilizada debe ser eliminada previo al transporte para evitar
riesgos de salpicaduras y derrames.
Eliminar restos de material desechable conforme a las recomendaciones del
establecimiento. Eliminar material cortante en contenedores especiales. La
separacin del material contaminado desechable del reutilizable, permite reducir la
cantidad de material que finalmente se va a transportar, al tiempo que permite reducir
los riesgos de accidentes con material cortante. Al eliminar material descartable,
verificar que sea efectivamente material descartable; algunos dispositivos
reutilizables utilizan material descartable.
Separar material textil reutilizable. Este material debe ser puesto en bolsas
adecuadas o contenedores. Se debe tener especial atencin de evitar
accidentalmente, eliminar material cortante junto con el material textil.
28
Todos los Derechos reservados, 2015
Eliminar fluidos de los contenedores. Todo el material que sea utilizado para contener
fluidos como botellas, contenedores o receptculos; deben ser vaciados previo el
transporte.
Separa material punzante en contenedores exclusivos.
Notificar acerca de materiales o instrumentos que requiera reparaciones o
verificaciones.
2. Transporte del material contaminado.
El transporte de material debe lograr desplazar el material contaminado al lugar de
descontaminacin, evitar la propagacin de agentes infecciosos, diferenciar claramente tipos
de materiales y realizar la entrega del material en un tiempo adecuado.
El transporte debe realizarse:
En contenedores cerrados completamente. En ausencia de estos, contenedores
cubiertos deben ser utilizados. Los contenedores deben tener una base cerrada, de
manera de evitar derrames o salpicaduras.
Se debe diferenciar el material de riesgo biolgico de otros materiales.
El personal debe ser entrenado en la prevencin de cadas de instrumental, de
derrames y en asegurar que el material se encuentra adecuadamente cargado en
los carros de transporte.
El transporte de material contaminado debe ser claramente separado de aquel
material descontaminado, desinfectado o esterilizado.
Todo el material utilizado, debe ser considerado material contaminado y debe ser tratado como
tal. El personal responsable del transporte del material debe utilizar elementos de proteccin
29
Todos los Derechos reservados, 2015
personal que incluyen guantes y cobertor de cuerpo. Frente a potenciales derrames o
salpicaduras, protectores faciales y gafas deben ser utilizados.
El personal responsable del transporte de material contaminado en carros, debe tener la
capacidad de maniobrar de manera segura estos carros, previniendo accidentes con el personal,
pacientes o visitantes.
3. Limpieza y Descontaminacin.
La limpieza del material es fundamental en el ciclo necesario para lograr material estril (o
desinfectado a alto nivel).
Diversos aspectos deben ser considerados al momento de realizar la limpieza y
descontaminacin, dentro de los cuales es fundamental considerar:
a. La limpieza busca reducir la presencia de material visible en el instrumental. Permite
eliminar exceso de suciedad y facilitar la descontaminacin posterior.
b. La descontaminacin ayuda a reducir la carga biolgica en el instrumental,
preparando el material para ser desinfectado o esterilizado.
c. El agua juega un rol fundamental en el proceso. Utilizar agua de calidad adecuada
es necesario para reducir los riesgos de acumulacin de sales en material metlico
y reducir acumulacin de sarro en elementos canulados.
d. Los detergentes enzimticos ayudan a reducir la temperatura necesaria y acelerar la
destruccin de ciertos agentes contaminantes (residuos grados, de sangre y residuos
almidonados.
e. Los detergentes tradicionales buscan reducir la tensin superficial de la suciedad,
permitiendo que el agua pueda penetrar el residuo y acelerar su solubilidad.
30
Todos los Derechos reservados, 2015
4. Inspeccin y ensamblaje.
Es fundamental realizar una inspeccin
rigurosa del material limpio y
descontaminado. Si bien, el objetivo de la
desinfeccin de alto nivel y de la
esterilizacin es reducir y eliminar
organismos patgenos viables,
respectivamente; es fundamental que el
instrumental est libre de suciedad visible.
La inspeccin permite determinar la presencia de residuos visibles en zonas complejas del
instrumental, como las articulaciones o zonas rugosas. La completa ausencia de residuos
permite avanzar en el proceso. Es importante durante la inspeccin detectar problemas de
limpieza y descontaminacin como la presencia de residuos
Adicionalmente, la inspeccin permite establecer el correcto funcionamiento de los
dispositivos y establecer planes de mantencin y vida til.
5. Preparacin de paquetes y contenedores.
Los paquetes deben ser preparados en condiciones que permitan asegurar la mantencin
su condicin, sea esta elemento desinfectado a alto nivel o elemento estril.
Para esto, los empaquetes deben ser capaces de mantener una barrera fsica continua, a lo
largo del tiempo dado como vida til al producto.
Los paquetes se deben preparar de manera estndar en el caso de los materiales
desechables no tejidos o de papel y reutilizables como telas.
En el caso de los empaques de papel-plstico, estos deben ser sellados con una termo-
selladora adecuada, conforme las recomendaciones del fabricante.
31
Todos los Derechos reservados, 2015
En el caso de contenedores rgidos, estos deben seguir las recomendaciones del fabricante
en trminos de la distribucin del material y la cantidad de este.
En todos los paquetes y contenedores rgidos, se deben utilizar indicadores qumicos
internos y externos.
Los indicadores qumicos internos deben ser Clase 3, 4 5 o 6 de acuerdo a la clasificacin
del estndar ISO 11.140-1:2006 y deben cumplir con los requisitos establecidos en este
estndar.
Los indicadores qumicos externos o de proceso deben ser Clase 1 de acuerdo a la
clasificacin del estndar ISO 11.140-1:2006 y deben cumplir con los requisitos establecidos
en este estndar.
6. Etiquetado.
Todo el material debe ser rotulado en el exterior de los
empaques y deben existir registros que permitan trazar
el material hasta el usuario.
Los registros deben incluir:
Nmero de lote
Fecha de la carga en el esterilizador
Fecha de expiracin
7. Indicadores qumicos externos e internos.
Indicadores qumicos internos y externos deben ser usados en cada paquete o contenedor
rgido.
32
Todos los Derechos reservados, 2015
Los indicadores qumicos internos, son dispositivos que permiten verificar de manera visual,
si se cumplieron algunos o todos los parmetros de la esterilizacin. Estos, entregan
informacin a travs de cambios de color o desplazamiento lateral.
De esta forma, permiten descartar el uso de material que no cumpli con los parmetros de
la esterilizacin, de acuerdo a indicadores qumicos que no han cambiado totalmente en su
color.
Indicadores qumicos internos deben ser usados en el centro geomtrico de cada paquete y
pueden ser indicadores clase 3, 5, 5 o 6 de acuerdo al Estndar ISO 11.140-1:2006.
El objetivo de los indicadores qumicos internos es verificar los paquetes o contenedor rgido;
previo al uso de los instrumentos que contienen en la sala de ciruga. Esto, forma parte
integral de las listas de verificacin que se deben llevar a cabo en instituciones hospitalarias
conforme a las recomendaciones de la Organizacin Mundial de la Salud y su Programa de
Ciruga Segura.
Indicadores qumicos externos, permiten diferenciar paquetes o contenedores rgidos que no
han sido sometidos al proceso de esterilizacin.
Son indicadores qumicos Clase 1 conforme al estndar ISO 11.140-1:2006 y estn
construidos de manera que al ser expuestos a la esterilizacin, generan cambios de color
en su superficie.
Los indicadores externos ms comunes son en forma de cinta adhesiva para paquetes y de
candados o sellos plsticos.
Esterilizacin.
La esterilizacin es el proceso sobre el cual se eliminan los La esterilidad de un artculo,
dispositivo mdico o elemento implantable; es definida como el resultado de un proceso
validado por el cual se obtiene un producto libre de microorganismos viables. Esta esterilidad,
es establecida como la probabilidad de un tem de encontrarse estril. Esta probabilidad es
referida como el nivel de aseguramiento de la esterilidad o SAL por sus siglas en ingls, de
33
Todos los Derechos reservados, 2015
un producto especfico; y es definida como la probabilidad de existencia de un organismo
viable en el dispositivo esterilizado, luego de concluido el ciclo de esterilizacin.
Resulta entonces, que la esterilidad del contenido de un paquete o contenedor rgido es el
objetivo final del ciclo dentro de la Central de Esterilizacin y Reproceso.
Existen diversos mtodos para lograr la esterilidad en dispositivos e instrumental mdico, las
que sern abordadas en captulos posteriores.
8. Almacenamiento.
El almacenamiento del material estril debe ser realizado en
zonas adecuadas, alejadas del trnsito de personas y con
condiciones fsicas y ambientales que permitan garantizar que
el material mantendr la esterilidad a travs del tiempo y a lo
largo de la vida til entregada al paquete o contenedor rgido.
El almacenamiento debe ser realizado en reas:
Alejadas del trnsito de personas
Con al menos 4 renovaciones de aire por hora
Con presin positiva respecto de otras reas
Con temperatura y humedad relativa controlada
En gavetas o despensas separadas del suelo y de las paredes posteriores.
Ms detalles de las condiciones adecuadas de almacenamiento sern discutidas en el Captulo 10.
34
Todos los Derechos reservados, 2015
Captulo 3: Preparacin en Punto de uso y descontaminacin.
Preparacin en punto
de uso y
descontaminacin
35
Todos los Derechos reservados, 2015
Captulo 3: Preparacin en Punto de uso y descontaminacin.
La adecuada preparacin del material luego de ser utilizado es fundamental para el xito de la
descontaminacin posterior. Esto involucra a los profesionales y tcnicos del rea peri operativa y
de la Central de Esterilizacin y Procesos.
El seguimiento de prcticas adecuadas en esta etapa del reprocesamiento, puede contribuir
activamente a lograr el objetivo (esterilidad o desinfeccin), extender la vida til de los instrumentos
y reducir los tiempos totales de reprocesamiento.
1. Clasificacin de los materiales.
Antes de la dcada de 1950, la totalidad de los materiales utilizados dentro de una central de
esterilizacin eran materiales metlicos. Esto haca relativamente fcil la clasificacin,
descontaminacin y esterilizacin al tener propiedades fsicas similares.
A finales de la dcada de 1950, se generaron una serie de avances en la industria qumica los
que permitieron la produccin masiva de distintos materiales polimricos, que en su conjunto
son conocidos como materiales plsticos. Esto impuso una seria de desafos que condujeron al
desarrollo de la esterilizacin a travs de xido de etileno.
a. Tipos de agentes contaminantes.
Luego del uso del material e instrumental, este se encuentra habitualmente
contaminado.
Existen distintos tipos de agentes contaminantes que deben ser removidos a la
brevedad para posteriormente realizar la descontaminacin.
Dentro de estos agentes contaminantes se encuentran:
i. Suciedad visible.
Se incluyen en esta categora aquellos residuos de un procedimiento que son
usualmente eliminados directamente. Adicionalmente, cualquier acumulacin
36
Todos los Derechos reservados, 2015
de sangre, tejido adiposo u otras sustancias del cuerpo son incluidas en esta
categora.
Deben ser removidas lo antes posible para evitar una remocin posterior
compleja.
ii. Agentes biolgicos.
1. Sangre: la sangre es
uno de los principales
residuos que se
encuentra presente en
el material e
instrumental. Genera
usualmente grandes
desafos en la medida que se seca; su solubilidad en agua disminuye
rpidamente. La fibrina al ser expuesta a agua sobre 45C se vuelve
insoluble en agua y genera enlaces con la rugosidad del instrumental.
2. Protenas: dado que los residuos proteicos pueden tener amino
cidos hidroflicos o hidrofbicos, se pueden dar situaciones de fcil
limpieza y otras ms complejas.
3. Lpidos: los residuos grasos adheridos al material e instrumental
generan desafos dada su insolubilidad en agua.
37
Todos los Derechos reservados, 2015
Para facilitar la remocin de estos agentes contaminantes se utilizan
detergentes ya sea enzimticos, que afecten la tensin superficial o
floculantes que sern discutidos posteriormente.
b. Material a desinfectar y/o esterilizar.
i. Material metlico.
Si bien el acero inoxidable es el principal material metlico utilizado, este es
una categora dentro de los materiales, existiendo muchos tipos de aceros.
En la construccin de material e instrumental quirrgico, se utilizan
fundamental dos tipos de acero inoxidable:
- Acero Serie 400. Este acero es
tambin conocido como acero
endurecido y se utiliza en piezas
metlicas que requieren
extremos filosos. Algunos tipos
de instrumental construido con
este tipo de acero son las tijeras, frceps, cinceles hemostatos.
38
Todos los Derechos reservados, 2015
- Acero serie 300. Este acero es ligeramente menos rgido y ofrece
propiedades de maleabilidad. Algunos tipos de instrumental construido
con este tipo de acero son retractores, cnulas, dispositivos de succin.
El material de acero, fabricado de acero inoxidable de serie 300 o 400, se
producto luego de un proceso de forjado y fresado, para darle las formas y
caractersticas como rugosidad, dobleces o pinzas.
Luego el acero es calentado a ms de 800C para ser enfriado rpidamente.
Esto le confiere propiedades de dureza y resistencia.
Finalmente, el instrumental es pulido para disminuir la rugosidad de la
superficie. Esta rugosidad de no ser eliminada, contribuye a la acumulacin
de residuos y dificulta la descontaminacin. Luego de obtenido un acabado
muy liso, se termina el proceso con un proceso electroqumico conocido como
pasivizacin. Este proceso, logrado a travs del uso de cido ntrico; permite
eliminar el hierro superficial. Esta remocin qumica permite desarrollar una
pelcula externa de xido de cormo altamente resistente a la corrosin.
Adicionalmente, existen instrumentos con una terminacin dorada que indican
que se trata de instrumental delicado o instrumental para cortes o sostener
agujas. En ambos casos, tienen en su parte de trabajo un material
denominado carburo de tungsteno que le provee una dureza aun mayor al
acero serie 400.
ii. Materiales polimricos.
Los materiales e instrumentos construidos total o parcialmente de polimricos
son un grupo de materiales bastante amplio. En general son conocidos
errneamente como materiales plsticos.
Estos son utilizados en accesorios, instrumental, recubrimiento y bandejas.
Parte de este instrumental es descartable y otro es reutilizable.
Existen dos categoras de los materiales plsticos:
1. Materiales Termoplsticos:
39
Todos los Derechos reservados, 2015
Los termoplsticos son aquellos materiales que son moldeados
mediante temperatura. Suelen fundirse o tomar consistencia de fluido
cuando se calientan y luego se enfran vuelve a sus propiedades
originales.
2. Materiales Termoestables:
Los materiales termoestables, son aquellos que tienen propiedades
establecidas y cuando se les somete a un aumento de temperatura;
no se funden o cambian su consistencia, por el contrario, sufren
daos y pueden perder sus propiedades originales a travs de
quebraduras, daos o quemaduras.
Dentro de los materiales polimricos comnmente se encuentran:
- Estirenos utilizados como en dispositivos intravenosos, conectores y
vlvulas, sostenedores y engrapadoras.
- Polisteres utilizados en materiales de empaque, instrumental dental,
tapas de filtros y sostenedores de bistures.
- Poliamidas utilizadas en bandejas, accesorios mdicos y tubos.
- Polivinilos y acrlicos utilizados como revestimientos de asas de
instrumentos.
- Fluoropolimeros utilizados en tuberas de transferencia de fluidos.
40
Todos los Derechos reservados, 2015
Todos estos materiales son
fundamentales en el mundo
mdico quirrgico. La
importancia en el uso y
reutilizacin de estos
materiales; radica en
conocer la informacin del
fabricante de cmo reutilizar,
descontaminar, desinfectar
y/o esterilizar sin daar sus
propiedades.
c. Dispositivos mdicos de estructura compleja.
Si bien todos los dispositivos mdicos deben ser cuidadosamente mantenidos,
descontaminados y desinfectados o esterilizados; existen instrumentos que por su
geometra requieren especial cuidado en la fase de descontaminacin. Estos
dispositivos de estructura compleja tienen una seria de articulaciones, perforaciones
o rugosidades que dificultan la limpieza y descontaminacin, as como la penetracin
de agentes desinfectantes o esterilizantes.
En general, se debe poner especial cuidado en las fases de preparacin luego del
uso, descontaminacin y verificacin de funcionalidad en aquellos dispositivos con
las siguientes caractersticas:
- Bordes dentados y trinquetes. Instrumental con estos elementos tienen a
acumular carga biolgica como residuo luego del uso.
- Dispositivos con articulaciones como retractores o tijeras. Se debe verificar la
acumulacin de residuos.
- Dispositivos canulados como tubos de succin. Se debe verificar la ausencia de
residuos luego de continuos enjuagues durante la fase de descontaminacin.
41
Todos los Derechos reservados, 2015
- Alicates y pinzas gubias. Se debe verificar la ausencia de residuos y la integridad
de la pieza, detectando potenciales grietas que contribuyan a acumular suciedad.
- Dispositivos con mltiples piezas ajustables como espculos.
d. Uso de material en sala de operaciones y servicios clnicos.
Con algunas variaciones El material e instrumental, es utilizado fundamentalmente
en dos unidades de una institucin hospitalaria: Ciruga o Servicios Clnicos.
Estos son los centros de generacin de material e instrumental contaminado. Dada
la infraestructura de una institucin hospitalaria, es posible que el punto de uso del
material e instrumental; se encuentre alejado de la Central de Esterilizacin. Dado
esto, se recomienda que el material sea preparado en el lugar de uso.
La preparacin en el lugar de uso entrega tres beneficios principales:
- La preparacin en el lugar de uso extiende la vida til del material e instrumental.
La presencia de sustancias como sangre y soluciones salinas, a las que el
material e instrumental se encuentra expuesto; pueden alterar las propiedades
qumicas del material e instrumental, reduciendo su vida til por un dao
acelerado del revestimiento que llevan los instrumentos.
- La suciedad y residuos que se secan sobre el instrumental, generan una mayor
dificultad de remocin de estos; incidiendo en la necesidad de realizar una
limpieza mecnica ms agresiva.
- La preparacin en el punto de uso, permite evitar que la suciedad se seque sobre
el material e instrumental, facilitando la descontaminacin posterior y
contribuyendo a la rapidez del proceso completo de descontaminacin y posterior
desinfeccin de alto nivel o esterilizacin.
Las recomendaciones para preparacin en el lugar de uso son las siguientes:
42
Todos los Derechos reservados, 2015
- Conocer y disponer en un lugar de fcil acceso; las recomendaciones del
fabricante del material e instrumental para la preparacin en punto de uso. El no
conocer ni respetar estas recomendaciones puede incidir en un dao irreversible
del material e instrumental o material y la perdida de garantas si existieses.
En ausencia de instrucciones del fabricante; se debe evaluar en la Central de
esterilizacin cual es la prctica ms adecuada para la preparacin del material
e instrumental o material.
- Remover la suciedad visible inmediatamente luego del uso del instrumento o
material.
- Mantener el material e instrumental hmedo. Evitar el secado de la suciedad
sobre la superficie del material facilitar la posterior descontaminacin. Para esto,
puede utilizar soluciones enzimticas rociadas sobre el material e instrumental,
sumergiendo el material e instrumental en agua o cubriendo el material e
instrumental con toallas hmedas.
-
En el caso de sumergir el material, se deben utilizar contenedores cerrados y
tomar las precauciones necesarias para evitar salpicaduras o derrames en la
etapa de transporte del material.
- Separar el material descartable del material reutilizable. Esto incluye la
separacin del material de tela reutilizable del descartable (e.g. Campos
quirrgicos y gasas).
- Separar material cortante o punzante de otros materiales.
- Si un material contaminado tiene contenedores, botellas o recipientes que
acumulen lquidos; asegrese de eliminar los lquidos de manera adecuada.
- Ubicar materiales que forman parte de un set quirrgico en el mismo contenedor.
Esto le permitir reducir las prdidas de piezas especficas de un set.
43
Todos los Derechos reservados, 2015
e. Preparacin y traslado a la Central de Esterilizacin.
Una vez que el material e instrumental ha sido preparado luego de su uso; debe ser
trasladado a la Central de Esterilizacin, donde ser sometido a procesos de
descontaminacin y a desinfeccin de alto nivel y/o esterilizacin.
El traslado del material debe ser realizado en contenedores cerrados, con base
sellada completamente de manera de evitar salpicaduras o derrames.
f. Descontaminacin.
La descontaminacin, entendida como la reduccin o remocin de contaminantes es
un proceso fundamental para lograr la desinfeccin de alto nivel o esterilizacin de
productos.
El principio fundamental es que no se puede desinfectar o esterilizar lo que se
encuentra contaminado.
Algunas consideraciones del rea de descontaminacin tienen relacin con el diseo
de toda la institucin. Idealmente, la descontaminacin debe ser centralizada y ser
parte de la Central de Esterilizacin y Equipos.
La superficie del rea de descontaminacin debe ser al menos equivalente al rea
de inspeccin y esterilizacin/desinfeccin. Superficies menores generan efectos de
embotellamiento y se convierten en la principal causa de la demora en la entrega de
material descontaminado.
La zona de descontaminacin debe ser construida de manera que suelos, paredes
y cielo puedan ser sometidos a constantes lavados. La presencia de drenaje en el
suelo es fundamental para la limpieza y para eliminar derrames que pudiesen ocurrir.
Las condiciones de ambientales son importantes y se debe contar con las siguientes
condiciones:
al menos 10 renovaciones de aire por hora
temperatura entre 16 y 18C.
humedad relativa entre 60 y 80%.
44
Todos los Derechos reservados, 2015
La iluminacin debe cumplir recomendaciones locales y debe ser adecuada para
realizar las labores cotidianas con seguridad sin generar fatiga visual en los
trabajadores.
Adicionalmente, es necesario que se generen programas de desinfeccin de
superficies de manera peridica, al igual que la eliminacin de residuos con riesgo
biolgico.
g. Agua para Limpieza y descontaminacin.
Se debe asegurar que existe un suministro adecuado de agua potable y que esta es
tratada conforme a los requerimientos de la instalacin.
i. Caractersticas del agua.
Existen dos caractersticas que afectan el proceso de descontaminacin y
limpieza.
1. Presencia de minerales:
Tambin conocido como la dureza del agua, es una medida de la
cantidad de sales de carbonato de calcio y magnesio. Controlar la
dureza del agua es fundamental para lograr la mxima efectividad al
utilizar detergentes tenso activos o enzimticos. Lo mismo ocurre con
aquellos desinfectantes de alto, bajo y medio nivel.
Esto se controla a travs de distintos sistemas de filtracin incluidos
filtros primarios, ablandadores, filtros de osmosis reversa
45
Todos los Derechos reservados, 2015
2. pH:
El pH es la medida de alcalinidad o acidez del agua. Al igual que
con la presencia de minerales, el pH puede tener una gran influencia
en la efectividad de detergentes.
ii. Sistemas de filtracin.
Al igual que no es posible esterilizar sin una adecuada descontaminacin;
para filtrar de forma adecuada el agua debe ser previamente purificada.
Actualmente, existen al menos 3 procesos distintos de purificacin:
1. Filtros: los filtros permiten reducir la cantidad de material insoluble
en el agua. Son construidos usualmente de membranas plsticas
que permiten capturar las partculas. Estas partculas pueden afectar
la turbidez del agua y son de tamaos del orden de micrones.
Los filtros deben ser lavados de manera reversa o reemplazados de
forma peridica, pues en la medida que se saturan pierden su
efectividad y el caudal de agua entregado es menor a travs del
tiempo.
2. Carbn activado: se utiliza dentro de filtros y permite remover
principalmente cloruros. Esta etapa es fundamental dado que los
cloruros disueltos en el agua, afectan el desempeo de sistemas de
osmosis reversa y generan fenmenos de corrosin en los sistemas.
3. Ablandadores: los ablandadores se usan para reducir la dureza del
agua (e.g. sales de calcio magnesio). La remocin de estas sales se
realiza a travs de intercambios inicos.
iii. Sistemas de purificacin.
Existen diversos mtodos para que el agua se encuentre en buenas
condiciones para ser utilizada en los procesos de la central de esterilizacin.
46
Todos los Derechos reservados, 2015
1. Destilacin: es el proceso en el cual se obtiene agua que luego de ser
hervida, su vapor es condensado y llevado nuevamente a su forma
lquida.
Es un proceso relativamente econmico, dependiendo de los
volmenes de produccin.
2. Deionizacin: a travs de columnas de intercambio aninico y catinico;
la deionizacin permite eliminar los iones disueltos en el agua. Esto
permite lograr agua de buena calidad para ser utilizada en procesos de
limpieza.
3. Osmosis reversa: esta alternativa es quizs la ms utilizada y la que
provee agua de mayor calidad. Los sistemas de osmosis reversa deben
estar funcionando en lnea con sistemas de pre filtro, sistemas de
carbn activado, ablandadores y filtros secundarios.
h. Limpieza.
La limpieza en general se debe realizar a travs de accin mecnica y el uso de
algn detergente. Los detergentes permiten lograr a travs de distintos fenmenos;
la incorporacin de la suciedad en el detergente, eliminando esta suciedad del medio
que se busca limpiar.
i. Detergentes.
1. Uso de detergentes: los detergentes son utilizados por 3 motivos
principalmente:
a. Disminucin de la tensin superficial: esto permite que el
lquido pueda penetrar la suciedad y lograr la limpieza. Los
detergentes son diseados en funcin del tipo de suciedad
que buscan remover.
47
Todos los Derechos reservados, 2015
b. Floculacin: la generacin de flculos permite romper y
dispersar la suciedad permitiendo que esta quede suspendida
en el lquido para ser posteriormente eliminada.
c. Suspensin: en la medida que la suciedad se mantiene
suspendida en el lquido, esta podr ser eliminada en los
enjuagues [posteriores.
2. Tipos de detergentes.
a. Agentes tenso activos: los detergentes con en base a tenso
activos buscan flocular, reducir tensin superficial y facilitar la
suspensin de la suciedad.
b. Agentes enzimticos: los agentes enzimticos son
detergentes altamente especficos que se benefician del uso
de enzimas. Las enzimas, son molculas de naturaleza
proteica que permiten catalizar reacciones qumicas,
disminuyendo tanto el tiempo como la temperatura a la que
se llevan a cabo las reacciones. Estas enzimas, permiten
catalizar la destruccin de sangre, heces y albumina
(proteasa), cidos grasos y residuos grasos (pipasa) y
almidones (amilasa).
ii. Procedimientos de lavado manual.
1. Tcnicas de lavado manual.
Luego de remover la suciedad visible, el lavado manual debe ser
siempre realizado bajo un chorro de agua. Esto para evitar que los
48
Todos los Derechos reservados, 2015
contaminantes pueden convertirse en spray y mantenerse en la sala
sin ser eliminados.
El fregado o accin mecnica es fundamental en este tipo de limpieza
para asegurar la remocin de toso los residuos en el instrumental o
material.
2. Elementos de proteccin personal.
Durante el lavado manual, es necesario utilizar elementos de
proteccin personal que garanticen la seguridad del trabajador.
Dentro de estos elementos se cuentan:
o Guantes
o Cubre rostro
o Delantal o cotona impermeable
iii. Equipos para lavado automtico.
1. Equipos de ultrasonido: Las lavadoras de ultra sonido son un gran avance
en pos de la limpieza adecuada. Utilizan el principio de cavitacin, siendo
este la generacin de pequeas burbujas generadas a travs de
vibracin, que se expanden en el lquido para luego impresionar. Estas
pequeas burbujas permiten actuar como accin mecnica. Dados los
niveles de cavitacin (vibracin) generados; las burbujas son de tamaos
imperceptibles, sin embargo pueden penetrar eficientemente
instrumentos canulados logrando una limpieza excelente.
Cuentan con entre 1 y 3 cmaras siendo la primera de lavado y
cavitacin, la segunda de enjuague y la tercera de enjuague final.
49
Todos los Derechos reservados, 2015
2. Vapor a alta presin. El vapor a alta presin permite hacer fluir vapor
por lmenes o partes mviles de instrumental, eliminando residuos.
3. Termodesinfectoras: este tipo de equipos utiliza detergentes, agua y
temperatura para realizar el lavado final previo a la revisin y
empaque.
Utilizan ciclos variables en funcin del tipo de material a lavar y son
altamente eficientes para la limpieza final de materia e instrumentos.
iv. Criterios de control de la calidad: registros.
1. Control de lavadora Termodesinfectoras.
Los fabricantes de este tipo de lavadoras, usualmente proveen de
verificadores visuales de la limpieza. Estos se componen de una
suciedad estandarizada, que solo puede ser removida al cumplirse
los criterios de presin de agua, detergentes y temperatura.
Usualmente, son de forma rectangular con un centro donde se
adhiere la suciedad estandarizada. Esta debe ser removida
completamente para considerar que el proceso fue exitoso.
Estos monitores son una buena forma de realizar la verificacin del
funcionamiento del equipo, sin embargo no reemplazan la inspeccin
visual individual de cada uno de los instrumentos desinfectados.
2. Control de calidad de equipos de ultrasonido.
Al igual que las Termodesinfectoras, los equipos de ultrasonido
utilizan sistemas de verificacin.
Estos dispositivos, son usualmente pequeos contenedores
hermticos, que contienen molculas especficas que son afectadas
por las ondas generadas en el equipo, generando un cambio de color
en su contenido.
50
Todos los Derechos reservados, 2015
El resultado de estos dispositivos, permite establecer que se est
generando una cantidad adecuada de cavitacin en los ciclos, al
tiempo que permite determinar que la cantidad de dispositivos que se
sumergen en las cmaras es adecuada. En aquellos casos que las
cmaras contengan muchos dispositivos, el monitor de cavitacin
puede arrojar un resultado errado, indicando que la cantidad de
instrumental puede superar las recomendaciones del fabricante o
algn desperfecto del equipo.
51
Todos los Derechos reservados, 2015
Desinfeccin de alto
nivel y su monitoreo
52
Todos los Derechos reservados, 2015
Captulo 4: Desinfeccin de alto nivel y su monitoreo.
En el ao 1973, el profesor Doctor E.H. Spaulding; estableci una clasificacin para determinar el
procedimiento para el reprocesamiento de un instrumental de uso mdico. Esta escala consideraba
3 categoras las que se determinaban en funcin del tipo de contacto que tendra con un paciente.
En la actualidad, esta escala conocida simplemente como Escala de Spaulding; se utiliza para
determinar si se realizar desinfeccin comn o de bajo nivel, desinfeccin de alto nivel o
esterilizacin a un determinado dispositivo.
Dados los cambios en los dispositivos mdicos incluida su geometra y los materiales utilizados en
su construccin, la creciente prevalencia de sper microorganismos o microorganismos resistentes
a diversos tratamientos antibiticos y la gran cantidad de procedimientos ambulatorios que se
realizan diariamente; es importante conocer las alternativas para realizar la desinfeccin de alto
nivel.
1. Desinfeccin de Alto nivel (DAN).
Es actualmente aceptado internacionalmente, que el reprocesamiento ideal de un dispositivo de
uso mdico es la esterilizacin. Sin embargo, por motivos variados no siempre es posible
esterilizar dispositivos. De acuerdos a las recomendaciones de la CDC de 2008; en ausencia de
la posibilidad de esterilizar, los dispositivos considerados como semi crticos deben ser
sometidos a desinfeccin de alto nivel.
Dado el tipo de accin sobre los microorganismos y virus; la desinfeccin de alto nivel permite
destruir los microrganismos vegetativos, bacilos como el de la tuberculosis, la mayora de los
hongos y los virus lipdicos y no lipdicos de tamaos pequeos. Sin embargo, la desinfeccin
de alto nivel no permite eliminar esporas bacterianas.
Dado esto, es fundamental definir cules son los procesos adecuados para lograr la mayor
efectividad de la desinfeccin de alto nivel.
53
Todos los Derechos reservados, 2015
a. Escala de Spaulding y postura de CDC.
Esta clasificacin se mantiene vigente en la actualidad, permitiendo a los profesionales
de la salud determinar de forma clara e inequvoca los riesgos asociados a los
dispositivos mdicos y los modos de reducir los riesgos asociados al uso de estos.
Crtico Aquellos dispositivos mdicos que Agujas, escalpelos, Esterilizacin SAL 10e-6
entran en contacto con tejido implantes
vascular o estril
Semi Crtico Aquellos dispositivos mdicos que Endoscopios o tubos endo Esterilizacin SAL 10e-6 o desinfeccin
entran en contacto con traqueales de alto nivel
membranas mucosas no estriles
No Crtico Aquellos dispositivos mdicos que Termmetros Desinfeccin de nivel medio o bajo
entran en contacto con piel intacta
Ilustracin 4: Resumen de la Clasificacin de Spaulding.
Respecto del Centro de Control de infecciones de Estados Unidos, CDC; la vigencia
de la escala de Spaulding se mantiene y sigue siendo recomendada como una
efectiva estrategia de determinacin de los tipos de reprocesamiento a los que se
deben someter los dispositivos mdicos reutilizables.
b. Criterios de seleccin de procesos.
En funcin de lo establecido en la escala de Spaulding, se debe determinar en qu
espacio se encuentra el dispositivo a reprocesar:
54
Todos los Derechos reservados, 2015
No crtico Semi Critico Critico
Limpieza y Limpieza Limpieza
desinfeccin de bajo
nivel
Descontaminacin Descontaminacin
Desinfeccin de alto
Esterilizacin
nivel
Ilustracin 5: Procesos requeridos en funcin de la criticidad del dispositivo.
2. Uso de desinfectantes de alto nivel.
Al utilizar cualquier agente qumico, existe informacin que resulta fundamental a la hora de
utilizar los desinfectantes. El conocer sus modos de uso, limitaciones, concentracin efectiva,
tiempos de contacto requerido, duracin y toxicidad resulta fundamental para el xito de los
procesos y para la salud de los operarios.
a. Tipos de desinfectantes de alto nivel:
Existen en la actualidad diversos productos disponibles, sin embargo; con pocas
variaciones, todos entran en alguna de las siguientes categoras:
i. Formaldehido:
1. Caractersticas:
El formaldehido es un agente esterilizante en algunos sistemas que
lo utilizan como vapor, los que sern discutidos posteriormente; y es
tambin utilizado como desinfectante en de alto nivel en forma lquida.
Usualmente se comercializa diluido en agua al 37% bajo el nombre
de Formalina.
55
Todos los Derechos reservados, 2015
2. Precauciones:
La agencia de Salud Ocupacional de Estados Unidos OSHA;
establece que el Formaldehido debe ser manejado como potencial
carcingeno y establece que los lmites de exposicin en una jornada
de 8 horas es de 0.75 ppm.
3. Modo de accin y Actividad microcida:
El formaldehido inactiva microorganismos mediante alquilacin
aminocidos y grupos sulfidros de las protenas y de los anillos
nitrogenados.
Existen diversas concentraciones y tiempos de exposicin, sin
embargo en una concentracin normalmente usada de 4%, requiere
2 horas para inactivar Bacilo antracis en niveles de 104.
4. Desventajas:
Irritante de las membranas mucosas y sufre inactivacin en presencia
de materia orgnica.
ii. Glutaraldehido:
1. Caractersticas:
El glutaraldehido es uno de los desinfectantes de alto nivel ms
comnmente utilizados en la actualidad. Cuando se encuentra en
estado normal, tiene un pH bajo, siendo una solucin cida. Al ser
activado mediante el uso de tampones que aumentan su pH a 7.5
8; se convierte en un desinfectante con cierto efecto esporicida.
En este estado, tiene una duracin promedio de 14 das hasta que
comienza su decaimiento, permitiendo su efecto microcida.
56
Todos los Derechos reservados, 2015
2. Precauciones:
La agencia de Salud Ocupacional de Estados Unidos OSHA;
establece que el glutaraldehido debe ser manejado como qumico
peligroso y los usuarios deben ser entrenados en su uso seguro.
Se debe reducir la exposicin a sus vapores y el contacto con la piel.
Se requiere ventilacin igual o superior a 10 cambios por hora en el
rea de uso.
3. Modo de accin y Actividad microcida:
El formaldehido inactiva microorganismos mediante alquilacin de
diversos grupos de aminocidos alterando los cidos nucleicos
(Desoxi y ribo nucleicos).
Diversos estudios han demostrado que se requiere una solucin de
2% e inmersin durante al menos 45 minutos a 25C parar lograr
desinfeccin de alto nivel.
4. Desventajas:
Irritante de las membranas mucosas.
iii. Ortoftalaldehido (OPA).
1. Caractersticas:
El OPA es un desinfectante relativamente nuevo dentro de la
industria. Presenta compatibilidad con la mayora de los materiales,
incluyendo metales, plsticos y polmeros. Se presenta en una
solucin transparente con un pH de 7,5.
2. Precauciones:
La agencia de Salud Ocupacional de Estados Unidos OSHA;
establece que el OPA debe ser manejado como qumico peligroso y
los usuarios deben ser entrenados en su uso seguro.
57
Todos los Derechos reservados, 2015
Se debe reducir la exposicin a sus vapores y el contacto con la piel.
Se requiere ventilacin igual o superior a 10 cambios por hora en el
rea de uso.
3. Modo de accin y Actividad microcida:
Genera interacciones con los aminocidos, protenas de los
microrganismo, evitando su reproduccin.
Tiene un comportamiento ms efectivo y en menor tiempo al ser
comparado con el Glutaraldehido y presenta una mayor estabilidad
en las soluciones al igual que una duracin sobre el doble de ciclos
en reprocesadores automticos de endoscopios (82 vs 40 ciclos).
4. Desventajas:
Al igual que otros desinfectantes de alto nivel, puede provocar
irritacin en las membranas mucosas e irritacin en la piel.
b. Consideraciones de seguridad generales.
Se debe contar con un plan escrito que considere
las medidas de seguridad ocupacional necesarias
para mantener a los trabajadores seguros y ajenos
a riesgos de exposicin.
Para evitar riesgos relacionados con la exposicin
ocupacional se recomienda:
El personal debe utilizar elementos de
proteccin personal, incluyendo ropa
adecuada, guantes, proteccin respiratoria y antiparras.
58
Todos los Derechos reservados, 2015
Se debe contar con adecuada ventilacin en el lugar donde se realizan las
labores de desinfeccin.
Se debe contar con duchas de ojos o botellas dispuestas para el lavado
rpido y adecuado de ojos en caso de salpicaduras.
c. Criterios tcnicos para elegir un desinfectante.
Como cualquier producto a utilizarse dentro de un ambiente hospitalario, la decisin
de uso debe basarse en criterios tcnicos.
Esto es particularmente importante al encontrarse en la actualidad variedad tan
amplia tanto de productos para desinfeccin de alto nivel como de proveedores
disponibles dispuestos a venderlos.
Un anlisis riguroso debe incluir al menos:
Caractersticas tcnicas del producto.
Forma de uso.
Material de entrenamiento, incluidas hojas de seguridad.
Duracin.
Compatibilidad con material existente.
Se deben tomar las medidas adecuadas para definir la idoneidad de los productos a
utilizar en la central, tanto del punto de vista de la efectividad como del uso adecuado
de los recursos.
d. Requisitos ambientales para DAN.
Los desinfectantes de alto nivel, son en general compuestos orgnicos disueltos en
agua en distintas proporciones. Dada su naturaleza, tienen la tendencia a volatilizar
parte de sus compuestos, particularmente aquellos que a temperatura ambiente
59
Todos los Derechos reservados, 2015
pueden convertirse en vapores. Este fenmeno se ve incrementado con el aumento
de la temperatura del agua.
Teniendo esto en consideracin, es necesario que los procesos de desinfeccin de
alto nivel; sean monitoreados ambientalmente y se cuenten con las condiciones de
ventilacin adecuadas para evitar la exposicin prolongada en los trabajadores que
realizan los procesos de desinfeccin de alto nivel, particularmente aquellos
realizados de forma manual.
e. Elementos de proteccin personal.
Dependiendo las regulaciones particulares de los pases; el uso de elementos de
proteccin personal es obligatorio y todos los elementos deben ser provistos por el
empleador.
Esto incluye proteccin ocular, proteccin respiratoria, guantes y material para
proteger el cuerpo de salpicaduras.
3. Procedimiento de DAN Manual.
a. Preparacin en punto de uso y transporte.
De ser posible, los dispositivos deben ser preparados en el punto de uso, de manera
de reducir la contaminacin y/o de prevenir la deshidratacin de los contaminantes.
Posteriormente deben ser trasladados en contenedores cerrados a la central de
esterilizacin.
b. Pre limpieza.
Se debe realizar la limpieza de la superficie exterior de los dispositivos.
c. Limpieza manual y enjuague.
Se debe realizar la limpieza conforme a las instrucciones del fabricante, poniendo
especial atencin en la completa eliminacin de residuos del desinfectante a travs
60
Todos los Derechos reservados, 2015
de mltiples enjuagues; de manera de eliminar la mayor cantidad de residuos en el
instrumento.
d. Desinfeccin de alto nivel y enjuague.
Se deben seguir las instrucciones tanto del fabricante del instrumental como del
proveedor del desinfectante de alto nivel.
Especial atencin se debe prestar al tiempo y temperatura, al igual que la
concentracin del desinfectante.
En aquellos dispositivos (e.g. terapia respiratoria) que presenten dificultad para
mantenerse sumergidos, debe asegurarse la total inmersin del dispositivo.
Finalmente se debe verificar la completa eliminacin del desinfectante de alto nivel.
Se debe prestar atencin en dispositivos con canales internos que puedan acumular
desinfectante en su interior.
e. Secado y almacenamiento.
Luego de cumplido el tiempo de desinfeccin, se debe sumergir el dispositivo en
agua de enjuague para realizar la remocin de cualquier remanente de desinfectante.
En el caso de los dispositivos con canales, se debe hacer fluir alcohol por el interior
de los canales y posteriormente utilizar aire comprimido.
Utilice un pao libre de pelusa o material descartable con alcohol para limpiar el
dispositivo por el exterior.
Almacene el dispositivo.
61
Todos los Derechos reservados, 2015
Preparacin en
punto de uso y
transporte:
Almacene el
Pre limpieza:
dispositivo.
Secado y Limpieza manual
almacenamiento. y enjuague.
Desinfeccin de
alto nivel y
enjuague.
Ilustracin 6: Resumen del proceso de desinfeccin de alto nivel.
4. Modos de falla de la desinfeccin de alto nivel.
La desinfeccin de alto nivel tiene distintas posibilidades donde puede fallar el proceso,
generando que un dispositivo sea utilizado en pacientes sin haber sido correctamente
desinfectado.
a. Concentracin del desinfectante.
La letalidad que logre un desinfectante de alto nivel es funcin de su concentracin.
Una ausencia de monitoreo puede afectar el resultado de la desinfeccin, toda vez
que la concentracin de un desinfectante disminuye continuamente, vindose
acelerado por aspectos como la materia orgnica y la temperatura.
b. Proceso de limpieza manual y materia orgnica.
En el caso de aquellos dispositivos con alto contenido de materia orgnica inicial
(e.g. duodenoscopios); la pre limpieza y limpieza manual resultan fundamentales.
62
Todos los Derechos reservados, 2015
No obstante una adecuada tcnica y personal experimentado, as como la geometra
compleja de algunos dispositivos; es posible que el dispositivo an tenga una gran
cantidad de materia orgnica. El exceso de materia orgnica va a afectar la
efectividad del desinfectante y reducir su vida til.
c. Tiempo de exposicin.
Al igual que en un ciclo de esterilizacin por vapor, en la desinfeccin de alto nivel;
la desinfeccin es funcin del tiempo. Considerando que otros aspectos crticos se
encuentran controlados (temperatura y concentracin), la desinfeccin se alcanzar
en un tiempo determinado para cada desinfectante. La ausencia en el control del
tiempo de exposicin, puede afectar el resultado del producto.
d. Inmersin.
En aquellos dispositivos que no presentan dificultad para mantenerse sumergidos,
se deben determinar una forma efectiva de lograr inmersin completa en el
desinfectante. Un desinfectante no puede ser efectivo si no logra contacto con la
superficie a desinfectar.
5. Registros de la desinfeccin.
Es necesario mantener un registro al utilizar desinfectantes de alto nivel.
Este registro, debe mantener informacin vigente, incluyendo:
Fecha de apertura del contenedor primario (empaque del fabricante) del
desinfectante.
Fecha de vaciado de la solucin de su contenedor primario al contenedor
secundario.
Fecha estimada de expiracin del desinfectante.
Fecha de expiracin de las tiras reactivas.
63
Todos los Derechos reservados, 2015
Fecha y resultado de ltima evaluacin con tiras reactivas, incluyendo Concentracin
Mnima Efectiva.
Responsable.
Ubicacin Central de Reproceso Desinfectante Glutaraldehido
Fecha de Fecha de Fecha de Fecha de Resultado Responsable Comentarios
apertura del expiracin de expiracin de ensayo
contenedor la solucin tiras reactivas
primario
01/01/2015 01/15/2015 Oct 2015 01/10/2015 + WLP Solucin turbia
01/15/2015 01/30/2015 Oct 2015 01/20/2015 + WLP Sin comentarios
02/01/2015 02/15/2015 Oct 2015 02/08/2015 + WLP Solucin OK
02/15/2015 02/28/2015 Oct 2015 02/17/2015 - WLP Solucin con
baja C.M.E.
Ilustracin 7: Ejemplo de registro de D.A.N.
Junto con mantener informacin para efectos de trazabilidad, los registros permiten
determinar la vigencia del desinfectante, su concentracin y los plazos adecuados de uso.
64
Todos los Derechos reservados, 2015
Verificacin de
instrumental, armado y
empaque
65
Todos los Derechos reservados, 2015
Captulo 5: Verificacin de instrumental, armado y empaque.
Cuando usted adquiere leche en un contenedor del tipo Tetra Pak o en botellas desechables,
probablemente observar que el contenedor no est derramando su contenido. Adicionalmente,
usted sabe que la leche fue pasteurizada; envasada y que se encuentra en ptimas condiciones
para ser consumida por usted y su familia. Tambin muy probablemente sabe que al abrir alguno
de estos contenedores, la leche debe ser refrigerada desde ese momento, de lo contrario;
fenmenos de acidificacin, fermentacin gaseosa o viscosa, protelisis o lipolisis van a alterar la
leche; todos fenmenos asociados a la presencia de microrganismos.
En consecuencia, el contenedor de la leche, junto con la integridad de este; permite asegurarse que
la leche estar en condiciones adecuadas para su consumo.
En el mundo de la esterilizacin sucede lo mismo. Todo material estril mantendr su condicin de
esterilidad tanto como el empaque que lo contiene; no sea alterado o daada su integridad
(rasgaduras de papel, humedad excesiva, daos en las tapas de los contenedores rgidos, rotura de
empaques plstico papel).
En el presente capitulo, se abordar la verificacin de funcionalidad y el armado del instrumental;
junto al empaque de este.
1. Verificacin de la funcionalidad del instrumental y Armado del instrumental.
El armado del instrumental se debe realizar conforme las recomendaciones establecidas en las
instrucciones de uso provistas por el fabricante.
66
Todos los Derechos reservados, 2015
a. Verificacin general de
instrumental y material mdico
quirrgico.
La verificacin e inspeccin se realiza a
travs de una meticulosa observacin
del material descontaminado. Durante
este proceso, se recomienda el uso de
lupas iluminadas, de manera de poder
magnificar cualquier residuo remanente,
alteracin en la forma del instrumento, dao o prdida de funcionalidad.
Dentro de los daos comunes se cuentan la presencia de pequeas grietas o fisuras, la
reduccin de la movilidad en piezas articuladas y la perdida de la rugosidad necesaria.
En esta etapa, es fundamental realizar una observacin rigurosa en zonas complejas de
algunos instrumentos; por ello se recomienda tener acceso a las instrucciones del fabricante
siguiendo indicacin de limpieza, descontaminacin y verificacin final. En aquellas
instituciones donde no se cuentan con las instrucciones de uso del fabricante, se deben
establecer protocolos internos validados para garantizar el adecuado proceso de
descontaminacin.
Finalmente, en dispositivos canulados, se deben verificar que tanto la descontaminacin
como los continuos enjuagues permitieron eliminar todos los restos de residuos biolgicos
del interior de los lmenes.
v. Uso de lubricantes.
Inicialmente creados como lubricantes para prevenir la corrosin del material
mdico, en la actualidad se utilizan como parte integral del proceso de
descontaminacin y verificacin del instrumental, extendiendo la vida til y
garantizando una adecuada funcionalidad de los mismos.
67
Todos los Derechos reservados, 2015
La lubricacin se realiza una vez concluida la limpieza y descontaminacin y
es la etapa previa a la esterilizacin.
Los lubricantes deben permitir facilitar la movilidad de instrumental articulado,
sin afectar su integridad (e.g. facilitar la corrosin), ni agregar elementos
contaminantes al instrumental.
Adicionalmente, deben ser utilizados lubricantes aprobados por el fabricante
del dispositivo mdico.
Los lubricantes en la actualidad tienen un aspecto lechoso, de color blanco.
Son lubricantes de base acuosa (libres de solventes o aceites) y no afectan
el proceso de esterilizacin ni entregan contaminantes al producto final.
vi. Verificacin de corte.
La verificacin de corte se debe realizar antes o despus de la aplicacin de
lubricantes. Permite garantizar que los dispositivos se encuentran en
condiciones adecuadas para desarrollar labores de corte durante cirugas o
procedimientos mdicos, con una facilidad adecuada y un esfuerzo mnimo.
Existen en la actualidad tres prcticas comunes para esta verificacin:
1. Verificacin diaria:
Se establece que cada da, la totalidad del material cortante se
verifica utilizando un material de referencia.
Se realizan al menos 3 cortes con el material cortante en la superficie.
Todo el material que realice los cortes con xito se pone mantiene
en el proceso, se esteriliza y se pone disponible para su uso.
2. Verificacin semanal.
Se establece que al menos 3 das a la semana, la totalidad del
material cortante se verifica utilizando material de referencia.
68
Todos los Derechos reservados, 2015
Se realizan al menos 3 cortes con el material cortante en la superficie.
Todo el material que realice los cortes con xito se pone mantiene
en el proceso, se esteriliza y se pone disponible para su uso.
3. Verificacin mensual.
Se establece que al menos 1 vez por mes, la totalidad del material
cortante se verifica utilizando material de referencia.
Se realizan al menos 3 cortes con el material cortante en la superficie.
Todo el material que realice los cortes con xito se pone mantiene
en el proceso, se esteriliza y se pone disponible para su uso.
El uso de material de referencia, supone riesgos de exposicin al
ltex, por lo que medidas preventivas deben ser consideradas.
b. Verificacin de instrumental complejo.
El instrumental utilizado por los profesionales de la medicina fue durante siglos, relativamente
sencillo. Frceps, tijeras y pinzas eran dispositivos comnmente utilizados, sin embargo con
los avances tecnolgicos se han incorporado a la prctica mdica, una seria de instrumentos
complejos. Esta complejidad viene dada por la funcionalidad, diseo, materiales y en los
recursos que utiliza para obtener movilidad: dispositivos neumticos o funcionales a travs
de aire comprimido, dispositivos con motor y bateras; son instrumentos que se observan
con frecuencia en las instituciones mdicas de la actualidad.
Las precauciones necesarias para su limpieza, descontaminacin y verificacin, al igual que
los instrumentos mismos; han evolucionado para que estos sean utilizados con niveles de
seguridad conformes a la prctica mdica.
Estos nuevos instrumentos, sumamente complejos, son a la vez frgiles y deben ser
reprocesados conforme a las instrucciones del fabricante. En estas instrucciones, se pueden
encontrar los detergentes recomendados, los procesos manuales de limpieza y
69
Todos los Derechos reservados, 2015
descontaminacin y las instrucciones de cmo realizar el armado y desarmado sin alterar su
funcionalidad.
A continuacin se describirn las principales diferencias y cuidados a tener para instrumentos
de dos categoras: elctricos y neumticos.
i. Instrumental elctrico:
Esta categora incluye los dispositivos que utilizan electricidad ya sea por batera
o por corriente alterna (suministro del edificio).
Estos instrumentos deben ser desarmados para limpieza y descontaminacin y
quedar listos para la esterilizacin. Se debe tener especial cuidado en la
manipulacin de estos para evitar daos; as como realizar una adecuada
limpieza. La contaminacin al interior de estos instrumentos puede generar daos
en estos, incluidas la disminucin o la prdida de funcionalidad.
ii. Instrumental neumtico.
Esta categora incluye los dispositivos que utilizan aire comprimido para su
funcionamiento.
Estos instrumentos deben ser desarmados para limpieza y descontaminacin y
quedar listos para la esterilizacin. Se debe tener especial cuidado en la
manipulacin de estos para evitar daos; as como realizar una adecuada
limpieza. La contaminacin al interior de estos instrumentos puede generar daos
en estos, incluidas la disminucin o la prdida de funcionalidad.
2. Objetivos del empaque.
El empaque de un producto a ser esterilizado, tiene por objetivo fundamental tiene relacin con
mantener la condicin de esterilidad del producto. Esto se logra a travs de una barrera fsica
70
Todos los Derechos reservados, 2015
entre el exterior y el interior del paquete, que permite evitar contacto con contaminantes pero
tambin con los vectores de estos.
Dentro de los factores que afectan la esterilidad de un paquete, se encuentra la presencia de
humedad tanto en vapor como gotas.
Cualquier desgarro o dao del material de empaque afecta la esterilidad del producto, por lo que
debe ser reprocesado.
3. Seleccin de material de empaque.
La seleccin de un material de empaque tiene como otras decisiones; un componente econmico
y otro tcnico.
La evidencia disponible sugiere que el uso de material desechable en el uso de empaques puede
contribuir de mejor forma a mantener la esterilidad de los paquetes, por periodos mayores de
tiempo. Sin embargo, esto no obsta que se puedan utilizar materiales convencionales de manera
exitosa.
Se deben observar ciertos criterios a la hora de seleccionar el material de empaque, dentro de
los cuales se pueden destacar:
Todo nuevo material de empaque debe ser evaluado confirmando su desempeo en los
mtodos de esterilizacin a los cuales se van a someter.
El material de empaque se debe almacenar en condiciones adecuadas para mantener
sus propiedades.
Todo material de empaque debe ser utilizado en estricto cumplimiento con las
instrucciones del fabricante.
Se debe considerar el diseo, material y construccin de los contenedores rgidos.
71
Todos los Derechos reservados, 2015
a. Empaques reutilizables.
Los empaques reutilizables son an en la actualidad,
utilizados con gran frecuencia.
Estos materiales, son en general compuestos de algodn
y fibras sintticas como polister.
Proveen una barrera adecuada contra el medio, sin
embargo al ser reutilizados continuamente, pueden sufrir
daos en su superficie y vulnerar la capacidad de
Ilustracin 8: La adecuada iluminacin
mantener la esterilidad del producto. contribuye con la inspeccin de la integridad
Adicionalmente, por su composicin, deben ser del material de empaque.
acondicionados en un ambiente con humedad relativa
controlada; para evitar que al ser esterilizados absorban demasiado vapor y generen
resultados adversos en el proceso de esterilizacin con vapor.
b. Empaques desechables.
Las tecnologas de materiales no tejidos o de
mezclas plstico-papel, proveen excelentes
barreras externas para el material esterilizado.
Cumplen de forma adecuada la proteccin
mecnica (desgarros) y la proteccin frente la
humedad.
72
Todos los Derechos reservados, 2015
Los materiales ms comunes son:
- Papel grado mdico.
- Empaques o mangas Tyvek
- Papel no tejido (e.g. Kimberly KC-600).
c. Cestas perforadas.
Son dispositivos diseados para proveer una
mayor proteccin a los instrumentos. Permiten
ordenar distintos instrumentos con distintas
caractersticas (material, diseo y funcin), de
manera que se logre esterilidad en los
instrumentos y que se presenten de manera
ordenada para su uso.
Las cestas deben ser empacadas posteriormente con material reutilizable o desechable.
d. Contenedores rgidos.
Los contenedores rgidos se utilizan en la actualidad
con una frecuencia creciente. Si bien son utilizados
con frecuencia en kits de cirugas especficas, a
travs de sistemas de arriendo de instrumental;
tambin se encuentran disponibles para compra y ser
usados en los instrumentos convencionalmente
utilizados.
Permiten mantener de manera segura kits completos
de ciruga, de forma ordenada y por supuesto cumpliendo con la mantencin de la
esterilidad de los productos.
73
Todos los Derechos reservados, 2015
e. Ventajas y desventajas.
Existen sin duda ventajas y desventajas en los materiales de empaque.
Por ejemplo, el papel grado mdico no provee una gran resistencia mecnica al desgarro,
por lo que los paquetes pueden sufrir daos durante el transporte o almacenamiento,
afectando la esterilidad de los productos.
Por otro lado, la implementacin de contenedores rgidos; requiere inversiones
sustantivamente altas.
Finalmente, el uso de campos quirrgicos o telas para empaque; supone inicialmente un
costo menor que otras soluciones, sin embargo se deben considerar los costos de
mantencin (lavado y secado) y los riesgos de que los campos en malas condiciones se
sigan utilizando debido a la ausencia de recursos.
La tabla a continuacin muestra un resumen de algunos atributos evaluados.
Ilustracin 9: Algunos atributos del material de empaque.
4. Preparacin de paquetes.
a. Antes de empacar.
Se debe verificar la integridad del material de empaque y evitar el uso de cualquier material
con perforaciones, desgarros o daos visibles de cualquier tipo.
Se debe verificar que el almacenamiento fue adecuado. En el caso de los campos o material
de empaque reutilizable (telas); se debe verificar que estas se encuentren acondicionadas.
74
Todos los Derechos reservados, 2015
El acondicionamiento incluye mantener los campos en un rea con humedad relativa entre
30 y 60% y entre 18 y 23C por al menos dos horas antes de su uso.
En el caso de un inadecuado acondicionamiento, existen dos problemas que se pueden
presentar:
i. Humedad de los campos superior al 60%:
En este caso, el exceso de humedad puede afectar el ciclo de esterilizacin al
contribuir a aumentar la cantidad de vapor disponible al interior de la cmara,
cambiando la condicin del vapor de vapor saturado a vapor mojado y
generando como consecuencia una baja en la temperatura del ciclo o paquetes
hmedos al final del ciclo.
ii. Humedad de los campos inferior al 30%:
En este caso, los campos resecos (humedad relativa inferior a 30%) pueden
absorber parte de la humedad al interior de la cmara del esterilizador;
generando vapor sobrecalentado (temperatura sobre la especificada en el ciclo,
e.g. 132C).
Este vapor sobrecalentado ya no es considerado vapor hmedo, en
consecuencia durante el tiempo de exposicin ya no posee la capacidad de entrar
en contacto con el material a esterilizar, por medio de la hidratacin de las
paredes celulares de agentes infecciosos.
Este vapor seco, se comporta como aire caliente y no como vapor, perdiendo
sus propiedades que permiten la letalidad.
b. Sets quirrgicos.
Los sets quirrgicos constituyen parte importante del material a esterilizar de forma diaria.
75
Todos los Derechos reservados, 2015
Dada su geometra, densidad y distribucin interna;
pueden producir un desafo considerable a la
penetracin del vapor.
Es importante siempre seguir las instrucciones del
fabricante relativas al reproceso, verificacin de
contenido y adecuado cierre del contenedor o caja.
Es importante considerar que todos los instrumentos con
articulaciones, deben empacarse en posicin abierta de
manera de facilitar el contacto con el agente esterilizante.
5. Tcnicas de empaque.
a. Empaque con bolsa plstico papel o peel pouch.
Los empaques plstico papel son usualmente utilizados para instrumental pequeo y
resultan tiles al poder observar el contenido del empaque.
Al disponer un instrumento en un empaque plstico papel, es importante asegurarse de
la remocin del aire, toda vez que este puede afectar la capacidad del vapor para
penetrar el empaque.
En general, cualquier instrumento empacado en este tipo de material, debe ser dispuesto
en un empaque que provea suficiente espacio para el instrumento.
Un instrumento que se encuentra en contacto con los bordes del empaque debe evitarse,
toda vez que el instrumento provoca un estrs innecesario al material de empaque.
Existen fundamentalmente dos tcnicas de empaque con material plstico papel:
Empaque simple: se dispone un instrumento en el interior del empaque el que
luego se somete a esterilizacin.
Empaque doble: se empacan los instrumentos en una bolsa plstico papel, sellar
esta y luego volver a sellar este paquete en una bolsa plstico papel de mayor
76
Todos los Derechos reservados, 2015
tamao. Si bien esto no aumenta la mantencin de la esterilidad a travs del
tiempo, esta tcnica contribuye a mejorar la presentacin asptica.
Independiente de las opciones de material de empaque plstico papel utilizado; este
material se debe sellar con equipos aprobados por el fabricante y que tengan una
temperatura definida y constante. Un exceso de temperatura puede fundir el plstico y
una temperatura muy baja puede no ser suficiente para sellar el empaque. En ambos
casos, se afecta la hermeticidad del empaque y en consecuencia su esterilizada se
puede ver comprometida.
b. Empaque con telas o material descartable.
Existen fundamentalmente dos tcnicas para el cerrado de paquetes de material
reutilizable o de material descartable como papel grado mdico o material no tejido.
i. Tcnica de empaque cuadrado o tipo sobre.
1. Ubique el material de empaque orientado paralelo a la mesa de trabajo.
2. Ubique el dispositivo a empacar en el centro del paquete, paralelo al
material de empaque.
3. Doble el extremo del material de empaque sobre la parte superior del
dispositivo a empacar.
4. Doble la el segundo extremo del material de empaque sobre el dispositivo
a empacar.
5. Tome el extremo lateral derecho y ubquelo sobre el centro del material
a empacar.
6. Tome el extremo lateral izquierdo y ubquelo sobre el centro del material
a empacar.
7. Cierre el paquete con cinta de proceso en el extremo libre del material
de empaque.
77
Todos los Derechos reservados, 2015
Ilustracin 10: Envoltorio tipo sobre.
ii. Tcnica de envoltorio rectangular.
1. Ubique el material de empaque con uno de los vrtices hacia el operario.
2. Ubique el material a empacar en el centro del material de empaque.
3. Tome el vrtice del material de empaque que se encuentra cercano al
cuerpo del operario y dblelo sobre el centro del material a empacar.
4. Tome el extremo lateral derecho y ubquelo sobre el centro del material
a empacar.
5. Tome el extremo lateral izquierdo y ubquelo sobre el centro del material
a empacar.
6. Realice un doblez en el vrtice superior del material de empaque.
7. Cierre el vrtice superior sobre el centro del paquete y fjelo con cinta de
proceso.
78
Todos los Derechos reservados, 2015
Ilustracin 11: Envoltorio rectangular.
En cada una de estas tcnicas, es posible realizar un empaque simple (con un campo o
material descartable) o doble (con dos pliegos de campo o material descartable).
Si bien en la medida que se duplica el envoltorio del paquete, sea esto con campos
(telas) o material descartable; se aumenta la resistencia mecnica del empaque,
proveyendo mayor resistencia a daos durante el transporte o almacenamiento. Este
aumento, no implica necesariamente que se duplica el tiempo de almacenamiento del
paquete.
6. Etiquetado de paquetes o contenedores.
Es fundamental identificar los paquetes de manera
inequvoca antes del proceso de esterilizacin. Esta
informacin es fundamental en orden a seleccionar y
utilizar el paquete adecuado en funcin del
procedimiento a realizar.
La informacin contenida en la etiqueta debe incluir:
Contenido del paquete.
79
Todos los Derechos reservados, 2015
Iniciales de la persona que prepara el paquete o contenedor.
Nmero de lote.
Identificacin del esterilizador a utilizar al igual que el tipo de agente esterilizante.
Identificacin de ciclo de esterilizacin.
Fecha de esterilizacin.
En caso de paquetes especiales, indicar quien es la unidad o profesional que requiere
el paquete.
En el proceso de registro o etiquetado de los paquetes, es recomendable estandarizar los
trminos y nombres de las personas que realizan las labores; al igual que equipos de
esterilizacin y agentes esterilizantes. Esta estandarizacin contribuye a la reduccin de
errores tanto de inscripcin como de interpretacin.
7. Cuidados adicionales en paquetes.
Todo el material debe almacenarse a temperatura y humedad relativa controlada, esto
es entre 18 y 22C y 35 y 70% de humedad relativa. (Referencia numeral 4.a.1 y 4.a.2).
La limitacin de la cantidad de paquetes, su tamao y masa permite ayudar en el proceso
de secado. Cada equipo debe ser evaluado para determinar el nmero de paquetes que
se pueden esterilizar en un ciclo especfico.
Los fabricantes de esterilizadores recomiendan que los paquetes no excedan una masa
de 7.25 Kg. En el caso de contenedores rgidos, estos no deben superar una masa de
11.4 Kg.
Todos el material estril (procesado en la Central de Esterilizacin y Reproceso o
adquirido previamente esterilizado); debe ser inspeccionado antes de almacenar,
despachar y abrir; en bsqueda de daos en el material de empaque o cualquier
condiciones que pueda evidenciar una prdida de la esterilidad.
80
Todos los Derechos reservados, 2015
Dada la dificultad que un nico mtodo de empaque pueda ser exitosamente utilizado
para la gran variedad de instrumentos y material a esterilizar; se debe garantizar que se
cuenta con la informacin necesaria de material de empaque, recomendaciones del
fabricante, idoneidad para un proceso de esterilizacin especifico, entre otros aspectos.
Esto debe estar documentado al interior de la central de esterilizacin y reproceso y todo
su personal debe tener acceso a esta informacin y ser entrenados en su uso adecuado.
8. Compatibilidad con agentes esterilizantes.
Como se ha mencionado previamente, todos los materiales de empaque deben ser
seleccionados en funcin del material a empacar y el tipo de esterilizacin al que sern
sometidos.
Agente Esterilizante
Tipo de material
Vapor xido de Etileno Perxido de hidrgeno
Campos de algodn Compatible No Compatible No Compatible
Papel kraft Compatible No Compatible No Compatible
Papel grado mdico Compatible Compatible No Compatible
Sobres de papel plstico Compatible Compatible No Compatible
Contenedor rgido perforado Compatible Compatible Compatible
Contenedor especial Depende instrucciones del Depende instrucciones del Depende instrucciones del
fabricante fabricante fabricante
Tabla 1: Compatibilidad de material de empaque y agentes esterilizantes.
9. Condiciones de almacenamiento.
El objetivo de un paquete o contenedor rgido es mantener la esterilidad de los productos que
contienen hasta que es intencionalmente abierto. Esto puede parecer una afirmacin en extremo
simple; sin embargo es importante reforzar esta idea, dada la importancia que cobra el
almacenamiento de un producto estril.
81
Todos los Derechos reservados, 2015
Si bien algn tiempo atrs; se consideraba que la esterilidad de un producto era un evento
relacionado con el tiempo, hoy es aceptado por organismos como Joint Comission y la
Asociacin de Enfermeras Peri operativas (AORN) que la esterilidad de un producto es un
evento relacionado con los eventos asociados a su manipulacin y almacenamiento.
Esta aproximacin de esterilidad asociada a eventos; reconoce que la contaminacin de un
paquete o contenedor estril, se ve afectada Los eventos que pueden afectar la esterilidad,
tienen relacin con eventos como transporte y
manipulacin.
Causas comunes de eventos que afectan la esterilidad
de productos tienen relacin con manipulacin y
almacenamiento.
Problemas de manipulacin pueden surgir antes de la
esterilizacin, por ejemplo al cargar un esterilizador que
tiene sus cestas daadas y al ingresar los paquetes, su
empaque puede ser desgarrado.
La manipulacin est directamente relacionada con la labor manual de la Central de
Esterilizacin y Reproceso e incluye el transporte.
Desde que desplaza el material verificado como estril hasta que se
almacena; existen una serie de puntos que pueden alterar la
esterilidad del paquete:
Manipulacin directa del material estril.
Carros de transporte.
Disposicin de los paquetes en las bandejas o repisas de
almacenamiento.
Bandejas de almacenamiento.
y como se almacena.
82
Todos los Derechos reservados, 2015
Visto de otra forma, si usted tiene en su Central de Esterilizacin y Reproceso una caja que
contiene un marcapasos; que fue recibido correctamente, almacenado y mantenido en
condiciones adecuadas, la fecha de expiracin muy probablemente indique que el producto
expirar dentro de los 5 aos posteriores a la fecha de fabricacin.
a. Variables a considerar en el almacenamiento de material estril.
i. Uso del material estril.
El material se debe utilizar bajo un adecuado programa de manejo de inventario.
Una adecuada gestin del inventario considera la lgica de que aquel producto
estril con mayor tiempo desde esterilizado (el ms antiguo) se debe utilizar
primero, tambin conocido como primero en entrar, primero en salir.
ii. Contaminacin por humedad y/o
fluidos.
Aquella propiedad deseada en un
material o sistema de empaque
(contenedores) que es la capacidad
de permitir al agente esterilizante
penetrar el empaque y entrar en
contacto con el instrumento o
dispositivo a esterilizar; juega un rol
fundamental en la contaminacin por humedad y fluidos.
Dado que los empaques deben ser permeables al vapor y al xido de etileno;
estos empaques pueden permitir que agua o humedad excesiva penetre el
material de empaque o fluya a travs de los filtros de contenedores rgidos. Esta
situacin ciertamente afecta la esterilidad del producto.
En el caso de la humedad ambiental; dada que esta es muy difcil de determinar
si esta penetr o no un paquete; hace necesario que sea controlada por medio
de sistemas adecuados de climatizacin.
83
Todos los Derechos reservados, 2015
En el caso de aquel material esterilizado mediante perxido de hidrgeno, si es
menos probable que un exceso de humedad ambiental penetre el paquete, si
puede verse afectado por fluidos; por esto se deben tomar medidas para evitar
que fluidos entren en contacto con paquetes o contenedores con material estril.
Se deben implementar las medidas que eviten que fluidos o humedad excesiva
estn en contacto con el material estril.
iii. Contaminacin por partculas.
Los sistemas de ventilacin en instalaciones hospitalarias cuentan con distintos
medios de controlar el material articulado (Filtros de bolsa y en algunos casos
filtros de alta eficiencia); sin embargo es necesario verificar la ausencia de polvo
u otro tipo de material particulado en las zonas de almacenamiento.
Una adecuada restriccin de acceso al rea, limitada solo para personal
autorizado; el uso de adecuada ropa de trabajo y la ausencia de ventanas
conexiones directas al exterior contribuyen a reducir este tipo de contaminacin.
iv. Daos fsicos del producto estril.
Las situaciones ms complejas que surgen del dao fsico de los paquetes o
contenedores es cuando estos se entregan para ser utilizados y en sala de
ciruga; se descubre que el paquete o contenedor tiene daos que puedan afectar
su esterilidad.
Nuevamente, los danos fsicos en paquetes y contenedores pueden ser
generados por una variedad de factores; que salvo eventos inusuales, siempre
estarn relacionados de manera directa con la manipulacin de las personas.
Es fundamental verificar con frecuencia que las reas de almacenamiento como
gavetas, cajones, muebles, bandejas y otros dispositivos de acumulacin de
84
Todos los Derechos reservados, 2015
material estril; sean verificados frecuentemente buscando daos en la
estructura.
En aquellas situaciones que los paquetes se almacenen en cajas plsticas para
facilitar almacenamiento y distribucin, se debe verificar que estas no contengan
bordes que pudieran desgarrar material de empaque.
v. Otros factores a considerar.
El rea de almacenamiento debe estar adecuadamente iluminado para
facilitar la lectura de las etiquetas de los paquetes.
El acceso debe ser fluido y ser restringido solo a personal autorizado.
Se deben evitar esquinas o rincones en ngulos de 90. Se deben preferir
bordes sanitarios para facilitar limpieza y evitar acumulacin de suciedad.
Las superficies del rea de almacenamiento deben estar construidas de
un material que facilite la limpieza, incluidos pisos y paredes.
La sala debe tener presin positiva respecto de las reas adyacentes.
Los muebles que contienen el material estril, deben estar separados por
al menos 5 centmetros de las paredes que incluyan vidrios o ventanas
que puedan fomentar la condensacin de agua. Adicionalmente, los
muebles deben tener una separacin de al menos 20 centmetros del
suelo para prevenir contaminacin desde el suelo. Adicionalmente, los
paquetes se deben mantener a un mnimo de 20 centmetros desde el
cielo del rea para evitar el contacto con suciedad.
b. Condiciones fsicas y medioambientales.
Conforme a las actualizaciones realizadas al estndar AAMI ST 79:2014; las condiciones
de almacenamiento deben cumplir lmites mximos y mnimos para la temperatura y
humedad relativa mxima para el rea de almacenamiento.
85
Todos los Derechos reservados, 2015
Variable Temperatura Humedad relativa
Humedad Relativa Mxima Mnima Mxima
Temperatura 24C 18C 74%
Tabla 2: condiciones ambientales requeridas.
c. Tiempo de caducidad.
En el caso de aquellos productos esterilizados por
fabricantes en instalaciones industriales (i.e. Marcapasos,
guantes estriles o reemplazos articulares); este tiempo est
determinado rigurosamente en funcin de las regulaciones
vigentes, material de empaque, agente esterilizante y
condiciones de empaque primario y secundario.
En estos casos, el control de la vigencia de la esterilidad es
relativamente fcil. Adicionalmente, en el caso de los productos fabricados en Estados
Unidos y en consecuencia considerados Dispositivos mdicos por la Administracin de
Alimentos y Drogas (FDA); se considera una ventana adicional de uso adicional a la
fecha de esterilizacin. Estas ventanas de esterilizacin deben ser consultadas con el
fabricante del producto o dispositivo.
Para los paquetes esterilizados en una Central de Esterilizacin y Reproceso; la
esterilidad se considera relacionada con eventos.
En consecuencia, la esterilidad de un material, producto o instrumento se mantiene toda
vez que el material de empaque mantenga su integridad fsica y que las condiciones de
almacenamiento, transporte y manipulacin se mantenga.
86
Todos los Derechos reservados, 2015
Procesos de
esterilizacin a alta
temperatura
87
Todos los Derechos reservados, 2015
Captulo 6: Procesos de esterilizacin a alta temperatura.
En instituciones Hospitalarias, entre el 75 y el 90% de los productos procesados son esterilizados a
travs del uso de vapor. El vapor, es el medio de esterilizacin ms ampliamente estudiado,
econmico y compatible con la mayora de los instrumentos y dispositivos mdicos.
En el presente capitulo, se describen las caractersticas, funcionamiento y formas de controlar los
procesos de esterilizacin a alta temperatura.
1. Factores de importancia para la esterilizacin.
La esterilizacin es un proceso altamente sofisticado, que en general involucra variables como
tiempo, temperatura y presin de vapor; y en procesos especficos le agrega condiciones de
vaco o presin negativa, concentracin del agente esterilizante y aireacin
Para lograr el xito del proceso, se deben controlar estas variables y mantener registros del
cumplimiento.
Adicionalmente, los equipos deben ser sometidos a mantenciones y calibraciones con
frecuencias definidas, a modo de mantener el correcto funcionamiento de los equipos.
2. Mtodos de transferencia de calor para la esterilizacin
a. Esterilizacin por calor hmedo.
En los esterilizadores a vapor o autoclaves; el calor es transferido por el ingreso de vapor
saturado a la cmara de esterilizacin.
Esto permite elevar la temperatura y la presin a los niveles deseados durante el tiempo
necesario para las distintas etapas del ciclo de esterilizacin.
b. Esterilizacin por calor seco.
Los esterilizadores por calor seco, funcionan mediante el uso de resistencias que
aumentan la temperatura la cmara de esterilizacin.
Existen dos tecnologas diferentes que lucen de manera similar en el exterior pero
presentan un funcionamiento diferente.
88
Todos los Derechos reservados, 2015
1. Equipos de aire esttico:
El equipo cuenta con resistencias
elctricas que contribuyen a entregar la
energa al interior de la cmara. Este calor
generado, fluye por conveccin (desde las
zonas de mayor temperatura a las de
menor temperatura) logrando una
temperatura uniforme.
Dado que el aire caliente fluye por conveccin, el tiempo de calentamiento suele
ser mayor al compararlo con equipos dinmicos.
2. Equipos dinmicos:
El equipo cuenta con resistencias
elctricas que contribuyen a entregar la
energa al interior de la cmara.
La unidad cuenta con un ventilador
interno que permite hacer circular el aire
dentro de la cmara, logrando
homogeneidad trmica de manera rpida
y eficiente.
Ilustracin 12: Esterilizador de calor seco con
aire forzado.
3. Ciclos de esterilizacin ms comunes.
La esterilidad de un producto es funcin del tiempo y la temperatura a la que fue expuesto. A
mayor temperatura menor tiempo de exposicin es necesario. Existe una serie de ciclos
ampliamente conocidos y utilizados, los que son elegidos fundamentalmente en funcin del tipo
de equipo y de los productos que se van a esterilizar.
89
Todos los Derechos reservados, 2015
a. Esterilizacin a 121C:
Se realiza para todo tipo de materiales y en especial, para aquellos sensibles a
temperaturas superiores. Al alcanzar la temperatura de esterilizacin a 121C; la
exposicin al vapor se debe extender por 30 minutos.
Ciclos con menores tiempos de exposicin pueden ser realizados siempre que el proceso
haya sido validado por el fabricante y monitoreado con indicadores fsicos, biolgicos y
qumicos.
b. Esterilizacin a 132C.
Se realiza para todo tipo de materiales que soporten esta temperatura. Una vez
alcanzados los 132C; la carga es expuesta al vapor durante 4 minutos.
c. Esterilizacin a 135C.
Se realiza para todo tipo de materiales que soporten esta temperatura. Una vez
alcanzados los 135C; la carga es expuesta al vapor durante 3 minutos.
Ilustracin 13: Ciclos de esterilizacin comunes y letalidad.
4. Ciclos de esterilizacin extendidos.
Dados los nuevos materiales, diseos y geometra de diversos dispositivos mdicos; unidos a la
presencia de nuevos microrganismos ms resistentes a ciclos de esterilizacin convencionales,
es que se han desarrollados ciclos extendidos de esterilizacin.
90
Todos los Derechos reservados, 2015
Adicionalmente, los instrumentos que se utilizan en conjunto (e.g. Kit de reemplazo articular);
son usualmente despachados en contenedores rgidos especficamente diseados; lo que
supone un mayor desafo para la remocin de aire, la penetracin del vapor y la posterior
evacuacin de este.
La informacin de dispositivos que requieren ciclos
extendidos de esterilizacin debe ser provista por el
fabricante del dispositivo de manera directa o a travs
de sus distribuidores. En esta informacin, conocida
como Instrucciones de Uso; se describen los pasos
necesarios para el reprocesamiento adecuado, al igual
que las condiciones de esterilizacin y caractersticas
del ciclo.
Estos ciclos extendidos de esterilizacin pueden
requerir exposicin de 5, 8, 10, 18 o 20 minutos a 132-135C.
Los ciclos extendidos suponen un desafo adicional debido a la compatibilidad de los equipos
esterilizadores para realizar estos ciclos extendidos.
Se debe poner especial atencin en el monitoreo de estos ciclos, toda vez que los fabricantes
de esterilizadores validan sus equipos para ciertos sets de temperatura y tiempo de exposicin
y es responsabilidad de la Central de Esterilizacin monitorear la idoneidad del ciclo manteniendo
registro de indicadores fsicos, qumicos y biolgicos.
La validacin de un ciclo extendido se debe realizar toda vez que se incorpora un nuevo set
quirrgico o dispositivo que requiere ciclos extendidos de esterilizacin. Adicionalmente, se debe
validar el ciclo toda vez que se realicen cambios sustantivos en el proceso de esterilizacin,
incluyendo nuevos materiales de empaque (incluidos contenedores), cambios en las
configuraciones de los paquetes, diferencias sustantivas en la masa, etc.
91
Todos los Derechos reservados, 2015
5. Factores relevantes en la esterilizacin por vapor.
Para lograr la esterilidad, el vapor debe entrar el
contacto con el producto o instrumento a esterilizar,
por el periodo especificado en el ciclo de
esterilizacin. Esto puede resultar obvio; sin embargo
muchas veces, el vapor no lograr entrar en contacto
con el material a esterilizar por el tiempo adecuado,
debido a diversos factores.
a. Tipo de microorganismos presentes. No todos los agentes infecciosos se destruyen o
inactivan a la misma temperatura o en iguales condiciones de exposicin.
b. Carga biolgica. Algunos dispositivos pueden despus del proceso de descontaminacin;
contener cantidades considerables de carga biolgica.
c. Geometra de los dispositivos. Aquellos dispositivos con geometras complejas pueden
requerir tiempos adicionales de esterilizacin.
d. Masa de los paquetes. La esterilizacin se logra manteniendo el vapor saturado en
contacto con todos los dispositivos y material de empaque a esterilizar, durante un tiempo
determinado. En el caso de paquetes con masas altas; puede ser necesario aumentar
el tiempo de acondicionamiento para permitir al vapor entrar en contacto con el paquete
de forma efectiva durante la fase de exposicin.
No obstante estos desafos; los ciclos de esterilizacin estndares se encuentran validados de
manera de garantizar un nivel de seguridad, denominada ciclo de sobre muerte.
Debido a que en microbiologa no es posible determinar con certeza absoluta la eliminacin de
agentes patgenos o microrganismos; o alcanzar esterilidad en un nivel 0; se utiliza un indicador
denominado Nivel de Seguridad de Esterilizacin (N.S.E.) conocido por sus siglas del Ingls
como SA.L.
92
Todos los Derechos reservados, 2015
En el mundo de la esterilizacin, se utiliza un SAL de 10e-6; es decir; una probabilidad de 1 en
1.000.000 de que luego de la esterilizacin sobrevida una unidad formadora de colonias. Esto
resulta un nivel seguro para el instrumental que entrar en contacto con tejidos estriles de los
pacientes.
Sin embargo, como medida adicional de seguridad, la esterilizacin hospitalaria utiliza la
aproximacin denominada ciclo de sobre muerte.
Si un ciclo a una temperatura determinada, se estima que inactivar agentes infecciosos al ser
expuestos a un determinado tiempo de exposicin; este tiempo se publica para asegurar que no
obstante las variables que puedan surgir, se alcance la esterilidad en la carga.
Los ciclos de sobre muerte permiten proveer un nivel de seguridad de la esterilizacin de 10e12.
Esta aproximacin se realiza con todos los agentes esterilizantes disponibles.
Ilustracin 14: Esterilizacin con un nivel de seguridad de
10e6.
Ilustracin 15: Esterilizacin con un ciclo de
sobre muerte o S.A.L de 10e12.
93
Todos los Derechos reservados, 2015
6. Tipos de esterilizadores por vapor.
a. Sobremesa.
Los esterilizadores de sobremesa son
relativamente simples, teniendo en su diseo una
estructura similar a una olla a presin vertical.
Su diseo incluye un reservorio de agua que es
calentada mediante una resistencia elctrica. Al
comenzar a generar vapor, este ingresa a la
cmara desplazando el aire que se encuentra en la cmara, desplazndolo por presin
y diferencia de gravedad especfica.
El aire escapa por una vlvula inferior. Cuando el vapor alcanza los 121C; se cierra la
vlvula inferior y se inicia el ciclo de esterilizacin.
Estos equipos, dada su baja capacidad; se utilizan principalmente en clnicas dentales y
centros de atencin ambulatoria.
b. Desplazamiento por gravedad.
El principio de funcionamiento de estos equipos es el mismo de los esterilizadores de
sobremesa.
Estos equipos, permiten la admisin de vapor a la cmara, el que por diferencias de
gravedad especfica, forma capas de vapor, que van progresivamente desplazando el
aire hacia una vlvula inferior.
El vapor, dado que se dirige a gran velocidad en las tuberas; previo su ingreso a la
cmara; pasa por un separador de agua. Este separador provee un camino sinuoso para
el vapor, reteniendo el exceso de agua lquida. Este mtodo permite que el vapor alcance
un mnimo 97% de saturacin. Estos separadores son fabricados de materiales porosos,
plsticos o mallas de metal.
Junto al separador, se utiliza un reductor que ayuda a reducir la velocidad del vapor.
Esta reduccin es fundamental para reducir las turbulencias al interior del esterilizador
que pueden dejar bolsas de aire al interior de la cmara.
94
Todos los Derechos reservados, 2015
Luego de realizada la remocin de aire mediante la diferencia entre el vapor y el aire;
se inicial el ciclo de esterilizacin.
Si bien la mayora de los esterilizadores actualmente comercializados en instituciones de
salud son de Pre vaco; los esterilizadores de gravedad siguen vigentes.
Este tipo de esterilizador es particularmente til en la industria para la esterilizacin de
lquidos.
c. Remocin dinmica de aire.
Los equipos de remocin dinmica o
pre vaco; durante su fase de pre
acondicionamiento reducen la
presin al interior de la cmara. Esta
reduccin de presin permite que el
aire al interior de la cmara y
paquetes sea eliminado antes de
alcanzar la temperatura de
exposicin.
Dado que el equipo realiza varias
fases de pre vaco, son equipos con ciclos ms rpidos que los esterilizadores de
gravedad y proveen mayores niveles de seguridad. Adicionalmente, funcionan a
temperaturas ms altas, usualmente entre 121 y 135C.
d. Uso inmediato (equipos Flash).
Los equipos de esterilizacin de uso inmediato, conocidos como flash; son un grupo de
esterilizadores de uso especfico. Funcionan bajo el principio de los esterilizadores de
gravedad y son utilizados para esterilizar instrumentos que van a ser utilizados de
manera inmediata.
El ciclo aceptado para estos equipos es de 3 minutos de exposicin a 132; realizado
una presin de 27 a 28 libras en instrumentos sin empaque.
95
Todos los Derechos reservados, 2015
7. Fases del ciclo de esterilizacin.
Las fases de un equipo esterilizador a vapor varan en funcin del tipo de funcionamiento
(gravedad, pulso variable, pre vaco), sin embargo tienen fases relativamente similares que se
pueden describir con claridad.
a. Acondicionamiento.
Durante el acondicionamiento, la puerta del esterilizador se encuentra cerrada y el ciclo
se inicia. Los sellos de la puerta forman una barrera hermtica para prevenir la fuga del
vapor.
El vapor comienza a entrar a la cmara, saturando los paquetes al interior de esta.
El objetivo del acondicionamiento, es realizar la remocin de aire, incrementando la
cantidad de vapor en la cmara. Al final del acondicionamiento, la cantidad de aire al
interior de la cmara debe ser del inferior al 3.5% del total de la masa de los gases en
la cmara (96.5% de vapor y 3.5% de aire).
b. Exposicin.
En la medida que el vapor contina ingresando a la cmara; la presin al interior de esta
comienza a aumentar. Como consecuencia del aumento de la presin interna, la
temperatura del vapor comienza a aumentar de igual forma.
Cuando se alcanza la temperatura de ciclo, (e.g. 132C); se inicia la fase de exposicin,
que se extiende por la duracin del ciclo de esterilizacin.
Esta fase busca que cada dispositivo a esterilizar, se mantenga en contacto con el vapor
a la temperatura y presin necesaria; durante el tiempo de exposicin definido.
c. Vaco.
Concluido el tiempo de exposicin, la vlvula de salida es abierta; permitiendo la salida
del vapor. Esto crea un pequeo vaco en la cmara; en la medida que aire filtrado y
estril es ingresado a la cmara. Esto permite que la presin al interior de la cmara
lentamente disminuya.
96
Todos los Derechos reservados, 2015
d. Secado.
La fase de secado utiliza parte del calor remanente al interior de las chaquetas del
esterilizador, al tiempo que aire filtrado y calentado se hace circular al interior de la
cmara.
Esto permite eliminar el vapor que se pudo condensar al interior de la cmara, generando
paquetes hmedos.
8. Condiciones necesarias para la esterilizacin.
a. Contacto con la superficie a esterilizar.
En cualquier mtodo de esterilizacin, es fundamental que el agente esterilizante se
mantenga en contacto con los materiales a esterilizar. Sin contacto, no hay esterilizacin.
En el caso de la esterilizacin mediante vapor saturado; dadas las propiedades y
condiciones del vapor, resulta relativamente sencillo el contacto del vapor con los
materiales a esterilizar. Sin embargo, un cambio en el proceso de esterilizacin sin ser
validado, puede afectar la capacidad del vapor de alcanzar la totalidad de los paquetes.
El cambio de densidad de un material de empaque, el uso de paquetes muy densamente
preparados, el uso de un exceso de instrumentos por bandeja y la ubicacin de los
paquetes la interior de la cmara pueden afectar el contacto del vapor con los productos
a esterilizar.
b. Temperatura.
La temperatura es una variable fundamental para la esterilidad. Su rol es inversamente
proporcional al tiempo, esto es: a mayor temperatura, menor tiempo de esterilizacin
(exposicin).
Si bien es tcnicamente posible realizar ciclos a temperaturas superiores a 135C;
reduciendo el tiempo de exposicin sustantivamente (30 @ 121C versus 3.5 @ 134C);
este aumento de temperatura puede generar efectos adversos en los materiales,
causando reduccin en su vida til e incluso daos irreversibles.
97
Todos los Derechos reservados, 2015
Es fundamental que la temperatura del ciclo se encuentre dentro de lo establecido en
los procedimientos de la institucin, las recomendaciones del fabricante y las
instrucciones de uso de los materiales a esterilizar.
Es comn que las temperaturas entregadas por los equipos se vean alteradas a travs
del tiempo, por lo que es necesario realizar verificaciones peridicas a los termmetros
y de ser necesario calibrarlos o reemplazarlos.
c. Calidad del vapor.
La esterilizacin utilizando vapor, ocurre dado que el vapor tiene una gran cantidad de
energa, la que es transferida a las superficies que busca esterilizar.
Sin embargo, este vapor, tiene un delgado equilibrio para lograr esterilizar con
efectividad.
Por una parte, se deben considerar los aspectos que podemos denominar qumicos y
los aspectos fsicos.
Cuando pensamos en la qumica del vapor saturado, debemos considerar el origen de
este vapor: el agua que se convierte en vapor.
Si el agua no tiene una calidad adecuada, el vapor no ser de buena calidad. Dentro de
los principales desafos, se encuentran el tratamiento del agua que se utilizar para
generar vapor.
La presencia de sales como carbonatos de calcio o magnesio y la contaminacin por
metales; resultan comunes en muchos lugares; por lo que un adecuado tratamiento del
agua es fundamental para la generacin de vapor.
Al pensar en los aspectos fsicos del vapor, el vapor debe encontrarse saturado al menos
en un 97% para lograr ser un adecuado agente esterilizante. Esto significa, que un 3%
del contenido de ese vapor, puede ser agua en su estado lquido.
Este nivel de saturacin contribuye a la hidratacin de las paredes celulares de los
agentes infecciosos, logrando la desnaturalizacin de protenas, ergo; la esterilizacin.
98
Todos los Derechos reservados, 2015
Sin embargo, existen dos posibles escenarios adicionales al vapor ideal saturado en un
97%:
Vapor sper calentado ocurre cuando se agrega energa al vapor que ya no contiene
agua en estado lquido. Esto genera que la temperatura aumente sin aumentar la presin,
generando un vapor seco.
Dado que este vapor no tiene la saturacin suficiente, no puede esterilizar con la misma
eficiencia que el vapor saturado a la misma temperatura.
Cuando se encuentra la situacin inversa, un vapor saturado con un contenido alto de
agua en su forma lquida (i.e. vapor con saturacin menor al 97%); se genera fenmenos
de condensacin de agua en los paquetes; dada la gran cantidad de agua disponible y
los fenmenos de conductividad trmica.
9. Carga y descarga del esterilizador.
Cuando el ciclo ha concluido, si bien la temperatura al interior de la cmara es sustantivamente
menor que durante el proceso de esterilizacin, los paquetes pueden estar an calientes, ya sea
por calor latente o por presencia de vapor. Para evitar quemaduras y prevenir potencial
contaminacin de los paquetes; se debe esperar un tiempo con la puerta abierta para permitir a
los paquetes enfriarse y eliminar el vapor remanente.
Si bien cada equipo puede funcionar ligeramente distinto a otros; la regla general es que se
debe esperar 10 minutos en equipos de pre vaco y entre 25 y 30 minutos para equipos de
gravedad.
Los paquetes no deben ser manipulados haya que se encuentran fros. Esto es importante dado
que al poner paquetes en superficies fras, podra causar condensacin al interior o exterior del
paquete.
En el caso de que los paquetes sean almacenados usando contenedores rgidos de plstico o
incluso bolsas plsticas, el poner los paquetes aun tibios o calientes dentro de estos; va a
generar condensacin, afectando la esterilidad del paquete.
99
Todos los Derechos reservados, 2015
Los paquetes no deben manipularse mientras an estn calientes. Esto puede tomar entre 30
minutos y varias horas; dependiendo de las condiciones ambientales y del tipo de paquete. Los
paquetes pequeos tardaran menos tiempo en enfriarse que los grandes como bandejas o kits.
Finalmente, se recomienda que los paquetes se manipulen lo menor posible.
10. Mantencin preventiva de un esterilizador.
Para el adecuado funcionamiento de un equipo se debe realizar mantencin preventiva, es decir
mantencin que se realiza sin mediar una falla evidente en el equipo. Esta mantencin permite
operar de manera segura los equipos y contribuir a garantizar la seguridad de la calidad del
proceso de esterilizacin.
La mantencin preventiva contribuye a reducir las tasas de falla de los equipos y a disminuir el
impacto de estas.
Se definen en la mantencin preventiva diversas actividades, con distintas frecuencias y
responsables.
Frecuencia Actividad Responsable
Diario Limpieza del interior y exterior del equipo Operador
Diario o Semanal Limpieza del filtro del dreno Operador
Descarga del generador de vapor
Verificacin de la limpieza de los
Mensual electrodos Ingeniero o Tcnico
Lubricacin del sistema de calentamiento
Verificar trampas de agua
Verificacin de sistemas de seguridad Ingeniero o Tcnico
Semestral
Verificar filtros de entrada de agua
Anual Limpieza del generador de vapor Ingeniero o Tcnico
Tabla 3: Mantencin Preventiva.
100
Todos los Derechos reservados, 2015
11. Control de la calidad del proceso.
a. Necesidad.
Todo proceso es susceptible de ser controlado y al obtener informacin del proceso, se
puede mejorar. Dado esto, el uso de controles de calidad del proceso resulta fundamental
en el desempeo exitoso de una Central de Esterilizacin y Reproceso.
b. Tipos de controles
i. Fsicos (mecnicos).
Los indicadores fsicos son dispositivos mecnicos o
electrnicos que permiten proveer informacin de las
variables fsicas del proceso como temperatura, presin y
tiempo.
ii. Qumicos.
Los indicadores qumicos, fueron los
primeros controles del proceso de
esterilizacin utilizado, que comenz a
proveer un mayor entendimiento de las
condiciones de esterilizacin. Permiten controlar
exposicin (Tipo 1), remocin de aire (Tipo 2), y
variable(s)
del proceso de esterilizacin (Tipo 3, 4, 5 y 6),
101
Todos los Derechos reservados, 2015
iii. Biolgicos.
Para determinar la letalidad de un ciclo de esterilizacin, se
puede determinar de va indirecta utilizando registros de
controles fsicos y qumicos. Sin embargo, no obstante la valiosa
informacin que entregan, ninguno de estos dispositivos esporas
especficas.
Los indicadores biolgicos, utilizados desde 1971; son los nicos
controles de la esterilizacin que proveen una medida directa de
la letalidad, mediante la determinacin de la capacidad de
eliminar una cantidad conocida de esporas viables.
iv. Paquetes de desafo de proceso.
El uso de indicadores qumicos Tipo 2 o Test de Bowie Dick; representa un
desafo para el agente esterilizante dada la existencia de un paquete pre armado
o uno de 16 toallas, en consecuencia el vapor; tiene una dificultad especfica
para llegar al centro del paquete y determinar la adecuada remocin de aire. En
el caso de indicadores qumicos internos Tipo 2 3, 4, 5 o 6, estos se utilizan en
el interior del paquete o contenedor; lo que nuevamente supone un desafo
adecuado a la penetracin y tiempo de contacto con el agente esterilizante.
Sin embargo, los indicadores biolgicos no son utilizados dentro de paquetes o
contenedores con instrumentos. En el caso que los indicadores biolgicos sean
utilizados sin paquetes de desafio, o con paquetes inadecuados, la probabilidad
que sea capaz de detectar fallas en el proceso de esterilizacin; es
extremadamente baja. Debido a esto, es necesario su uso en paquetes
especialmente construidos (en la Central de Esterilizacin y Reproceso), o pre
armados en condiciones industriales, aprobadas para su uso.
102
Todos los Derechos reservados, 2015
Posteriormente, se discutir la importancia y detalles especficos de los indicadores de control
de proceso.
103
Todos los Derechos reservados, 2015
Tecnologas de
Esterilizacin a baja
temperatura y
prcticas de monitoreo
104
Todos los Derechos reservados, 2015
Captulo 7: Tecnologas de esterilizacin a baja temperatura y prcticas de monitoreo.
A partir de 1950, se comenzaron a incorporar
materiales nuevos a la vida cotidiana. Estos
materiales tenan propiedades diferentes a los
tradicionales como metales o resinas y
rpidamente fueron incorporados en cada aspecto
de la vida, incluidos los dispositivos mdicos.
En la medida que ms materiales polimricos
fueron incorporados a la industria de la salud;
comenzando esta tendencia en la dcada de 1950; fue necesario el desarrollo de mtodos de
esterilizacin a baja temperatura.
Esto se debe, fundamentalmente a que como se vio en el captulo 3- muchos materiales sufren
deterioro en sus propiedades al ser expuestos a condiciones de temperatura elevada
(particularmente aquellos termo estables), afectando su funcionamiento, reduciendo su vida o til o
en caso ms extremos; inutilizndolos por completo.
Para el reprocesamiento de este tipo de materiales, se requieren entonces otros mtodos de
esterilizacin que provean un conjunto de condiciones fsicas menos agresivas. Estos mtodos de
esterilizacin se conocen en trminos generales como esterilizacin a baja temperatura y funcionan
bajo el principio de una atmosfera controlada y el uso de esterilizantes qumicos. Estos mtodos de
esterilizacin funcionan utilizando la toxicidad de los compuestos qumicos utilizados. Esta toxicidad,
es la que permite eliminar todos los microorganismos viables en el instrumental a esterilizar.
1. Agentes esterilizantes y Toxicidad.
En el mundo de la esterilizacin a alta temperatura, el vapor saturado o el calor seco; son los
medios ms comunes. Como resulta evidente; los riesgos asociados no tienen que ver con
toxicidad (el valor ni el calor es per se nocivo); si no que se encuentran asociado al contacto
con las personas.
Al verse expuesto a un metal a 180C, o a vapor saturado a alta presin a 121C; los daos en
la piel resultan evidentes.
105
Todos los Derechos reservados, 2015
En la esterilizacin por agentes fsicos; los materiales a esterilizar son expuestos a distintos
agentes como rayos X o rayos gamma, logrando esterilidad. El contacto con estos agentes
esterilizantes, supone daos inmediatos a la vida, con riesgos de largo plazo que pueden afectar
la fertilidad o desarrollar cncer en neonatos.
La tercera categora de agentes esterilizantes, se refiere a agentes qumicos. Dentro de ellos se
cuenta el ozono, el dixido de nitrgeno, el vapor de formaldehido, cido peractico, xido de
etileno y perxido de hidrgeno. Todos estos agentes son altamente txicos. En el caso de los
agentes esterilizantes qumicos utilizados a baja temperatura; esta toxicidad es la que permite
alcanzar la letalidad en las cargas.
No obstante estos riesgos, todos los das se llevan a cabo miles de procesos de esterilizacin,
con los agentes esterilizantes descritos previamente, con muy bajas tasas de riesgo o incidentes
que afecten la seguridad y salud de los trabajadores. La clave es utilizar tecnologas confiables,
de manera segura y en consistencia con lo recomendado por el fabricante del equipo.
Lmite NIOSH para riesgo inmediato a
Agente esterilizante Lmite OSHA para 8 horas
la vida
xido de etileno 1 ppm 800 ppm
Perxido de hidrgeno 1 ppm 75 ppm
Vapor de formaldehido 0.75 ppm 20 ppm
Ilustracin 16: Toxicidad de Agentes Esterilizantes (De acuerdo a OSHA y NIOSH).
A continuacin veremos los dos principales agentes esterilizantes a baja temperatura utilizados
en la actualidad en ambientes hospitalarios.
106
Todos los Derechos reservados, 2015
2. Requerimientos bsicos
a. Efectividad:
Cualquiera sea el agente esterilizante a utilizar, este
debe ser efectivo para las condiciones de trabajo
normales de la Central de esterilizacin.
Esta efectividad se evala en funcin del
instrumental mdico existente y en poder lograr la
esterilidad de estos al ser monitoreados con indicadores qumicos y biolgicos.
Dentro de las variables que pueden afectar la efectividad de los esterilizadores a baja
temperatura, se cuentan los dispositivos canulados con lmenes extensos y con dimetro
pequeo.
b. Seguridad:
La seguridad de cualquier proceso de esterilizacin, de
alta o baja temperatura; viene dado por 2 variables:
i. Seguridad del proceso: el proceso se debe realizar
de manera segura para quien va a estar en contacto
con el dispositivo estril. Esto est ligado a la
efectividad del proceso.
ii. Seguridad del personal: dado que estos sistemas de esterilizacin de baja
temperatura utilizan esterilizantes qumicos; se debe garantizar la seguridad del
personal durante la manipulacin del equipo, carga y apertura del esterilizador y uso
del material estril.
107
Todos los Derechos reservados, 2015
c. Monitoreo:
El agente esterilizante debe ser susceptible de ser monitoreado internamente en sus
parmetros fsicos (e.g. temperatura), como en su letalidad a travs de indicadores
qumicos y biolgicos.
La ausencia de indicadores de proceso externo no permite garantizar la calidad del
proceso de esterilizacin.
Ilustracin 17: Ejemplo de indicador biolgico.
d. Aseguramiento de la calidad:
El uso de monitores e indicadores de proceso (fsicos, qumicos y biolgicos), permiten
proveer informacin fundamental para el sistema de gestin de la calidad y garantizar la
mejora continua de los procesos realizados.
e. Penetracin:
El agente esterilizante debe tener
la capacidad de penetrar el
material de empaque, entrar en
contacto con el material a
esterilizar en las concentraciones
en que garantiza la esterilizacin
y finalmente, ser eliminado completamente del paquete y de la cmara del esterilizador.
108
Todos los Derechos reservados, 2015
f. Compatibilidad de materiales:
Se deben evaluar los efectos adversos del
agente esterilizante sobre algunos materiales
a esterilizar, e.g. material polimrico
absorbente, daos en piezas pticas y
lquidos.
3. Tecnologas
a. xido de Etileno.
El xido de etileno es el agente esterilizante a
baja temperatura que se ha utilizado por un mayor
nmero de aos y con mayores estudios respecto
de su efectividad. Se utiliza desde principios de
1930 y desde 1960 en condiciones seguras para
los usuarios. Ilustracin 18: Molcula de Oxirano
Provee la mayor flexibilidad de uso y el menor costo (nombre IUPAC de xido de Etileno).
de operacin.
En 1988, durante una conferencia de la Asociacin Internacional de Fabricantes de
Fabricantes de Dispositivos Mdicos, en su discurso de apertura, el seor G. Briggs
Phillips sealo:
Durante los ltimos 10 aos (1978-1988), la investigacin y regulaciones han hecho
al xido de etileno un elemento cotidiano en el mundo de la esterilizacin. Es claro que
el uso del xido de etileno ser diferente en el futuro, pero sera iluso pensar que el
xido de etileno ser prohibido en el futuro. El xido de etileno es absolutamente
fundamental para alcanzar las metas de prevencin de infecciones. Simplemente
debemos cambiar la forma de utilizarlo
109
Todos los Derechos reservados, 2015
El seor Briggs, haca referencia a la prohibicin del uso de xido de etileno mezclado
con gases que generaban efectos invernadero o daaban la capa de ozono
(clorofluorocarbonos e hidroclorofluorocarbonos). Esto fue aprobado durante el protocolo
de Montreal en 1987. Si bien esto era una prctica comn en algunos equipos, no todos
eran utilizados con mezcla de xido de etileno y otros gases.
27 aos despus, el lunes 4 de
mayo de 2015, el Doctor William
Rutala, durante una presentacin
en la conferencia anual de
IAHCSMM; hizo referencia al
reprocesamiento de
duodenoscopios y a un brote de
entero bacterias resistentes a
carbapenos. Ilustracin 19: Presentacin de W. Rutala en Mayo de
2015.
En su presentacin, doctor Rutala;
hace referencia a la esterilizacin de duodenoscopios como medida de prevencin de
infecciones asociadas a la atencin en instituciones de salud.
El 8 de enero de 2015; la FDA (Administracin de Alimentos y Drogas de Estados
Unidos); entreg la aprobacin a la solicitud de pre aprobacin de mercado 510K para
dispositivo Clase 2 a 3M Company. Este documento le permite a 3M; iniciar la
comercializacin de los nuevos equipos de esterilizacin mediante xido de Etileno,
Steri-Vac GS y GSX.
Esta aprobacin permite la fabricacin y comercializacin de esterilizadores que utilicen
100% de xido de etileno, manteniendo la vigencia de los equipos Steri-Vac.
110
Todos los Derechos reservados, 2015
Como se puede desprender
de los prrafos previos; el
xido de etileno es una
tecnologa vigente y
necesaria en la
esterilizacin hospitalaria.
Su uso adecuado, permite
otorgar seguridad en el uso
de dispositivos mdicos en
pacientes; con altos niveles
de seguridad para los
trabajadores que operan los
equipos.
i. Efectividad.
Los estudios realizados por diversos profesionales e investigadores, ubican a la
esterilizacin por xido de etileno como el principal agente esterilizante de baja
temperatura.
Aproximadamente el 60% de todos los dispositivos mdicos esterilizados en
origen (esterilizacin industrial), incluyendo implantes y dispositivos desechables
se esteriliza utilizando este mtodo.
El xido de etileno provee excelente penetracin en dispositivos canulados,
incluso en longitud prolongada y dimetros pequeos.
Dentro de las variables crticas para alcanzar la esterilizad se encuentra el
tiempo, la temperatura, la humedad relativa y la concentracin del xido de
etileno.
111
Todos los Derechos reservados, 2015
Si bien los tiempos de exposicin varan en funcin de la temperatura (a mayor
temperatura menor tiempo de exposicin); se debe considerar la humedad
relativa para alcanzar la esterilidad.
Los ciclos deben tener una humedad relativa entre 40 y 80%.
En el caso de agentes infecciosos altamente deshidratados, es necesario
hidratar las paredes celulares para lograr la penetracin del xido de etileno.
ii. Monitoreo.
1. Indicadores qumicos de proceso tipo 1 e indicadores internos o de carga
tipo 3.
2. Indicadores biolgicos de crecimiento con resultado en 48 horas e
indicadores biolgicos enzimticos con resultado en 4 horas.
En ambos casos, la espora utilizada es Bacillus subtilis.
3. Los equipos de presin negativa, considerados los ms seguros del
mercado; cuentan con monitoreo de las variables fsicas del ciclo,
incluyendo temperatura, humedad relativa y tiempo; incluidos registros
electrnicos.
iii. Ciclos disponibles.
Los ciclos varan en funcin del tipo de tecnologa.
La tecnologa de presin negativa, ofrece ciclos de 37 y 55C.
iv. Material esterilizable.
Prcticamente todos los materiales que esteriliza una central de esterilizacin
pueden ser esterilizados utilizando xido de etileno.
Se debe sin embargo, seguir siempre las recomendaciones del fabricante.
Puede esterilizar dispositivos de geometras complejas.
112
Todos los Derechos reservados, 2015
v. Toxicidad:
1. Categora: Txico
2. Promedio ponderado diario(8 horas de trabajo): 1 ppm
3. Riesgo inmediato a la vida: 800 ppm.
vi. Tecnologas.
1. Cmaras de presin positiva o ambiental.
Esta es la tecnologa tradicional de uso de xido de etileno. Utiliza
ampollas de vidrio que son incluidas en bolsas plsticas selladas junto a
los productos a esterilizar. Estas bolsas son conectadas a tubos
extractores del xido de etileno para airear la carga al final del ciclo.
Luego de ingresar a la cmara, la ampolla de vidrio se rompe, exponiendo
a la carga al xido de etileno.
Finalmente, se realiza un proceso de aireacin para eliminar el C de
etileno de los paquetes.
Si bien son equipos de bajo costo de operacin e implementacin, existen
tres principales desventajas:
Riesgos de exposicin. Dado que son equipos de carga y
descarga manual, los riesgos ocupacionales son altos,
fundamentalmente por exposicin al gas remanente en la bolsa.
Efectividad del ciclo. Dado que no existe control dinmico de
temperatura o humedad relativa, no es posible determinar la
letalidad.
Tiempo de proceso. La extensin del ciclo puede extenderse por
20 horas.
113
Todos los Derechos reservados, 2015
2. Cmaras de presin negativa.
Los equipos que funcionan con presin negativa (e.g. 3M Steri-Vac),
utilizan un sistema presurizado para realizar vaco en la cmara.
De esta forma, se verifican todos los parmetros crticos de seguridad y
efectividad de ciclo, previa exposicin al xido de etileno.
En este tipo de tecnologas, existen una serie de etapas para lograr un
ciclo efectivo y seguro.
114
Todos los Derechos reservados, 2015
I. Inicio II. Acondicionamiento
1. Inicio del vaco. 3. Aumento de temperatura.
2. Verificacin de parmetros. 4. Control de humedad relativa.
5. Verificacin de parmetros.
Si los parmetros de vaco,
temperatura y humedad relativa
cumplen, se perfora el cilindro.
III. Injeccion de O.E. IV. Exposicin a O.E.
6. Perforacin del cilindro de gas. 7. Exposicin de la carga durante el
tiempo pre seleccionado en funcin de
la temperatura.
V. Remocin de O.E. VI. Aireacin
8. Inicio de proceso de purga con aire 9. Aireacin final de la carga.
filtrado, varias veces para garantizar la 10. Liberacin del vacio para equilibrar
remocin de la totalidad del O.E. la presin interna con la presin
externa.
11. Liberacin del mecanismo de
apertura.
Ilustracin 20: Etapas en la esterilizacin con equipos 3M Steri-Vac.
115
Todos los Derechos reservados, 2015
116
Todos los Derechos reservados, 2015
b. Perxido de hidrgeno.
El perxido de hidrogeno es una tecnologa comn en instituciones de salud dado el
tiempo de ciclo reducido. Este proceso utiliza pequeos contenedores de perxido de
hidrgeno (entre 58 y 95%). Su utilizacin comenz a medidos de 1980, cuando los
primeros equipos comerciales salieron al mercado.
Este tipo de tecnologa, realiza una fase de acondicionamiento, generando un vaco
dentro de la cmara, para eliminar la humedad relativa existente en interior de la cmara.
Adicionalmente, la temperatura comienza a aumentar.
Luego de alcanzadas las condiciones ideales, se realiza la incorporacin del perxido de
hidrgeno a travs de un vaporizador que mantiene el perxido de hidrgeno durante el
tiempo de exposicin determinado.
i. Efectividad.
La tecnologa de esterilizacin utilizando perxido de hidrgeno; resulta efectiva
en una cantidad importante de materiales.
Existen dos limitantes que afectan la efectividad del ciclo:
Geometra y dimensiones de los dispositivos: la esterilizacin de
materiales textiles y de dispositivos canulados extensos y con dimetro
inferior a 5 mm presenta desafos al ciclo.
Presencia de humedad: el exceso de humedad en la cmara, si bien
reducido por el proceso de verificacin y secado de materiales; puede
afectar la capacidad del equipo de mantener el perxido de hidrgeno en
su fase vapor, generando concentracin. Esto se reduce con los sistemas
de acondicionamiento que tienen los equipos actuales, sin embargo sigue
siendo un problema.
ii. Monitoreo.
Existen indicadores qumicos y biolgicos para monitorear las cargas. Los
indicadores biolgicos proveen resultado a travs del crecimiento de las esporas
117
Todos los Derechos reservados, 2015
viables y un cambio de color en el medio de cultivo al cabo de 24 horas (e.g.
Veryfy V24).
La espora utilizada es Geobacillus estearothermophilus.
iii. Ciclos disponibles::
Los ciclos varan entre 28 y 55 minutos, dependiendo el ciclo seleccionado, el
fabricante y la tecnologa utilizada (vapor de perxido de hidrgeno o vapor de
perxido de hidrgeno y plasma).
iv. Material esterilizable: dispositivos metlicos y polimricos.
Puede esterilizar algunos dispositivos de geometras complejas. Se debe sin
embargo, seguir siempre las recomendaciones del fabricante.
v. Toxicidad (OSHA):
1. Categora: Txico
2. Promedio ponderado diario: 1 ppm
3. Lmite de exposicin permisible: 75 ppm
vi. Tecnologas.
1. Vapor de perxido de hidrgeno.
El ciclo incluye fases de pre acondicionamiento, pre calentamiento y vaco
para remocin de humedad, exposicin y liberacin.
2. Vapor y plasma de perxido de hidrgeno.
El ciclo incluye fases de pre acondicionamiento, pre calentamiento y vaco
para remocin de humedad, exposicin y generacin de plasma previa
liberacin de la carga.
Para la fase de generacin de plasma, (e.g. Sterrad); una corriente
elctrica generada al final del ciclo, permite que el perxido de hidrgeno
se convierta en plasma; es decir en sus constituyentes originales
118
Todos los Derechos reservados, 2015
(Hidrgeno y oxgeno). Finalmente, estos se recombinan para ser
eliminados como agua.
c. Otros esterilizantes qumicos de baja temperatura
i. Vapor de formaldehido:
Utilizado principalmente en Asia y Europa, el vapor de formaldehido a baja
temperatura se utiliza para esterilizar dispositivos mdicos variados.
Los sistemas de vapor de formaldehido; utilizan cartuchos o contenedores semi
rgidos que tienen solucin de formaldehido en base acuosa, con una
concentracin entre 2 y 37% en peso. Otros equipos pueden utilizar
paraformaldehdo en fase slida que luego es transformado en formaldehido y
vaporizado.
Los ciclos son concluidos entre 4 y 6 horas, siendo esto inversamente
proporcional a la temperatura.
Para lograr efectividad en el ciclo, se debe mantener la humedad relativa entre
un 75 y 100%; sin condensacin. La humedad es lograda mediante la admisin
de vapor a la cmara. La temperatura de los ciclos usualmente oscila entre 60
y 80C.
Durante el ciclo de esterilizacin, realizan las siguientes fases:
Pre vaco.
Humidificacin.
Exposicin.
Pulsos de vapor.
Pulsos de aire.
119
Todos los Derechos reservados, 2015
1. Efectividad.
La efectividad se encuentra estudiada frente a diversos agentes
infecciosos. El vapor de formaldehido destruye los agentes infecciosos
mediante alquilacin.
2. Monitoreo.
Existen indicadores qumicos y biolgicos con resultados en 24 horas,
utilizando Geobacillus estearothermophilus.
3. Toxicidad (OSHA):
a. Categora: Txico
b. Promedio ponderado diario: 1 ppm
c. Lmite de exposicin permisible: 75 ppm
4. Comparacin de agentes qumicos esterilizantes a baja temperatura.
Revisados diversos antecedentes de los distintos agentes esterilizantes, es posible realizar un
anlisis comparativo de los 3 principales mtodos utilizados en la actualidad.
El resumen se presenta en la Tabla 20.
120
Todos los Derechos reservados, 2015
Agente esterilizante Toxicidad Efectividad Comentarios
60% de la
produccin mundial
Agente qumico txico de dispositivos
mdicos se
Cancergeno Efectivo en todos
esteriliza con xido
xido de Etileno Concentracin mxima los materiales a
de etileno.
promedio de 1 ppm esterilizar.
Un ciclo completo
Riesgo inmediato a la (incluido resultado
vida: 800 ppm. de indicador
biolgico) demora
16 horas.
Efectivo en la
Agente qumico txico mayora de los Ciclos rpidos (25 a
materiales a 60 minutos).
Cancergeno
Perxido de
esterilizar. Un ciclo completo
Concentracin mxima
Hidrgeno Presenta desafos (incluido resultado
promedio de 1 ppm
en la penetracin de indicador
Riesgo inmediato a la de lmenes biolgico) demora
vida: 75 ppm. extensos y 25 horas.
angostos.
Ciclos de duracin
intermedia (4 a 6
horas).
Agente qumico txico
Se requiere validar
Cancergeno Efectivo en la
diariamente
Vapor de Concentracin mxima mayora de los
equipos duales.
formaldehido promedio de 0.75 ppm materiales a
esterilizar. Un ciclo completo
Riesgo inmediato a la
(incluido resultado
vida: 20 ppm.
de indicador
biolgico) demora
28 horas.
Tabla 4: resumen de agentes esterilizantes qumicos.
121
Todos los Derechos reservados, 2015
5. Criterios de eleccin de agentes esterilizantes.
La decisin de adquisicin de un equipo esterilizador
de baja temperatura implica una serie de anlisis, que
involucran una revisin del proceso de esterilizacin, la
capacidad de adquisicin de equipos, el costo de
implementacin, el costo de operacin y el costo de
monitoreo, entre otros factores.
Las variables a considerar se pueden desagregar en 4
categoras:
a. Capacidad.
Se debe determinar la capacidad necesaria
a instalar. Para esto es necesario conocer el nmero de paquetes que requieren ser
esterilizados a baja temperara sobre una base mensual o anual.
Se deben considerar las alternativas de equipos, incluyendo la capacidad de la cmara
y el porcentaje mximo de utilizacin de esa capacidad.
Esto llevar a estimar un volumen de capacidad instalada que se requiere para dar
cumplimiento a los requerimientos.
b. Costo operacional.
Esto permitir determinar el costo de la operacin de las alternativas.
Se debe considerar todo el insumo requerido para la operacin del equipo, incluido el
agente esterilizante (material de empaque, indicador qumicos y biolgicos y otros
Se deben determinar las variables necesarias para realizar un costeo realista. En el caso
de determinar que una variable no ser utilizada, se debe utilizar el principio de ceteris
paribus para todas las opciones.
c. Costo operacional anual.
Se deben incluir los costos de mantencin, verificacin o validacin necesarios para
mantener el equipo en funcionamiento.
122
Todos los Derechos reservados, 2015
Dado que parte de los recursos para la operacin de un equipo y su mantencin
adecuada pueden provenir de otros centros de gasto en la institucin de salud; es posible
decidir eliminar alguno de estos costos para simplifica el clculo.
Este anlisis puede ser utilizado en la adquisicin de cualquier equipo necesario en una Central de
Esterilizacin y Reproceso.
123
Todos los Derechos reservados, 2015
Tipos de monitores de
proceso de
esterilizacin.
124
Todos los Derechos reservados, 2015
Captulo 8: Tipos de monitores de proceso de esterilizacin.
Cualquier proceso que se realice, en distintos ambientes y con distintos propsitos; debiera ser
controlado en algn punto para garantizar que el resultado de dicho proceso sea satisfactorio.
En el mundo de la esterilizacin hospitalaria, esto resulta an ms crtico; toda vez que los productos
esterilizados se utilizan en pacientes.
El monitoreo de los procesos de esterilizacin, permite de manera adicional al control de la esterilidad
y la asociada seguridad del paciente; entregar informacin respecto de los niveles de cumplimiento.
Esta informacin permite establecer programas de mejora que contribuyan a la seguridad del
paciente.
Comprender los distintos controles disponibles, su frecuencia de uso y el anlisis de la informacin
que entregan es una herramienta fundamental que deben tener los profesionales de la Central de
Esterilizacin y Reproceso y Reproceso.
1. Control de la calidad del proceso.
Un principio fundamental del control de la calidad de los procesos es que todo lo que se puede
medir se puede mejorar. Esta mxima es fundamental a la hora de establecer los controles
necesarios dentro de una Central de Esterilizacin y Reproceso.
Este control de la calidad de los procesos, es adicionalmente requerido por organismos
nacionales de distintos pases y recomendado por organismos internacionales como la
Organizacin Panamericana de la Salud, organismos locales y guas internacionales.
En el caso de la Central de Esterilizacin y Reproceso; existen distintos dispositivos que permiten
garantizar la calidad del producto estril y controlar la idoneidad del proceso; proveyendo
informacin para analizar tendencias y desviaciones a los procesos.
Esta informacin permite justificar inversiones, determinar oportunidades de mejora, necesidades
de entrenamiento y anlisis de causalidad de eventos adversos.
2. Tipos de monitores e indicadores.
a. Fsicos (mecnicos).
Son dispositivos que permiten controlar el funcionamiento del equipo conforme a las
especificaciones del fabricante para un ciclo especfico.
De esta forma, los indicadores fsicos permiten verificar mediante indicadores visuales
(relojes o manmetros), y registros impresos; entregar la informacin del ciclo de
esterilizacin realizado.
Esta informacin resulta valiosa al analizar las causas de problemas que se pueden
presentar en un ciclo, incluyendo paquetes hmedos, indicadores qumicos sin cambio
de color o indicadores biolgicos positivos; entre otras causas comunes de falla de ciclos.
Muchos de estos indicadores son en la actualidad digitales.
Estos indicadores son parte integral del equipo esterilizador y deben ser verificados y
calibrados anualmente.
i. Importancia del monitoreo fsico.
Permiten establecer si los parmetros de un ciclo se
cumplieron de forma adecuada y determinar potenciales
fallas en los ciclos, relacionados con el funcionamiento del
esterilizador.
ii. Tipos de indicadores
1. Indicadores presin del vapor dentro de la cmara.
2. Indicadores de temperatura del ciclo.
3. Indicadores de tiempo de ciclo.
iii. Frecuencia de uso y verificacin.
Los indicadores fsicos deben ser verificados anualmente y luego de cada
reparacin mayor realizada al equipo.
126
Todos los Derechos reservados, 2015
Esto permite mantener un adecuado registro e informacin valida. Los
termmetros pueden sufrir des calibraciones a travs del tiempo por desgaste de
las piezas de registro y los manmetros o medidores de presin pueden sufrir
descalibracin dadas los continuos cambios en la presin que registran.
b. Indicadores Qumicos.
Son indicadores o monitores que
sufren cambios fsicos (cambios de
color o forma) al ser expuestos al
proceso de esterilizacin. Se usan
tanto dentro como fuera de paquetes
con material estril y para verificar el
funcionamiento del equipo.
i. Importancia del monitoreo con indicadores qumicos.
Los indicadores qumicos se usan para verificar equipos, paquetes y procesos. Son
los indicadores que ms se utilizan y que entregan la informacin ms rpidamente
disponible para la toma de decisiones.
Ilustracin 21: estndar ISO 11140-1:2014.
127
Todos los Derechos reservados, 2015
ii. Tipos de indicadores.
El estndar ISO 11140-1:2014; establece las distintas clasificaciones de
indicadores qumicos. En esta nueva actualizacin que reemplaza la versin de
2006; se establecen Tipos de Indicadores por sobre clases; para evitar un
lenguaje ambiguo que podra interpretarse desde las antiguas Clases de
indicadores.
1. Indicador Tipo 1: indicadores de proceso para diferenciar paquetes
sometidos a ciclos de esterilizacin de aquellos que estn a la espera de
ser sometidos. e.g. cinta de proceso o sellos de contenedores rgidos.
2. Indicador Tipo 2: indicadores de Bowie-Dick, utilizados para realizar
pruebas de vaci0 en equipos esterilizadores de vapor con sistema de pre
vaco. e.g. Hojas Comply 00130 o paquete de prueba Bowie-Dick
Comply 00135LF.
3. Indicador Tipo 3: indicadores de una variable (e.g. Temperatura o
humedad). e.g. Comply 1251 para xido de etileno.
4. Indicador Tipo 4: indicadores de varias variables (e.g. Temperatura,
humedad y tiempo). e.g. Comply 1250, 117, 119.
5. Indicador Tipo 5: indicadores integradores que reaccionan a todas las
variables crticas del proceso de esterilizacin de manera simultnea
(Temperatura, presin, humedad relativa y tiempo). e.g. Comply 1243.
6. Indicador Tipo 6: indicadores emuladores o especficos para procesos.
e.g. Comply 6600, 6601, 1259.
iii. Importancia de los Tipos de indicadores.
Los distintos Tipos de indicadores, cumplen funciones complementarias en un
adecuado programa de monitoreo de la esterilizacin. Si bien los indicadores
Tipo 4, 5 y 6 pueden ser utilizados indistintamente al interior de paquetes o
contenedores; el indicador qumico Tipo 5 o Integrador; es que en entrega la
128
Todos los Derechos reservados, 2015
mayor cantidad de informacin en todos los ciclos que se desarrollan en una
Central de Esterilizacin y Reproceso.
Para aquellos ciclos extendidos, se recomienda el monitoreo con indicadores
especficos para el ciclo, o indicadores Tipo 6 e indicadores biolgicos.
iv. Prcticas recomendadas para el uso de indicadores qumicos.
1. Control de externo de
paquetes: Todos los paquetes
deben utilizar indicadores
qumicos externos para separar
aquellos paquetes sometidos al
proceso de esterilizacin de
aquellos no sometidos. Se
utilizan indicadores Tipo 1 para este efecto. Usualmente se utilizan Cintas
de proceso para cerrar paquetes de telas, papel grado mdico o material
no tejido.
En el caso de los contenedores rgidos se utilizan sellos plsticos que
cuentan en su construccin con un indicador Tipo 1.
En el caso de los materiales de empaque plstico papel o Tyvek; estos
traen incorporado un indicador de proceso en el borde del empaque.
Las cintas de proceso o Indicadores Qumicos Tipo 1, generan un cambio
visual de color cuando han sido expuestos al proceso de esterilizacin.
129
Todos los Derechos reservados, 2015
Ilustracin 22: Indicador de Proceso Tipo 1 3M Comply 1322 sin exposicin al
vapor.
Ilustracin 23: Indicador de Proceso Tipo 1 3M Comply 1322 con exposicin al
vapor.
Ilustracin 24: Indicador de Proceso Tipo 1 3M Comply 1228 sin exposicin a
Perxido de Hidrgeno.
130
Todos los Derechos reservados, 2015
Ilustracin 25: Indicador de Proceso Tipo 1 3M Comply 1228 con exposicin a
Perxido de Hidrgeno.
Los indicadores de proceso Tipo 1 no entregan informacin de la letalidad
o del xito o fracaso de un proceso de esterilizacin; por lo que no deben
ser utilizados como indicador de letalidad.
Existen en la actualidad, Indicadores Qumicos Tipo 1 para los principales
agentes esterilizantes (i.e. vapor, xido de etileno, perxido de
hidrgeno).
2. Control del equipo:
Uno de los principales
desafos para lograr
esterilidad de cargas en un
equipo esterilizador de
vapor; es la remocin de
aire.
El aire que se acumula en la
cmara, junto con el aire que se encuentra al interior de paquetes y
contenedores; debe ser removido completamente para permitir que el
vapor entre en contacto con los dispositivos e instrumentos a esterilizar.
Esto resulta fundamental por dos motivos:
El aire dentro de una cmara si bien aumenta su temperatura; no
cuenta con la misma cantidad de energa para lograr esterilidad.
131
Todos los Derechos reservados, 2015
El aire tiene 27 veces menos energa latente que el vapor
saturado al 97% a igual temperatura; por lo que no obstante una
alta temperatura no puede esterilizar dispositivos.
Los equipos esterilizadores que cuentan con sistema asistido de
remocin de aire (i.e. pre vaco); deben ser monitoreados diariamente
para determinar que el equipo puede de manera exitosa; remover el aire
del interior de la cmara. Este monitoreo es fundamental dada la
posibilidad de fallas en los sistemas de remocin de aire, incluso en
equipos nuevos.
Cuando realizar una prueba Como realizar una prueba de Donde ubicar el paquete de
de vaco? vaco? desafo?
Para equipos que En la zona fria del
Cada maana antes de la permanecieron apagados esterilizador, i.e. en la
primera carga. durante la noche, realice bandeja sobre el drenaje.
un ciclo de pre
Siempre realizar la calentamiento. Tome las medidas
prueba a la misma hora.
necesarias para evitar
Para esterilizadores que Luego, seleccione un quemaduras.
trabajan las 24 horas del ciclo a 132 o 134, con
da, defina una hora para un tiempo de exposicin Utilice guantes
realziar la prueba. de 3.5 o 4 minutos protectores para
respectivamente. remover el paquete de
pruebas de la cmara.
Detenga el ciclo al
concluir el tiempo de
exposicin.
Este monitoreo, se realiza con indicadores qumicos Tipo 2 o test de
Bowie-Dick en un paquete de desafo especialmente diseado. Este test
132
Todos los Derechos reservados, 2015
o paquete de desafo; permite evaluar la capacidad del equipo para
remover el aire.
Los paquetes de prueba Bowie-Dick se construyen en un paquete pre
armado de 16 campos; o en un paquete disponible comercialmente.
Cuando un paquete
preparado con
indicador qumico
Tipo 2 o Bowie-Dick
se ingresa en la
cmara
esterilizadora; el
equipo debe
eliminar el aire al
interior de cada una
de las capas del Ilustracin 26: construccin de un paquete de prueba
paquete. Bowie-Dick Comply.
Al remover esto, el espacio utilizado por al aire es reemplazado por vapor
que entra en contacto con la hoja con indicador qumico.
Si la hoja cambia complemente su color (de amarillo a marrn-negro), la
evaluacin es exitosa.
Si la hoja cambia de color solo de manera parcial (marrn-negro en los
costados y amarillo en el centro), el equipo no pudo remover todo el aire
y se considera un proceso fallido lo que implica que el equipo debe ser
puesto fuera de servicio hasta que la mantencin necesaria es realizada.
133
Todos los Derechos reservados, 2015
Ilustracin 27: Paquete de prueba Bowie- Ilustracin 28: Paquete de prueba Bowie-Dick
Dick 3M Comply 00135LF sin ser 3M Comply 00135LF procesado
procesado. evidenciando falla en la remocin de aire.
Ilustracin 29: Paquete de prueba Bowie-Dick
3M Comply 00135LF procesado
demostrando una adecuada remocin de aire.
134
Todos los Derechos reservados, 2015
Las pruebas de Bowie-Dick, permiten detectar fallas inmediatas en el
equipo. Sin embargo, existen paquetes de prueba que permiten entregar
informacin predictiva de futuras fallas. En el caso de los paquetes de
prueba Bowie-Dick 3M Comply 00135LF; estos cuentan con una hoja
de alerta temprana que permite predecir fallas futuras.
En su construccin, se incluye una hoja de alerta temprana en la parte
inferior del paquete.
Al igual que los paquetes de prueba convencionales, el vapor debe
penetrar cada una de las capas, reemplazando el aire. Luego entrar en
contacto con la hoja de prueba primaria (cruz de san Andrs modificada).
Posteriormente, el vapor debe continuar desplazndose hacia el inferior
del paquete; donde debe entrar en contacto con la hoja de prueba de
advertencia anticipada.
En aquellos casos que la hoja de prueba de advertencia temprana cambia
completamente a color marrn oscuro negro; existe un vaco de aire
adecuado y no existe evidencia que indique una falla futura prxima.
135
Todos los Derechos reservados, 2015
En aquellos casos que la hoja de prueba de advertencia temprana cambia
parcialmente a color marrn oscuro negro; o simplemente no cambia
de color; existe evidencia que el equipo no est realizando un aire
completo y resulta necesario realizar una mantencin preventiva al
equipo.
Los paquetes de desafo Bowie-Dick con hoja de alerta temprana; son
una herramienta, que proactivamente pueden contribuir a una adecuada
planificacin de las mantenciones de los equipos esterilizadores; evitando
fallas completas del equipo, con las consecuencias que esto genera.
Ilustracin 30: Hoja de Alerta temprana de Paquete de Prueba Bowie-Dick 3M
Comply 00135LF sin ser procesado.
136
Todos los Derechos reservados, 2015
Ilustracin 31: Hoja de Alerta temprana de paquete de prueba Bowie-Dick 3M
Comply 00135LF evidenciando una falla futura en la bomba de vaco. En ambas hojas,
el cambio de color no es total.
Ilustracin 32: Hoja de Alerta temprana de paquete de prueba Bowie-Dick 3M
Comply 00135LF evidenciando un adecuado funcionamiento de la bomba de vaco.
3. Control de interno de paquetes:
Un ciclo de esterilizacin que no es verificado con indicadores biolgicos
no puede ser verificado como exitoso sin la ausencia de indicadores
137
Todos los Derechos reservados, 2015
qumicos en cada uno de los paquetes (sin embargo esto no aplica para
cargas con material implantable que deben ser siempre monitoreadas con
indicadores qumicos internos e indicadores biolgicos en la carga).
Debido a esto, todos los empaques deben tener al menos un indicador
qumico interno (ms pueden ser requeridos de acuerdo al tamao del
paquete o en el caso de cajas o contenedores multinivel).
Se pueden utilizar indicadores Tipo 3, 4, 5 o 6, siendo recomendando los
indicadores Tipo 5 o integradores, dado que son los nicos que
correlacionan su desempeo con indicadores biolgicos.
Ilustracin 33: Curvas de respuesta de indicadores Tipo 5 Integrador (3 temperaturas/tiempo definidos y Tipo 6
Emulador (1 temperatura tiempo/definido).
Los indicadores qumicos Tipo 5; generan cambios visibles en su color
yo forma (indicadores qumicos con frente mvil); que permite determinar
posterior a la apertura de un paquete; que este alcanz las condiciones
requeridas para considerarse estril.
Los indicadores qumicos Tipo 6; deben ser usados en los ciclos para los
cuales son etiquetados por el fabricante.
138
Todos los Derechos reservados, 2015
Ilustracin 34: Ejemplo de indicador qumico para vapor Tipo 4 Comply 1250. Este
indicador cambia de color amarillo a marrn-negro al cumplirse las condiciones
necesarias para alcanzar la esterilizacin.
Ilustracin 35: Ejemplos de indicadores qumicos para vapor Tipo 4 Comply 00117,
00118 y 00119. Estos indicadores cambian de color amarillo a marrn-negro al
cumplirse las condiciones necesarias para alcanzar la esterilizacin.
v. Estrategias de seleccin de un indicador qumico.
En la actualidad, existen variadas opciones para adquirir indicadores qumicos.
Sin embargo, el criterio de eleccin debe pasar por una serie de evaluaciones
tanto tcnicas como econmicas.
Debido a restricciones financieras, es posible que en algunas instituciones, los
criterios econmicos priman sobre los criterios tcnicos.
139
Todos los Derechos reservados, 2015
Cuando se trata de
atributos tcnicos, un
producto puede marcar
la diferencia entre un
paquete
adecuadamente
esterilizado y otro que
no lleg a la esterilidad;
esto trae consigo
Ilustracin 36: Un indicador qumico Tipo 3 puede cambiar al
riesgos para el paciente. ser expuesto a calor mediante una pistola de calor.
La variable ms crtica a la hora de definir un indicador qumico Tipo 3, 4, 5 o 6;
es el valor establecido. El Valor Establecido (Stated Value o SD por sus siglas
en ingls); se define como el valor o valores al cual(es) el indicador est diseado
para alcanzar el punto de cambio final y es definido por el fabricante y se
encuentra medido en minutos.
Este valor es crtico debido a que se debe elegir un indicador qumico que
reaccione a las variables crticas del proceso de esterilizacin, a una temperatura
especfica.
A continuacin se describen 5 puntos a considerar al definir la adquisicin de un
nuevo Tipo de indicadores.
1. Ciclos realizados en la central de esterilizacin: los indicadores debe ser
adecuados a los ciclos de esterilizacin realizados, tanto para la
temperatura, tiempo de exposicin y agente esterilizante. Se deben elegir
los indicadores adecuado a cada proceso.
2. Caractersticas de desempeo del producto: se debe analizar la
informacin de desempeo de los indicadores, incluyendo resultado final
(cambio de color o desplazamiento) al cumplir los parmetros que mide
(uno, dos o mltiples parmetros).
140
Todos los Derechos reservados, 2015
3. Metodologa para obtener la data del indicador: si bien los indicadores
son en general construidos para cumplir con los requerimientos del
estndar ISO 11140: esto debe quedar demostrado en un certificado de
producto.
Certificaciones internacionales o externas son adecuadas para diferenciar
un producto (FDA, BS, ANVISA, Etc.)
4. Condiciones de almacenamiento requeridas: determine la factibilidad de
almacenar de manera adecuada los indicadores que no son utilizados.
Las condiciones de almacenamiento establecidos por el fabricante deben
ser seguidas para mantener el desempeo del indicador.
5. Elementos o agentes externos que pueden afectar los indicadores: debe
conocer cules son los agentes externos que pueden afectar el
desempeo del indicador. Indicadores qumicos pueden verse afectados
por otros agentes esterilizantes, distintos a aquellos para los que fueron
diseados (e.g. cintas de Proceso Tipo 1 para vapor, se ven afectadas
en presencia de perxido de hidrgeno).
6. Los indicadores qumicos deben cumplir con los requisitos establecidos
en la norma ISO 11140.
7. Idealmente, deben contar con una validacin de tercera parte (e.g. FDA)
8. Se deben elegir conforme a las variables del proceso. (e.g. se deben
elegir indicadores adecuados al ciclo a monitorear).
En el caso especfico de ciclos extendidos, se deben seleccionar
indicadores adecuados.
9. Se deben elegir aquellos que permitan la obtencin de informacin del
proceso y poder tomar decisiones de liberacin en funcin de su
desempeo.
10. Los indicadores deben entregar informacin de manera rpida y sencilla
tara personal de la Central de Esterilizacin y Reproceso y Reproceso
como de quirfano.
141
Todos los Derechos reservados, 2015
Ejemplo de Valor establecido:
Si en su Central de Esterilizacin y Reproceso; sus equipos funcionan a 134C con un tiempo de exposicin de 4 minutos; debe
elegir un indicador qumico que est alineado con esto. En este caso, si usted utiliza un indicador Tipo 4, con valor establecido
de 4 minutos; su indicador le permitir determinar si el ciclo fue exitoso o no.
Sin embargo, si lo sindicadores utilizados tienen un valor establecido a 21.1 minutos, a una temperatura de 121C; sus indicadores
qumicos van a mostrar una falla en el proceso de esterilizacin. Esto ocurre debido a una inadecuada eleccin de los indicadores
qumicos en funcin de su proceso.
Una manera ms sencilla de controlar los procesos, es mediante el uso de indicadores qumicos Tipo 5 o Integradores, dado
que son los nicos indicadores que tienen 3 valores establecidos en un rango entre 118 y 138C; cubriendo todos los ciclos de
esterilizacin hospitalaria; cubriendo todos los ciclos comnmente realizados.
Los indicadores Tipo 5 se correlacionan con el comportamiento de los indicadores biolgicos, esto es especficamente con el
Valor D o Valor de reduccin decimal del indicador biolgico.
Cada lote de indicador biolgico cuenta con un certificado que incluye el valor D.
Un indicador qumico no debe ser utilizado si cuenta con un valor establecido menor al valor D.
vi. Ubicacin de los indicadores qumicos.
1. Los indicadores externos (Tipo 1 e.g. cintas de proceso o sellos de
contenedores) deben ser ubicados en el exterior de los paquetes de
manera que sean fcilmente visibles para determinar si los paquetes
fueron o no sometidos al proceso de esterilizacin.
Ilustracin 37: Cinta de proceso y sello de contenedor rgido, ejemplos de indicadores qumicos
Tipo 1. Cinta de proceso a la izquierda, sello para contenedor rgido a la izquierda.
142
Todos los Derechos reservados, 2015
2. Los indicadores internos (Tipo 3, 4, 5 o 6) deben ser ubicados en el
centro geomtrico del paquete.
Ilustracin 38: Indicador Qumico Tipo 5 o Integrador en el centro geomtrico
de una bandeja perforada.
3. En el caso de contenedores rgidos pequeos, estos deben utilizar un
indicador qumico interno. En el caso de contenedores rgidos grandes,
estos deben utilizar dos indicadores qumicos internos ubicados en
esquinas opuestas.
Ilustracin 39: Contenedor rgido con dos indicadores qumicos, en extremos
opuestos.
143
Todos los Derechos reservados, 2015
4. En el caso de contenedores rgidos con cajas multinivel o cestas
perforadas con dos niveles, se debe utilizar al menos un indicador
qumico en cada uno de los niveles.
Ilustracin 40: Indicador qumico ubicado en bandeja inferior (izquierda) y superior
(derecha).
5. Los indicadores de control de equipo (Bowie-Dick) deben ser ubicados
en la zona superior al drenaje del equipo.
Ilustracin 41: Test Bowie-Dick
ubicado en la parte superior del
drenaje.
144
Todos los Derechos reservados, 2015
vii. Frecuencia de uso de los indicadores qumicos.
1. Indicadores qumicos Tipo 1: en cada paquete o contenedor rgido en el
exterior de estos.
2. Indicadores qumicos Tipo 2: una vez al da, antes del primer ciclo; para
cada uno de los esterilizadores con vaco asistido.
3. Indicadores qumicos Tipo 3, 4, 5 y 6: al menos uno en cada paquete.
Tipo Descripcin Ejemplos Frecuencia de uso
En cada paquete o
1 Indicador de proceso Cintas o sellos de contenedores
contenedor rgido
Diariamente antes del
2 Prueba de remocin de aire Paquete de pruebas Bowie-Dick
primer ciclo.
Tipo 3: Indicador de concentracin de xido de
En cada paquete
Indicador mono parmetro etileno
Se debe
Tipo 4:
escoger Indicador de temperatura y vapor En cada paquete
Indicador multi parmetro
entre 3, 4, 5
Tipo 5:
o6 Integrador En cada paquete
Indicador de variables crticas
Tipo 6:
Emulador En cada paquete
Indicador especfico para ciclo
Tabla 5: Resumen de indicadores qumicos.
145
Todos los Derechos reservados, 2015
3. Indicadores Biolgicos.
En la actualidad, el uso de indicadores biolgicos es algo
relativamente cotidiano, toda vez que se conoce la importancia
de la informacin que entregan respecto de determinacin de la
letalidad de un ciclo de la letalidad de un ciclo de esterilizacin.
Su uso es ampliamente aceptado y obligatorio en muchos pases;
particularmente para el monitoreo de cargas con material
implantable.
Si bien los indicadores qumicos proveen informacin de las
condiciones necesarias para alcanzar la esterilidad de los
productos; no proveen informacin directa de la letalidad.
Indicadores qumicos Tipo 5, si bien se correlacionan con el
desempeo de un indicador biolgico (en su curva de reduccin
de poblacin); los indicadores biolgicos son simplemente
irreemplazables.
Ilustracin 42: Resistmetro
para evaluacin de
indicadores qumicos y
a. Evolucin de los indicadores biolgicos. biolgicos.
Los primeros indicadores biolgicos documentados fueron
realizados en 1881 por Koch y Releluk; quienes realizaron investigaciones inoculando
esporas en papel filtro para desafiar la esterilizacin.
Posteriormente, en 1897; Kilmer realiz lo mismo con una mezcla hasta ese entonces
desconocida de microorganismos (hoy se sabe que era probablemente ntrax),
inoculndolo en pequeos campos que utilizaba para determinar letalidad en su
esterilizador a vapor.
En ambos casos, se buscaba entender los procesos de descomposicin de los alimentos.
146
Todos los Derechos reservados, 2015
Previo a estos esfuerzos embrionarios; el principal indicador biolgico en la industria de
los alimentos, era el alimento per se. El cambio de color, sabor, aparicin de hongos y
malos olores en los alimentos era indicacin de un proceso de produccin deficiente.
A partir de 1921, Bigelow y luego en 1923, Bigelow y Esty establecieron el entendimiento
de la relacin entre temperatura y tiempo y la inactivacin de agentes infecciosos. Esto
posteriormente deriv en el entendimiento de lo que hoy conocemos como valor D
(discutido posteriormente).
A partir de 1950; el entendimiento de la nueva disciplina conocida como Micro Biologa
(derivada de la bacteriologa); entreg ms informacin del comportamiento de los
agentes infecciosos. Posteriormente, el desarrollo de los contendores Bier o
Resistmetros; permiti el estudio riguroso de la letalidad durante ciclos de esterilizacin
terminal. La gran cantidad de informacin disponible era procesada con los nuevos
computadores de los aos 1960.
Finalmente; llegamos a las tecnologas iniciadas en los aos 1970. Estas sentaron la
base de los indicadores biolgicos utilizados en la actualidad.
i. Indicadores de crecimiento:
En el ao 1971, 3M lanz los primeros indicadores biolgicos auto contenidos
para aplicaciones hospitalarias. Estos indicadores, fueron desarrollados a partir de
lo que era aceptado en la industria como Microorganismos ampliamente
reconocidos (Irving J. Pflug). Estos microorganismos cambian en funcin del
agente esterilizante y se utilizan esporas; a fin de proveer el mayor desafo al
agente esterilizante.
Los indicadores tradicionales, con resultados entre 10 y 48 horas, generan una
indicacin de presencia o ausencia de actividad en las esporas (xito o falla del
147
Todos los Derechos reservados, 2015
proceso de esterilizacin) a travs del cambio de color de la solucin (medio de
cultivo).
Este cambio de color ocurre por la presencia de metabolitos cidos producidos
durante el crecimiento de esporas especficas para el agente esterilizante a
evaluar. Los metabolitos cidos, son parte de una serie de reacciones que ocurren
durante el crecimiento de las esporas. Este crecimiento, produce un cambio de pH;
que genera un cambio de coloracin en el medio de cultivo.
Los indicadores con resultado a travs de crecimiento, pueden entregar resultados
usualmente luego de ser incubado durante 10 a 48 horas a la temperatura
asociada a la espora. Esta temperatura facilita el crecimiento de las esporas
generando los cambios a travs de las reacciones previamente descritas.
Los proveedores de estos productos entregan usualmente incubadoras que deben
estar validadas para el indicador biolgico (espora) especfica. Estas incubadoras,
son dispositivos de operacin sencilla, que constan de una resistencia elctrica
que genera un aumento de temperatura hasta alcanzar la temperatura necesaria
para la incubacin.
Dado el tipo de tecnologa, no es posible que estos indicadores logren durante la
fase de cultivo; suficientes metabolitos para obtener una cambio de color en el
medio de cultivo, ergo; entregar un resultado confiable del ciclo de esterilizacin
en periodos inferiores a las 10 horas.
ii. Indicadores de desarrollo enzimtico:
Estos indicadores, desarrollados a partir de 1990, utilizan una cmara auto lectora
para permitir hacer crecer las esporas viables (de un ciclo fallido de esterilizacin).
Al crecer las esporas en un medio favorable, generan una reaccin enzimtica que
el auto lector detecta como un aumento de la bioluminiscencia en el indicador
biolgico; permitiendo cualitativamente determinar un proceso de esterilizacin
fallido
148
Todos los Derechos reservados, 2015
Esta tecnologa entrega resultados entre 30 minutos y 3 horas.
1. Indicadores con resultado a travs de reacciones enzimticas (lectura
rpida o sper rpida).
Los indicadores con resultado a travs de reacciones enzimticas,
detectan la actividad de la enzima alfa glucosidasa, una enzima que se
genera naturalmente en las esporas de Geobacillus stearothermophilus y
que se encuentra estrechamente ligada a la funcin celular de la espora.
Estos indicadores de lectura rpida/sper rpida tienen en su medio de
cultivo un colorante incluido en el medio de cultivo que acta como un
indicador cido-base. Adicional a esto, poseen un segundo colorante.
Este colorante se encuentra adherido a un azcar (glucosina). Cuando
las esporas entran en contacto con la glucosina la utilizan como recurso
para alimentarse. Esto causa que el colorante fluorescente se libere de
la glucosina.
El indicador fluorescente solo puede ser detectado cuando ya ha sido
liberado de la glucosina. Es en consecuencia, la actividad biolgica de la
espora que libera el colorante fluorescente para indicar un proceso de
esterilizacin fallido.
La presencia de alfa glucosidasa activa, es medida por un sustrato
enzimtico no fluorescente, denominado 4-metillumbelliferil-alfa-D-
Gucosidasa y es convertida por la enzima activa asociada a la espora
(alfa glucosidasa) para generar un sub producto fluorescente: 4-
metillumbelliferona.
Este proceso se describe en la Ilustracin N3.
Los indicadores con resultados a travs de reacciones enzimticas,
utilizan una tecnologa ptica para realizar la deteccin de fluorescencia.
149
Todos los Derechos reservados, 2015
Esto se realiza a travs de un equipo Autolector; que contiene un sistema
emisor/detector de radiacin electromagntica que permite identificar la
presencia de fluorescencia a travs de una longitud de onda especfica.
Estos dispositivos auto lectores son especficos para cada fabricante de
indicadores biolgicos y deben ser validados por el fabricante.
Al proveer este tipo de indicadores una lectura a travs de deteccin de
fluorescencia, se logra una mayor precisin en la lectura (positiva o
negativa), un tiempo considerablemente reducido. Adicionalmente, este
sistema permite detectar con precisin fenmenos como esterilizacin
marginal o resultados falsos negativos.
150
Todos los Derechos reservados, 2015
Ilustracin 43: Resumen de efecto enzima-sustrato en indicadores biolgicos rpidos y sper
rpidos.
b. Esporas utilizadas en indicadores biolgicos.
Basado en la evidencia disponible, en la resistencia especfica a las condiciones de
esterilizacin y al uso de agentes esterilizantes especficos; en la actualidad, es
internacionalmente aceptado el uso de dos esporas para el monitoreo de procesos de
esterilizacin.
Espora utilizada Agente esterilizante
Vapor
Perxido de hidrgeno
Geobacillus stearothermophilus ATCC - 7953 Ozono
Formaldehido
Bacilus athropaeus ATCC 9372 xido de etileno
(previamente conocido como Bacillus niger) cido peractico
Tabla 6: Esporas utilizadas para distintos agentes esterilizantes.
151
Todos los Derechos reservados, 2015
c. Definiciones en indicadores biolgicos.
i. Valor D:
El valor D se define como el valor de reduccin decimal y se refiere al tiempo
requerido para alcanzar la inactivacin del 90% de la poblacin de
microorganismos en un indicador biolgico, al ser este expuesto a las condiciones
de esterilizacin.
El valor D se expresa a una temperatura especfica que es aquella a la que fue
determinado, siendo su denominacin D XXX siendo XXX la temperatura en grados
Celsius.
t
Valor D =
Log 10 (N0) - Log 10 (Nu)
t = tiempo de exposicin
No = Poblacin inicial de esporas
Donde:
Muestra total
Nu = Ln( )
Total de unidades negativas
Tabla 7: frmula de clculo de valor D.
152
Todos los Derechos reservados, 2015
Ilustracin 44: Explicacin grfica del Valor D.
ii. Valor F:
Producto del logaritmo de la poblacin y el Valor de, donde el valor F es la
expresin de la resistencia del indicador.
153
Todos los Derechos reservados, 2015
Ilustracin 45: Clculo del valor F.
iii. Valor Z:
Cambio en la exposicin a la temperatura en un proceso de esterilizacin por
calor. Corresponde a un cambio de orden 10 en el valor D.
154
Todos los Derechos reservados, 2015
Ilustracin 46: Explicacin grfica del Valor Z.
iv. Tiempo de sobrevida/muerte:
Es la extensin del proceso de esterilizacin bajo condiciones definidas, donde
se genera la transicin de in indicador biolgico que muestra resultados positivos
y uno que muestra resultados negativos (letalidad completa del proceso)
v. Fluorescencia:
Es la emisin de radiacin emitida por sustancias como resultado de una
radiacin incidente. Esto puede ocurrir tambin por absorcin de radiacin en
cierta longitud de onda y una emisin a una diferente longitud de onda.
vi. Poblacin:
La poblacin de esporas viables contenidas en un indicador biolgico debe ser
1.0 X 105.
155
Todos los Derechos reservados, 2015
vii. Inactivacin:
Prdida de la capacidad de un organismo de reproducirse o multiplicarse.
viii. Resistmetro:
Equipo para establecer condiciones de referencia de variables fsicas y/o
qumicas de un proceso de esterilizacin.
ix. ATCC:
Compaa privada sin fines de lucro; fundada para la investigacin, orientado a
la produccin y preservacin de microrganismos estndares de referencia.
x. Uso de Indicadores Biolgicos.
Imagine que se le ha solicitado que evale la efectividad de un desinfectante
para manos.
Usted puede realizar esta evaluacin, aplicando una cantidad conocida del
desinfectante (1 gramo) sobre una superficie con una poblacin conocida de un
microorganismo; digamos Escherichia coli (100 UFC) por un tiempo conocido (1
minuto).
Luego de un minuto, usted enva esa muestra a un laboratorio, donde se cultiva
y se determina que el producto evaluado; permite una reduccin de un 90% de
\las unidades formadoras de colonias
Sera adecuado decir entonces que el desinfectante evaluado, ha demostrado
una reduccin del 90% de las UFC de Escherichia coli; al ser ensayado en una
superficie inanimada (e.g. placa de cultivo).
Por el contrario; podra decirse que el desinfectante evaluado puede reducir en
un 90% las UFC de Escherichia coli en las manos? Probablemente, usted estar
de acuerdo con que no sera adecuado (e incluso potencialmente ilegal), hacer
esta ltima afirmacin.
En el caso de un esterilizador, probablemente usted no estara de acuerdo con
evaluar la prueba de vaco con una hoja de prueba Bowie-Dick que no se
156
Todos los Derechos reservados, 2015
encuentra dentro de un paquete de desafo de 16 campos o pre armada-; toda
vez que no le proveer informacin realista de la capacidad de remover el aire
de la cmara.
Si pensamos en las evaluaciones con indicadores biolgicos; es posible decir
que una carga con indicador biolgico negativo ha cumplido con la letalidad
esperada (indicador negativo); si y solo si: este indicador se ha utilizado en un
paquete de desafo de proceso adecuado.
A continuacin se discutir la importancia del uso de indicadores biolgicos al
interior de paquetes de desafo de proceso, tambin conocidos como paquetes
de reto o test pack.
1. Importancia de los paquetes de desafo de proceso.
Si bien los indicadores biolgicos son fundamentales para el monitoreo
de procesos de esterilizacin, estos deben ser utilizados en paquetes de
desafo de proceso.
Estos paquetes, permiten establecer un nivel de desafo a la penetracin
del vapor, correlacionndose con la dificultad que tiene el vapor, de
penetrar todos los espacios dentro de un paquete con material mdico.
El uso de indicadores biolgicos sin formar parte de un desafo de
proceso; no entrega informacin relacionada con la letalidad alcanzada
en dicho proceso, en consecuencia no debe ser utilizado.
2. Prcticas recomendadas para los paquetes de desafo de proceso.
Existen dos opciones con evidencia cientfica disponible e
internacionalmente aceptadas- de uso de indicadores biolgicos en
paquetes de desafo de proceso que se encuentran ampliamente
estudiadas y en consecuencia, tienen la evidencia cientfica suficiente
para amparar su uso:
157
Todos los Derechos reservados, 2015
a. Paquete de 16 toallas conforme a Estndar AAMI/ANSI St 79-
2013.
Los paquetes de 16 toallas son una opcin fcilmente
implementarle dentro de una Central de Esterilizacin y
Reproceso y Reproceso. Constan de 16 toallas de algodn, que
deben cumplir las siguientes condiciones:
Medidas de 41*66 cm
Se deben acondicionar en un rea con temperatura entre
18 y 23 C y una humedad entre 30 y 60% durante 3
horas.
Cada toalla se dobla en 3 partes.
Se montan las toallas previamente dobladas una sobre
otra.
Se incluye un indicador biolgico entre la
octava y novena toalla. Idealmente se debe incluir
tambin un indicador qumico junto al indicador
biolgico
Se siguen apilando toallas hasta completar 16.
Se envuelve el paquete de 16 toallas con cinta
de proceso o indicador qumico clase 1.
El paquete final deben cumplir con:
o Medidas de 30*30*50.8 cm
o Masa de 4.5 a 5.4 Kg
o Densidad de 0.12 g/cm3
Ilustracin 47: Paquete de desafo armado.
158
Todos los Derechos reservados, 2015
Ilustracin 48: Armado de los paquetes de desafo.
b. Paquete de desafo pre armado conforme a estndares ISO
11138, 11140 y criterios de FDA para dispositivos mdicos
clase 2.
Estos paquetes pueden tener diferentes tamaos pero deben
cumplir con tener un indicador biolgico.
Ilustracin 49: Paquete de desafo Comply con Indicador Qumico Tipo5 -
Integrador.
159
Todos los Derechos reservados, 2015
Ilustracin 50: Paquete de Desafo pre armado Attest 1296 con Indicador Biolgico
de Lectura Rpida.
Ilustracin 51: Paquete de Desafo pre armado Attest 41382V con Indicador
Biolgico de Lectura Rpida e Indicador Qumico Tipo 5-Integrador
Ilustracin 52: Paquete de Desafo pre armado Attest 1496V con Indicador Biolgico
de Lectura Sper Rpida.
160
Todos los Derechos reservados, 2015
Ilustracin 53: Paquete de Desafo pre armado Attest 4182V con Indicador Biolgico de
Lectura Sper Rpida e Indicador Qumico Tipo 5-Integrador
Ilustracin 54: Paquete de desafo pre armado Attest 1298 con Indicador Biolgico de
lectura rpida para ciclos de xido de Etileno.
161
Todos los Derechos reservados, 2015
Ilustracin 55: Paquete de desafo de proceso para ciclos de xido de etileno
conforme AAMI St41 2008.
3. Ubicacin de los indicadores biolgicos en un paquete de desafo de
proceso.
Los paquetes de desafo de proceso deben ser ubicados en el lugar de
mayor dificultad para la penetracin del vapor en el paquete. Se ubica en
consecuencia en la parte inmediatamente superior al drenaje del equipo.
4. Consistencia y reproducibilidad de paquetes de desafo de proceso.
Existen en distintas instituciones de salud, diversos paquetes de desafos
y estrategias de ubicacin de estos dentro de la cmara del esterilizador,
sin embargo, lo paquetes previamente descritos son los nicos que
162
Todos los Derechos reservados, 2015
cuentan con evidencia cientfica en trminos de la consistencia y
reproducibilidad a travs del tiempo.
Cualquiera sea el paquete de desafo que se vaya a utilizar, este debe
cumplir con los criterios de consistencia y reproducibilidad.
En el caso de los paquetes manualmente elaborados, estos deben ser
verificados de manera que dadas las variables naturales en la
elaboracin>n, tanto ambientales como de recursos humanos; se
mantenga un paquete que cumpla el objetivo de estandarizacin.
xi. Frecuencia de uso de los indicadores biolgicos.
La frecuencia de uso de indicadores biolgicos es un tema discutido en distintos
pases.
En Filipinas, se recomienda el monitoreo frecuente con estos indicadores,
mientras que en Estados Unidos, se recomienda el monitoreo una vez por
semana, idealmente con mayor frecuencia. Canad, utiliza un estndar que
exige que la totalidad de las cargas sea monitoreada utilizando indicadores
qumicos y biolgicos.
Lo concreto es que al aumentar la frecuencia del monitoreo con indicadores
biolgicos, aumenta la probabilidad que la totalidad de las cargas, paquetes e
instrumental; tenga el mayor nivel de seguridad para el paciente disponible, es
decir; que se demuestre que para cada material, instrumento o dispositivo
utilizado en un paciente, la esterilidad de estos se encuentre garantizada.
En consecuencia, los niveles de seguridad entregados al paciente, son
directamente proporcionales a la frecuencia del monitoreo con indicadores
biolgicos.
Adicionalmente, se debe considerar cuales son las recomendaciones para
realizar el monitoreo en funcin del agente esterilizante.
163
Todos los Derechos reservados, 2015
Frecuencia de monitoreo
Agente esterilizante Tipo de carga
requerido
Vapor Material implantable Un indicador biolgico por carga.
Al menos una carga por semana e
Vapor Material convencional
idealmente con mayor frecuencia.
xido de etileno Material convencional En cada carga
Diariamente e idealmente en cada
Perxido de hidrgeno Material convencional
carga.
Diariamente e idealmente en cada
Vapor de formaldehido Material convencional
carga.
Ilustracin 56: Resumen de frecuencia de monitoreo con indicadores biolgicos
conforme AAMI ST79:2013.
1. Frecuencia de monitoreo en cargas sin material implantable.
El estndar de oro es el monitoreo de cada una de las cargas. Practicas
comunes incluyen el monitoreo de una carga al da o una carga por
semana.
2. Frecuencia de monitoreo en cargas con material implantable.
En las cargas con material implantable sin embargo, no es sencillo
encontrar dos mensajes: La totalidad de las cargas con material
implantable deben ser liberadas luego de conocer el resultado del
indicador biolgico.
El uso de material implantable solo basado en el resultado de indicadores
de proceso, o de indicadores qumicos internos debe constituir la
excepcin y no la norma. Si se realiza un anlisis en funcin del riesgo
asociado al uso de material no verificado como estril, se puede
establecer un nivel de riesgo asociado a la frecuencia de uso de
indicadores biolgicos.
Existen 3 opciones que sern presentadas para su discusin:
164
Todos los Derechos reservados, 2015
Monitoreo con indicadores biolgicos una vez por semana por
cada esterilizador.
Monitoreo con indicadores biolgicos una vez da.
Monitoreo con indicadores biolgicos una vez por carga.
A continuacin se presenta un ejemplo de la relacin de paquetes verificados
respecto de los no verificados utilizando estas tres diferentes aproximaciones.
Valor
Variable
hipottico
Ciclos por da 5
Paquetes procesados por ciclo 25
Paquetes procesados por da 125
Das por semana 5
Nmero de esterilizadores 2
Paquetes procesados por semana 1250
Paquetes Paquetes % de Paquetes
Frecuencia de monitoreo procesados verificados por verificados por
por semana semana semana
Una vez por semana 1250 25 2%
Una vez por da 1250 250 20%
Una vez por carga 1250 1250 100%
Tabla 8: Verificacin de paquetes utilizando distintas aproximaciones.
Posteriormente, en el Captulo 17; discutiremos cual es el impacto de esto en su Central de
Esterilizacin y Reproceso.
165
Todos los Derechos reservados, 2015
Verificacin de los
procesos en una
Central de
Esterilizacin y
Reproceso
166
Todos los Derechos reservados, 2015
Captulo 9: Validacin y verificacin de los procesos en una Central de Esterilizacin y
Reproceso.
La totalidad de los equipos que usted utiliza en su institucin, fueron provistos en condiciones
adecuadas para el uso esperado. Esto incluye etapas de control de calidad durante la fabricacin,
verificacin posterior, cuidados en el transporte y la determinacin que al concluir la instalacin; el
equipo se encuentra funcionando como se espera.
Es importante, mantener los equipos en estas condiciones ptimas, de lo contrario se corre el riesgo
de realizar procesos deficientes. La validacin de equipos por parte del fabricante y la verificacin
cotidiana se debe realizar de manera de garantizar la idoneidad del funcionamiento de estos y el
ptimo resultado del producto final.
1. Conceptos asociados.
a. Validacin.
La validacin se refiere al proceso realizado por el fabricante del equipo. Incluye pruebas
rigurosas en cumplimiento con estndares internacionalmente aceptados y se define
como un procedimiento documentado con evidencias con respecto al equipo en
operacin.
Algunos de los requisitos se encuentran en las normas ISO 11135 para Esterilizadores
por xido de Etileno, ISO 15883 para Termo Desinfectaras e ISO 17665 para
Esterilizadores por vapor.
En cada estndar se definen los requisitos especficos que deben cumplir los equipos
para ser liberados y enviados para su comercializacin.
Cualquier nuevo equipo que vaya a ser considerado para adquisicin, debe cumplir al
menos los estndares internacionales que rigen el equipo en especfico. Todos los
proveedores, locales o internacionales, deben ser evaluados con rigurosidad de manera
de garantizar que el equipo cumplir con el objetivo especfico.
167
Todos los Derechos reservados, 2015
i. Importancia.
Dada la naturaleza de su funcionamiento, partes y piezas, diferencias en el
suministro de insumos requeridos para su funcionamiento (energa, agua, vapor,
etc.), los equipos como esterilizadores, pistolas de vapor, termo desinfectaras o
reprocesadores de endoscopios, si bien son fabricados de manera masiva; deben
ser validados individualmente.
Adicionalmente, el fabricante, representante o distribuidor, debe realizar la
validacin final del equipo una vez que se ha instalado.
ii. Responsables.
El proveedor es el responsable de proveer toda la informacin relacionada con
la validacin del equipo, as como de las pruebas que demuestren un adecuado
funcionamiento. Esta informacin debe ser provista en el idioma que sea
adecuado al uso del equipo.
iii. Proceso.
La validacin vara en funcin del tipo
de equipo, sin embargo se deben
validar todos los parmetros crticos
para que el equipo funcione de manera
exitosa.
Ilustracin 57: Diversas termocuplas son
necesarias para validar la distribucin de
temperatura al interior de un equipo de vapor.
1. Esterilizadores a vapor: deben ser evaluadas las condiciones requeridas
para la esterilidad de los productos, incluyendo distribucin del calor,
control de temperatura, tiempo y presin.
168
Todos los Derechos reservados, 2015
2. Esterilizadores por agentes qumicos: deben ser evaluadas las
condiciones requeridas para la esterilidad de los productos, incluyendo
distribucin del calor, humedad relativa, control de temperatura,
concentracin del agente esterilizante, aireacin y tiempo.
3. Termo desinfectoras: se debe evaluar la capacidad de remover suciedad
en placas de control. Adicionalmente, se debe monitorear la presin del
agua, sistemas de inyeccin de detergente y temperatura de ciclo.
b. Verificacin y/o calificacin de equipos.
Este proceso busca determinar que el equipo sigue operando de manera idnea.
Esto es diferente del monitoreo.
i. Importancia.
La verificacin o calificacin es un proceso que se debe realizar de manera
peridica. Esto busca determinar la idoneidad de funcionamiento del equipo, toda
vez que a travs del tiempo, los equipos experimentan cambios.
ii. Responsables.
Los profesionales de la Central de Esterilizacin y Reproceso; son usualmente
los responsables de la verificacin/calificacin de equipos.
En caso de ser necesario, los profesionales de Ingeniera Hospitalaria, pueden
ser requeridos.
iii. Proceso.
La verificacin/calificacin depende del equipo especfico.
El proceso ms comnmente realizado es la validacin de distintos equipos
esterilizadores.
169
Todos los Derechos reservados, 2015
2. Frecuencia de verificacin.
La verificacin de equipos se debe realizar cada vez que
se ha detectado que existe un mal funcionamiento del
equipo, una reparacin o es necesaria la reubicacin del
equipo dentro de la unidad o en otro edificio.
a. Tipos de verificacin.
i. Verificacin de nuevas cargas.
Las cargas nuevas (e.g. kits de ciruga Ilustracin 58: Verificacin con paquete
externos, contenedores rgidos), deben ser de desafo de 16 toallas/campos.
validadas con el uso de indicadores
qumicos y biolgicos (descrito su uso en el Captulo 8).
ii. Verificacin de equipos esterilizadores por vapor.
Se deben seguir las instrucciones del fabricante.
iii. Verificacin de equipos esterilizador por xido de etileno.
Se deben seguir las instrucciones del fabricante.
b. Verificacin por tipo de equipo.
La verificacin/calificacin de esterilizadores por vapor, se deben realizar utilizando
paquetes de desafo de proceso, con indicadores biolgicos. Estos paquetes pueden ser
de 16 toallas/campos o paquetes pre armado.
En el caso de los esterilizadores con remocin de aire por sistemas de pre vaco; antes
de realizar las pruebas de verificacin con indicadores biolgicos se debe verificar que
el equipo es capaz de realizar una adecuada remocin de aire.
170
Todos los Derechos reservados, 2015
Ilustracin 59: La informacin provista por el equipo es fundamental en el proceso de verificacin.
i. Determinacin de nmero de paquetes de desafo de proceso.
Para los tres esterilizadores de vapor comnmente utilizados, se deben realizar
3 ciclos consecutivos con paquetes de desafo de proceso, en la zona indicada
por el fabricante como la zona de mayor dificultad para que el vapor penetre las
cargas.
ii. Verificacin de equipos de ms de 2 pies cbicos.
1. Etiquetar el paquete de desafo a utilizar con la informacin del equipo a
evaluar.
2. Ubicar el paquete de desafo de manera horizontal, sea este de 16 toallas
o paquete pre armado. Se debe ubicar, en la zona indicada por el
fabricante como la zona de mayor dificultad para que el vapor penetre
las cargas.
171
Todos los Derechos reservados, 2015
3. Se debe realizar el ciclo conforme las instrucciones del fabricante del
equipo y las indicadores del indicador biolgico.
4. Finalizado el ciclo, se debe retirar el indicador biolgico del paquete de
desafo y someterse a incubacin o auto lectura. Cada lote diferente de
indicador biolgico debe ser testeado con un indicador biolgico de
control. Se deben registrar los resultados.
5. Se debe repetir este proceso 3 veces utilizando paquetes de desafo de
proceso e indicadores biolgicos en las mismas condiciones de ciclo. En
el caso del uso de paquetes de desafo de proceso se deben utilizar
toallas nuevas (distintas a las utilizadas en el paquete de desafo
previamente usado).
Una vez concluidos los 3 ciclos y demostrada la letalidad del ciclo, las condiciones
de ciclo con indicadores biolgicos y la informacin del resultado impreso (si existe)
demuestre que el ciclo ha cumplido los parmetros necesarios, el equipo es
validado como pato para su uso con cargas que sern utilizadas en pacientes.
iii. Verificacin de equipos de esterilizacin de sobre mesa.
1. El paquete de desafo a utilizar en
esterilizadores de sobre mesa;
debe ser una bandeja
representativa de los materiales
que se esterilizan de forma
cotidiana.
2. Etiquetar el paquete de desafo a Ilustracin 60: Esterilizador de sobre
utilizar con la informacin del mesa.
equipo a evaluar.
172
Todos los Derechos reservados, 2015
3. La verificacin de equipos de sobre mesa se debe realizar con carga
completa, utilizando el paquete de desafo en uno de los extremos de la
cmara del esterilizador, o en una zona que sea la indicada por el
fabricante.
4. Se debe realizar el ciclo conforme las instrucciones del fabricante del
equipo y las indicadores del indicador biolgico.
5. Finalizado el ciclo, se debe retirar el indicador biolgico del paquete de
desafo y someterse a incubacin o auto lectura. Cada lote diferente de
indicador biolgico debe ser testeado con un indicador biolgico de
control. Se deben registrar los resultados. El material utilizado en la carga
NO debe ser utilizado en pacientes hasta que el equipo se encuentra
validado.
6. Se debe repetir este proceso 3 veces utilizando paquetes de desafo de
proceso e indicadores biolgicos en las mismas condiciones de ciclo.
Una vez concluidos los 3 ciclos y demostrada la letalidad del ciclo, las condiciones
de ciclo con indicadores biolgicos y la informacin del resultado impreso (si existe)
demuestre que el ciclo ha cumplido los parmetros necesarios, el equipo es
validado como pato para su uso con cargas que sern utilizadas en pacientes.
iv. Verificacin de equipos de esterilizacin de uso inmediato (Flash).
La verificacin de esterilizadores para uso inmediato, se debe realizar para la
totalidad de las cargas a esterilizar en este tipo de equipo.
Estas cargas incluirn una configuracin especfica que debe ser validada previo
el uso del material en pacientes.
1. Se debe utilizar uno o ms indicadores biolgicos junto a uno o ms
indicadores qumicos en una bandeja a validar. La cantidad de
173
Todos los Derechos reservados, 2015
indicadores biolgicos y qumicos se debe realizar en funcin de los
criterios discutidos en el Captulo 8.
2. Se debe determinar el nmero de especifico de indicadores para todo el
material y configuracin a esterilizar, por ejemplo:
Bandeja perforada.
Bandeja rgida empacada con campos o toallas.
Bandeja rgida empacada con material descartable.
Contenedor rgido.
Carga para organizar instrumentos.
Ilustracin 61: La totalidad de las
configuraciones que se van a
esterilizar en equipos de uso
inmediato deben ser validadas.
Se deben evaluar todas las configuraciones posibles de material de
empaque, contenedor, densidad de carga y tipo de material de manera
individual siguiendo este procedimiento.
3. Etiquetar el paquete de desafo a utilizar con la informacin del equipo a
evaluar.
174
Todos los Derechos reservados, 2015
4. La verificacin de equipos de sobre mesa se debe realizar con carga
completa, utilizando el paquete de desafo en uno de los extremos de la
cmara del esterilizador, o en una zona que sea la indicada por el
fabricante.
5. Se debe realizar el ciclo conforme las instrucciones del fabricante del
equipo y las indicadores del indicador biolgico.
6. Finalizado el ciclo, se debe retirar el indicador biolgico del paquete de
desafo y someterse a incubacin o auto lectura. Cada lote diferente de
indicador biolgico debe ser testeado con un indicador biolgico de
control. Se deben registrar los resultados. El material utilizado en la carga
NO debe ser utilizado en pacientes hasta que el equipo se encuentra
validado.
7. Se debe repetir este proceso 3 veces utilizando paquetes de desafo de
proceso e indicadores biolgicos en las mismas condiciones de ciclo.
Una vez concluidos los 3 ciclos y demostrada la letalidad del ciclo, las condiciones
de ciclo con indicadores biolgicos y la informacin del resultado impreso (si existe)
demuestre que el ciclo ha cumplido los parmetros necesarios, el equipo es
validado como pato para su uso con cargas que sern utilizadas en pacientes.
La verificacin es un proceso fundamental para garantizar la esterilidad de las cargas y es realizado
por los profesionales y tcnicos de la Central de Esterilizacin. Permite establecer que la idoneidad
del funcionamiento de los equipos se mantiene a travs del tiempo y luego de errores de desempeo,
fallas de carga, reparaciones menores o mayores y cambios de ubicacin.
175
Todos los Derechos reservados, 2015
Almacenamiento y
entrega de material
estril y reprocesado
con D.A.N.
176
Todos los Derechos reservados, 2015
Captulo 10: Almacenamiento y distribucin de material estril y procesado con Desinfeccin
de alto nivel.
Un adecuado almacenamiento permite extender la vida til del producto estril, manteniendo su
condicin en el estado deseado. Si bien esto presenta un desafo en muchas instituciones de salud
con infraestructura limitada; es fundamental proteger el material que ya ha sido reprocesado, tanto
para proteger a los pacientes en quienes se utilizara el material; como para evitar costos de
reprocesamiento.
1. Condiciones de almacenamiento.
El objetivo de un paquete o contenedor rgido es mantener la esterilidad de los productos
que contienen hasta que es intencionalmente abierto. Esto puede parecer una afirmacin
en extremo simple; sin embargo es importante reforzar esta idea, dada la importancia que
cobra el almacenamiento de un producto estril.
Si bien algn tiempo atrs; se consideraba que la esterilidad de un producto era un evento
relacionado con el tiempo, hoy es aceptado por organismos como Joint Comission y la
Asociacin de Enfermeras Peri operativas (AORN) que la esterilidad de un producto es un
evento relacionado con los eventos asociados a su manipulacin y almacenamiento.
Esta aproximacin de esterilidad asociada a eventos; reconoce que la contaminacin de un
paquete o contenedor estril, se ve afectada Los eventos que pueden afectar la esterilidad,
tienen relacin con eventos como transporte y
manipulacin.
Causas comunes de eventos que afectan la
esterilidad de productos tienen relacin con
manipulacin y almacenamiento.
Problemas de manipulacin pueden surgir antes de
la esterilizacin, por ejemplo al cargar un
esterilizador que tiene sus cestas daadas y al ingresar los paquetes, su empaque puede
ser desgarrado.
177
Todos los Derechos reservados, 2015
La manipulacin est directamente relacionada con la labor manual de la Central de
Esterilizacin y Reproceso e incluye el transporte.
a. Condiciones ambientales.
En general, el rea de almacenamiento, debe utilizarse exclusivamente para el
almacenamiento de este tipo de material.
Se debe evitar utilizar el rea de almacenamiento para mantener cualquier otro tipo
de material o insumo de uso cotidiano.
i. Temperatura.
La temperatura de almacenamiento debe encontrarse cercana a los 25C. Un
exceso de temperatura, puede afectar la integridad del material del empaque,
al igual que puede generar cambios en los indicadores qumicos externos.
ii. Humedad relativa:
La humedad relativa debe ser menor a 70%, esto permite evitar condensacin
de la humedad, particularmente en paquetes que contengan material
metlico.
En el caso de los indicadores qumicos externos, una excesiva humedad
puede generar cambio de color; derivando en una falsa seal de perdida de
esterilidad o de material no procesado.
iii. Presencia de agentes esterilizantes:
El material estril debe almacenarse lejos de agentes esterilizantes, toda vez
que estos pueden generar cambios en los indicadores qumicos externos,
derivando en una falsa seal de perdida de esterilidad o de material no
procesado.
178
Todos los Derechos reservados, 2015
iv. Renovaciones de aire:
La renovacin debe ser de al menos 4 cambios por hora. Esto se determina
entre el cociente del caudal de aire ingresado a la zona de almacenamiento
y el volumen total de la sala.
Renovaciones de aire = Caudal de aire (m3/h) / Volumen de la sala (m3)
Renovaciones de aire = (100 m3) / (25 (m3))
Renovaciones de aire = 4 Cambios de aire por hora
Ilustracin 62: ejemplo de clculo de renovaciones de aire por hora.
b. Condiciones fsicas.
i. Accesos:
El acceso a la sala de almacenamiento debe ser restringido exclusivamente
a personas con acceso controlado.
Este personal debe utilizar indumentaria adecuada para prevenir
contaminacin al interior de la sala de almacenamiento.
ii. Ubicacin del material a almacenar:
La estantera debe ser construida de material tipo rejilla, a modo de evitar
acumulacin de polvo, partculas o condensacin de humedad.
El material debe ser almacenado en repisas que se encuentren separadas
del cielo en al menos 45 cm; al menos 20 cm sobre el suelo y al menos a 5
cm de las paredes.
Idealmente, deben ser almacenados en gavetas cerradas.
En el caso de repisas abiertas (tipo malla o reja); el nivel inferior debe
ubicarse una barrera fsica entre el material almacenado y el nivel inferior.
179
Todos los Derechos reservados, 2015
Ilustracin 63: ejemplos de almacenamiento de material estril.
iii. Caducidad de paquetes en funcin del tipo de empaque y
almacenamiento.
En el Captulo 5, se discuti que en la actualidad; se considera que la
caducidad de un material de empaque se encuentra relacionado con eventos
y no necesariamente con el material de empaque o el tipo de
almacenamiento. Sin embargo, la Organizacin Panamericano de la Salud,
en su Manual de Esterilizacin para Centros de Salud de 2008; establece
180
Todos los Derechos reservados, 2015
una sugerencia de un criterio para determinar el tiempo de almacenamiento
basado en diferentes elementos.
1. Tipo de envoltorio, siendo este primario y/o secundario (entre 20 y
250 puntos).
2. Embalaje de proteccin (entre 60 y 400 puntos).
3. Medio de almacenamiento (entre 0 y 100 puntos).
4. Lugar de almacenamiento (entre 00 y 300 puntos).
181
Todos los Derechos reservados, 2015
Criterio 1: Envoltorio
Tipo de envoltorio Papel crep Material no Bolsa de Bolsa plstico Contenedor
tejido papel papel Rgido
Envoltorio simple 20 40 40 80 100
Envoltorio doble 60 80 80 100 250
Criterio 2: Embalaje de proteccin
Bolsa sellada 400
Contenedor plstico 60 Ejemplo de Producto A
Criterio 1 80
Criterio 3: Medio de almacenamiento Criterio 2 60
Cajones / contenedores 0 Criterio 3 100
Armarios abiertos 0 Criterio 4 300
Armarios cerrados 100 Total 540
Duracin 1 ao
Criterio 4: Lugar de almacenamiento
Habitacin del paciente 0
Oficina de enfermeria 50
Deposito de material 75
Almacenamiento estril 250
Depsito en Quirfano 300
Puntaje Duracin
01-25 1 da
26-50 1 semana
51-100 1 mes
101-200 2 meses
201-300 3 meses
301-400 6meses
401-600 1 ao
601-750 2 aos
751 y superior 5 aos
Ilustracin 64: Ejemplo de clculo de vida til de acuerdo a OPS.
Finalmente, no debe de olvidarse que el almacenamiento est directamente relacionado con los
eventos y en consecuencia con el tiempo. A mayor tiempo de almacenamiento mayor probabilidad
de que ocurra un evento que altere la condicin del material almacenado.
182
Todos los Derechos reservados, 2015
2. Administracin del inventario.
La Central de Esterilizacin y Reproceso; debe mantener una rotacin de material con alta
calidad (estril o desinfectado); en un tiempo limitado y con recursos muchas veces ms
limitados.
En la medida que se puede balancear la produccin de material estril, su almacenamiento
y entrega a los clientes internos; se logran eficiencias que permiten un adecuado
funcionamiento y un elevado nivel de servicio.
a. Qu es el inventario?
Para efectos de una Central de Esterilizacin y Reproceso, el inventario ser definido
como la cantidad de material disponible para su uso; en un periodo determinado.
Esta cantidad ser funcin del tipo de demanda de material (procedimientos) y el
nmero de esta demanda.
Dado el nivel de complejidad del inventario existente en una Central de Esterilizacin
y Reproceso; el inventario suele ser bajo; es decir el material tiene una alta rotacin
y uso.
b. Preocupaciones del manejo de inventario.
Como cualquier fbrica, existen dos principales preocupaciones: la demanda del
producto y la materia prima para fabricar.
Estas dos preocupaciones generales que la planificacin del reprocesamiento sea
fundamental. Esta debe encontrarse alineada con la programacin de cirugas y
procedimientos. Esto se hace ms evidente en cirugas de alta complejidad o en
aquellas que involucran material externo.
c. Medidas de control de inventario.
Usted puede tener o no; visibilidad de los costos asociados a su unidad. Estos
implican los gastos de utilidades (agua, energa), los recursos humanos, los insumos
y otras unidades de costo.
183
Todos los Derechos reservados, 2015
Dado que los recursos son limitados, puede resultar interesante para usted;
establecer sus propias medidas de productividad. Una medida interesante es la
Capacidad de produccin que posee su Unidad. Esta medida, le provee visibilidad
de la relacin de eficiencia para procesar un lote determinado de productos.
Capacidad de produccin = (Tiempo requerido para procesamiento / Tiempo total) *100
Capacidad de produccin = (18 / 90) * 100
Capacidad de produccin = 20%
Si un proceso de descontaminacin en total toma 18 minutos, pero la totalidad del tiempo de
reprocesamiento es de 90 minutos; la capacidad de produccin es de 20%.
Ilustracin 65: Ejemplo de capacidad de produccin.
Resulta conveniente conocer su capacidad de produccin por dos motivos: si conoce
su desempeo puede mejorar sus resultados; si conoce su desempeo puede
pronosticar cunto tardar un reprocesamiento especfico.
Esto resulta til para dispositivos complejos o kits para cirugas especficas.
Respecto de administracin de inventarios; en una Central de Esterilizacin y
Reproceso; pueden existir varios cientos o hasta miles de insumos diferentes, lo que
hace el control de inventario an ms complejo.
Una estrategia que permite subsanar esto, es la priorizacin de los insumos en
funcin de su criticidad. Si se requiere controlar inventarios, se puede comenzar
estableciendo los materiales con mayor rotacin/demanda y analizar las tendencias
de estos materiales; para poder planificar mejor. Para esto es necesario, tener
claridad de cules son los materiales con mayor rotacin.
d. Sistemas de distribucin.
No resulta til tener el material esterilizado o reprocesado a tiempo; si no puede ser
distribuido a tiempo dentro de la institucin. En consecuencia, una adecuada
distribucin es fundamental. Sin embargo, la distribucin no puede ser exitosa si no
se cuenta con una adecuada comunicacin entre los usuarios de productos estriles
y los proveedores.
184
Todos los Derechos reservados, 2015
En general, los sistemas de distribucin funcionan en la mayora de los casos; siendo
los procedimientos de emergencia los que alteran los patrones tradicionales.
En estos casos, es conveniente contar con material previamente preparado, en
carros o contenedores separados; listos para ser entregados a quirfano. Esto por
cierto depende de la cantidad de material disponible.
185
Todos los Derechos reservados, 2015
Trazabilidad
186
Todos los Derechos reservados, 2015
Captulo 11: Trazabilidad
Si pensamos en la Central de Esterilizacin y Reproceso, existen retos fundamentales dentro
de los que se encuentran:
Validacin de la limpieza.
Gestin de riesgos.
Normativa nacional (o ausencia de esta).
Definir un balance entre productividad y seguridad.
Desinfeccin de alto nivel.
Trazabilidad
La trazabilidad es un proceso fundamental de seguimiento del material que ingresa y sale
de la Central de Esterilizacin. Un adecuado programa de Trazabilidad, permite asegurar
que el material fue adecuadamente esterilizado/desinfectado, entregar informacin del
comportamiento de la central evaluar desempeo y establecer programas de mejora.
La necesidad de la trazabilidad, incluye dentro de sus objetivos:
Asegurar la posibilidad de identificar la ubicacin de instrumentos y productos de
manera rpida.
Determinar cuando los productos deben ser utilizados.
Medir las tasa de uso de los productos.
Mantener registros con informacin vigente de uso, ciclos realizados, resultados, etc.
Asistir con la informacin requerida en el sistema de aseguramiento de la calidad.
Obtener informacin para anlisis financieros.
1. Importancia de la trazabilidad en las Centrales de Esterilizacin.
La necesidad de conocer el origen y destino de un material o instrumento es el origen de la
necesidad de la trazabilidad. Permite contar con la capacidad de identificar de forma univoca,
187
Todos los Derechos reservados, 2015
el origen de un producto, los procesos de esterilizacin, el resultado de estos y en que
paciente se van a utilizar.
Permite adems entregar informacin de tendencias de procesos y establecer con esta
informacin, planes de mejora para la central.
2. Informacin necesaria para lograr trazabilidad.
Es necesario en primer lugar, establecer un programa que permite contar con un registro de
todo el material existente que vaya a ser procesado en la Central de Esterilizacin. Esto
debe incluir los procedimientos que permitan incluir progresivamente todo el material nuevo.
Una de las mximas de un programa de trazabilidad es que no se puede controlar lo que
no se conoce.
En aspectos ms especficos, se debe conocer:
a. Identificacin de Productos, instrumentos, materiales: uso, frecuencia,
almacenamiento.
b. Mtodo de esterilizacin incluyendo informacin de caractersticas del ciclo. Esto
permite entender fechas de caducidad en funcin de las condiciones de
almacenamiento.
c. Identificacin del equipo, permite tener informacin del funcionamiento de equipos,
mantenciones preventivas, reparaciones, etc.
d. Identificacin del Operador, permite establecer la responsabilidad de los
profesionales y tcnicos de una central, hacindolos parte integral de los roles de
la Central de Esterilizacin, e involucrndolos en el objetivo de calidad total.
e. Fecha de esterilizacin, permite establecer fecha de caducidad y optimizar la
rotacin del inventario estril o desinfectado.
f. Si procede, incluir fecha de caducidad. La fecha de caducidad se establece en
cada Central de Esterilizacin, en funcin de la integridad del material de empaque
y de las condiciones de almacenamiento.
188
Todos los Derechos reservados, 2015
3. Estrategias de uso de la informacin.
Toda la informacin obtenida de un adecuado programa de trazabilidad, debe ser recopilada
para anlisis y uso. De lo contrario, se cuenta con datos que no permiten la toma de
decisiones.
Dentro de las formas efectivas de uso de esta informacin se cuentan:
a. Gestin general del servicio: evaluar la calidad del producto entregado, de la
oportunidad de la entrega, de las tasas de fallo y reproceso y del correcto
funcionamiento de la Central de Esterilizacin.
Esta gestin general incluye el uso de los datos para construir y mejorar los
resultados de indicadores de calidad.
b. Gestin del material: permite establecer la trazabilidad de contenedores e
instrumental, codificar cajas e instrumental, etc. Esto se realiza mediante registros
manuales (e.g. Separacin por colores) o medios digitales utilizando cdigos de
barra, cdigos QR o dispositivos RFID.
c. Gestin de los equipos: dentro de la gestin de equipos se cuentan los registros de
mantencin, reparacin, calibracin de indicadores fsicos y problemas de
funcionamiento.
4. Procesos y trazabilidad:
a. Recepcin: origen del material contaminado y verificacin del nmero de piezas,
kits completos.
b. Lavado: cuales son las restricciones de lavado para un material. Cules son las
caractersticas del detergente, temperatura de agua, elementos de accin
mecnica, etc.
189
Todos los Derechos reservados, 2015
c. Preparado: verificacin de los materiales, funcionalidad, corte, movilidad, etc. Se
realiza el empaque que permitir asociar el empaque a un lote de produccin.
d. Esterilizacin: elegir el ciclo y/o agente esterilizante adecuado conforme el material
a esterilizar.
e. Almacenamiento: seleccin en funcin de la rotacin del material, uso y
departamentos o unidades.
5. Alternativas de Trazabilidad.
La trazabilidad no depende estrictamente de recursos ilimitados, si no de la presencia de
informacin y de procesos controlados.
No resulta posible implementar un programa de trazabilidad si no existe una poltica de
calidad, procedimientos escritos y registros asociados a estos.
En la actualizad existen distintas tecnologas que permiten automatizar parte del proceso de
trazabilidad.
a. Cdigo de barras.
Los cdigos de dos o tres dimensiones entregan informacin a
travs de etiquetas que se adhieren a las cajas quirrgicas o
paquetes.
Estas, al ser ledas por un lector laser, permiten obtener la
informacin del paquete y determinar fecha de procesamiento,
ciclo, agentes esterilizantes usados, personal involucrado, Ilustracin 66: Etiqueta con
cdigo de 3 dimensiones
fecha de produccin y eventualmente de expiracin. Este impreso en material Scotch-
Calc.
sistema es particularmente til en paquetes o contenedores
cuando se usan etiquetas.
En el caso de las etiquetas de 3 dimensiones, estas
Este sistema permite un nico uso de las etiquetas impresas.
190
Todos los Derechos reservados, 2015
b. Identificacin por Radio frecuencia (RFID).
El principio de la identificacin por radio frecuencia, involucra el uso de pequeos
dispositivos marcadores de instrumentos, bandejas, kits o contenedores rgidos.
El sistema incluye una antena, un marcador y un lector de radio frecuencia, el que
enva informacin especfica del producto.
Este sistema permite un uso repetido, toda vez que los marcadores son instaladores
en el instrumental o caja a identificar.
c. Identificacin por marcado qumico.
La identificacin qumica, consiste en realizar marcas a travs del uso de soluciones
acidas, que realizan un dao controlado en la pelcula exterior de los instrumentos
metlicos. Esto permite establecer identificacin inequvoca para cada uno de los
instrumentos disponibles.
Cualquiera de las alternativas presentadas, provee excelente informacin para la toma de
decisiones.
Todos los sistemas previamente descritos se asan en los principios de administracin de la
informacin y la creacin de registros. La ausencia de estos registros, descritos en
procedimientos rigurosos, claramente entendidos e implementados, impide una exitosa
implementacin.
191
Todos los Derechos reservados, 2015
192
Todos los Derechos reservados, 2015
Fallas en el proceso
de esterilizacin
193
Todos los Derechos reservados, 2015
Captulo 12: Fallas en el proceso de esterilizacin.
Las fallas son inherentes a los procesos, tanto debido a errores de equipo, de suministros
(e.g. electricidad o vapor), o dado a errores humanos.
Un adecuado seguimiento, anlisis de las causas y posterior solucin a estas fallas permite
dar continuidad a la produccin de material estril, junto con la entrega de informacin valiosa
que permite entender tendencias y prevenir fallas futuras.
1. Fallas en procesos de esterilizacin a alta temperatura (vapor).
a. Problemas con el cambio de indicadores:
Los indicadores entregan informacin valiosa, sean estos indicadores fsicos,
qumicos o biolgicos. Sin embargo cuando los indicadores no presentan el resultado
esperado, se piensa con frecuencia que son los indicadores son los que presentan
falla y no necesariamente los factores asociados al ciclo (carga, calidad de vapor,
temperatura, etc.).
Al igual que la fiebre en los nios nos indica que algo no anda bien sin decirnos cul
es el problema; los indicadores son elementos que entregan informacin del
sntoma, no dicen cul es la enfermedad; por lo que resulta fundamental tener
una adecuada comprensin de las posibles fallas y como solucionarlas.
i. Indicadores Qumicos sin cambio de color o sin virar a la zona de
aceptacin:
Los indicadores qumicos estn diseados para ser voces de alerta de
problemas en el ciclo. Esto incluye las cintas de proceso, los Test Bowie &
Dick, y los indicadores qumicos Tipos 3, 4, 5 y 6. La indicacin de una no
conformidad en el indicador, entrega ms informacin que la que se asume
muchas veces.
194
Todos los Derechos reservados, 2015
1. Indicadores qumicos tipo 5 sin
cambio a la zona de cumplimiento.
Dado que los indicadores qumicos
tipo 5 o integradores, estn
diseados para reaccionar a todas Ilustracin 67: Integrador sin cambio luego
las variables de la esterilizacin; el del ciclo de esterilizacin.
indicador de la Ilustracin 1; las
condiciones necesarias para la esterilizacin no fueron alcanzadas.
Posibles motivos tiene relacin con:
Temperatura del ciclo es inferior a lo establecido en el tiempo
de exposicin (e.g. ciclo a 121C con 30 minutos de
exposicin al vapor).
Calidad de vapor inadecuada.
Nivel de saturacin de vapor.
Carga demasiado densa.
Tiempo de exposicin inadecuado.
Temperaturas insuficientes.
ii. Indicadores biolgicos negativos al cabo de 4 horas y positivos al
incubar por 24/48 horas.
Existe un fenmeno que ocurre en los indicadores biolgicos denominado
Esterilizacin marginal. Esto se refiere a una situacin donde se alcanzan
las condiciones para inactivar las esporas del indicador biolgico; pero por
motivos de falla en el proceso de esterilizacin (tiempo reducido, temperatura
inadecuada o calidad del vapor deficiente), no son inactivadas la totalidad de
las enzimas que reaccionan generan fluorescencia.
Esto da cuenta de una falla del proceso de esterilizacin y las cargas deben
ser reprocesadas.
195
Todos los Derechos reservados, 2015
iii. Indicadores biolgicos negativos.
En muchas Centrales de Esterilizacin y Reproceso, los resultados de
indicadores bilgicos han sido histricamente negativos.
Esto permite dos interpretaciones: El proceso es perfecto y consistente o; el
indicador biolgico se utiliza de manera incorrecta en paquetes de desafos
no validados.
Es fundamental que los indicadores biolgicos sean utilizados en paquetes
de desafo de proceso adecuado, de manera de entregar la informacin real
del proceso que monitorean.
iv. Indicadores Biolgicos positivos:
El indicador siempre ha salido negativo; es una frase comn en las
Centrales de Esterilizacin y Reproceso. Sin embargo los equipos
esterilizadores cambian ligeramente su funcionamiento con el uso, el vapor
que se genera no es necesariamente el mismo, la frecuencia de limpieza del
drenaje puede no ser cotidiana y finalmente; la carga biolgica en los
paquetes a esterilizar puede afectarse debido a procesos de
descontaminacin y lavado deficientes. En consecuencia, el indicador nos
dice que algo est mal.
Los indicadores biolgicos estn diseados para responder a ciclos de sobre
muerte, en consecuencia si el resultado es negativo, se puede contar con la
esterilidad de la carga. Sin embargo, un indicador biolgico positivo habla de
un cambio en las condiciones del agente esterilizante que deben ser
investigadas.
b. Problemas con la calidad del vapor.
El vapor se genera en los equipos, o en calderas especiales.
Este se genera a partir de agua, por lo que tanto como la calidad del agua sea
adecuada (sales reducidas, bajo contenido de metales) el vapor cumplir con las
condiciones bsicas.
196
Todos los Derechos reservados, 2015
Sin embargo, como cualquier proceso industrial, la generacin de vapor cambia
continuamente y se pueden presentar problemas en la calidad de este.
Esto se puede identificar por la presencia de acumulaciones calcreas en la cmara
del esterilizador (sarro o polvo blanco), o acumulaciones que simulan los colores de
un arcoris en instrumentos metlicos (presencia de metales). En ambos casos se
debe contactar a la mantencin de la institucin para obtener evidencia de la calidad
del agua.
La calidad del vapor debe permitir obtener un vapor con niveles de secado del orden
de 97% (i.e. 97% de vapor saturado y un 3% de agua).
Adicionalmente, el vapor debe ser producido a partir de agua con una cantidad de
solidos totales disueltos de 2000 ppm como mximo.
c. Paquetes hmedos.
Es importante conocer el origen de la humedad en paquetes.
Cuando un esterilizador inicia su ciclo, acondiciona la carga y posteriormente la
expone al vapor saturado. Cuando esto ocurre, el vapor transfiere su energa o calor
latente a los instrumentos (la energa se desplaza desde zonas de mayor temperatura
(vapor de la cmara) a zonas de menor temperatura (paquetes).
En la medida que esta humedad se condensa, paulatinamente comienza a ser
eliminada a travs del drenaje. Los paquetes hmedos son el resultado de ciclos que
no pueden eliminar el condensado o que no pueden secar el exceso de este al final
del ciclo.
Los paquetes hmedos se pueden generar por un ciclo inadecuado en la fase de
secado, particularmente en cargas que sean nuevas.
Adicionalmente, se puede generar debido a la ausencia de limpieza del drenaje del
equipo, evitando un adecuado vaco del vapor en la fase de secado.
Otras causas tienen relacin con los requerimientos de saturacin de vapor. En
aquellos equipos que proveen vapor en saturaciones menores a 97%, el nivel de
197
Todos los Derechos reservados, 2015
agua que se aporta al sistema (cmara del esterilizador) puede ser suficiente para
incidir en la generacin de paquetes hmedos.
Una ltima causa, podra tener relacin con el sistema de inyeccin de vapor, que
evita que se reduzca la velocidad de flujo del vapor y permitan que ingrese vapor
saturado en rangos inferiores a 97%.
d. Falla de prueba vaco de aire Bowie & Dick.
La presencia de residuos en el drenaje puede afectar la capacidad del equipo de
lograr un vaco adecuado.
Adicionalmente, la presencia de gases no condensables producto de un vapor de
mala calidad, puede afectar la penetracin del vapor en el paquete de prueba Bowie
Dick.
La presencia de pruebas de Bowie & Dick fallidas, indica un malfuncionamiento del
sistema de remocin de aire, en consecuencia el equipo debe ser puesto fuera de
servicio hasta que la mantencin necesaria ha sido realizada.
Luego de que el equipo haya sido reparado; se debe realizar la validacin de este
realizando 3 pruebas consecutivas de Bowie & Dick con equipo vaco. Luego de
concluidas estas pruebas, se deben realizar 3 pruebas consecutivas con carga vaca
utilizando indicador biolgico (se puede incluir indicador qumico interno) en un
paquete de desafo de proceso.
198
Todos los Derechos reservados, 2015
e. Errores en la carga de paquetes.
Los equipos esterilizadores pueden esterilizar
una cantidad limitada de material en cada ciclo.
Esta cantidad, se encuentra determinada por
elementos fijos y variables.
La capacidad del esterilizar no vara a travs del
tiempo, dado que viene determinado por el
volumen de su cmara, usualmente descrito en
litros. No importa cunto uno se esfuerce; esto
no variar.
Las condiciones de carga varan entre personas,
das y por supuesto turnos de trabajo. Esta es
una de las variables ms importantes en los
errores de carga de paquetes en las cmaras de
esterilizadores.
Esto trae como consecuencias la ausencia de Ilustracin 68: Tipos de cargas
esterilidad en los paquetes, determinado por excesivas que generan errores
indicadores qumicos y biolgicos; como tambin la de ciclo.
cancelacin de ciclos de esterilizacin en el caso
de equipos de xido de etileno o perxido de hidrogeno.
199
Todos los Derechos reservados, 2015
Variables fijas
Ilustracin
Una gua69:tilejemplos de prcticasunadecuadas
para determinar adecuadode llenado
carga de de
esterilizadores.
las canastas de esterilizacin
es la determinacin de la masa de cada paquete a esterilizar.
Cada paquete, no debiera superar una masa de 5.44 Kg ni una densidad de 115
Kg/m3.
200
Todos los Derechos reservados, 2015
Estndares
relacionados con la
esterilizacin
201
Todos los Derechos reservados, 2015
Captulo 13: Estndares relacionados con la esterilizacin.
Es importante estar consciente de las distintas regulaciones existentes relacionadas con las
centrales de esterilizacin. De esta forma, existe una jerarqua donde siempre se debe respetar la
regulacin local.
En aquellos pases donde la regulacin local no ha sido actualizada recientemente, o no tienen
niveles de exigencia elevados, se pueden observar las regulaciones, normas, guas y estndares
internacionales o de organismos de inters (e.g. OPS, OMS).
1. Jerarqua de normas, estndares y regulaciones.
a. Regulacin: es una ley o cuerpo legal de carcter obligatorio en un pas o regin.
b. Estndar: es un mtodo uniforme de definicin de parmetros bsicos para procesos,
productos, servicios y mediciones.
c. Estndar regulatorio: una comparacin con una situacin ideal obligatoria generada por
un cuerpo legal o agencia estatal. La ausencia de cumplimientos, puede ser causar de
sanciones penales o civiles.
d. Estndar voluntario: una comparacin con una situacin ideal que es altamente
recomendada, generada por un cuerpo legal o asociacin profesional o agencia estatal,
que provee la implementacin de mejores prcticas para el mejor cuidado del paciente.
e. Estatuto: una documentacin escrita y promulgada como ley, que es emanada por un
cuerpo gubernamental y es de carcter obligatorio.
202
Todos los Derechos reservados, 2015
Otros organismos de
inters
Normas, guas y
estndares
Regulacin internacional
Regulacin local
2. Organismos de inters.
a. FDA. La Administracin de Alimentos y Drogas de Estados Unidos, es la agencia
encargada de asegurar la salud pblica, eficacia de medicamentos para animales y
humanos, productos biolgicos, dispositivos mdicos, productos alimenticios, cosmticos
y dispositivos que emiten radiacin.
La FDA, establece una clasificacin de 3 niveles para dispositivos de uso mdicos en
funcin del riesgo de uso:
Clase 1: dispositivos de bajo riesgo. Por ejemplo, seda dental.
Clase 2: dispositivos de riesgo mayor. Por ejemplo preservativos o sillas de
ruedas y test de embarazo.
Clase 3: dispositivos que presentar soporte a la vida del paciente o dispositivos
implantables. Por ejemplo reemplazos articulares o marcapasos.
b. AAMI: La asociacin Americana para el Avance de la Instrumentacin mdica (por sus
siglas en Ingles), desarrollan estndares internacionalmente aceptados para la mejora
de las prcticas de la esterilizacin.
203
Todos los Derechos reservados, 2015
Incluye estndares homologados en Estados Unidos as como documentos tcnicos de
diversos tipos.
c. ANSI: El Instituto Nacional Americano de Estndares (por sus siglas en Ingles), homologa
guas internacionales o locales (como AAMI) para que sean utilizadas en su territorio.
d. IAHCSMM: La Asociacin Internacional de Centrales de Materiales en recintos
hospitalarios (por sus siglas en Ingles), establece protocolos y comparte buenas
prcticas.
Organiza conferencias en distintas regiones del mundo para contribuir a estandarizar
prcticas en las Centrales de Esterilizacin.
e. AORN: Asociacin de Enfermeras Peri operatorias Registradas (por sus siglas en Ingles),
establece protocolos de atencin y cuidado a pacientes y recomendaciones para las
prcticas de la esterilizacin.
f. WHO OPS: Tanto la Organizacin Mundial como la Organizacin Panamericana de la
Salud, establecen recomendaciones a nivel de instituciones gubernamentales para
mejorar la salud pblica.
La OPS, cuenta con una gua de prcticas recomendadas en esterilizacin.
g. CDC: El Centro de Control de Enfermedades, (por sus siglas en Ingles), establece los
lineamientos a nivel gubernamental en Estados Unidos, para la Prevencin y reduccin
de enfermedades.
Estableci una gua el ao 2008, donde se recomiendan distintas prcticas y mtodos
en las Centrales de Esterilizacin.
h. APIC: Asociacin de Profesionales de control de infecciones. Elaboran documentos de
referencia que tienen un impacto tangencial en la Central de Esterilizacin y Reproceso.
i. ISO: Organizacin internacional de estandarizacin. Organismo de alcance global que
desarrolla estndares de libre uso e implementacin. Los estndares relacionados con
la Central de Esterilizacin y Reproceso tienen relacin con los atributos de los
indicadores qumicos, fsicos, biolgicos, construccin de autoclaves, monitoreo de
procesos y sistemas de gestin de la calidad entre otros.
204
Todos los Derechos reservados, 2015
j. JCI: La Comisin conjunta Internacional; es una organizacin sin fines de lucro que busca
estandarizar la calidad de servicio en instituciones de salud a travs del mundo.
Elaboran guas de cotejo y pautas de auditoria para las visitas inspectivas que realizan
a los Hospitales que buscan la acreditacin.
k. EPA: La agencia de proteccin ambiental de Estados Unidos; establece los lmites para
emisin de contaminantes y la restriccin de uso de productos que contengan qumicos
peligrosos.
3. Prcticas recomendadas internacionales.
a. AAMI ANSI ST 79: Establece los requerimientos para una Central de Esterilizacin y
Reproceso Hospitalaria, utilizando Vapor Saturado como agente esterilizante.
Incluye infraestructura, requerimientos de recursos humanos, procesos de
descontaminacin, monitoreo y control de la calidad entre otros aspectos.
b. AAMI ANSI ST 58: Establece los requerimientos para una Central de Esterilizacin y
Reproceso Hospitalaria, utilizando Agentes qumicos como esterilizante y desinfectante
de alto nivel.
Incluye infraestructura, requerimientos de recursos humanos, procesos de
descontaminacin, monitoreo y control de la calidad entre otros aspectos.
c. AAMI ANSI ST 41: Establece los requerimientos para una Central de Esterilizacin y
Reproceso Hospitalaria, utilizando xido de Etileno agente esterilizante.
Incluye infraestructura, requerimientos de recursos humanos, procesos de
descontaminacin, monitoreo y control de la calidad entre otros aspectos.
d. Guas AORN: Establecen guas de prctica peri operativa donde se incluyen 6 practicas
recomendadas para la Central de Esterilizacin y Reproceso:
i. Limpieza, manipulacin y reprocesamiento de equipos de anestesia.
ii. Desinfeccin de alto nivel.
iii. Seleccin de material de empaque para sistemas de esterilizacin.
iv. Limpieza y reprocesamiento de endoscopios flexibles y sus accesorios.
205
Todos los Derechos reservados, 2015
v. Limpieza y cuidado de instrumentos motorizados.
vi. Prcticas de esterilizacin.
4. Estndares internacionales.
a. ISO 11135: Esterilizacin en Instituciones de salud: Requerimientos para la validacin,
desarrollo y control rutinario de dispositivos mdicos esterilizados con xido de etileno.
b. ISO 11138: Esterilizacin de dispositivos mdicos, Indicadores Biolgicos.
c. ISO 11140: Esterilizacin de dispositivos mdicos, Indicadores qumicos.
d. ISO 15882: Esterilizacin de dispositivos mdicos, Indicadores qumicos, gua de
seleccin, uso e interpretacin de resultados.
e. ISO 17665: Requerimientos para el desarrollo, validacin y control rutinario de procesos
de control de esterilizacin de dispositivos mdicos.
5. Situacin regional en la regulacin de la esterilizacin.
Un anlisis comparativo puede proveer informacin valiosa acerca
de cmo se estn realizando las labores cotidianas de una Central
de Esterilizacin y Reproceso en otros pases con realidades
diferentes.
Si bien los pases desarrollados, con gran cantidad de recursos
financieros y tcnicos; lideran las prcticas de monitoreo de la esterilizacin, al igual que los
controles previos relacionados con descontaminacin de material; no necesariamente lideran las
prcticas en trminos de frecuencia de monitoreo.
Esto es entendiendo que cuando los procesos previos a la esterilizacin se encuentran altamente
controlados, no resulta necesariamente crtico monitorear cada aspecto de los procesos que
ocurren dentro de la Central de Esterilizacin y Reproceso.
a. Casos seleccionados.
Se presentan a continuacin casos seleccionados de inters para analizar las practicas
respecto del monitoreo de los procesos de esterilizacin.
206
Todos los Derechos reservados, 2015
Este anlisis comparativo pondera la informacin disponible respecto de los estndares
vigentes en los pases y sus niveles de inversin en salud pblica per cpita en funcin
de su producto interno bruto. En este grupo se incluyen pases desarrollados y en vas
de desarrollo.
Pas Inversin per cpita 1995 Inversin per cpita 2014 Evolucin de Inversin (1995-
(U$) (U$) 2014)
Brasil USD 316 USD 1,083 343%
Costa Rica USD 219 USD 1,005 459%
Estados Unidos USD 3,818 USD 9,146 240%
Filipinas USD 37 USD 122 330%
Las comparaciones se realizan en base a 4 categoras:
1. Monitoreo de equipo.
2. Monitoreo de proceso.
3. Capacitacin.
4. Gestin de la Calidad.
i. Brasil: RDC 15, 2012.
1. Monitoreo de equipo.
ART. 93: realizar pruebas de Bowie -
Dick diariamente.
ART. 99: al menos de manera diaria, se
debe monitorear el ciclo de
esterilizacion con paquete de desafio
conteniendo indicador biologico en la zona de mayor desafio dentro del
esterilizador.
207
Todos los Derechos reservados, 2015
2. Monitoreo de proceso.
ART. 96: realizar monitoreo en paquetes de desafio de proceso, con
integradores quimicos o emuladores (Indicadores quimicos Tipo 5 o 6).
ART. 98: Cargas con material implantable deben ser monitoreadas con
indicadores biologicos.
ART. 99: al menos de manera diaria, se debe monitorear el ciclo de
esterilizacion con paquete de desafio conteniendo indicador biologico en la
zona de mayor desafio dentro del esterilizador.
3. Capacitacin.
ART. 29 (V): Los profesionales de la Central de Esterilizacin y Reproceso o
la empresa proveedora, deben recibir capacitacion especifica y periodida en
los siguientes temas:
Clasificacin de productos de salud.
Conceptos bsicos de microbiologa.
Transporte de productos contaminados.
Proceso de limpieza, desinfeccin, preparacin, inspeccin,
acondicionamiento, empaque, esterilizacin y funcionamiento de
equipos existentes.
Monitoreo de procesos utilizando indicadores fsicos, qumicos y
biolgicos.
Trazabilidad, almacenamiento y distribucin de productos.
Mantencin de esterilidad de producto.
Seguridad y salud en el lugar de trabajo.
4. Gestin de la Calidad.
ART. 26: La Central de Esterilizacin y Reproceso o la empresa proveedora;
debe disponer de un sistema de informacin manual o automatizado con
208
Todos los Derechos reservados, 2015
registro Registro del monitoreo y control de las estapas de limpieza,
desinfeccion o esterilizacin, al igual que la mantencion y monitoreo de los
equipos.
La resolucin RDC 15, es rigurosa en material de control de procesos,
educacin y monitoreo de procesos de esterilizacin en instituciones de salud
o en proveedores de servicios de esterilizacin; suponiendo una buena
referencia para implementar en pases con regulaciones laxas o no
actualizadas.
ii. Estados Unidos: AAMI/ANSI St79:2013.
1. Monitoreo de equipo.
Se debe realizar el
monitoreo de equipo
cada da (i.e.
esterilizadores de pre
vaco).
2. Monitoreo de proceso.
Se deben controlar las variables del proceso a travs de indicadores
fsicos, qumicos y biolgicos.
Cada paquete debe tener:
Indicador qumico Tipo 1 (i.e. control de exposicin).
Indicador qumico interno Tipo 3, 4, 5 o 6.
Se debe utilizar indicadores biolgicos en paquetes de desafo de
proceso al menos una vez por semana pero idealmente con mayor
frecuencia.
209
Todos los Derechos reservados, 2015
Todas las cargas con material implantable deben ser verificadas con
indicadores biolgicos.
3. Capacitacin.
Todo el personal debe contar con una certificacin de procesamiento
estril con una vigencia de al menos dos aos.
Se debe evaluar la competencia de los trabajadores de la Central de
Esterilizacin y Reproceso.
4. Gestin de la Calidad.
Se deben mantener registros de uso, esterilizacin, mantencin de
equipos y capacitacin del personal.
Se deben realizar control de equipos, de lote, de esterilizador, fecha de
expiracin.
iii. Costa Rica: norma Tcnica de Central de Esterilizacin, 2005.
1. Monitoreo de equipo.
Se debe realizar diariamente
un Test de Bowie-Dick en el
primer ciclo con la cmara
vaca.
2. Monitoreo de proceso
Los controles biolgicos deben aplicarse idealmente en cada ciclo de
esterilizacin de todos los esterilizadores de vapor las 24 horas del da,
y como mnimo aceptable en un ciclo por turno, preferiblemente en todos
los esterilizadores, y de manera elemental en alguno o varios de ellos
(una ampolleta por carga).
Se debe utilizar un indicador qumico interno en cada paquete.
210
Todos los Derechos reservados, 2015
3. Capacitacin:
La Jefa/Supervisora de la Central de Esterilizacin debe tener la
capacidad de conducir programas de entrenamiento continuo y
actualizacin permanente al personal bajo su dependencia; como al que
solicite la Educadora en Servicio.
4. Gestin de la Calidad:
Se establecen criterios de calidad para lograr el cumplimiento de la
verificacin de la efectividad del proceso de esterilizacin.
iv. Filipinas.
1. Monitoreo de equipo:
Se debe monitorear
cada equipo
esterilizador de pre
vaco con pruebas de
Bowie-Dick.
2. Monitoreo de proceso:
El monitoreo del proceso de esterilizacin debe incluir indicadores fsicos,
qumicos y biolgicos.
Cada carga debe monitorearse con indicadores qumicos internos (tipo 3,
4, 5 o 6) e indicadores qumicos externos (Tipo 1).
Una vez al da, se debe monitorear el equipo con indicadores biolgicos.
Los ciclos de perxido de hidrgeno y xido de etileno deben ser
monitoreados con indicadores biolgicos en el 100% de las cargas.
211
Todos los Derechos reservados, 2015
3. Capacitacin:
Todo el personal debe poseer entrenamiento y educacin continua,
entrenamiento y calificacin en central de procesamiento, certificado de
entrenamiento, salud adecuada y buena higiene personal.
4. Gestin de la Calidad:
Debe existir un programa de aseguramiento de la calidad establecido
para asegurar la adecuada esterilizacin y el monitoreo continuo del
proceso.
Se deben establecer protocolos en el lugar de trabajo.
Se deben mantener registros para cada tipo de esterilizador y ciclo
utilizado, lote de esterilizacin, contenido, parmetros de exposicin, etc.
Como se puede desprender de la informacin presentada; este anlisis comparativo
pondera las prcticas realizadas en los pases desde la perspectiva de la inversin que
se realiza en salud.
Si bien no existe evidencia de una correlacin directa entre inversin en salud pblica a
nivel pas y la infraestructura de cada Central de Esterilizacin y Reproceso; se presume
que a mayores niveles de inversin; tanto la infraestructura como el equipamiento de
una Central de Esterilizacin y Reproceso y reproceso sern mayores comparados con
pases con menores niveles de inversin.
Resulta interesante que se observan prcticas que parecen estar muy avanzadas en
algunos pases cuando se comparan con sus niveles de inversin (i.e. Costa Rica y
Filipinas).
Cabe preguntarse qu es lo que ocurri en estos pases que gatillaron un cambio positivo
en trminos de las prcticas de monitoreo de la esterilizacin y como se pueden utilizar
212
Todos los Derechos reservados, 2015
como un pas de referencia para replicar las prcticas en las centrales de esterilizacin
y reproceso de Latino Amrica.
Existen fundamentalmente 3 factores comunes en aquellos pases que lograron cambios
en las prcticas:
Liderazgo transversal:
Si bien lo que ocurre en la Central de
Esterilizacin y Reproceso y reproceso
se encuentra fuertemente ligado al
liderazgo de la unidad; la Central de
Esterilizacin y Reproceso y reproceso
no es el nico ente vinculado con la
seguridad de los pacientes. Tanto las
unidades de ciruga, epidemiologa, direccin mdica y bioingeniera son actores
fundamentales en reducir los riesgos para los pacientes por el uso de material
reprocesado de manera inadecuada a los pacientes (desinfectado o esterilizado).
Aquellas instituciones que abordan los problemas que se presentan en la Central
de Esterilizacin y Reproceso y reproceso con una perspectiva de equipos
multidisciplinarios tienen ms probabilidades de mejorar procesos de manera
ms rpida que aquellas centrales que no cuentan con el apoyo de otras
unidades.
Documentacin de la evidencia:
En ausencia de evidencia cientfica vigente, o en ausencia de una inadecuada
comunicacin del impacto de las labores realizadas en una Central de
Esterilizacin y Reproceso y reproceso; resulta difcil lograr el compromiso de
otras unidades dentro de una institucin de salud.
La adecuada comunicacin a distintas unidades dentro de un hospital resulta
fundamental para compartir la comprensin de los riesgos asociados a material
213
Todos los Derechos reservados, 2015
reprocesado de manera inadecuada y lograr el compromiso de otras unidades
para implementar proyectos de mejora.
Disposicin para cambiar el statu quo:
Siempre resulta sencillo mantener las cosas en la manera que se han hecho
durante aos; sin embargo a veces es necesario renovar prcticas, proceso y
miradas de cmo realizar las labores cotidianas. Si bien el personal de las
centrales de esterilizacin y equipos tiene una mirada continua de mejora de
procesos, esto debe ser compartido en la organizacin para implementar
proyectos de mejora de manera exitosa.
214
Todos los Derechos reservados, 2015
Liberacin paramtrica
215
Todos los Derechos reservados, 2015
Captulo 14: Liberacin Paramtrica.
La declaracin de conformidad de que un producto es estril,
basado en los registros que demuestran que los parmetros
del proceso fueron cumplidos de acuerdo a un nivel de
tolerancia. Esta es la definicin de la liberacin paramtrica. En
el mundo de la esterilizacin de dispositivos mdicos, ya sean
estos reprocesados (i.e. Central de Esterilizacin y Reproceso)
o dispositivos nuevos (fabricantes de dispositivos mdicos),
existen dos formas de aproximar el problema del
aseguramiento de la calidad: Monitoreo de procesos de manera
continua o liberacin paramtrica.
Esta ltima, es una forma parcialmente utilizada en el ambiente
industrial y en algunos pases de Europa. En trminos simples, se refiere a la liberacin de cargas
contando solo con informacin de los parmetros fsicos dele quipo.
Como concepto, la liberacin paramtrica parece ser el sueo en una Central de Esterilizacin y
Reproceso: no se debe usar indicadores qumicos o biolgicos ni tampoco esperar para la liberacin
de cargas, sin embargo como todo en la vida; se debe tener una perspectiva general de cmo
aplicar esto y cules son los requisitos, riesgos y beneficios.
En el presente capitulo se discutir la aplicabilidad de esta estrategia de liberacin de cargas, al
igual que el marco normativo y regulatorio vigente.
1. Principios de la liberacin paramtrica.
La liberacin paramtrica es el mtodo preferido en diversas industrias incluidas la farmacutica
e industria de fabricacin de dispositivos mdicos. Dado los niveles de control internos y
regulatorios tanto nacionales como internacionales, las industrias logran un nivel de confiabilidad
en sus procesos extremadamente alto.
216
Todos los Derechos reservados, 2015
Debido a la definicin establecida en el estndar ISO 11139-
2006, la liberacin paramtrica podra ser interpretada como
la forma de liberar cargas, considerando solo la informacin
provista por el equipo (e.g. tiempo, temperatura y presin) y
la informacin existente respecto de la calidad del vapor.
En cierta forma, esto es cierto. Sin embargo la posibilidad de
realizar liberacin de cargas solo conociendo los parmetros
fsicos del ciclo, requieren una segunda lectura de manera de
proveer productos asegurados como estriles.
La implementacin de estrategias de liberacin paramtrica involucra la ausencia parcial de
indicadores qumicos y biolgicos, todo dependiendo del nivel de seguridad de que los
parmetros crticos de la esterilizacin sean alcanzados.
2. Requerimientos para la implementacin de liberacin paramtrica.
Para poder implementar un programa de liberacin paramtrica, se deben cumplir 3 categoras
de requisitos:
a. Sistema de gestin de la calidad:
Es necesario contar con un adecuado sistema de gestin de
la calidad, en un programa de liberacin paramtrica.
En l se incluyen:
Responsabilidades
Procesos documentados
Registros
Recursos.
Plan de calidad
Instrucciones de trabajo
217
Todos los Derechos reservados, 2015
Requerimientos de
entrenamiento
Medicas de control de
procesos.
Criterios de la instalacin.
Programa de auditoria.
Uno de los principales objetivos del Ilustracin 70: Estndar ISO 17665 establece los
requisitos para validacin de ciclos.
sistema de gestin de la calidad, es que
se debe mantener consistencia en el proceso productivo; no importando el turno, la carga
de trabajo, la distribucin del personal, el funcionamiento de equipos u otras variables
comnmente encontradas en un ambiente tan dinmico como la Central de Esterilizacin
y Reproceso.
b. Definicin de productos y procesos.
Se debe contar con una adecuada definicin de cules son
los procesos a realizar (incluidas todas sus variables) y
cules son los productos a reprocesar. Esto incluye todos
los atributos fsicos de los instrumentos o materiales a
esterilizar (masa, geometra, material, conductividad trmica,
sistema de empaque, criterio para asignar familias de
productos, etc.).
Adicionalmente, se deben documentar de manera especfica los procesos previos a la
esterilizacin par cada familia de productos. Tabla 1.
La definicin de procesos debe incluir al menos todos los aspectos crticos incluyendo
fases previas a la esterilizacin. Dentro de la definicin de los procesos se debe incluir:
Mtodos de limpieza y descontaminacin.
Tipos de productos utilizados y especificaciones de parmetros crticos.
218
Todos los Derechos reservados, 2015
Tipos de sistemas de lavado utilizado (cavitacin, termo desinfectoras, manual).
Para cada uno se debe detallar el proceso.
Lmites de agente esterilizante, concentracin, tiempos de exposicin, etc.
Niveles de aseguramiento de la esterilizad para agente esterilizante utilizado.
Atributo del producto Tipo de consideraciones
Material del que est construido Fibras naturales vs artificiales.
Metales vs plsticos.
Absorcin de hmeda.
Sensibilidad a la temperatura.
Reaccin de la superficie al agente esterilizante.
Diseo del instrumento Material canulado o slido.
Cnulas extensas.
Superficie mate o brillante.
Ciclos necesarios.
Como se prepara el producto Producto seco vs hmedo.
Fue ensamblado en una sala limpia.
Uso de lubricante.
Fue almacenado previo a la esterilizacin y en qu
condiciones.
Cul es el uso del dispositivo Material implantarle.
Uso tpico.
Aplicacin a piel daada.
Dispositivo neurolgico.
Dispositivo ocular.
Como se empaca para esterilizacin Plstico-papel.
Bolsa plstica.
Empaque de celulosa.
Empaque sinttico.
Contenedor con filtro superior e inferior.
Contenedor con filtro superior.
Contenedor con vlvulas.
Material absorbente.
Tabla 9: Atributos de productos.
219
Todos los Derechos reservados, 2015
c. Validacin.
La validacin es quizs la parte ms importante de un
programa de esterilizacin basado en liberacin
paramtrica.
La validacin es fundamental en la obtencin de resultados
consistentes a travs del tiempo. Dado que un producto
estril es considerado especial, debido a que no puede
verificarse su esterilidad luego del proceso de esterilizacin
pues esto significara la prdida de la esterilidad (abrir un
paquete para verificar esterilidad de su contenido); es
fundamental realizar la validacin del proceso mediante el
cual se logra la esterilidad de dicho producto.
Para completar la validacin, se requiere obtener una gran cantidad de informacin,
fundamentalmente a travs de 3 etapas:
i. Calificacin de la instalacin:
Es el proceso mediante el cual se obtiene la evidencia que el equipo funciona
conforme las especificaciones del fabricante.
ii. Calificacin operacional:
Es el proceso mediante el cual se obtiene la evidencia que el equipo instalado
funciona dentro de los lmites predeterminados al ser utilizado conforme a los
procedimientos de uso.
iii. Calificacin de desempeo:
Es el proceso mediante el cual se obtiene la evidencia que el equipo funciona y
es operado conforme a los procedimientos de uso y con los criterios de carga.
Estas tres validaciones deben ser realizadas antes de la puesta en servicio de un
esterilizador.
220
Todos los Derechos reservados, 2015
En el caso de instalaciones que ya cuentan con equipos en funcionamiento, se deben
validar los procesos antes de migrar totalmente a liberacin paramtrica.
Al menos de manera anual, se debe realizar la validacin de cada uno de los equipos
esterilizadores. Esto debe incluir todos los parmetros crticos que afectan la
esterilizacin.
3. Cundo se puede aplicar la liberacin paramtrica?
En primer lugar, se debe entender cul es la regulacin vigente en el pas a implementar el
sistema de monitoreo de la esterilizacin.
En pases como Brasil, Chile, Colombia o Per; la normativa vigente hace exigible que los
procesos de esterilizacin sean monitoreados con indicadores biolgicos y qumicos; por lo que
no es posible implementar liberacin paramtrica en una institucin de salud.
Aquellas organizaciones de carcter industrial que se dediquen tanto a la fabricacin de
dispositivos mdicos como al reprocesamiento de instrumental quirrgico para uso hospitalario;
pueden optar a realizar sus liberaciones en funcin de los parmetros, siempre que se cumplan
los criterios de validacin de procesos.
4. Resumen de mtodos de monitoreo y liberacin de cargas estriles.
Atributo Industria farmacutica o de Hospitales
dispositivos mdicos
Estndares de referencia: ISO 11135 AAMI/ANSI ST79
ISO 9001 RCD 15 BRASIL
GMP NT 045 - MEXICO
FDA
Tipos de cargas Un lote de produccin a la vez con Paquetes variables en cada carga.
ciclo conocido y nico. Distinta composicin, densidad,
Nmero de productos constante. masa, etc.
Carga biolgica Material con baja carga biolgica. Contaminacin inicial alta.
Proceso desarrollado para esa Ausencia de monitoreo de limpieza
carga biolgica. Limpieza puede ser difcil de lograr.
221
Todos los Derechos reservados, 2015
Atributo Industria farmacutica o de Hospitales
dispositivos mdicos
Mtodos de esterilizacin Variados para un mismo agente Ciclos limitados (e.g. 121, 132,134
esterilizante. C).
Ciclos diseados de forma Parmetros determinados por el
especfica. fabricante del esterilizador.
Desarrollo de ciclos Ciclos definidos en funcin de la Diversos materiales y geometras.
carga a esterilizar. Ciclos genricos.
Se puede predecir la curva de
letalidad al conocer la carga
biolgica.
Material de empaque Empaque seleccionado por facilidad El empaque se elige por costo.
para esterilizar, vida til, No se cuenta con validacin para
presentacin, etc. cargas especficas.
El mtodo de esterilizacin se valida Se necesitan indicadores externos
con el paquete. para validad la esterilidad.
Proceso de documentacin Estndar para cumplir con requisitos Variable en funcin de la Central de
regulatorios. Esterilizacin y Reproceso.
Consistente a travs del tiempo. Vara entre turnos.
Sistemas de calidad Definido con criterios rgidos. Flexible en funcin del sistema de
Ausencia de cumplimiento puede gestin adoptado.
llevar al cese de operaciones. Acreditaciones internacionales
contribuyen a la rigurosidad del
sistema.
Validacin Requerido en funcin de nivel de Validacin para comprobar letalidad
seguridad mnimo. de al menos 10e6.
Validacin necesaria anualmente. Validacin de equipos es relativa.
Ensayo de dispositivos producidos Ensayados de manera rigurosa Los productos no pueden ser
incluyendo propiedades qumicas, evaluados sin reprocesamiento.
biolgicas y fsicas. La inspeccin fsica altera la
letalidad.
Consecuencias de ciclos fallidos En extremo inusual. Baja incidencia de material no estril
Los controles permiten prevenir la e impacto al paciente.
liberacin de material no estril. En caso de ocurrir las
consecuencias son graves (I.S.Q.).
Personal Entrenamiento extensivo para todo Existen programas de evaluacin de
el personal. competencia.
222
Todos los Derechos reservados, 2015
Atributo Industria farmacutica o de Hospitales
dispositivos mdicos
Se debe validar y re certificar al Existe diferentes vas de
personal de manera continua. determinacin de competencias.
Instalacin reas limpias a nivel industrial. Presupuestos exiguos.
Parmetros ambientales altamente Diseo de la Central de
controlados. Esterilizacin y Reproceso puede no
ser ideal.
Responsabilidad legal Los acuerdos firmados pueden Depende el tipo de institucin y las
alcanzar varios millones de dlares. investigaciones realizadas.
223
Todos los Derechos reservados, 2015
Aseguramiento de la
calidad
224
Todos los Derechos reservados, 2015
Captulo 15: Aseguramiento de la calidad.
Este es un concepto un tanto etreo,
principalmente porque existe un gran
nmero de decisiones dependiendo del
contexto en el que se evalu la calidad.
La calidad de un vehculo puede ser
interpretada como la duracin de su
motor, o como funcin de atributos
especficos de seguridad o hasta lujo.
En el mundo hospitalario y
especficamente en el mundo de la
esterilizacin, los atributos de calidad tienen relacin con la seguridad para los pacientes. El servicio
prestado, debe ser oportuno, preciso y seguro; de manera de restaurar la condicin del paciente de
la mejor forma posible. Sin embargo, esta calidad; se encuentra acotada a distintos aspectos de la
atencin en instituciones de salud, por lo que abordaremos este Captulo de manera especfica
orientado a la calidad de los procesos y productos de una Central de
Esterilizacin y Reproceso.
Actuar Planear
Verificar Hacer
Es en la actualidad ampliamente aceptado que la esterilidad de los
materiales, instrumentos e insumos utilizados en pacientes es fundamental para garantizar que
obtienen la mejor atencin disponible. Sin embargo, en algunas instituciones de salud se siguen
utilizando prcticas que distan de lo ideal.
La evidencia cientfica disponible, ha relacionado la ausencia de adecuados procesos de
esterilizacin con brotes de agentes infecciosos. Recientemente, el inadecuado reprocesamiento de
colonoscopios; ha sido relacionado con un brote de eneterobacterias resistentes a carbapenos; con
dos pacientes muertos y varios cientos contaminados.
225
Todos los Derechos reservados, 2015
Existen criterios que indican la obligatoriedad del acceso a una atencin universal de salud, que son
los marcos regulatorios de los pases, en orden a proveer salud adecuada a sus ciudadanos y
residentes.
1. Introduccin a la necesidad de la calidad en una institucin de salud.
a. Necesidad del monitoreo del proceso de esterilizacin.
En el establecimiento de los programas de monitoreo de los procesos de esterilizacin,
existen distintos elementos que surgen. Sin lugar a dudas, los aspectos econmicos son
importantes, sin embargo existen elementos ticos y de inclusin, de acceso a la salud y de
justicia. Si bien esto puede parecer muy etreo, e incluso alejado de la realidad de la Central
de Esterilizacin y Reprocesamiento; sin embargo los principios que rigen la salud pblica
de un pas, aplican a cada uno de los eslabones que construyen la cadena de la salud de
sus ciudadanos.
b. Ejemplos de Polticas de Salud Pblica de Latinoamrica.
i. Per: el ao 2020 los habitantes del Per gozarn de salud plena, fsica, mental
y social, como consecuencia de una ptima respuesta del Estado, basada en los
principios de universalidad, equidad, solidaridad, de un enfoque de derecho a la
salud e interculturalidad, y de una activa participacin ciudadana.
Con el Gobierno Nacional, Gobierno Regional, Gobierno Local y la Sociedad Civil
que logran ejecutar acuerdos concertados para el bien comn.
As mismo, las instituciones del Sector Salud se articularn para lograr un sistema
de salud fortalecido, integrado, eficiente, que brinda servicios de calidad y
accesibles, que garantiza un plan universal de prestaciones de salud a travs del
aseguramiento universal y un sistema de proteccin social.
ii. Ecuador: Ejercer la rectora, regulacin, planificacin, coordinacin, control y
gestin de la Salud Pblica ecuatoriana a travs de la gobernanza y vigilancia y
control sanitario y garantizar el derecho a la Salud a travs de la provisin de
226
Todos los Derechos reservados, 2015
servicios de atencin individual, prevencin de enfermedades, promocin de la
salud e igualdad, la gobernanza de salud, investigacin y desarrollo de la ciencia
y tecnologa; articulacin de los actores del sistema, con el fin de garantizar el
derecho a la Salud.
iii. Brasil: Promover a sade da populao mediante a integrao e a construo
de parcerias com os rgos federais, as unidades da Federao, os municpios,
a iniciativa privada e a sociedade, contribuindo para a melhoria da qualidade de
vida e para o exerccio da cidadania"
iv. Mexico: un sistema nacional de salud universal, equitativo, integral, sustentable,
efectivo y de calidad, con particular enfoque a los grupos de la poblacin que
viven en condicin de vulnerabilidad, a travs del fortalecimiento de la rectora
de la autoridad sanitaria y la inter sectorialidad; de la consolidacin de la
proteccin y promocin de la salud y prevencin de enfermedades, as como la
prestacin de servicios plurales y articulados basados en la atencin primaria; la
generacin y gestin de recursos adecuados, la evaluacin y la investigacin
cientfica, fomentando laparticipacin de la sociedad con corresposabilidad.
Como se puede recoger, existen pocas diferencias entre distintos pases, respectos
de los objetivos generales de la salud de la poblacin. En la mayora de estos
extractos se habla de universalidad de la atencin, atencin oportunidad,
promocin de la salud, prevencin de enfermedades, etc.
2. Definicin de calidad.
La calidad es definida como el conjunto de atributos, especificaciones y caractersticas de un
producto, que permiten satisfacer una necesidad o requerimiento especfico.
Un atributo fundamental en la Central de Esterilizacin y Reproceso; es que los productos sean
estriles, o en su defecto hayan sido satisfactoriamente procesados con desinfeccin de alto
nivel. En consecuentica, la dimensin de la calidad es binaria tiene solo dos opciones-; es decir
se cumple o no se cumple este atributo.
227
Todos los Derechos reservados, 2015
La calidad, puede ser medida tambin en funcin del servicio u oportunidad de la entrega del
servicio. Una Central de Esterilizacin y Reproceso, es una fbrica de material estril; que debe
ser entregado de manera oportuna s los clientes del hospital. Una baja en la calidad del
servicio, puede significar retraso en los procedimientos quirrgicos con impactos para los
pacientes e impactos financieros para la institucin.
En consecuencia, la calidad se puede abordar desde distintas dimensiones. La calidad, como
atributo de un producto o servicio; debe ser medida. La ausencia de mtricas relacionas con la
calidad, impiden el anlisis de tendencias y el establecimiento de planes de mejoras. Estas,
mtricas de la calidad, deben ser realistas, objetivas y medibles, de lo contrario pierden mpetu
dentro de la organizacin y no se observan mejoras.
Adicionalmente, todas las mtricas asociadas con la calidad, deben ser un esfuerzo
mancomunado en la organizacin: no existe calidad s solo la Jefa trabaja para lograr
cumplimiento de requisitos.
La calidad tiene distintas dimensiones, dependiendo del aspecto que se quiere evaluar. Por
ejemplo, imagine que se requiere realizar una ciruga de urgencia para un paciente con una
fractura expuesta de tibia.
Rpidamente, la Central de Esterilizacin y Proceso entrega el material quirrgico a quirfano.
Hasta aqu la calidad percibida de servicio ser alta, dado que el material fue entregado de
manera oportuno. Sin embargo, si el material no estaba verificado como estril; la calidad total
del servicio es muy baja; poniendo innecesariamente en riesgo al paciente.
La calidad es fundamental en las instituciones de salud, en principio porque se sabe que altos
niveles de servicio calidad- permiten entregar mejores oportunidades de recuperaciones a los
pacientes. Sin embargo existen actualmente otros motivos por los que resulta importante la
calidad. Por ejemplo, las acreditaciones de instituciones de salud (e.g. Joint Comission); permiten
diferenciar a un proveedor de servicios de salud de otros. Estas acreditaciones pueden ser
locales y tener relacin con la cantidad de recursos que el estado puede entregar a una
institucin especifica.
228
Todos los Derechos reservados, 2015
Otro motivo tiene relacin con la evolucin de la industria de la salud, donde los proveedores
de salud no son necesariamente del estado. En el caso de los proveedores privados; deben
buscar asegurar el acceso a un numero de terminado de pacientes a travs de aseguradoras
privadas. Estas aseguradoras, buscan proveedores de salud con altos niveles de calidad dado
los costos menores asociados a la reduccin de eventos adversos.
3. Elementos de la Calidad en la Central de Esterilizacin y Reproceso.
a. Empoderamiento: el
empoderamiento
permite hacer que las
cosas sucedan. Es la
capacidad de tomar
decisiones e
implementar a travs
de la lnea de mando
dentro de una institucin. El empoderamiento debe ser incorporado en todos los
empleados de una Central de Esterilizacin y Reproceso.
b. Liderazgo: el desarrollo y planificacin de planes de mejor, desarrollo de oportunidades,
priorizacin de actividades y la implementacin de procesos es fundamental. El liderazgo
permite establecer roles, responsabilidades, delegar y contribuir a que el equipo de
trabajo logre los objetivos en conjunto.
c. Informacin: en la actualidad existe suficiente informacin para la toma de decisiones en
una Central de Esterilizacin y Reproceso; y quizs, demasiada informacin. Es
fundamental utilizar la informacin necesaria, determinar cul es relevante y de qu tipo
de informacin se puede prescindir.
La adecuada informacin lleva a la toma de decisiones; el resto, son probablemente
datos innecesarios.
229
Todos los Derechos reservados, 2015
d. Planificacin de herramientas y procedimientos: nada ocurre por azar al liderar un grupo
de personas.
La planificacin de actividades, la documentacin de procedimientos y las actividades de
educacin continua deben ser planificadas de manera adecuada.
e. Personal: el/la mejor Jefe/a de Central de Esterilizacin y Reproceso no es ms que un
eslabn a la hora de lograr el xito de una Unidad. Este puede ser solo tan exitoso como
el conjunto del equipo de trabajo puede serlo. Es fundamental identificar los talentos del
personal, orientarlos en el trabajo, capacitar de manera continua y potenciar las mejores
habilidades de cada empleado.
f. Administracin de procesos: se debe determinar, mediante herramientas de priorizacin,
cuales son los factores claves de xito. Uno fundamental es la esterilidad de los
productos; sin embargo hay que identificar otros factores de xito.
Dentro de estos factores se incluyen las relaciones con otras unidades, la comunicacin
fluida, la evaluacin continua de procesos y personas y el establecimiento de planes de
mejora de procesos.
Recuerde, lo que puede ser medido puede ser mejorado; y esto aplica a todos los
procesos y sub procesos de una Central de Esterilizacin y Reproceso.
4. Indicadores de la calidad.
Los indicadores de calidad, son
informacin que permiten cuantificar la
calidad de los procesos. Como tal,
permiten establecer el cumplimiento de
objetivos.
Existen 3 tipos de indicadores de la
calidad:
a. Indicadores de gestin:
230
Todos los Derechos reservados, 2015
Estos indicadores estn regulados por polticas y procedimientos y otras acciones
administrativas para asegurar la seguridad y eficiencia de la unidad.
Existen 3 tipos diferentes:
i. Indicadores de control de la administracin: esta es una pieza fundamental de
un programa de gestin de la calidad y se basa en el establecimiento de polticas,
procedimientos, instrucciones de trabajo y otros documentos necesarios para un
adecuado funcionamiento.
El contar con documentos escritos, provee consistencia a travs del tiempo y
evita la dependencia exclusiva en personas; lo que es reducido al cargo que la
persona ostenta.
ii. Indicadores de Inspeccin: estos indicadores son utilizados con informacin entre
la Central de Esterilizacin y Reproceso y otros servicios; por ejemplo
Epidemiologia. En la medida que se cruza la informacin entre ambos se puede
determinar el comportamiento de tendencias en infecciones de pacientes;
presumiblemente relacionadas con el uso de material estril (e.g. Infecciones de
sitio quirrgico).
iii. Informacin de reuniones entre unidades: las minutas de reuniones pueden
entregar informacin til respecto de tasas de uso de producto, tendencias de
tiempo de entrega, presencia de paquetes con error (indicador qumico
externo/interno sin cambios).
b. Indicadores de satisfaccin de clientes.
Cualquier unidad dentro de una institucin hospitalaria que espere algo (servicio o
producto) de la Central de Esterilizacin y Reproceso; es un cliente de esta ltima. Por
tanto, es importante entender la informacin recopilada por estos clientes y analizarla
para poder establecer mejoras.
231
Todos los Derechos reservados, 2015
i. Encuestas de calidad de Servicio: las encuestas proveen informacin valiosa
cuando son diseadas de forma objetiva. Estas pueden proveer informacin de
la calidad de servicio as como de la percepcin de este.
ii. Reportes de incidentes: quizs la mejor forma de obtener informacin que
evidencie problemas en los procesos es un reporte de incidente. Estos tienen
relacin con una falla que se debe mejorar a la brevedad y que puede ser de
distintos aspectos.
Un incidente puede incluir la falta de oportunidad en la entrega de material, o la
deteccin de material no estril (gracias a indicador interno o externo) en el
quirfano.
iii. Reclamos internos o externos: los reclamos deben ser presentados de manera
parcial y analizados de manera acorde. Adecuadas habilidades de comunicacin
son necesarias tanto para la redaccin como para la evaluacin de reclamos
provenientes del personal de la unidad como de clientes dentro de la institucin.
c. Indicadores tcnicos.
Quizs los indicadores que podemos denominar
tcnicos, son los que entregan informacin ms
directamente relacionada con productividad y tasas
de falla de los procesos realizados en una Central
de Esterilizacin y Reproceso. Estos se relacionan
con reas muy especficas dentro de la unidad.
Estos indicadores deben ser construidos en
funcin de una base de produccin de material estril/desinfectado para definir una
mtrica objetiva a travs del tiempo.
232
Todos los Derechos reservados, 2015
5. Construccin de Indicadores de la calidad
Hemos sealado en varias oportunidades que todo lo que se puede medir, se puede mejorar;
sin embargo, al implementar indicadores de la calidad, se debe enfocar el esfuerzo en medir lo
que entregue informacin adecuada.
Es frecuente, que durante la implementacin de programas de mejora de la calidad, se
construyan demasiados indicadores, haciendo poco prctico el control de todos estos
indicadores.
En aquellas instituciones que cuentan con una unidad especfica de calidad; responsable de
obtener y analizar la informacin, es posible tener muchos indicadores de manera simultnea,
sin embargo muchas veces es la Central de Esterilizacin y Reproceso; y su lder, quien debe
hacer la gestin de la calidad junto a sus otras responsabilidades.
Los indicadores que usted defina, deben ser indicadores que:
Sean medibles y especficos: deben entregar informacin del proceso a medir.
Sean alcanzables: deben ser razonables pero presentar un desafo para ser alcanzados.
Sean relevantes: entregan informacin que es fundamental medir.
Estn asociados a una mtrica de tiempo o produccin: permiten establecer mejoras al
obtener sus resultados.
Permitan tomar decisiones.
Indicador A = (nmero de oportunidades / nmero de oportunidades totales) *100
Ejemplo: Indicador de Monitoreo de equipos de pre vaco (Test de Bowie & Dick) en una central
con 2 esterilizadores de pre vaco utilizados 5 das por semana.
El total de equipos monitoreados por semana es 8 (de lunes a jueves se evalan ambos equipos,
el viernes no haban test de Bowie & Dick disponibles.
El total de equipos que pudieron ser evaluados era 10 (2 equipos, 5 das por semana = 10).
Indicador B&D = (Equipos evaluados por semana / Total de oportunidad de evaluar)*100
Indicador B&D = (8/10)*100
Indicador B&D = 80%.
Ilustracin 71: Ejemplo de clculo de indicador de proceso.
233
Todos los Derechos reservados, 2015
Los indicadores de calidad, se calculan en funcin de una frmula internacionalmente aceptada.
Los indicadores de calidad deben incluir rangos especficos de tiempo, asociados a la criticidad
de estos, a la generacin de datos o a otros criterios especficos.
Rangos de tiempo de medicin pueden incluir:
resultados semanales generales.
Resultados semanales por turno.
Recopilacin mensual de informacin.
Recopilacin semestral o anual.
6. Rangos de aceptacin de indicadores.
Para la construccin de los indicadores de la calidad, se deben establecer rangos de
cumplimientos; dentro de estos debemos separar el estndar y el umbral del indicador.
El estndar siempre se va a referir a la condicin ideal, es decir al cumplimiento ptimo que ser
de 100%.
En el caso del umbral definido, se establece como el objetivo a cumplir en las condiciones
actuales
Si bien el estndar no cambiar no se puede exceder el 100% de desempeo- el umbral va a
ir continuamente mejorando, reduciendo los rangos de cumplimiento en los niveles superiores.
Teniendo en cuenta los 5 principios de un indicador de calidad (Medibles y especficos,
alcanzables, relevantes, asociados a una mtrica de tiempo o produccin, permitan tomar
decisiones); es necesario establecer criterios de aceptacin o cumplimiento.
Los rangos son arbitrarios y deben estar alineados con estos 5 principios.
Se debe tener en cuenta que los rangos de cumplimiento son dinmicos y deben ser
continuamente re evaluados para determinar que se mantienen vigentes. Adicionalmente, el
objetivo ltimo de la calidad es lograr un 100% de cumplimiento de los indicadores medidos.
234
Todos los Derechos reservados, 2015
Nivel de
Resultado del indicador Estndar Umbral del indicador
cumplimiento
Optimo Cumplimiento sobre 85% 100% Ao 1 sobre 75%
Adecuado Cumplimiento entre 50 y 84% 100% Ao 2 sobre 80%
Deficiente Cumplimiento 26 y 49%bajo 25% 100% Ao sobre 85%
Extremo Cumplimiento bajo 25% 100% Ao sobre 85%
Ilustracin 72: Ejemplo de rangos de cumplimiento.
Al implementar programas de aseguramiento de la calidad y construir sus indicadores, las tasas
de cumplimiento deben ser alcanzables. Si se fija un objetivo tan alto que no es posible que
dadas las condiciones actuales se sepa a priori que no puede ser alcanzado, esto generar un
desinters en el equipo.
Si por el contrario se fija un objetivo demasiado bajo; este ser rpidamente alcanzado.
Un ejemplo de un indicador que debiese ser de un 100% de cumplimiento es el monitoreo de
cargas con material implantable, utilizando indicadores biolgicos. La evidencia cientfica
disponible indica que el riesgo de infecciones de sitio quirrgico (i.e. ISQ), es sustantivamente
alto en este tipo de cirugas, por lo que en orden a proteger al paciente, todo el material utilizado
en una ciruga de implante debe ser monitoreado con indicador biolgico.
Si en su Unidad, esto se realiza en el 20% de las cargas con material implantable; sera irrealista
pensar que al cabo de un mes, se lograr monitorear el 100% de las cargas con material
implantable.
De esta manera, se hace necesario establecer los objetivos de la calidad, acotados a un plazo
especfico. Esto permite conseguir informacin y respaldar la necesidad de mejoras, en este
caso; relacionadas con el monitoreo de cargas con material implantable.
7. Ejemplos de indicadores de la calidad.
Dada la diversidad de etapas, sub procesos y procesos realizados en una Central de
Esterilizacin y Reproceso; y la complejidad de las unidades a las que le presta servicios, nos
centraremos en ejemplos especficos de indicadores de calidad que pueden resultar tiles.
235
Todos los Derechos reservados, 2015
a. Indicadores de gestin.
i. Capacitacin a empleados.
ii. Verificacin de conocimientos. Induccin a nuevos empleados.
b. Indicadores de satisfaccin
i. Paquetes con indicador qumico interno con cambio.
ii. Ordenes completas a tiempo.
iii. Verificacin de concentracin de desinfectante de alto nivel.
c. Indicadores tcnicos
i. Prueba de Bowie & Dick.
ii. Monitoreo de implantes usando Indicadores biolgicos.
iii. Paquetes hmedos.
Total de eventos Total de eventos Resultado del
Indicador Rango Evaluado
realizados requeridos Periodo
Indicadores de Gestin
a. Capacitacin de empleados. 5 7 Semestral 71%
b. Verificacin de conocimientos. 2 8 Mensual 25%
c. Induccin a nuevos empleados 2 2 Mensual 100%
Indicadores de Satisfaccin de Clientes
a. Paquetes con I.Q. Interno. 952 1022 Semanal 93%
b. Ordenes completas a tiempo. 312 465 Semanal 67%
c. Verificacin de concentracin de D.A.N. 10 18 Quincenal 56%
Indicadores Tcnicos
a. Pruebas de Bowie & Dick. 12 14 Semanal 86%
b. Monitoreo de cargas con implantes usando I.B. 65 102 Semanal 64%
c. Paquetes hmedos. 952 952 Semanal 100%
Ilustracin 73: Ejemplo de resumen de indicadores.
236
Todos los Derechos reservados, 2015
8. Anlisis de calidad
a. Modos de falla y anlisis de causa efecto.
Cuando su vehculo enciende la luz de revisar motor; el sistema de este vehculo
estableci que existe una falla potencial.
Al llevar este vehculo al servicio tcnico,
mediante un anlisis con un computador externo,
el automvil indica cuales son los problemas y
buscar la reparacin de estos.
En el caso de un motor, puede tener relacin con
el reemplazo de piezas para evitar daos
mayores.
Este es un ejemplo de un anlisis de modo de
falla y causa efecto. La pregunta bsica que uno busca resolver es si falla una etapa
A como afecta el resultado de mi proceso.
Este anlisis permite determinar cules entradas del proceso pueden fallar y cules son
los efectos de esta falla. Permite determinar el riesgo asociados a un malfuncionamiento
y determinar actividades especficas y priorizadas para reducir este riesgo.
Acciones
Proceso o etapa Falla potencial Impacto de las fallas Medidas de control
recomendadas
Esterilizacin por Suministro de vapor Detencin de la Pruebas de calidad Mantencin
Vapor Calidad del vapor produccin. de agua. preventiva
Remocin de aire Paquetes hmedos. Indicadores de Mantencin
Ausencia de calidadd de predictiva.
esterilidad Pruebas de vaco. Calibracin anual.
Ilustracin 74: Anlisis de modos de falla de un esterilizador por vapor.
237
Todos los Derechos reservados, 2015
i. Etapas para identificar modos de falla:
1. Documente el proceso.
2. Identifique las entradas de su proceso.
3. Identifique fallas especficas de este proceso.
4. Determine el impacto de la falla especfica en el resultado del proceso.
5. Establezca las estrategias para reducir la posibilidad de falla.
En anlisis de modo de falla y causa efecto es un modelo proactivo para reducir la
probabilidad de fallas de procesos. Permite anticiparte a las potenciales causas de un
defecto y en consecuencia permite entregar una herramienta valiosa a la hora de prevenir
detenciones innecesarias en los procesos realizados en una Central de Esterilizacin y
Reproceso, tanto por falla de equipos como de reduccin de productos defectuosos.
b. Causa raz.
Cuando su vehculo se detiene en el medio de una carretera; sabe que existe una causa
raz que debe resolver: el vehculo dej de funcionar. Las causas de esta falla para
quienes no somos mecnicos- son totalmente desconocidas; por lo que se deben
determinar en un servicio tcnico adecuado.
En el caso de los anlisis de causa raz de fallas; los anlisis se realizan a posteriori, es
decir con informacin de algo acontecido. Son desde este punto de vista, anlisis
reactivos.
Si bien entregan informacin de la falla, est ya ha ocurrido y se ha generado una
disrupcin en el proceso, por ejemplo de esterilizacin a baja temperatura.
El aseguramiento de la calidad es un proceso dinmico, que debe ser evaluado continuamente para
mejorar de manera continua. Esto involucra recursos tcnicos y humanos y una colaboracin a
travs de distintas unidades.
La capacitacin y divulgacin de la informacin a travs de la organizacin resulta fundamental para
el xito de los objetivos.
238
Todos los Derechos reservados, 2015
Si bien la mejora continua es un proceso fuertemente arraigado en las instituciones de salud, este
es el objetivo ltimo; toda vez que existen distintas herramientas utilizadas con xito en distintas
instrucciones.
Las herramientas que usted utilice o elija implementar deben ser ajustadas a vuestra propia realidad,
incluyendo infraestructura, personal, procesos y comunicacin interna con otras unidades.
239
Todos los Derechos reservados, 2015
Herramientas para
Lderes de una Central
de Esterilizacin y
Reproceso
240
Todos los Derechos reservados, 2015
Captulo 16: Herramientas para Lderes de una Central de Esterilizacin
Las labores diarias en una Central de Esterilizacin y Reproceso son diversas, variadas en complejidad y
frecuencia. Un(a) lder de una Central de Esterilizacin y Reproceso; debe cumplir una serie de roles diversos.
Dentro de estos se encuentran la administracin de presupuesto, distribucin de turnos de trabajo, planificacin
de ausencias programas, cobertura de ausencias no programadas, planificacin de demanda futura de servicio y
reuniones multi funcionales en la institucin; solo por nombrar algunas.
Existen algunas herramientas que pueden permitir articular de forma ms exitosa las labores diarias y optimizar el
tiempo para cumplir a cabalidad con las responsabilidades.
Este captulo est diseado para ser visto de forma interactiva.
Las actividades descritas se desarrollarn a travs de ejercicios prcticos cubriendo los siguientes puntos:
1. Herramientas tcnicas
a. Clculos de densidad de paquetes.
b. Justificacin de frecuencia de monitoreo.
2. Herramientas de gestin
a. Anlisis financieros para toma de decisiones.
b. Priorizacin de actividades.
c. Construcciones de indicadores de gestin.
3. Herramientas de comunicacin.
a. Liderazgo efectivo.
241
Todos los Derechos reservados, 2015
Bibliografa
242
Todos los Derechos reservados, 2015
Bibliografa:
1. Disinfection, Sterilization and preservation Seymour Block Lippincott Williams and Wilkings
Fifth Edition.
2. Principles and methods of sterilization in health sciences Perkings Thomas Second Edition
3. The basics of Sterile Processing CBSPD Second Edition.
4. Central Services manual IAHCSMM Seventh Edition.
5. Comprehensive Guide to steam sterilization and sterility assurance AAMI ANSI St 79-2013
6. 2013 AORN Perioperative Standards and Recommended practices.
7. Ethylene Oxide sterilization in Health Care facilities: Safety and effectiveness AAMI/ANSI
St:41:2008.
8. Water for the reprocessing of medical devices AAMI TIR 34:2014.
9. Chemical sterilization and high level disinfection in health care facilities ANSI/AAMI ST58:2013.
10. ISO 17665-1:2006 Sterilization of health care products moist heat.
11. ISO 11138: Sterilization of health care products Biological indicators.
12. ISO 11138: Sterilization of health care products Chemical indicators.
13. OMS: Programa de Ciruga Segura 2008.
14. Guideline for disinfection and sterilization in Healthcare Facilities, 2008.
15. Disinfection, Sterilization and Antisepsis William Rutala, 2008.
16. Biological Indicators for Sterilization Process - Gomez & Moldenhauer, 2009.
17. Sterilization Technology for the Health Care Facility Reichert & Young, Second Edition.
243
Todos los Derechos reservados, 2015
244
Todos los Derechos reservados, 2015
Todos los Derechos reservados, 2015
Todos los Derechos reservados, 2015
Potrebbero piacerti anche
- Manipulación de cargas con carretillas elevadoras. IEXD0108Da EverandManipulación de cargas con carretillas elevadoras. IEXD0108Nessuna valutazione finora
- Simposio Aesculap Gestion Integral de Instrumental Quirurgico Santa Cruz 2014Documento77 pagineSimposio Aesculap Gestion Integral de Instrumental Quirurgico Santa Cruz 2014Deysisita Ruiz CamposNessuna valutazione finora
- Funciones ingeniero biomédico hospitalDocumento2 pagineFunciones ingeniero biomédico hospitalEDGAR ANDRES CARTAGENA ESPINELNessuna valutazione finora
- Guia Buenas Practicas Equipos de ElectromedicinaDocumento204 pagineGuia Buenas Practicas Equipos de ElectromedicinaErnestoKhunNessuna valutazione finora
- Mantenimiento preventivo equipos hospital MacasDocumento86 pagineMantenimiento preventivo equipos hospital MacasLuism120Nessuna valutazione finora
- Requisitos Dotacion HospitalariaDocumento33 pagineRequisitos Dotacion HospitalariaZully Karina AvellanedaNessuna valutazione finora
- Identific. Pacientes Hosp.Documento28 pagineIdentific. Pacientes Hosp.Alma Remigio EstupiñaNessuna valutazione finora
- SilicosisDocumento26 pagineSilicosisjorgex_sarcasmo-bodomNessuna valutazione finora
- Plan de Contigencia Equipos BiomedicosDocumento18 paginePlan de Contigencia Equipos BiomedicosGERENCIA DE LINEA BIOMEDICANessuna valutazione finora
- Instalaciones y Equipos de Un Laboratorio Clínico - EbelynDocumento21 pagineInstalaciones y Equipos de Un Laboratorio Clínico - EbelynSusan Ruiz EcheNessuna valutazione finora
- 7 - Gestión de MantenimientoDocumento34 pagine7 - Gestión de MantenimientoPaz MarcelyNessuna valutazione finora
- FMS 6Documento13 pagineFMS 6Leandro MartinezNessuna valutazione finora
- Programa Mantenimiento Preventivo y Correctivo de EquiposDocumento6 paginePrograma Mantenimiento Preventivo y Correctivo de EquiposSantiago GutiérrezNessuna valutazione finora
- Manual Miditron JRDocumento130 pagineManual Miditron JROmar De Leon ColungaNessuna valutazione finora
- Ceye ModernaDocumento54 pagineCeye Modernaalex100% (4)
- 03 Equipos de Primer NivelDocumento38 pagine03 Equipos de Primer Nivelmoises antolinezNessuna valutazione finora
- Introducciòn Al Programa de Mantenimiento de Equipo Mèdico-1Documento25 pagineIntroducciòn Al Programa de Mantenimiento de Equipo Mèdico-1Ari MontesNessuna valutazione finora
- PS120(西语)Documento62 paginePS120(西语)Diego PachecoNessuna valutazione finora
- Guía verificación requisitos equipos biomédicosDocumento9 pagineGuía verificación requisitos equipos biomédicosBetancur AlejandroNessuna valutazione finora
- Manual ECG600 EspañolDocumento87 pagineManual ECG600 EspañolNicolás Di Lullo100% (1)
- Camilla AmbulanciaDocumento81 pagineCamilla AmbulanciaNovoa Flores Tito MauryNessuna valutazione finora
- Amef Equipo MedicoDocumento5 pagineAmef Equipo MedicojhonnyNessuna valutazione finora
- Manual de Buenas Practicas de EsterilizacionDocumento190 pagineManual de Buenas Practicas de EsterilizacionVioletts KarmonaNessuna valutazione finora
- Propuesta de MantenimientoDocumento28 paginePropuesta de MantenimientoBAMBINOS MultiEventosNessuna valutazione finora
- Lab 1: Metrology FundamentalsDocumento42 pagineLab 1: Metrology FundamentalsrubenkolosovasNessuna valutazione finora
- Cema MN Bi 6Documento9 pagineCema MN Bi 6GERENCIA DE LINEA BIOMEDICANessuna valutazione finora
- Publicacion Web 201413 03 2018Documento20 paginePublicacion Web 201413 03 2018Andres Riascos EnriquezNessuna valutazione finora
- Manual Atencion Contingencias Manejo RPBIDocumento46 pagineManual Atencion Contingencias Manejo RPBIHaide RamosNessuna valutazione finora
- Modelo de Gestion de Mtto BiomedicoDocumento86 pagineModelo de Gestion de Mtto BiomedicoYesid Dayan De Leon EscorciaNessuna valutazione finora
- Tipos de MantenimientoDocumento4 pagineTipos de MantenimientoJavier García RamosNessuna valutazione finora
- c111 Guia CortaDocumento14 paginec111 Guia CortaArturho VargasNessuna valutazione finora
- FMC-00-M03 Manual de Gases MedicinalesDocumento10 pagineFMC-00-M03 Manual de Gases MedicinalesKtalina BeltranNessuna valutazione finora
- Propuesta de Cedula de EvaluacionDocumento2 paginePropuesta de Cedula de EvaluacionJob Gonzaga100% (1)
- Gestión mantenimiento equipos biomédicos hospitalariosDocumento14 pagineGestión mantenimiento equipos biomédicos hospitalariosJuan Alberto Florez CoteNessuna valutazione finora
- Manual de Mantenimientos PreventivosDocumento15 pagineManual de Mantenimientos PreventivosMonica FajardoNessuna valutazione finora
- Manual de CistosDocumento88 pagineManual de CistosFernando Arroyo SanchezNessuna valutazione finora
- Incubadora C-100 control preciso de temperaturaDocumento1 paginaIncubadora C-100 control preciso de temperaturaMaria Gloria Sanchez EliasNessuna valutazione finora
- Formato para Solicitud de Adquisición de TecnologíaDocumento4 pagineFormato para Solicitud de Adquisición de TecnologíaJuan David SanchezNessuna valutazione finora
- Biosonic S1Documento4 pagineBiosonic S1popovski100% (1)
- Gestión de EquiposDocumento9 pagineGestión de EquiposJavier García Ramos0% (1)
- Procedimiento de Codigo AzulDocumento17 pagineProcedimiento de Codigo AzulCarlosNessuna valutazione finora
- Funciones Del Departamento de Ingeniería BiomédicaDocumento16 pagineFunciones Del Departamento de Ingeniería BiomédicaJose MirandaNessuna valutazione finora
- Sierra Electrica Oscilante para Cortar Yesos, AllgaierDocumento7 pagineSierra Electrica Oscilante para Cortar Yesos, AllgaierPABLO ZAMUDIONessuna valutazione finora
- Manual profesional estándar de limpieza y desinfección de endoscopios flexiblesDocumento112 pagineManual profesional estándar de limpieza y desinfección de endoscopios flexiblesAna Marcela Calderón TamayoNessuna valutazione finora
- Cemento Efectos en La SaludDocumento31 pagineCemento Efectos en La SaludLuis Pintado Sanchez100% (1)
- Desarrollo de Un Programa de Gestión de Equipo Médico en Un Hospital Privado de LeónDocumento4 pagineDesarrollo de Un Programa de Gestión de Equipo Médico en Un Hospital Privado de LeónalvarochavezzNessuna valutazione finora
- Plandecontingenciadetecnología BiomédicaDocumento19 paginePlandecontingenciadetecnología BiomédicaGERENCIA DE LINEA BIOMEDICANessuna valutazione finora
- Criterios de IndicadoresDocumento25 pagineCriterios de IndicadoresAndrea GallardoNessuna valutazione finora
- 6 - FFR Link - H7495551000 - Manual OperacionDocumento28 pagine6 - FFR Link - H7495551000 - Manual OperacionAngela BetancurNessuna valutazione finora
- Informe Daños Maquina de AnestesiaDocumento5 pagineInforme Daños Maquina de Anestesiajulián Andrés ToroNessuna valutazione finora
- Portafolio BiomedicaDocumento43 paginePortafolio Biomedicasamira23185Nessuna valutazione finora
- Glosario Ingeniería ClínicaDocumento6 pagineGlosario Ingeniería ClínicaAna Paulina Arango CarmonaNessuna valutazione finora
- Campana Codigo ConductaDocumento2 pagineCampana Codigo ConductaPaulina ArguellesNessuna valutazione finora
- Nom 197 Ssa1 2000Documento63 pagineNom 197 Ssa1 2000Enrique IbarraNessuna valutazione finora
- Limpieza y desinfección de equipos médicos guíaDocumento26 pagineLimpieza y desinfección de equipos médicos guíaMoncho MacNessuna valutazione finora
- Manual técnico del clima MC-15Documento55 pagineManual técnico del clima MC-15Faustina2013Nessuna valutazione finora
- Formato para Visita de Preinstalacion de Dispositivos MedicosDocumento3 pagineFormato para Visita de Preinstalacion de Dispositivos MedicosJuan Camilo EspinosaNessuna valutazione finora
- ESTERILIZACIONDocumento249 pagineESTERILIZACIONGrover Luis Mendieta100% (1)
- Laboratorio de ReferenciaDocumento6 pagineLaboratorio de ReferenciaAnderson GilNessuna valutazione finora
- Analisis Procesos HPTUDocumento11 pagineAnalisis Procesos HPTUlunaNessuna valutazione finora
- Trabajo Ensayo INNOVACION DOCENTE Y USO DE LAS TIC EN LA ENSEÑANZA UNIVERSITARIADocumento4 pagineTrabajo Ensayo INNOVACION DOCENTE Y USO DE LAS TIC EN LA ENSEÑANZA UNIVERSITARIAPhilip Salcedo50% (8)
- 02 Operaciones y Mantenimiento PDFDocumento650 pagine02 Operaciones y Mantenimiento PDFPhilip SalcedoNessuna valutazione finora
- Cartera de Produccion de Servicios Enero 2022Documento1 paginaCartera de Produccion de Servicios Enero 2022Philip SalcedoNessuna valutazione finora
- Informe Epidemiologico Semanal CovidDocumento21 pagineInforme Epidemiologico Semanal CovidPhilip SalcedoNessuna valutazione finora
- Diplomado de Gas Modulo 3Documento12 pagineDiplomado de Gas Modulo 3Philip SalcedoNessuna valutazione finora
- Colelitiasisycolecistitis 130924172028 Phpapp01Documento116 pagineColelitiasisycolecistitis 130924172028 Phpapp01Philip SalcedoNessuna valutazione finora
- La Didactica Universitaria en El Contexto de La AndragogiaDocumento5 pagineLa Didactica Universitaria en El Contexto de La AndragogiaSoledad AlbinoNessuna valutazione finora
- Mapa CognitivoDocumento1 paginaMapa CognitivoPhilip SalcedoNessuna valutazione finora
- Metodologías y procesos de evaluación: modelos, enfoques y métodosDocumento26 pagineMetodologías y procesos de evaluación: modelos, enfoques y métodosPhilip SalcedoNessuna valutazione finora
- Via Clinica CA 2 Junio 2016Documento102 pagineVia Clinica CA 2 Junio 2016Eduardo Cristian MB MisakiNessuna valutazione finora
- 4 130804173220 Phpapp02Documento47 pagine4 130804173220 Phpapp02Philip SalcedoNessuna valutazione finora
- Diplomado de Gas Modulo 3Documento12 pagineDiplomado de Gas Modulo 3Philip SalcedoNessuna valutazione finora
- Metodologías y procesos de evaluación: modelos, enfoques y métodosDocumento26 pagineMetodologías y procesos de evaluación: modelos, enfoques y métodosPhilip SalcedoNessuna valutazione finora
- HistoriaclnicadeemergenciaDocumento2 pagineHistoriaclnicadeemergenciaPhilip SalcedoNessuna valutazione finora
- Manual de Evaluacion y Acreditacion de Establecimientos de Salud Tercer Nivel de AtencionDocumento140 pagineManual de Evaluacion y Acreditacion de Establecimientos de Salud Tercer Nivel de AtencionjeancarNessuna valutazione finora
- 02 Operaciones y Mantenimiento PDFDocumento650 pagine02 Operaciones y Mantenimiento PDFPhilip SalcedoNessuna valutazione finora
- Medicion InteligenteDocumento19 pagineMedicion InteligentePhilip SalcedoNessuna valutazione finora
- Manual LZ 1600N 2000 Esp PDFDocumento3 pagineManual LZ 1600N 2000 Esp PDFPhilip SalcedoNessuna valutazione finora
- Metodologías y procesos de evaluación: modelos, enfoques y métodosDocumento26 pagineMetodologías y procesos de evaluación: modelos, enfoques y métodosPhilip SalcedoNessuna valutazione finora
- Detalles de Equipos Coriolis KrohneDocumento1 paginaDetalles de Equipos Coriolis KrohneleothekingsNessuna valutazione finora
- Tare de Lo Malo y Feo PDFDocumento1 paginaTare de Lo Malo y Feo PDFPhilip SalcedoNessuna valutazione finora
- Gas NaturalDocumento29 pagineGas NaturalPhilip SalcedoNessuna valutazione finora
- DigitalFlow™ GC868 PDFDocumento8 pagineDigitalFlow™ GC868 PDFIsabelen PazNessuna valutazione finora
- Metodologia y Procesos de EvaluacionDocumento18 pagineMetodologia y Procesos de EvaluacionIsabelen PazNessuna valutazione finora
- Manual de Metodologia Deinvestigaciones 1Documento74 pagineManual de Metodologia Deinvestigaciones 1Angel SánchezNessuna valutazione finora
- Colecistitis AgudaDocumento7 pagineColecistitis AgudaCynthia VeraNessuna valutazione finora
- Manual de Metodologia Deinvestigaciones 1Documento74 pagineManual de Metodologia Deinvestigaciones 1Angel SánchezNessuna valutazione finora
- Manual de Evaluacion y Acreditacion de Establecimientos de Salud Primer Nivel de AtencionDocumento112 pagineManual de Evaluacion y Acreditacion de Establecimientos de Salud Primer Nivel de AtencionGuido Terrazas Pozo100% (4)
- Vademecum Medicamentos PisaDocumento443 pagineVademecum Medicamentos PisaRossi Fuentes VargasNessuna valutazione finora
- Manual de Evaluacion y Acreditacion de Establecimientos de Salud Primer Nivel de AtencionDocumento112 pagineManual de Evaluacion y Acreditacion de Establecimientos de Salud Primer Nivel de AtencionGuido Terrazas Pozo100% (4)
- CatalogovacuDocumento163 pagineCatalogovacuCandy VlNessuna valutazione finora
- Parcial JuevesDocumento3 pagineParcial JuevesEver Kebdry ManjarrezNessuna valutazione finora
- EF Taller EnunciadosDocumento4 pagineEF Taller EnunciadosJuanNessuna valutazione finora
- Las maravillas del plástico: reutilización y cuidado del medio ambienteDocumento4 pagineLas maravillas del plástico: reutilización y cuidado del medio ambienteDelPieroMarchandNessuna valutazione finora
- Documento Técnico Que Soporta Solicitud Al Plan de Inversiones para La Dotación de Equipos Y Herramientas AsorettDocumento26 pagineDocumento Técnico Que Soporta Solicitud Al Plan de Inversiones para La Dotación de Equipos Y Herramientas AsorettTatiana LambrañoNessuna valutazione finora
- Portafolio tratamiento capilarDocumento51 paginePortafolio tratamiento capilarLiz Ramos OscorimaNessuna valutazione finora
- Tapas, Liners y Etiquetas.Documento20 pagineTapas, Liners y Etiquetas.J�SELYN GERALDY MARCATOMA RIVERANessuna valutazione finora
- Seleccion de Materiales No MetalicosDocumento13 pagineSeleccion de Materiales No MetalicosEduardo RomoNessuna valutazione finora
- Trabajo ReciclajeDocumento17 pagineTrabajo ReciclajeFernandoLantañoPintoNessuna valutazione finora
- Guia de Laboratorio de PlásticosDocumento8 pagineGuia de Laboratorio de PlásticosMarlon QuirogaNessuna valutazione finora
- Elaboración de platos biodegradablesDocumento10 pagineElaboración de platos biodegradablesValeria VelazquezNessuna valutazione finora
- Envasado de Agua en PETDocumento21 pagineEnvasado de Agua en PETFidel Mtz VillalobosNessuna valutazione finora
- Ficha de Trabajo 1Documento7 pagineFicha de Trabajo 1Cathy Vargas Alfaro100% (1)
- Catalogo Convermex PDFDocumento32 pagineCatalogo Convermex PDFsanto38% (8)
- Qué factores determinan la resistencia mecánica del plásticoDocumento9 pagineQué factores determinan la resistencia mecánica del plásticoluciaNessuna valutazione finora
- PolymerosDocumento28 paginePolymerosGermain Burgos Hernández100% (1)
- Ejercicio 9. Separación de Basura-WS5PDocumento5 pagineEjercicio 9. Separación de Basura-WS5PEdrey Jandery Rodriguez de la TrinidadNessuna valutazione finora
- Evaluacion 2788572Documento35 pagineEvaluacion 2788572Benja VelásquezNessuna valutazione finora
- 3-2537.090 Rev 11 Spanish ManualDocumento16 pagine3-2537.090 Rev 11 Spanish ManualDaniel SalgadoNessuna valutazione finora
- PolimerosDocumento17 paginePolimerosSabycochuNessuna valutazione finora
- Marca SostenibleDocumento3 pagineMarca SostenibleJeidy CondeNessuna valutazione finora
- Clasificacion de Los Materiales No MetalicosDocumento4 pagineClasificacion de Los Materiales No MetalicosMartin GarciaaNessuna valutazione finora
- CasoEjemploCapIIIDocumento13 pagineCasoEjemploCapIIIViviana Maureira BascuñanNessuna valutazione finora
- 60 - ELEC-OBTE - MANTENIMIENTO-FILTRO-ARMONICOS Rev. 0Documento9 pagine60 - ELEC-OBTE - MANTENIMIENTO-FILTRO-ARMONICOS Rev. 0Gonzalo Turpo100% (1)
- Autos Nuevos Vs Autos AntiguosDocumento3 pagineAutos Nuevos Vs Autos AntiguosFlavio Agusto SanchezNessuna valutazione finora
- Medio Ambiente CTSYVDocumento10 pagineMedio Ambiente CTSYVYuridia Espinoza RodriguezNessuna valutazione finora
- Manual de Normas Y Procedimientos.Documento99 pagineManual de Normas Y Procedimientos.Os Jo Ve RaNessuna valutazione finora
- 02-11-Cyt-El Mal Manejo de Los Residuos Sólidos Contribuye Al Calentamiento GlobalDocumento5 pagine02-11-Cyt-El Mal Manejo de Los Residuos Sólidos Contribuye Al Calentamiento GlobalJose Vilca Percca100% (1)
- Síntesis y Aplicación de Perovskitas en Sistemas Híbridos para Evolución de Hidrógeno en Bicapas Fosfolipídicas (DMPC) Primera Ultima Versiòn SaulDocumento58 pagineSíntesis y Aplicación de Perovskitas en Sistemas Híbridos para Evolución de Hidrógeno en Bicapas Fosfolipídicas (DMPC) Primera Ultima Versiòn SaulSaul LopezNessuna valutazione finora
- Frp-Fibras de Carbono, Vidrio y Aramida Usadas Como Refuerzo para EstructurasDocumento54 pagineFrp-Fibras de Carbono, Vidrio y Aramida Usadas Como Refuerzo para EstructurasCristianJavierNessuna valutazione finora
- Las 21 leyes irrefutables del liderazgo: Siga estas leyes, y la gente lo seguirá a ustedDa EverandLas 21 leyes irrefutables del liderazgo: Siga estas leyes, y la gente lo seguirá a ustedValutazione: 4 su 5 stelle4/5 (341)
- Despierta tu Energía Femenina: Secretos de Energía de la Diosa y Cómo Acceder a Tu Poder DivinoDa EverandDespierta tu Energía Femenina: Secretos de Energía de la Diosa y Cómo Acceder a Tu Poder DivinoValutazione: 4 su 5 stelle4/5 (5)
- El Monje Que Vendio Su Ferrari: Una Fábula EspiritualDa EverandEl Monje Que Vendio Su Ferrari: Una Fábula EspiritualValutazione: 4.5 su 5 stelle4.5/5 (1695)
- Resetea tu mente. Descubre de lo que eres capazDa EverandResetea tu mente. Descubre de lo que eres capazValutazione: 5 su 5 stelle5/5 (195)
- Liderazgo sin ego: Cómo dejar de mandar y empezar a liderarDa EverandLiderazgo sin ego: Cómo dejar de mandar y empezar a liderarValutazione: 4.5 su 5 stelle4.5/5 (171)
- 3 Decisiones que toman las personas exitosas: El mapa para alcanzar el éxitoDa Everand3 Decisiones que toman las personas exitosas: El mapa para alcanzar el éxitoValutazione: 4.5 su 5 stelle4.5/5 (321)
- Pasos de gigante: La información que necesitas para triunfar en la vida y en los negocios, explicada de manera sencillaDa EverandPasos de gigante: La información que necesitas para triunfar en la vida y en los negocios, explicada de manera sencillaValutazione: 5 su 5 stelle5/5 (56)
- El talento nunca es suficiente: Descubre las elecciones que te llevarán más allá de tu talentoDa EverandEl talento nunca es suficiente: Descubre las elecciones que te llevarán más allá de tu talentoValutazione: 5 su 5 stelle5/5 (150)
- Las 21 cualidades indispensables de un líder: Conviértase en una persona que los demás quieren seguirDa EverandLas 21 cualidades indispensables de un líder: Conviértase en una persona que los demás quieren seguirValutazione: 5 su 5 stelle5/5 (209)
- Cómo ganarse a la gente: Descubra los principios que siempre funcionan con las personasDa EverandCómo ganarse a la gente: Descubra los principios que siempre funcionan con las personasValutazione: 5 su 5 stelle5/5 (158)
- La Tabla Esmeralda: Incluye varias versiones y explicacionesDa EverandLa Tabla Esmeralda: Incluye varias versiones y explicacionesValutazione: 4.5 su 5 stelle4.5/5 (7)
- ¡Tómate un respiro! Mindfulness: El arte de mantener la calma en medio de la tempestadDa Everand¡Tómate un respiro! Mindfulness: El arte de mantener la calma en medio de la tempestadValutazione: 5 su 5 stelle5/5 (198)
- Las seis etapas definitivas para superar tu divorcioDa EverandLas seis etapas definitivas para superar tu divorcioValutazione: 4.5 su 5 stelle4.5/5 (10)
- Los 12 chakras: Desbloquea tus dones espiritualesDa EverandLos 12 chakras: Desbloquea tus dones espiritualesValutazione: 4 su 5 stelle4/5 (14)
- Disciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Da EverandDisciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Valutazione: 5 su 5 stelle5/5 (10)
- El lado positivo del fracaso: Cómo convertir los errores en puentes hacia el éxitoDa EverandEl lado positivo del fracaso: Cómo convertir los errores en puentes hacia el éxitoValutazione: 4.5 su 5 stelle4.5/5 (525)
- ¡Basta ya de ser un Tipo Lindo! (No More Mr. Nice Guy): Un Plan Probado para Que Obtengas Lo Que Quieras en La Vida El Sexo y El Amor (A Proven Plan for Getting What You Want in Love, Sex and Life)Da Everand¡Basta ya de ser un Tipo Lindo! (No More Mr. Nice Guy): Un Plan Probado para Que Obtengas Lo Que Quieras en La Vida El Sexo y El Amor (A Proven Plan for Getting What You Want in Love, Sex and Life)Valutazione: 5 su 5 stelle5/5 (47)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDa EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoValutazione: 5 su 5 stelle5/5 (2)
- Viaje a través del libro de ejercicios de un curso de milagros. Volumen 1Da EverandViaje a través del libro de ejercicios de un curso de milagros. Volumen 1Valutazione: 4 su 5 stelle4/5 (8)
- LOS ARCANOS DE NACIMIENTO: EL TAROT DEL ALMA: ¿CÓMO CALCULAR TU ARCANO PERSONAL O DE ALMA?Da EverandLOS ARCANOS DE NACIMIENTO: EL TAROT DEL ALMA: ¿CÓMO CALCULAR TU ARCANO PERSONAL O DE ALMA?Valutazione: 5 su 5 stelle5/5 (8)
- Fuerza de voluntad: Cómo practicar y dominar el autocontrolDa EverandFuerza de voluntad: Cómo practicar y dominar el autocontrolValutazione: 4.5 su 5 stelle4.5/5 (87)
- La curación de los chakras y el equilibrio energético: Mediante la atención plena, el yoga y el ayurvedaDa EverandLa curación de los chakras y el equilibrio energético: Mediante la atención plena, el yoga y el ayurvedaValutazione: 5 su 5 stelle5/5 (9)
- Cómo manifestar : Alinea tus objetivos con la alquimia del universoDa EverandCómo manifestar : Alinea tus objetivos con la alquimia del universoNessuna valutazione finora