Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Inhibidor Del Activador Del Plasminógeno Tipo 1 170216972005
Caricato da
Jorge MendozaCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Inhibidor Del Activador Del Plasminógeno Tipo 1 170216972005
Caricato da
Jorge MendozaCopyright:
Formati disponibili
Revista Latinoamericana de Hipertensin
ISSN: 1856-4550
latinoamericanadehipertension@gmail.com
Sociedad Latinoamericana de Hipertensin
Organismo Internacional
Ciszek, Ana; Bermdez, Valmore; Leal, Elliuz; Bermdez, Fernando; Cano, Raquel; Finol, Freddy;
Fara, Judith; Aparicio, Daniel; Acosta, Luis; Arraiz, Nailet; Rondn, Netxibeth; Reyes, Francia
Inhibidor del activador del plasmingeno tipo 1 (PAI-1) y su relacin con la aterosclerosis coronaria
Revista Latinoamericana de Hipertensin, vol. 2, nm. 5, septiembre-octubre, 2007, pp. 151-156
Sociedad Latinoamericana de Hipertensin
Caracas, Organismo Internacional
Disponible en: http://www.redalyc.org/articulo.oa?id=170216972005
Cmo citar el artculo
Nmero completo
Ms informacin del artculo
Pgina de la revista en redalyc.org
Sistema de Informacin Cientfica
Red de Revistas Cientficas de Amrica Latina, el Caribe, Espaa y Portugal
Proyecto acadmico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto
nhibidor del activador del plasmingeno tipo 1
(PAI-1) y su relacin con la aterosclerosis coronaria
Ana Ciszek, Valmore Bermdez, Elliuz Leal, Fernando Bermdez, Raquel Cano, Freddy Finol, Judith Faria, Daniel
Aparicio, Luis Acosta, Nailet Arraiz, Netxibeth Rondn, Francia Reyes.
Centro de Investigaciones Endocrino-Metablicas Dr. Flix Gmez.
Facultad de Medicina.
La Universidad del Zulia. Maracaibo-Venezuela
e-Mail: vbermudez@hotmail.com
Abstract
Resumen
151
La evaluacin del riesgo individual para
enfermedad cardiovascular esta cambiando en vista de la lista creciente de
factores de riesgo involucrados. En este marco, el inhibidor del activador del plasmingeno tipo-1(PAI-1)
es el principal inhibidor de la fibrinlisis, por lo que
altos niveles de ste pueden incrementar el riesgo
de enfermedad coronaria, ya que es bien conocido
que el PAI-1 contribuye a la formacin del trombo
y desarrollo del curso clnico de la enfermedad cardiovascular aguda y crnica.. El PAI-1 es miembro
de la superfamilia de inhibidores de proteinasas y su
nombre se debe a su capacidad de inhibir a los activadores del plasmingeno (PAs), incluyendo al tipo
tisular (t-PA) y al tipo uroquinasa (u-PA). Numerosas
serpinas han sido identificadas y caracterizadas, la
mayora de ellas son protenas que contienen un dominio conservado de entre 370 y 390 residuos.
Los niveles plasmticos de PAI-1 tienen una base de
regulacin gentica, pero, ms importante es su dependencia a una serie de factores de riesgo aterosclerticos como hipertriacilgliceridemia, diabetes e
insulinorresistencia. As, el incremento de los niveles
del PAI-1 pueden considerase un componente del
sndrome metablico. Los mecanismos de la sobreexpresion del PAI-1 en la obesidad son complejos y es
concebible que varios inductores estimulen al mismo
tiempo diversos sitios de sntesis. Interesantemente,
estudios recientes in vitro e in vivo han mostrado que
adems de su rol en la aterotrombosis, el PAI-1 esta
implicado en el desarrollo de tejido adiposo y el control de la sealizacin insulnica en adipocitos.
Palabras clave: Aterosclerosis, PAI-1, Factores de
riesgo, Infarto de miocardio, fibrinogeno.
Recibido: 20/07/2007
Aceptado: 23/08/2007
he cardiovascular disease risk evaluation in individual patients is challenging in light of the upward list of risk
factors. In this framework, plasminogen activator
inhibitor type 1 (PAI-1) is the main inhibitor of fibrinolysis, and high levels may increase the risk of
cardiovascular disease. PAI-1 is a member of the
serpin superfamily of proteinase inhibitors. Its name
pertains to its capacity to inhibit plasminogen activators (PAs), including tissue-type plasminogen activator (t-PA) and urokinase-type plasminogen activator
(u-PA). Their inhibition limits the dissolution of fibrin
by the fibrinolytic system in the blood. Numerous
serpins have been identified and characterized and
most of them are proteins containing a conserved
domain of between 370 and 390 residues. PAI-1 is
known to contribute to thrombus formation and to
the development and the clinical course of acute
and chronic cardiovascular diseases.
Plasma levels of PAI-1 are regulated on a genetic
basis but, more important, is the dependence on
a series of other atherosclerotic risk factors like hypertriglyceridemia, diabetes and insulin resistance.
Thus, increased PAI-1 level can be now considered
a component of the metabolic syndrome. The
mechanisms of PAI-1 overexpression during obesity are complex, and it is conceivable that several
inducers are involved at the same time at several
sites of synthesis. Interestingly, recent in vitro and
in vivo studies showed that besides its role in atherothrombosis, PAI-1 is also implicated in adipose
tissue development and in the control of insulin signaling in adipocytes.
Key words: Atherosclerosis, PAI-1, Risk factors,
Myocardial infarction, fibrinogen.
Introduccin
Revista Latinoamericana de Hipertensin. Vol. 2 N 5, 2007
a aterosclerosis en una enfermedad multifactorial compleja que involucra un dao
vascular repetitivo, acumulacin de lpidos, agregacin plaquetaria, formacin de depsitos de fibrina y migracin y proliferacin celular. Sus
complicaciones son la principal causa de muerte en
las sociedades industrializadas, presentndose por la
ruptura de la placa ateromatosa con la formacin
consecuente de trombos oclusivos que interrumpen
el flujo sanguneo a rganos como el miocardio y
el cerebro1. La formacin de trombos est mediada
por los elementos involucrados en la coagulacin y
la fibrinlisis, procesos que permiten la hemostasia.
Cuando el balance se pierde entre estos procesos,
favoreciendo a alguno de ellos, se producen alteraciones que se traducen en estados patolgicos.
Numerosos estudios han demostrado la aterosclerosis involucra un estado pro-trombtico mediado
por un desbalance en la hemostasia que favorece
la coagulacin y disminuye la fibrinlisis. De estos
estudios se ha derivado que los niveles plasmticos
de fibringeno constituyen un factor de riesgo para
infarto del miocardio2,3, al favorecer la trombosis y la
formacin de redes de fibrina en las lesiones aterosclerticas en desarrollo4. Para contrarrestar este
efecto, el organismo cuenta con una enzima degradadora de fibrina, la plasmina, la cual es formada a
partir de la proenzima inactiva plasmingeno mediante la accin de los activadores del plasmingeno
(PA), que pueden ser tipo-tisular (t-PA) y tipo-uroquinasa (u-PA). Los PAs son liberados por clulas en
respuesta a citoquinas producidas durante el remodelamiento tisular, inflamacin, y trombosis.
El principal inhibidor de los PA es el Inhibidor del
plasmingeno tipo 1 (PAI-1), por lo cual, una elevacin en sus concentracin se han asociado con
aumento en el riesgo de infarto de miocardio (IM), al
aumentar los depsitos de fibrina en la placa ateromatosa por inhibicin de su degradacin5,6. Estudios
han demostrado que el PAI-1 puede regular la migracin celular por mecanismos independientes de
la va de la fibrina7 y se ha relacionado con modificaciones en las caractersticas de los componentes
de la placa ateromatosa, afectando su estabilidad8.
Considerando estos efectos, el PAI-1 constituye un
factor de inters en el desarrollo de la aterosclerosis
y sus complicaciones.
El inhibidor del activador del plasmingeno:
Una serpina controversial
El inhibidor del activador del plasmingeno (PAI-1)
es una glicoprotena de 379 aminocidos con una
masa molecular de aproximadamente 54 kDa,9
miembro de la superfamilia serpina de inhibidores
de proteinasas. El nombre de esta familia (serpin)
proviene del ingls Serin proteinase inhibitor. La
accin de estos inhibidores como reguladores de la
actividad de enzimas proteolticas es fundamental
para el mantenimiento de la homeostasis. Numerosas serpinas han sido caracterizadas, y la mayora
son protenas de una sola cadena que contienen un
dominio conservado de 370-390 residuos. Entre los
miembros de esta familia tambin se encuentra por
ejemplo, la 1-antitripsina.
El PAI-1 es sintetizado por diferentes clulas que incluyen las clulas musculares lisas vasculares (VSMCs),
plaquetas, endotelio, hepatocitos, fibroblastos y
adipocitos, siendo las plaquetas las nicas que lo
almacenan en forma latente. El PAI-1 se encuentra
en la sangre asociado a la vitronectina, formando
un complejo con la misma a travs de su dominio
amino termimal, lo cual permite su estabilizacin
en estado funcional8,9,10. En condiciones fisiolgicas
acta a nivel del lumen y la pared vascular, reaccionando rpidamente con los PAs, tanto el tipo tisular
como el tipo uroquinasa, inhibindolos y limitando,
por consiguiente, la disolucin de la fibrina en los
cogulos por el sistema fibrinoltico8. El PAI-1 puede
encontrarse en tres formas funcionales: latente, activa y en complejos, con diferencias conformacinales
entre ellas. Otras tres molculas con actividad PAI se
han descrito: PAI-2, el cual posiblemente inhibe la
u-PA, PAI-3, conocida como inhibidor de la protena
C (para indicar su verdadera accin biolgica) y la
nexin-proteasa -110.
Regulacin de su expresin
La sntesis del PAI-1 est inducida por varios factores que afectan la transcripcin o la estabilidad del
ARNm. Varios de estos factores se citan en la Tabla
110. Los efectos de estos agonistas son especficos
para ciertas clulas. La supresin del PAI-1 ha sido
descrita ante ciertos compuestos como Interferon-,
xido ntrico, factores natriurticos y estatinas11,12,13.
Un factor interesante asociado a la expresin del
PAI-1 son los estrgenos, ya que los niveles de PAI1 son mayores en los hombres que en las mujeres, y
varios estudios sobre los efectos de los anticonceptivos orales y la terapia de reemplazo hormonal reportan disminucin del PAI-1 con la administracin
de estrgenos. Estos hallazgos podran relacionarse
con las diferencias en los perfiles de riesgo cardiovascular entre las mujeres premenopusicas y post
menopusicas9,14,15,16.
Tabla 1. Factores Estimulantes de la Expresin de PAI-1*
153
Factores
de Crecimiento
* Factor de crecimiento epidrmico (EGF)* Factor
de crecimiento fibroblstico (FGF)* Factor Estimulante de Colonias de Granulocitos y Macrfagos
(GMCSF)* Factor de crecimiento de hepatocitos*
Factor de crecimiento semejante a insulina (IGF)*
Factor Estimulante de Colonias de Macrfagos
(MCSF)* Factor de crecimiento derivado de plaquetas (PDGF)* Factores de crecimiento transformantes a y b (TGF-a y TGF-b)* Factor de Necrosis
Tumoral a (TNF-a)* Factor de crecimiento vascular
endotelial b (VEGF-b)
Elementos de la
Coagulacin
* Fragmentos de fibrina
* Trombina
* tPA
Elementos
Metablicos
* Glucosa
* Glucosamina
* Insulina
* LDL oxidadas
* Lp(a)
* Triacilglicridos
Hormonas
* Aldosterona
* Angiotensina
* Eritropoyetina
* Renina
Factores
Ambientales
* Hipoxia
* Radiaciones
* Modificado de Eddy, A. Plasminogen activator inhibitor-1 and the
kidney. Am J Physiol Renal Physiol. 2002;238(2):F209-F220.
Los estados de insulinoresistencia se han asociado
con niveles elevados de PAI-1, as como con alteraciones en los niveles de lpidos en plasma, lo cual
contribuye a explicar el estado protrombtico caracterstico de estas patologas. Disminucin en los
niveles de estos factores se han asociado con una
disminucin de los niveles de PAI-1, restaurando la
hemostasis normal8,9,10.
El sistema Renina-Angiotensina tambin se ha correlacionado con mayor expresin de PAI-1, por
consiguiente, la administracin de Inhibidores de la
Enzima Convertidota de Angiotensina (IECAS) e inhibidores de la aldosterona puede reducir los niveles
del mismo, disminuyendo el estado protrombtico
en pacientes hipertensos8.
Los niveles plasmticos de PAI-1 se han correlacionado
con la estructura de su gen (Cromosoma 7 -q21.3q22) y la presencia de alguno de los 8 polimorfismos
conocidos9. Este gen posee 9 exones y 8 intrones.
Niveles elevados de PAI-1 han sido encontrados
en una variante polimrfica en el nmero de bases
de guanina (4G en vez de 5G) en la posicin 675
corriente arriba del sitio de inicio de transcripcin.
El sitio 5G se une al E2F, una protena represora de
transcripcin, explicando la diferencia en la expresin
del gen10. Estudios han encontrado niveles elevados
de PAI-1 en homocigotos para el alelo 4G, siendo
an mayores en aquellos que presentaban diabetes
mellitus tipo 2, enfermedad coronaria e hipertriacil
gliceridemia9. La interaccin con los triacilglicridos
(TAG) se establece a nivel gentico, dado que existe
una regin de respuesta a los TAG adyacente al sitio
4G/5G17,18. Sin embargo, los estudios al respecto no
son concluyentes, quedando por establecerse con
mayor claridad la relacin entre el polimorfismo
gentico, la expresin y actividad del PAI-1, su
trascendencia clnica y la posibilidad de clasificar
estas diferencias genticas como factores de riesgo
para alguna patologa.
Por ltimo, algunos elementos inflamatorios como
Interleucinas 1 y 6, Factor de Necrosis Tumoral (TNF-), radicales libres de oxgeno y protena C
reactiva se han asociado con un aumento en la expresin de PAI-18.
Funciones del PAI-1 en la sangre y los tejidos
La degradacin de la fibrina en el sistema vascular
est mediada por la activacin del zimgeno
conocido como plasmingeno por accin del t-PA,
convirtindolo en plasmina. Esta proteasa de serina
es responsable de la disolucin de cogulos. El t-PA
es el PA predominante en la sangre y el u-PA es el
que predomina en los tejidos, siendo este ltimo
responsable de la activacin de metaloproteinasas
de la matriz (MMPs), como la colagenasa. El PAI1 inhibe al u-PA y al t-PA, formando un complejo
irreversible, que es consumido en el proceso10.
La inhibicin de la actividad del PA en plasma por
accin del PAI-1 es indispensable para mantener la
hemostasis y prevenir la aparicin de una ditesis
hemorrgica8. La accin del PAI-1 sobre el u-PA
disminuye la activacin de las MMPs, inhibiendo
la degradacin de matriz extracelular, as como la
accin de otras proteasas19.
El PAI-1 tambin afecta ciertos procesos celulares
por vas independientes de la inhibicin de los PAs.
Particularmente, modula la adhesin y migracin
celular y tiene un rol importante en los procesos de
inflamacin, cicatrizacin, angiognesis y metstasis
de clulas tumorales. Estas actividades involucran
una compleja interaccin entre PAI-1, vitronectina,
receptor del u-PA y ciertas integrinas, con diferentes
resultados dependiendo de la clula y la composicin
de su microambiente inmediato. Varios estudios
han descrito una accin promotora de la migracin
en clulas tumorales y una relacin positiva entre
el PAI-1 y la angiognesis, dado que al prevenir
la degradacin excesiva de la matriz extracelular
mantiene la base necesaria para la migracin de las
clulas endoteliales y la formacin del vaso10,20. Por
ltimo, algunos autores han descrito la inhibicin de
la migracin y proliferacin las clulas musculares
lisas vasculares (VSMCs) por parte del PAI-119,21,
inhibicin de la actividad de la Protena C,21, as
como una relacin inversa entre hipertensin y
niveles de PAI-122.
Asociacin del PAI-1 con la aterosclerosis y enfermedad coronaria
Desde hace ms de dos dcadas se sabe que niveles
elevados de PAI-1 en sangre constituyen un factor
Revista Latinoamericana de Hipertensin. Vol. 2 N 5, 2007
de riesgo para infarto de miocardio,6 al favorecer
la trombosis, la cual a su vez genera ms trombosis, dado que la trombina y otros componentes del
trombo son poderosos agonistas de la agregacin
plaquetaria y de la cascada de la coagulacin, inicindose y posteriormente, perpetundose un ambiente pro-trombtico local8,24.
La persistencia de la fibrina puede potenciar la fibrosis, la aterognesis y la trombosis arterial, as como,
aumentar la formacin de neontima en respuesta
al dao oxidativo. Painter y colaboradoresl25 demostraron que un aumento en el PAI-1 inactiva los mecanismos de defensa antitrombticos y resulta en el
desarrollo de trombos arteriales coronarios espontneos en ratones transgnicos. En el PHS (Physicians
Health Study) un aumento en la actividad del PAI-1
se asoci con aumentos en los eventos coronarios26.
As mismo, estudios recientes sugieren que la homocigocidad para el alelo 4G del gen del PAI-1 puede
ser un factor de riesgo independiente en el desarrollo de aterosclerosis y enfermedad cardiovascular27.
Otros estudios han demostrado aumentos en los niveles de ARNm de PAI-1 en vasos aterosclerticos,
los cuales se correlacionan con la severidad de la lesin aterosclertica6.
Evolucin de la placa ateromatosa vulnerable
La estabilidad de la placa ateromatosa es un punto
clave en el desarrollo de un evento coronario agudo,
dado que la ruptura de la misma es el evento desencadenante del trombo oclusivo. Dicha estabilidad
est determinada por los componentes de la placa
y su concentracin, de forma tal que el predominio
de uno u otro elemento harn la placa ms o menos estable. La American Heart Association (AHA)
desarroll una clasificacin para las placas basndose en estos aspectos28,17. Las placas que tienen un
ncleo lipdico separado del lumen vascular por una
capa gruesa de tejido fibroso, con alto contenido de
colgeno tipo I y VSMCs son capaces de soportar
un estrs elevado generado por fuerzas tensoras sin
romperse19. Las placas ms propensas a ruptura son
aquellas con predominio lipdico y bajo contenido
de VSMCs, cubiertas por capas fibrosas finas, siendo
estas las responsables de la mayora de los eventos
coronarios agudos21.
El PAI-1 disminuye la proliferacin y migracin de
VSMCs hacia la neontima produciendo un ateroma
relativamente carente de las mismas. Si consideramos que las VSMCs producen colgeno y elastina,
elementos que contribuyen a engrosar la capa fibrosa de la placa hacindola mas estable, altos niveles de PAI-1 generan placas con escaso contenido
fibrtico, aumentando la posibilidad de ruptura de
las mismas29,42. Adems, el aumento del PAI-1 puede
potenciar la formacin de la placa por sus efectos sobre el sistema fibrinoltico, al favorecer la persistencia
y propagacin de microtrombos, los cuales contienen
mitgenos que exacerban la aterotrombosis25.
Relacin con estados de insulino resistencia y el
sindrome metablico
La resistencia a la accin de la insulina, asociada o
no a diabetes tipo 2 (DM2), se ha asociado con alteraciones en la fibrinlisis sangunea debido a que
por un lado la hiperinsulinemia tiene un efecto estimulante sobre la expresin de PAI-1 y por el otro, a
que induce la aparicin de dislipidemias altamente
aterognicas, como la hipertriacilgliceridemia con
HDL bajas, LDL pequeas y densas y acumulacin
de remanentes. Mas an, tanto las LDL glucosiladas
como las oxidadas y la lipoprotena(a) [Lp(a)] pueden
inducir la sntesis de PAI-1 en clulas endoteliales.
Los cidos grasos libres (AGL) y los triglicridos, los
cuales se encuentran elevados en estados de insulinoresistencia, pueden aumentar la expresin y actividad de PAI-1, por lo que los niveles elevados de
PAI-1, con un desbalance de la hemostasia a favor
de la trombosis, forman parte del sndrome metablico.43 El impacto de la insulina sobre la expresin de
PAI-1 parece estar mediada por la estabilizacin de
su ARN-m, mediante la va de las MAPK44.
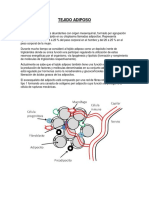
Por otra parte, aunque las plaquetas y las clulas endoteliales son la principal fuente de PAI-1, el tejido
adiposo tambin lo produce, por lo que la obesidad
contribuye a la aparicin de estados pro-trombticos
a un punto capaz de igualar o exceder la de otros
tejidos. Adems se ha demostrado que los niveles
del PAI-1 estn elevados en roedores y humanos
obesos. En adicin a esto, los niveles del inhibidor
del activador del plasmingeno-1 son regulados en
alta en el tejido adiposo por la accin del factor de
necrosis tumoral (TNF-), el factor de crecimiento
transformante (TGF-), angiotensina II, hiperinsulinemia e hipertriacilgliceridemia, de los cuales todos
son producidos en exceso en estados de obesidad e
insulinorresistencia45.
PAI-1 y restenosis
La restenosis y la respuesta vascular al dao reflejan la proliferacin de las VSMCs, mecanismo que
se encuentra inhibido por accin del PAI-1. Por consiguiente, podra establecerse que el PAI-1 constituye un elemento favorable al inhibir la restenosis. Sin
embargo, cuando existe dao vascular oxidativo hay
un aumento en la expresin de PAI-1 que favorece la formacin de neontima al proveer una base
de fibrina para la deposicin de tejido fibrtico y la
proliferacin de las VSMCs, favoreciendo por consiguiente la restenosis. Dado que la proliferacin de
los diversos tipos de clulas ms que un aumento en
la migracin es el proceso principal en la restenosis,
la limitacin de la migracin de las VSMCs por parte
del PAI-1 no contribuye a disminuir el proceso de
restenosis. Estas interpretaciones se correlacionan
con hallazgos de diferentes estudios en los que se
ha demostrado que en pacientes con DM2 sujetos
a intervenciones coronarias percutneas (una forma
de dao vascular), el PAI-1 se incrementa favore-
155
Conclusin
ciendo la restenosis. En segundo lugar, las lesiones restenticas en pacientes con diabetes son, de
forma caracterstica de contenido esclertico rico
en colgeno y no en VSMCs. Esto sugiere que un
proceso fibrtico acelerado es caracterstico de la
evolucin de las lesiones restenticas en pacientes
diabticos posterior a la angioplastia8.
Implicaciones clnicas
Al considerar al PAI-1 como uno de los factores causales en la evolucin de placas vulnerables cuando se
encuentra en concentraciones elevadas, sera ideal
poder disminuir su sobreexpresin para generar as
beneficios clnicos. Actualmente, esto se logra con
varios de los frmacos y modificaciones del estilo de
vida, utilizados en el manejo de pacientes con riesgo de padecer enfermedad arterial coronaria. Estos
incluyen drogas hipolipemiantes, como las estatinas
y los fibratos, las cuales al mejorar el perfil lipdico revierten los efectos de potenciacin que estos ejercen
sobre el PAI-1. Adems, varios estudios han descrito
a la disminucin del PAI-1 como un efecto pleiotrpico de las estatinas. La inhibicin del SRA por los IECAS, el aumento de la sensibilidad de la insulina con
tiazolidinedionas, dieta y ejercicio, y la disminucin
de la hiperinsulinemia compensatoria al mejorar los
niveles de glicemia con metformina y tiazolinedionas, son medidas que tienen un efecto antitrombognico al disminuir la expresin del PAI-1.8
El desarrollo de antagonistas especficos del PAI-1
podra proveer un alcance ms poderoso en la modulacin de la actividad del PAI-1, atenuando sus
efectos sobre el desarrollo de la aterosclerosis. Sin
embargo, es necesario considerar los riesgos tericos asociados con la generacin de inhibidores especficos de PAI-1, como el de facilitar la migracin
celular y lo consecuente metstasis de clulas tumorales ocultas, as como la aplicabilidad real y la relacin riesgo/beneficio generada por los mismos. A
pesar de estas condiciones, el estudio del PAI-1 y la
posibilidad de regularlo abre nuevas alternativas en
el manejo de pacientes con alto riesgo de padecer
enfermedad coronaria aguda.
Valor pronstico
Una disminucin en la actividad fibrinoltica se ha
asociado con reduccin en el riesgo de eventos asociados a enfermedad coronaria y la mortalidad por
las mismas. Sin embargo, el valor pronstico de las
variables es an controversial. Por un lado, estudios
han logrado correlacionar el PAI-1 como factor de
riesgo independiente para muerte post IM y recurrencia de eventos cardiovasculares, como se demostr
en el APSIS (Angina Prognosis Study in Stockholm)8.
Por otra parte, estudios han arrojado resultados
opuestos, probablemente porque los parmetros
fibrinolticos estn estrechamente relacionados con
otros factores de riesgo como insulinoresistencia y
marcadores de inflamacin. El ajuste de estas variables podra reducir el valor pronstico del PAI-1.
l sistema fibrinoltico endgeno est representado por el equilibrio entre los
activadores del plasmingeno (principalmente el de tipo tisular) y los inhibidores de dichos
activadores (como el inhibidor del activador del plasmingeno-1). Debido a que siempre se lleva a cabo;
de forma continua y en bajo grado; el proceso de
la coagulacin, la actividad fibrinoltica es necesaria
para mantener la fluidez de la sangre. Una inhibicin
excesiva de la fibrinlisis llevara a la coagulacin y
trombosis, procesos necesarios para la aparicin de
un evento cardiovascular46. Muchos clnicos que trabajan en el campo de la trombosis se muestran escpticos acerca del efecto individual de las protenas
del sistema de coagulacin o fibrinoltico como causa de enfermedad vascular ateromatosa y trombosis.
No obstante, actualmente es razonable considerar al
PAI-1 como uno de los factores que contribuyen en
la interaccin del complejo gentico/ambiental relacionado con la formacin y disolucin del trombo.
La mayora de los pacientes con infarto al miocardio
tienen una historia familiar de enfermedad arterial
coronaria, son obesos, muchos de ellos tienen diabetes y dislipidemia, fuman y son sedentarios, por lo
que cualquier teora de enfermedad aterosclertica
debe tomar en cuenta todos estos factores para ser
biolgicamente plausible. Las relaciones entre el gen
del PAI-1 y estos factores de riesgo clsicos ayudan a
explicar algunas de las asociaciones reportadas entre
la insulinorresistencia y el riesgo de trombosis27.
Fig. 1. Accin del Inhibidor del Activador del Plasmingeno
(PAI-1) en la fibrinlisis.
tPA activador tisular del plasmingeno
Revista Latinoamericana de Hipertensin. Vol. 2 N 5, 2007
Referencias
1. Hansson, G. Inflammation, Atherosclerosis, and Coronary Artery Disease. N
Engl J Med. 2005;352:1685-95
2. Wilhelmsen L, Svardsudd K, Korsan-Bengtsen K, Larsson B, Welin L, Tibblin
G. Fibrinogen as a risk factor for stroke and myocardial infarction. N Engl J
Med. 1984;311:501-505
3. Hankey, G. Potential New Risk Factors for Ischemic Stroke: What Is Their
Potential?. Stroke. 2006;37:2181-2188
4. Fibrinogen Studies Collaboration. Plasma Fibrinogen Level and the Risk of
Major Cardiovascular Diseases and Nonvascular Mortality. An Individual Participant Meta-analysis. JAMA. 2005;294:1799-1809
5. Loskutoff DJ. A slice of PAI. J Clin Invest. 1993;92:2563
6. Hamsten, A. De Faire, U. Walldius, G. Dahlen, G. Szamosi, A. Landou, C.
Blombck, M. Wiman, B. Plasminogen activator inhibitor in plasma: risk factor for recurrent myocardial infarction. Lancet. 1987;2:39
7. Eitzman, D. Westrick, R. Xu, Z. Tyson, J. Ginsburg, D. Plasminogen activator inhibitor-1 deficiency protects against atherosclerosis progression in the
mouse carotid artery. Blood.2000;96(13):4212-4215
8. Sobel, B. Taatjes, D. Schneider, D. Intramural Plasminogen Activator Inhibitor Type-1 and Coronary Atherosclerosis. Arteriosclerosis, Thrombosis, and
Vascular Biology. 2003;23:1979
pertension and Vascular Fibrosis in Response to Long-term Nitric Oxide Synthase Inhibition. Circulation. 2001;104: 839 844
24. Feinbloom, D. Bauer, K. Assessment of Hemostatic Risk Factors in Predicting Arterial Thrombotic Events. Arterioscler. Thromb. Vasc. Biol. 2005;25;2043-2053
25. Painter, E. et al. Age-dependent spontaneous coronary arterial thrombosis
in transgenic mice that express a stable form of human plasminogen activator inhibitor-1. Circulation. 2002; 106: 491496.
26. Ridker, PM. Vaughan, DE. Stampfer,
MJ. Manson, JE. Hennekens, CH.
Endogenous tissue-type plasminogen activator and risk of myocardial infarction. Lancet. 1993;341:11651168.
27. Kohler, HP and Grant, PJ. Plasminogen-activator inhibitor type 1and coronary
artery disease. N Engl J Med. 2000;342: 1792-1801.
28. Stary, HC. Chandler, AB. Dinsmore, RE. Fuster, V. Glagov, S. Insull, W.
Rosenfeld, ME. Schwartz, CJ. Wagner, WD. Wissler, RW. A definition of
advanced types of atherosclerotic lesions and a histological classification
of atherosclerosis: a report from the Committee on Vascular Lesions of
the Council on Atherosclerosis, American Heart Association. Circulation.
1995;92:1355-1374
29. Davies, MJ. Richardson, PD. Woolf, N. Kratz, DR. Mann, J. Risk of thrombosis in human atherosclerotic plaques: role of extracellular lipid, macrophage,
and smooth muscle content. Br Heart J. 1993; 69: 37738.
30. Falk, E. Shah, PK. Fuster, V. Coronary plaque disruption. Circulation. 1995;
92: 657671.
9. Cesari, M. Rossi, G. Plasminogen Activator Inhibitor Type 1 in Ischemic Cardiomyopathy. Arterioscler. Thromb. Vasc. Biol. 1999;19:1378 1386
31. Davies, MJ. Woolf, N. Rowles, P. Richardson, PD. Lipid and cellular constituents of unstable human aortic plaques. Basic Res Cardiol. 1994;89:3339.
10. Eddy, A. Plasminogen activator inhibitor-1 and the kidney. Am J Physiol Renal Physiol. 2002;238(2):F209-F220
32. Lendon, CL. Davies, MJ. Born, GVR. Richardson, PD. Atherosclerotic plaque
caps are locally weakened when macrophage density is increased. Atherosclerosis. 1991;87:8790.
11. Bouchie, JL. Hansen, H. Feener, EP. Natriuretic factors and nitric oxide
suppress plasminogen activator inhibitor-1 expression in vascular smooth
muscle cells. Role of cGMP in the regulation of the plasminogen system.
Arterioscler Thromb Vasc Biol. 1998;18: 1771-1779
12. Essig, M. Vrtovsnik, F. Nguyen, G. Sraer, JD. Friedlander, G. Lovastatin modulates in vivo and in vitro the plasminogen activator/plasmin system of rat
proximal tubular cells: role of geranylgeranylation and Rho proteins. J Am
Soc Nephrol. 1998;9:1377-1388.
13. Gallicchio, M. Hufnagl, P. Wojta, J. Tipping, P. IFN-gamma inhibits
thrombin- and endotoxin-induced plasminogen activator inhibitor type
1in human endothelial cells. J Immunol. 1996;157: 2610-2617.
33. Davies, MJ. Woolf, N. Katz, DR. The
role of endothelial denudation injury,
plaque fissuring and thrombosis in the progression of human atherosclerosis. Atheroscler Rev. 1991;23:105113.
34. Davies, MJ. A macro and micro view of coronary vascular insult in ischemic
heart disease. Circulation. 1990;80(II):II-38II-46.
35. Llorente-Corts, V. Badimon, L. LDL ReceptorRelated Protein and the Vascular Wall: Implications for Atherothrombosis. Arterioscler. Thromb. Vasc.
Biol. 2005;25;497-504
14. Winkler, UH. Effects of androgens on haemostasis. Maturitas. 1996;24:147155.
36. Richardson, PD. Davies, MJ. Born, GVR. Influence of plaque configuration
and stress distribution on fissuring of the coronary atherosclerotic plaques.
Lancet. 1989;2:941944.
15. Gebara, O. Mittleman, MA. Sutherland, P. Lipinska, I. Matheney, T. Xu, P.
Welty, FK. Wilson, P. Levy, D. Muller, JE. Tofler, GH. Association between
increased estrogen status and increased fibrinolytic potential in the Framingham Offspring Study. Circulation. 1995;91:19521958.
37. Cheng, GC. Loree, HM. Kamm, RD. Fishbein, MC. Lee, RT. Distribution of
circumferential mechanical stress in ruptured and stable atherosclerotic lesions: a structural analysis with histopathological correlation. Circulation.
1993; 87:11791187.
16. Scarabin, PY. Plu-Bureau, G. Zitoun, D. Bara, L. Guize, L. Samama, MM.
Changes in haemostatic variables induced by oral contraceptives containing
50 micrograms or 30 micrograms of estrogen: absence of dose-dependent
effect on PAI-1 activity. Thromb Haemost. 1995;74:928932
38. Gertz, SD. Roberts, WC. Hemodynamic shear force in rupture of coronary
arterial atherosclerotic plaques. Am J Cardiol. 1990;66:168-172.
17. Panahloo, A. Mohamed-Ali, V. Lane, A. Green, F. Humphries, SE. Yudkin, JS.
Determinants of plasminogen activator inhibitor 1 activity in treated NIDDM
and its relation to a polymorphism in the plasminogen activator inhibitor 1
gene. Diabetes. 1995; 44: 3742.
40. Loree, HM. Kamm, RD. Stringfellow, RG. Lee, RT. Effects of fibrous cap
thickness on peak circumferential stress in model atherosclerotic vessels.
Circ Res. 1992;71:850858.
18. Eriksson, P. Nilsson, L. Karpe, F. Hamsten, A. Very-low-density lipoprotein
response element in the promoter region of the human plasminogen activator inhibitor-1 gene implicated in the impaired fibrinolysis of hypertriglyceridemia. Arterioscler Thromb Vasc Biol. 1998; 18: 2026.
19. Davies, MJ. Stability and instability: two faces of coronary atherosclerosis:
the Paul Dudley White Lecture 1995. Circulation. 1996; 94: 20132020
20. Pepper, M. Role of the Matrix Metalloproteinase and Plasminogen ActivatorPlasmin Systems in Angiogenesis. Arterioscler. Thromb. Vasc. Biol., Jul
2001; 21: 1104 - 1117
21. Fay, W. Garg, N. Sunkar, M. Vascular Functions of the Plasminogen Activation System. Arterioscler Thromb Vasc Biol. 2007;27:1231-1237
22. Rezaie, AR. Vitronectin functions as a cofactor for rapid inhibition of activated protein C by plasminogen activator inhibitor-1: implications for the
mechanism of profibrinolytic action of activated protein C. J Biol Chem.
2001; 276: 1556715570
23. Kaikita, K. et al. Plasminogen Activator Inhibitor-1 Deficiency Prevents Hy-
39. Vito, RP. Whang, MC. Giddens, DP. Zarins, CK. Glagov, S. Stress analysis of the
diseased arterial cross-section. ASME Adv Bioeng Proc. 1990;19:273278.
41. Benditt, EP. Benditt, JM. Evidence for a monoclonal origin of human atherosclerotic plaques. Proc Natl Acad Sci U S A. 1973;70:17531756
42. Murry, C. Gipaya, C. Bartosek, T. Benditt, E. Schwartz, S. Monoclonality of
smooth muscle cells in human atherosclerosis. Am J Pathol. 1997;151:697
705.
43. Alessi, M. Juhan-Vague, I. PAI-1 and the Metabolic Syndrome: Links, Causes,
and Consequences. Arterioscler. Thromb. Vasc. Biol. 2006;26;2200-2207
44. Fattal, PG. Schneider, DJ. Sobel, BE. Billadello, JJ. Post-transcriptional regulation of expression of plasminogen activator inhibitor type 1 mRNA by insulin
and insulin-like growth factor 1. J Biol Chem. 1992; 267:1241212415.
45. Lau, D. Dhillon, B. Yan, H. Szmitko, P. Verma, S. Adipokines: molecular links
between obesity and atheroslcerosis. Am J Physiol Heart Circ Physiol. 2005;
288: H2031H2041
46. Fonseca, V. Desouza, C. Asnani, S. Jialal, I. Nontraditional Risk Factors for
Cardiovascular Disease in Diabetes. Endocrine Reviews. 2004;25:153175
Potrebbero piacerti anche
- Reporte de La Pelicula Nosotros Los NoblesDocumento13 pagineReporte de La Pelicula Nosotros Los NoblesMalinally GuerreroNessuna valutazione finora
- Esquema ONUDocumento1 paginaEsquema ONULuis Dvd PncHcls80% (5)
- Definicion de Vacios en El Conocimiento y AportacionesDocumento4 pagineDefinicion de Vacios en El Conocimiento y AportacionesYinaris Sanchez DiazNessuna valutazione finora
- Moléculas Que Influyen en La ObesidadDocumento4 pagineMoléculas Que Influyen en La ObesidadMirella MendozaNessuna valutazione finora
- 1 Revisión AdipocitoquinasDocumento26 pagine1 Revisión AdipocitoquinasPalo morNessuna valutazione finora
- SX MetabolicoDocumento29 pagineSX MetabolicoJeremy ChonilloNessuna valutazione finora
- Asociacion Entre El Sistema IGF y PAPP-A en AteroeDocumento9 pagineAsociacion Entre El Sistema IGF y PAPP-A en Ateroedesconocido 123 ambticonNessuna valutazione finora
- Enfermedad Hipertensiva Del EmbarazoDocumento27 pagineEnfermedad Hipertensiva Del EmbarazoGARDY LIZETT GONZALES PINTONessuna valutazione finora
- HT GestacionalDocumento16 pagineHT GestacionalJose luisNessuna valutazione finora
- Adipocitos, Obesidad Visceral, Inflamación y EnfermedadDocumento7 pagineAdipocitos, Obesidad Visceral, Inflamación y EnfermedadAna Gariza SolanoNessuna valutazione finora
- 2 - EndotelioDocumento29 pagine2 - EndotelioMarcelo De SimoneNessuna valutazione finora
- Tarea Sem 14Documento2 pagineTarea Sem 14Carmen Rios BermudoNessuna valutazione finora
- Las Adipocinas y Su Importancia en El EnvejecimientoDocumento5 pagineLas Adipocinas y Su Importancia en El EnvejecimientoGian Carlos Chafloque GuzmanNessuna valutazione finora
- Fisiologia Del Tejido Adiposo LipidosDocumento10 pagineFisiologia Del Tejido Adiposo LipidosStefany TorresNessuna valutazione finora
- Síndrome Antifosfolípidos PARA PPT MELISSADocumento11 pagineSíndrome Antifosfolípidos PARA PPT MELISSAMelissa Midori Altamirano Reategui De ReynosoNessuna valutazione finora
- Nefropatia DiabeticaDocumento9 pagineNefropatia DiabeticaKira KouNessuna valutazione finora
- Síndrome MetabolicoDocumento12 pagineSíndrome MetabolicoAzul PMNessuna valutazione finora
- Hta Embarazo 231204 181916Documento18 pagineHta Embarazo 231204 181916José María SilveyraNessuna valutazione finora
- Respuesta Inflamatoria Metabolismo Del Colesterol y ArteriosclerosisDocumento5 pagineRespuesta Inflamatoria Metabolismo Del Colesterol y Arteriosclerosisbelorofonte7Nessuna valutazione finora
- ObesidadDocumento26 pagineObesidadFernando VeraNessuna valutazione finora
- PreclamsiaDocumento18 paginePreclamsiaNaxhieDomínguezNessuna valutazione finora
- Función de Las Células Endoteliales en La Formación de Sustancias AnticoagulantesDocumento41 pagineFunción de Las Células Endoteliales en La Formación de Sustancias AnticoagulantesNataly Kassandra Lopez YarlequeNessuna valutazione finora
- 40 B. SafDocumento41 pagine40 B. Safgapupa19Nessuna valutazione finora
- Factores y Mecanismos Que Conllevan A La Activacion Del Inflamasoma NLRP3Documento9 pagineFactores y Mecanismos Que Conllevan A La Activacion Del Inflamasoma NLRP3Neider Dabid Canoles SamboniNessuna valutazione finora
- Manejo Anestésico de Paciente Obstétrica%2Documento6 pagineManejo Anestésico de Paciente Obstétrica%2freddygggNessuna valutazione finora
- Tejido AdiposoDocumento7 pagineTejido AdiposoJulinho M LeOnNessuna valutazione finora
- Endotelio y Aterogénesis - Cardiopatía IsquémicaDocumento7 pagineEndotelio y Aterogénesis - Cardiopatía IsquémicaFacundo MadariagaNessuna valutazione finora
- AdipocitocinasDocumento8 pagineAdipocitocinasCuenta GoogleNessuna valutazione finora
- Consenso Fasgo 2017 Hipertension y EmbarazoDocumento21 pagineConsenso Fasgo 2017 Hipertension y EmbarazoFranklin Vasquez BurgosNessuna valutazione finora
- Aterogenesis y Diabetes-IR e Hiperinsulinemia CompensatoriaDocumento5 pagineAterogenesis y Diabetes-IR e Hiperinsulinemia CompensatoriaEleana De La HozNessuna valutazione finora
- Tejido Adiposo Como Organo Endocrino PDFDocumento9 pagineTejido Adiposo Como Organo Endocrino PDFManuel GonzalezNessuna valutazione finora
- SafDocumento8 pagineSafErick CisnerosNessuna valutazione finora
- Alimentos Ricos en Procianidinas, Alimentación Funcional para Prevenir La Aparición de Síndrome MetabólicoDocumento11 pagineAlimentos Ricos en Procianidinas, Alimentación Funcional para Prevenir La Aparición de Síndrome MetabólicoJohnyOrellanaRuizNessuna valutazione finora
- G 8 Cap 14Documento14 pagineG 8 Cap 14Katherine SosaNessuna valutazione finora
- Revision Sobre Pancreatitis AgudaDocumento18 pagineRevision Sobre Pancreatitis Agudaluis enrique fonseca wilsonNessuna valutazione finora
- Sindrome MetabolicoDocumento27 pagineSindrome MetabolicoCh RoNessuna valutazione finora
- Exámenes AuxiliaresDocumento6 pagineExámenes AuxiliaresVictoria María Lopez MartinelliNessuna valutazione finora
- Bases Farmacológicas y Tratamiento de La InflamaciónDocumento50 pagineBases Farmacológicas y Tratamiento de La InflamaciónShabelNessuna valutazione finora
- Tejido Adiposo, Función de Las Adipoquinas en La ObesidadDocumento1 paginaTejido Adiposo, Función de Las Adipoquinas en La ObesidadvaleriaNessuna valutazione finora
- Como Manejar Al Gato Con Pancreatitis AgudaDocumento7 pagineComo Manejar Al Gato Con Pancreatitis Agudaherediaruben1896Nessuna valutazione finora
- Modulo04 SAFDocumento34 pagineModulo04 SAFEduardo BussoNessuna valutazione finora
- Enfermedades CardiovascularesDocumento3 pagineEnfermedades CardiovascularesAnita LozanoNessuna valutazione finora
- Tratamiento de La InflamacionDocumento50 pagineTratamiento de La InflamacionMiguel Angel Vereau GutiérrezNessuna valutazione finora
- Placenta FilatovDocumento2 paginePlacenta FilatovMartin Ramos AlvaradoNessuna valutazione finora
- Esteatosis HepáticaDocumento8 pagineEsteatosis HepáticaFernanda Reyes100% (1)
- Fisiopatología de La Hipertensión ArterialDocumento5 pagineFisiopatología de La Hipertensión ArterialErnesto GomezNessuna valutazione finora
- Sindrome Activacion MacrofagicaDocumento8 pagineSindrome Activacion MacrofagicaPaula Alicia Toribio RodriguezNessuna valutazione finora
- AdipocitoquinasDocumento19 pagineAdipocitoquinasLidia RamirezNessuna valutazione finora
- Sistema RAADocumento10 pagineSistema RAAMarian Vera HNessuna valutazione finora
- Insulinoresistencia e Hiperinsulinema Como Factores de Riesgo para Enfermedad CardiovascularDocumento11 pagineInsulinoresistencia e Hiperinsulinema Como Factores de Riesgo para Enfermedad CardiovascularRoberto Alejandro Munoz MendozaNessuna valutazione finora
- Metabolismo de LípidosDocumento9 pagineMetabolismo de LípidosJuliana CorderoNessuna valutazione finora
- Tarea de La Semana 14Documento2 pagineTarea de La Semana 14Christian Gianfranco Cartagena VelaNessuna valutazione finora
- Preeclampsia y Su Patologia DesarrolladaDocumento4 paginePreeclampsia y Su Patologia DesarrolladaEder Uziel VillaNessuna valutazione finora
- PlantillaControlLectura Congresoponencia1Documento3 paginePlantillaControlLectura Congresoponencia1RUSBEL MARTINEZ GOMEZNessuna valutazione finora
- Artritis ReumtoideaDocumento6 pagineArtritis ReumtoidealasaldereneNessuna valutazione finora
- Factores de Riesgo de AteroesclerosisDocumento3 pagineFactores de Riesgo de AteroesclerosisJknow StoneNessuna valutazione finora
- Perio y Enf CardioDocumento31 paginePerio y Enf CardioKatherine UlloaNessuna valutazione finora
- Reb 152 CDocumento10 pagineReb 152 CAmerica VillabonaNessuna valutazione finora
- Estudio Higado Graso y Ursotec ForteDocumento12 pagineEstudio Higado Graso y Ursotec ForteHarold83Nessuna valutazione finora
- Definición de DiabetesDocumento6 pagineDefinición de DiabetesPily Claros OsorioNessuna valutazione finora
- Hipertensión Pulmonar Arterial: (Ascitis) En Pollos De EngordaDa EverandHipertensión Pulmonar Arterial: (Ascitis) En Pollos De EngordaNessuna valutazione finora
- BullyingDocumento28 pagineBullyingJorge MendozaNessuna valutazione finora
- El Bullying MonografiasDocumento11 pagineEl Bullying MonografiasJorge MendozaNessuna valutazione finora
- Cómo Realizar Una Prueba de Glucosa de SangreDocumento7 pagineCómo Realizar Una Prueba de Glucosa de SangreJorge MendozaNessuna valutazione finora
- Tranvia Llamado DeseoDocumento3 pagineTranvia Llamado DeseoCindy Del Salto ViteryNessuna valutazione finora
- Adrenalectomía Laparoscópica PeruDocumento11 pagineAdrenalectomía Laparoscópica PeruJorge MendozaNessuna valutazione finora
- APUNTE Vacunas y AntisuerosDocumento13 pagineAPUNTE Vacunas y AntisueroslauraNessuna valutazione finora
- LipoproteínaDocumento9 pagineLipoproteínaJorge MendozaNessuna valutazione finora
- Acoso EscolarDocumento12 pagineAcoso EscolarJorge MendozaNessuna valutazione finora
- Posibles Errores en Las Mediciones de GlucosaDocumento4 paginePosibles Errores en Las Mediciones de GlucosaJorge MendozaNessuna valutazione finora
- Glucogeno DegradacionDocumento22 pagineGlucogeno DegradacionLudwin FerneyNessuna valutazione finora
- Las Diferencias Entre Las Catecolaminas y CortisolDocumento2 pagineLas Diferencias Entre Las Catecolaminas y CortisolJorge MendozaNessuna valutazione finora
- Relación Entre La Proteína C Reactiva Ultrasensible y El Síndrome Metabólico 13089501 - S300 - EsDocumento7 pagineRelación Entre La Proteína C Reactiva Ultrasensible y El Síndrome Metabólico 13089501 - S300 - EsJorge MendozaNessuna valutazione finora
- Articulo BotoxDocumento4 pagineArticulo BotoxViolet Leon Gomez100% (1)
- 4-Precauciones Estandar y Especificas IDocumento42 pagine4-Precauciones Estandar y Especificas ISebastian Andres Fernando C. Gomez50% (2)
- Ensayo Sobre La Problemática Social Dominicana.Documento7 pagineEnsayo Sobre La Problemática Social Dominicana.Carolina VenturaNessuna valutazione finora
- Requerimientos Nutricionales EnergiaDocumento61 pagineRequerimientos Nutricionales EnergiaDayana Camargo GarcìaNessuna valutazione finora
- Universidad Privada Domingo Savio Facultad de Ciencias EmpresarialesDocumento26 pagineUniversidad Privada Domingo Savio Facultad de Ciencias EmpresarialesArthur CespedesNessuna valutazione finora
- Osteogenesis Imperfecta Enf Legg CalvesDocumento48 pagineOsteogenesis Imperfecta Enf Legg CalvesJuan JiNessuna valutazione finora
- Dental BiomagnetismoDocumento5 pagineDental BiomagnetismoRafael MedinaNessuna valutazione finora
- Del Acompañamiento Terapéutico y El Acompañamiento SubjetivoDocumento6 pagineDel Acompañamiento Terapéutico y El Acompañamiento SubjetivoNatalyScarletMaturanaTortellaNessuna valutazione finora
- Auditoria Ambiental Rastro Municipal de TepicDocumento48 pagineAuditoria Ambiental Rastro Municipal de TepicMajo Rubio RNessuna valutazione finora
- Ud 6 Las Muestras de Sangre GMBDocumento89 pagineUd 6 Las Muestras de Sangre GMBMiguelNessuna valutazione finora
- Acp PaiDocumento5 pagineAcp PaiELIZABETH PALACIOS ROJASNessuna valutazione finora
- Sig-Prev-1746 Rev06 24-06-2021 Sci Chile SaDocumento88 pagineSig-Prev-1746 Rev06 24-06-2021 Sci Chile SaMarco BustosNessuna valutazione finora
- Pauta Guia Sesiones VincularesDocumento7 paginePauta Guia Sesiones VincularespatriciariquelmevenegasNessuna valutazione finora
- Psicología AeronaúticaDocumento18 paginePsicología AeronaúticaRenzo Alonso RaimondiNessuna valutazione finora
- Tercera SemanaDocumento26 pagineTercera SemanaJarley AndreeNessuna valutazione finora
- AIC - 2019 - Primer Examen - ClaveDocumento4 pagineAIC - 2019 - Primer Examen - Clavepedro pabloNessuna valutazione finora
- Informe PM10 y PM2.5Documento23 pagineInforme PM10 y PM2.5Ariana PierolaNessuna valutazione finora
- Allium Cepa L.Documento9 pagineAllium Cepa L.Georgina M.L.Nessuna valutazione finora
- Programa de Higiene Seguridad IndustrialDocumento69 paginePrograma de Higiene Seguridad IndustrialJhoana A. FicarraNessuna valutazione finora
- Dosier MaquillajeDocumento30 pagineDosier Maquillajeainharamejia224Nessuna valutazione finora
- Sepsisy Shocksptico Actualizacion 2023Documento73 pagineSepsisy Shocksptico Actualizacion 2023andres ruizNessuna valutazione finora
- Guía SexualidadDocumento3 pagineGuía SexualidadVinet PauNessuna valutazione finora
- Programa de Educación de La AfectividadDocumento3 paginePrograma de Educación de La AfectividadJuan Carlos Pérez PérezNessuna valutazione finora
- ANTIBIOTICOS AmbrizDocumento6 pagineANTIBIOTICOS AmbrizHelio M. Ambriz DelgadilloNessuna valutazione finora
- PETS-35 MinicargadorDocumento2 paginePETS-35 MinicargadorOscar CorreaNessuna valutazione finora
- Acuerdo Inasistencias Policias 180920Documento44 pagineAcuerdo Inasistencias Policias 180920guerrera8523Nessuna valutazione finora
- Síntesis - Empresa Don ManuelDocumento8 pagineSíntesis - Empresa Don ManuelPablo BravoNessuna valutazione finora
- Bolcan Vol 11 n4. Alteracion de La FR y FarmacoterapiaDocumento9 pagineBolcan Vol 11 n4. Alteracion de La FR y FarmacoterapiaIzaak AraujoNessuna valutazione finora