Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Ley de Charles
Caricato da
kathasujuelfCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Ley de Charles
Caricato da
kathasujuelfCopyright:
Formati disponibili
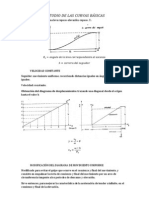
LEY DE BOYLE
I.
OBJETIVOS
Determinar experimentalmente la relacin existente entre la presin y
la temperatura a volumen constante.
II.
FUNDAMENTO TERICO
La ley de Charles es una de las leyes de los gases. Relaciona el volumen y
la temperatura de una cierta cantidad de gas ideal, mantenida a una presinconstante,
mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presin
constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la
temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura est
directamente relacionada con la energa cintica debido al movimiento de las molculas
del gas. As que, para cierta cantidad de gas a una presin dada, a mayor velocidad de
las molculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero haca referencia al trabajo
no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea
usualmente atribuida a Charles. La relacin haba sido anticipada anteriormente en los
trabajos de Guillaume Amontons en 1702.
Por
otro
lado,
Gay-Lussac
relacion
la
presin
la
temperatura
como magnitudes directamente proporcionales en la llamada segunda ley de GayLussac.
Volumen sobre temperatura: Constante (K -en referencia a si mismo)
o tambin:
donde:
V es el volumen.
T es la temperatura absoluta (es decir, medida en Kelvin).
k2 es la constante de proporcionalidad.
Adems puede expresarse como:
donde:
= Volumen inicial
= Temperatura inicial
= Volumen final
= Temperatura final
Despejando T se obtiene:
Despejando T se obtiene:
Despejando V es igual a:
Despejando V se obtiene:
Un buen experimento para demostrar esta ley es el de calentar una lata con
un poco de agua, al hervir el agua se sumerge en agua fra y su volumen
cambia.
III.
MATERIALES
IV.
Quad temperatura sensor : pasport
Relative pressure sensor: pasport
Termostato, calentador
Contenedor de volumen
Adquisidor de datos : Powerlink
PROCEDIMIENTO EXPERIMENTAL
1. Prender el termostato y esperar a que caliente el liquido
2. Colocar sensor de temperatura en el termostato y medir las
temperaturas
V.
RESULTADOS
LEY DE BOYLE (60 ml)
12
10
8
PRESION KPa
6
4
2
0
30
35
40
45
TEMPERATURA C
VOLUME
N
50
48
46
44
42
40
Valores
38
X
36
20
32
18
16
14
12
10
8
VI.
PRESI
N
96
100
102
105
107
110
Valores
112
Y
96
98
103
108
114
119
125
CONCLUCIONES
El volumen es inversamente proporcional a la presin:
Si la presin aumenta, el volumen disminuye.
Si la presin disminuye, el volumen aumenta.
Porque?
50
55
Al aumentar el volumen, las partculas (tomos o molculas) del gas tardan
ms en llegar a las paredes del recipiente y por lo tanto chocan menos veces
por unidad de tiempo contra ellas. Esto significa que la presin ser menor
ya que sta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las
partculas es menor y por tanto se producen ms choques en cada unidad de
tiempo: aumenta la presin.
Lo que Boyle descubri es que si la cantidad de gas y la temperatura
permanecen constantes, el producto de la presin por el volumen siempre
tiene el mismo valor.
VII.
RECOMENDACIONES
Para mejores resultados asegurarse que el sistema no tenga fuga de
aire para tener un bajo margen de error
Debe desplazar cuasiestticamente (muy lentamente) el pistn de la
jeringa y espere unos 5 segundos antes de desplazar a la otra unidad
de volumen, ya que podra afectar las condiciones de estabilidad del
sistema.
VIII.
IMGENES
IX.
BIBLIOGRAFIA
http://www.educaplus.org/gases/ley_boyle.html
http://servicios.encb.ipn.mx/polilibros/fisicoquimica/gases/Ley
%20Boyle.htm
Potrebbero piacerti anche
- Practica 1 Quimica AplicadaDocumento12 paginePractica 1 Quimica AplicadaPepe SolarNessuna valutazione finora
- Práctica 5-LAB TERMO EQ Ley de CharlesDocumento23 paginePráctica 5-LAB TERMO EQ Ley de CharlessentinelghostxpNessuna valutazione finora
- Practica 1Documento14 paginePractica 1alanntorres09ctrlNessuna valutazione finora
- Apunte de Arcoiris 2 - StudyWithArt (1) (Autoguardado)Documento5 pagineApunte de Arcoiris 2 - StudyWithArt (1) (Autoguardado)Montserrat Abril Soza VictoriaNessuna valutazione finora
- Práctico Ley de CharlesDocumento6 paginePráctico Ley de Charlesanalaura.englishNessuna valutazione finora
- REporte de QuimicaDocumento15 pagineREporte de Quimicaalanntorres09ctrlNessuna valutazione finora
- Ley de CharlesDocumento5 pagineLey de CharlesCejb Circulo de EstudiosNessuna valutazione finora
- CarrilloOrtiz DeliaEdith M12S4 ProyectoIntegradorDocumento10 pagineCarrilloOrtiz DeliaEdith M12S4 ProyectoIntegradorJimmy HDNessuna valutazione finora
- Informe Grupo 4Documento6 pagineInforme Grupo 4フェルディナンド 壁Nessuna valutazione finora
- La Lata Que Se Comprime :)Documento3 pagineLa Lata Que Se Comprime :)Uriel Hernandez80% (5)
- Protocolo 5 Ley de CharlesDocumento3 pagineProtocolo 5 Ley de CharlesPerla ZazilNessuna valutazione finora
- Informe LaboratorioDocumento14 pagineInforme LaboratorioVelazco Cano JonnathanNessuna valutazione finora
- Práctica de Laboratorio No 2 Ley de CharlesDocumento6 paginePráctica de Laboratorio No 2 Ley de Charlesmaria perezNessuna valutazione finora
- Ley de CharlesDocumento6 pagineLey de CharlesBarriga Espinoza Briseyda Danneth 5to ANessuna valutazione finora
- Practica 1 QuimicaDocumento17 paginePractica 1 QuimicaLuis Miguel Juarez MunguiaNessuna valutazione finora
- Practica 1 QuimicaDocumento11 paginePractica 1 QuimicaJoahn david Urieta ortizNessuna valutazione finora
- Practica 1 Quimica AplicadaDocumento10 paginePractica 1 Quimica AplicadaMauuricio GranadosNessuna valutazione finora
- Informe de Laboratorio de Quimica Practica 3Documento14 pagineInforme de Laboratorio de Quimica Practica 3Carmenza GutierrezNessuna valutazione finora
- Informe Gases Ideales (1) 2018Documento11 pagineInforme Gases Ideales (1) 2018lorenaNessuna valutazione finora
- Reporte de Practica 5 Gas Ideal - Suarez AngieDocumento6 pagineReporte de Practica 5 Gas Ideal - Suarez AngieANGIE DEYANIRA SUAREZ MEDINANessuna valutazione finora
- Gases QuímicaDocumento18 pagineGases QuímicaDiego Alejandro Ruiz PeñaNessuna valutazione finora
- Practica 3 Oxidacion ReduccionDocumento14 paginePractica 3 Oxidacion Reduccionhopny810Nessuna valutazione finora
- Ley de CharlesDocumento3 pagineLey de CharlesAgus AgustinaNessuna valutazione finora
- Investigacion Gases IdealesDocumento21 pagineInvestigacion Gases IdealesJohanna LopezNessuna valutazione finora
- Informe LAB 3 - TermodinámicaDocumento16 pagineInforme LAB 3 - Termodinámicamatias1gutierrez1henNessuna valutazione finora
- Informe FisicoquimicaDocumento5 pagineInforme FisicoquimicaAlejo AriasNessuna valutazione finora
- Ley de Boyle, Charles y LussacDocumento2 pagineLey de Boyle, Charles y LussacAdair BarriosNessuna valutazione finora
- Proyecto Extracción de Aceites EsencialesDocumento3 pagineProyecto Extracción de Aceites EsencialesAdriana Liseth Zapata RojasNessuna valutazione finora
- P4 FQ Equipo2vbwebsDocumento7 pagineP4 FQ Equipo2vbwebsvalofe5364Nessuna valutazione finora
- Experimentando Con Las Leyes de Los GasesDocumento7 pagineExperimentando Con Las Leyes de Los GasesNorma IsselaNessuna valutazione finora
- Leyes de Los GasesDocumento12 pagineLeyes de Los GasesHugo GimenzNessuna valutazione finora
- PRÁCTICA 4 FISICOQUIMICA - Docx - 20240322 - 230143 - 0000Documento6 paginePRÁCTICA 4 FISICOQUIMICA - Docx - 20240322 - 230143 - 0000jazminhurdzNessuna valutazione finora
- Practica 2 Quimica Equipo Final BRRRRDocumento25 paginePractica 2 Quimica Equipo Final BRRRRAngel GonzalezNessuna valutazione finora
- Gay - LussacDocumento18 pagineGay - LussacFiorelaGasparSaenzNessuna valutazione finora
- RESUMEN Presion VaporDocumento8 pagineRESUMEN Presion VapormiguelNessuna valutazione finora
- Ley GasesDocumento4 pagineLey GasesDiana NavaNessuna valutazione finora
- Leyes de Los GasesDocumento11 pagineLeyes de Los GasesAlvaro DamianNessuna valutazione finora
- Tarea 2Documento4 pagineTarea 2Luis KikeNessuna valutazione finora
- Gases Ideales EnsayoDocumento10 pagineGases Ideales EnsayoLeonardo Rodriguez ChavezNessuna valutazione finora
- Practica 2 GasesDocumento3 paginePractica 2 GasesJonathan Di CareiNessuna valutazione finora
- Gases Ideales. (Aplicaciones)Documento20 pagineGases Ideales. (Aplicaciones)Angie HernandezNessuna valutazione finora
- Trabajo Final Fisica 2 Quiñones - JHOAN GRULLON 1097919Documento9 pagineTrabajo Final Fisica 2 Quiñones - JHOAN GRULLON 1097919CapeexNessuna valutazione finora
- Repote TermoDocumento1 paginaRepote TermoDany AngelesNessuna valutazione finora
- Prac. 2. Gay Lussac 3Documento45 paginePrac. 2. Gay Lussac 3Tito HuillcaNessuna valutazione finora
- Gases Ideales. (Aplicaciones)Documento26 pagineGases Ideales. (Aplicaciones)Thi NgsNessuna valutazione finora
- Informe #7Documento3 pagineInforme #7Kevin PerezNessuna valutazione finora
- Ley de Charles-Gay LussacDocumento5 pagineLey de Charles-Gay LussacCRISTHEL SHANDIRA ARRUETA ABRIGONessuna valutazione finora
- Laboratorio Gases IdealesDocumento5 pagineLaboratorio Gases Idealesjulian esteban solano sanchezNessuna valutazione finora
- Exposicion Ley de CharlesDocumento6 pagineExposicion Ley de CharlesSebastian Galvis VillegasNessuna valutazione finora
- Reporte de Laboratorio 1 Quimica 2Documento18 pagineReporte de Laboratorio 1 Quimica 2Miguel RochaNessuna valutazione finora
- Practica #1 Ley de CharlesDocumento14 paginePractica #1 Ley de CharlesChristian Pinedo ReateguiNessuna valutazione finora
- Ley de CharlesDocumento5 pagineLey de CharlesJuan Rafael Vera PrecillaNessuna valutazione finora
- Informe 3 FisicoquimicaDocumento9 pagineInforme 3 FisicoquimicaRodrigo AlcaNessuna valutazione finora
- Propiedades de Los GasesDocumento9 paginePropiedades de Los GasesrocalojuNessuna valutazione finora
- Trabajo de QuimicaDocumento7 pagineTrabajo de QuimicaOsweli Isabel Mendez BozoNessuna valutazione finora
- P1 QuimicaDocumento16 pagineP1 QuimicaGabriela PerezNessuna valutazione finora
- Practica 1 de Quimica Aplicada EsimeDocumento10 paginePractica 1 de Quimica Aplicada EsimeDaniel VelázquezNessuna valutazione finora
- Trabajo para El Tercer Parcial Ime 2203 TermodinamicaDocumento27 pagineTrabajo para El Tercer Parcial Ime 2203 TermodinamicaFernando P.cNessuna valutazione finora
- Práctica #6. Leyes de Los Gases.Documento16 paginePráctica #6. Leyes de Los Gases.antonio mujicaNessuna valutazione finora
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDa EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNessuna valutazione finora
- Sesion La Voz HumanaDocumento2 pagineSesion La Voz Humanakathasujuelf50% (4)
- Simbología de Seguridad y ProtecciónDocumento19 pagineSimbología de Seguridad y ProtecciónkathasujuelfNessuna valutazione finora
- Monografia SalchichasDocumento17 pagineMonografia Salchichaskathasujuelf100% (1)
- Grilla de San JuanDocumento1 paginaGrilla de San JuankathasujuelfNessuna valutazione finora
- Simbología de Seguridad y ProtecciónDocumento19 pagineSimbología de Seguridad y ProtecciónkathasujuelfNessuna valutazione finora
- Crucigrama de El Bautizo de Jesus 2 AñoDocumento1 paginaCrucigrama de El Bautizo de Jesus 2 AñokathasujuelfNessuna valutazione finora
- Dia Pentecostes 3 AñoDocumento1 paginaDia Pentecostes 3 AñokathasujuelfNessuna valutazione finora
- La Garrapata Informe 1Documento10 pagineLa Garrapata Informe 1kathasujuelfNessuna valutazione finora
- Evaluacion Organoleptica de La LecheDocumento4 pagineEvaluacion Organoleptica de La Lechekathasujuelf100% (1)
- Canto de Las ÑustasDocumento1 paginaCanto de Las ÑustaskathasujuelfNessuna valutazione finora
- Desposte de CarneDocumento34 pagineDesposte de Carnekathasujuelf100% (1)
- Volumen MolarDocumento4 pagineVolumen MolarkathasujuelfNessuna valutazione finora
- Grupo 4 Auditorio de La Ciudad de LeónDocumento25 pagineGrupo 4 Auditorio de La Ciudad de LeónJuanito zezitoNessuna valutazione finora
- I Bimestre y II BimestreDocumento54 pagineI Bimestre y II Bimestregina vargasNessuna valutazione finora
- Que Se Puede Hacer Con El CacaoDocumento3 pagineQue Se Puede Hacer Con El CacaoGenesis J SantillanNessuna valutazione finora
- El Absurdo Creador - de El Mundo Como Un Supermercado - Michel HouellebecqDocumento5 pagineEl Absurdo Creador - de El Mundo Como Un Supermercado - Michel Houellebecqgabo245100% (1)
- Informe 8Documento4 pagineInforme 8Génesis Samara Corredor OvalleNessuna valutazione finora
- Clase 6 - Modelos de Parametros DistribuidosDocumento10 pagineClase 6 - Modelos de Parametros DistribuidosJose MirandaNessuna valutazione finora
- Los Fundamentos de La Teoría de La Gravitación de Einstein - Notas - Wikisource PDFDocumento106 pagineLos Fundamentos de La Teoría de La Gravitación de Einstein - Notas - Wikisource PDFpasc86Nessuna valutazione finora
- Reporte de DiodosDocumento6 pagineReporte de DiodosroshiesenseiNessuna valutazione finora
- QuimicaDocumento5 pagineQuimicaSergio Fernando Ramírez MendiolaNessuna valutazione finora
- 2.física 2º Movimiento Armónico SimpleDocumento7 pagine2.física 2º Movimiento Armónico SimpleKarl LiebknechtNessuna valutazione finora
- 1 - 2. Propiedades de Las Operaciones Con Vectores en El Plano y Vectores UnitariosDocumento5 pagine1 - 2. Propiedades de Las Operaciones Con Vectores en El Plano y Vectores UnitariosSimone bbbbeNessuna valutazione finora
- Diagrama de FaseDocumento11 pagineDiagrama de FaseAnonymous o5FX4oqBNessuna valutazione finora
- Introducion A La GeofisicaDocumento18 pagineIntroducion A La GeofisicaMiguelNessuna valutazione finora
- Rayos X - Wikipedia, La Enciclopedia LibreDocumento7 pagineRayos X - Wikipedia, La Enciclopedia LibreIsmael BonankenNessuna valutazione finora
- Resumen de LevasDocumento14 pagineResumen de LevasAmín Agustín AmuchNessuna valutazione finora
- Switches de Transfer en CIA TS 830Documento26 pagineSwitches de Transfer en CIA TS 830Ali Rave Rve100% (1)
- Teoria Cinetica de Los Gases y Leyes de La TermodinámicaDocumento120 pagineTeoria Cinetica de Los Gases y Leyes de La TermodinámicaAaron jimenezNessuna valutazione finora
- 7b CiclonesDocumento71 pagine7b CiclonesSteven ArceNessuna valutazione finora
- Análisis InstrumentalDocumento141 pagineAnálisis InstrumentalMariana PavónNessuna valutazione finora
- Nivelación 8Documento2 pagineNivelación 8Adriana Lorena SerranoNessuna valutazione finora
- Karenvrg 1Documento5 pagineKarenvrg 1Alim Andree sanchez arrietaNessuna valutazione finora
- Guía N°2 Propiedades Coligativas-FqDocumento9 pagineGuía N°2 Propiedades Coligativas-FqAlex Sabino SevillanoNessuna valutazione finora
- Laboratorio de Ecuaciones Diferenciales Segundo Corte.1.Documento11 pagineLaboratorio de Ecuaciones Diferenciales Segundo Corte.1.Alfredo Rodriguez MatuteNessuna valutazione finora
- ElectrodinamicaDocumento3 pagineElectrodinamicaMiguel Clark QuicañoNessuna valutazione finora
- Fibra OpticaDocumento11 pagineFibra OpticaVicenteObandoNessuna valutazione finora
- 01 - F2 - Temperatura y Calor - 3 - Btransferencia de Calor - ARQDocumento27 pagine01 - F2 - Temperatura y Calor - 3 - Btransferencia de Calor - ARQPATTYNessuna valutazione finora
- Sustentacion Trabajo Colaborativo - CB - SEGUNDO BLOQUE-FISICA II - (GRUPO4)Documento5 pagineSustentacion Trabajo Colaborativo - CB - SEGUNDO BLOQUE-FISICA II - (GRUPO4)Sebastian MontanoNessuna valutazione finora
- Calculo Tensorial - JUAN MIGUEL SUAY BELENGUERDocumento89 pagineCalculo Tensorial - JUAN MIGUEL SUAY BELENGUERElizabeth Hammon100% (1)
- Contenido Asignaturas UAMDocumento40 pagineContenido Asignaturas UAMJuan Felipe Mora RiosNessuna valutazione finora