Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Estructura de La Pirámide de Documentos
Caricato da
juealecCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Estructura de La Pirámide de Documentos
Caricato da
juealecCopyright:
Formati disponibili
Estructura de la pirmide de documentos
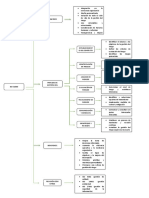
Fases de control de calidad:
Fase pre-analtica:
Solicitud de exmenes
Indicaciones previas al paciente
Identificacin completa del paciente
Identificacin del medico
Calidad en la toma de muestra
Criterios de aceptacin o rechazo de muestras
Interferencias
Trasporte y conservacin de las muestras
Fase analtica:
Consiste cuando la muestra est preparada para su proceso, hay que tener en cuenta
los siguientes factores:
Reactivos
Material de vidrio
Equipo
Soluciones de control
Mtodos de confiabilidad y aplicabilidad.
METODOS OFICIALES: Son aquellos requeridos por una ley o reglamento sin
importar que sean vlidos.
METODOS DE RUTINA: Se utilizan con la finalidad de hacer un gran nmero de
determinaciones en condiciones similares.
METODOS ESTANDARIZADOS: son elaborados por organismos o grupos que se
hacen estudios de cobertura y son vlidos.
METODOS DE REFERENCIA: Aquellos que utilizan cualquier tipo de laboratorio con
fines de calidad interno.
METODOS MODIFICADOS: Son mtodos oficiales o de referencia que han sido
modificados o acomodados a muestras diferentes para los que fueron previstos y
principalmente para eliminar la transferencia.
Fase post analtica:
OBTENCION DE LOS VALORES DE REFERENCIA
Se busca pacientes que tenga criterios de:
INCLUSION
18-30 aos.
Aparentemente sanos.
Un muestreo total de 1000 muestras
Proceso de la muestra
Media, desviacin estndar, coeficiente de variacin.
EXCLUSION:
Sedentarismo.
Obesidad.
Antecedentes hereditarios.
Embarazadas.
Periodos de lactancia.
Pacientes diabticos.
Enfermedades cardiopatitas.
Infecciones contagiosas: VIH, VPH, Hepatitis.etc.
Tratamiento por frmacos.
Alcohlicos.
Fumadores.
Drogadictos.
INFORME DE RESULTADOS
Informacin minima del reporte debe estar conformada por:
Identificacin completa del laboratorio
Nombre del paciente
Nmero de identificacin de la muestra
Sexo
Localidad del paciente
Fecha y hora de la solicitud
Fecha y hora de obtencin de la muestra
Fecha y hora de informe de resultados
Nombre del mdico solicitante.
Nombre de la prueba solicitada.
Valor numrico
Unidades de la prueba medible
Valores de referencia
Firma de la persona responsable
Observaciones
Entrega del resultado.
Norma iso 15189
ISO 15189 fue elaborada por el Comit Tcnico ISO/TC 212 (Clinical Laboratory
Testing and In Vitro Diagnostic Systems) tomando como referencia las normas ISO /
IEC 17025 e ISO 9001.
Se divide en dos partes, la parte de gestin correspondiente a los requisitos para la
certificacin del sistema de calidad y la parte tcnica que describe los requisitos para
el personal, instalaciones, equipos, procedimientos, garanta de calidad e informes. Es
en esta tima parte donde ms se diferencia de la Norma en la que se basa, la Norma
ISO 9001:2008. La Norma adems tiene dos anexos a nivel informativo, uno referente
a las recomendaciones para la proteccin de los sistemas de informacin del
laboratorio y otro sobre la tica en el laboratorio clnico.
Esta norma acredita y demuestra de manera objetiva e independiente el compromiso
de un laboratorio con la calidad y con la competencia tcnica. Se demuestra as, una
garanta sobre el funcionamiento del laboratorio, un control sobre sus procesos, as
como capacidad para satisfacer los requisitos tcnicos necesarios para asegurar una
informacin vital para el diagnstico clnico.
Potrebbero piacerti anche
- Orientaciones para la evaluación de riesgos y las reglas de decisión según la Norma ISO/IEC 17025Da EverandOrientaciones para la evaluación de riesgos y las reglas de decisión según la Norma ISO/IEC 17025Valutazione: 4.5 su 5 stelle4.5/5 (4)
- Pt-Ge-002 Procedimiento para El Control de Condiciones AmbientalesDocumento6 paginePt-Ge-002 Procedimiento para El Control de Condiciones AmbientalesAnonymous YwFJrk0yCNessuna valutazione finora
- Protocolo de Limpieza y Desinfección de Areas y EquiposDocumento8 pagineProtocolo de Limpieza y Desinfección de Areas y EquiposPedro L. TuiranNessuna valutazione finora
- 1.2. - Manual de CalidadDocumento40 pagine1.2. - Manual de CalidadviniciocabezasNessuna valutazione finora
- Iso 15189Documento21 pagineIso 15189jose antonio tafur gonzalesNessuna valutazione finora
- Lab-clini/formato/Lista de Verificacion NTP-IsO 15189 (DA-Acr-11P-20F)Documento63 pagineLab-clini/formato/Lista de Verificacion NTP-IsO 15189 (DA-Acr-11P-20F)JOSE ELESCANO CASTRONessuna valutazione finora
- Control de Calidad HematologiaDocumento1 paginaControl de Calidad HematologiaGreiner Duràn DiazNessuna valutazione finora
- Bioseguridad y Manejo de Desechos Biológicos en El Laboratorio ClínicoDocumento5 pagineBioseguridad y Manejo de Desechos Biológicos en El Laboratorio ClínicoNayme Leodan Cubas AlbercaNessuna valutazione finora
- Checklist LaboratorioDocumento10 pagineChecklist LaboratorioShirley MendozaNessuna valutazione finora
- Protocolo de Manejo de Reacciones Adversas Antes Durante y Despues.Documento12 pagineProtocolo de Manejo de Reacciones Adversas Antes Durante y Despues.Pedro L. TuiranNessuna valutazione finora
- Procedimiento de Transporte, Conservación y Remisión de MuestrasDocumento11 pagineProcedimiento de Transporte, Conservación y Remisión de MuestrasDAVIDNessuna valutazione finora
- Plan de Auditoria 17025Documento7 paginePlan de Auditoria 17025Miiq FiqNessuna valutazione finora
- Gad-Lcl-Ma-09 Manual Referencia y Contrarreferencia Laboratorio ClínicoDocumento28 pagineGad-Lcl-Ma-09 Manual Referencia y Contrarreferencia Laboratorio ClínicoPROFESIONALES ACREDITACIÓN 2021Nessuna valutazione finora
- If-P21-F22 Formato Hoja de Vida de Equipos - Laboratorio de Indicadores de Calidad de Aguas y LodosDocumento3 pagineIf-P21-F22 Formato Hoja de Vida de Equipos - Laboratorio de Indicadores de Calidad de Aguas y LodosFELIPE DAVILANessuna valutazione finora
- Ejemplo de Registro de Una Nota de HallazgoDocumento1 paginaEjemplo de Registro de Una Nota de Hallazgoisidora antonia soto lepezNessuna valutazione finora
- HACCAPDocumento19 pagineHACCAPJhonMars100% (1)
- Manual para La Toma de Muestras CusDocumento49 pagineManual para La Toma de Muestras CusHelen Soria GalvarroNessuna valutazione finora
- Gestión de Reactivos e InsumosDocumento8 pagineGestión de Reactivos e InsumosAna AnguloNessuna valutazione finora
- Certificado de Calibración PipetaDocumento2 pagineCertificado de Calibración Pipetagerardo Gaona montalva100% (1)
- Manual de Calidad SerlabDocumento30 pagineManual de Calidad SerlabFlavio ReyesNessuna valutazione finora
- Instrucciones de Uso Del Contador de ColoniasDocumento5 pagineInstrucciones de Uso Del Contador de ColoniasJeanette Huaya RamosNessuna valutazione finora
- COVENIN 2972-2-1997 Exactitud (Veracidad y Precisión) - Determinación de R y RDocumento42 pagineCOVENIN 2972-2-1997 Exactitud (Veracidad y Precisión) - Determinación de R y ROscar Rodriguez100% (1)
- Manual de Bioseguridad para Laboratorios ClínicosDocumento159 pagineManual de Bioseguridad para Laboratorios Clínicosgjca08100% (1)
- Manual de Bioseguridad DISA IV Lima EsteDocumento85 pagineManual de Bioseguridad DISA IV Lima EsteWilson CalcinaNessuna valutazione finora
- Iso 17025 Laboratorio de MicrobiologiaDocumento226 pagineIso 17025 Laboratorio de MicrobiologiaDiana Payan100% (4)
- Protocolo de Limpieza y Desinfeccion de Areas y Equipos para El Laboratorio de Microbiologia de La Empresa SchapeliDocumento5 pagineProtocolo de Limpieza y Desinfeccion de Areas y Equipos para El Laboratorio de Microbiologia de La Empresa SchapeliRuben Pato SarmientoNessuna valutazione finora
- BPL e Iso 9001Documento5 pagineBPL e Iso 9001Libertys ViaÑa0% (1)
- Seguridad Del Paciente en El Laboratorio ClinicoDocumento35 pagineSeguridad Del Paciente en El Laboratorio Clinicolaboratorio clinico baser 8100% (1)
- Laboratorio Clinico Yaliz MMMMMMMDocumento18 pagineLaboratorio Clinico Yaliz MMMMMMMAlvaro Restrepo GarciaNessuna valutazione finora
- Instructivo de EspectrofotometroDocumento5 pagineInstructivo de EspectrofotometroAngel PalominoNessuna valutazione finora
- Aseguramiento de Calidad Labaratorio de MicrobiologíaDocumento52 pagineAseguramiento de Calidad Labaratorio de MicrobiologíaDavid Rosado Porto100% (1)
- Cronograma de Actividaes para El Laboratorio Estabilidad de Medicamentos - 2022-1Documento2 pagineCronograma de Actividaes para El Laboratorio Estabilidad de Medicamentos - 2022-1Iván Narváez Aguilar100% (1)
- Norma de Aceites y Grasas PDFDocumento10 pagineNorma de Aceites y Grasas PDFjosue alvarez vargasNessuna valutazione finora
- Formulario LaboratorioDocumento2 pagineFormulario LaboratorioDenisse Saigua EncaladaNessuna valutazione finora
- Formato - Ats Laboratorio ClinicoDocumento2 pagineFormato - Ats Laboratorio ClinicoDHAIKILLS YrNessuna valutazione finora
- Verificacion Intermedia de Pesas PDFDocumento6 pagineVerificacion Intermedia de Pesas PDFFërnando Rodrîguëz Herrerä100% (1)
- Hoja de Seguridad Glassex Multiusos ProfessionalDocumento4 pagineHoja de Seguridad Glassex Multiusos Professionaljabastian21Nessuna valutazione finora
- OMS - Diez Sustancias Químicas Que Constituyen Una Preocupación para La Salud PúblicaDocumento2 pagineOMS - Diez Sustancias Químicas Que Constituyen Una Preocupación para La Salud PúblicaGesabelNessuna valutazione finora
- Validación de Procesos de Esterilización Con Óxido deDocumento18 pagineValidación de Procesos de Esterilización Con Óxido deTuliaRamírezM0% (1)
- Manual de Identificación de Riesgos y Eventos Adversos en El Laboratorio ClínicoDocumento12 pagineManual de Identificación de Riesgos y Eventos Adversos en El Laboratorio ClínicoHOSPITAL COCUYNessuna valutazione finora
- Guía Rápida para Limpieza de Equipos Médicos PDFDocumento1 paginaGuía Rápida para Limpieza de Equipos Médicos PDFNGA PerúNessuna valutazione finora
- Plan de Contingencia en Un Laboratorio Clínico.: Aleska Vega. CIP:4-798-1298Documento2 paginePlan de Contingencia en Un Laboratorio Clínico.: Aleska Vega. CIP:4-798-1298Aleska VegaNessuna valutazione finora
- Matriznriesgosnynpeligros 9862b3ccb37eb0cDocumento9 pagineMatriznriesgosnynpeligros 9862b3ccb37eb0cLaboratorio ClinicoNessuna valutazione finora
- Manual de Procedimientos Estandar Del Laboratorio ClinicoDocumento62 pagineManual de Procedimientos Estandar Del Laboratorio ClinicoNaylé LopézNessuna valutazione finora
- Acido Citrico RZBC - Ficha TecnicaDocumento1 paginaAcido Citrico RZBC - Ficha TecnicaAlex Carhuamaca100% (1)
- Procedimiento de LavadoDocumento3 pagineProcedimiento de LavadoAnonymous SiO8gwwRtoNessuna valutazione finora
- UIF-P-02-POI-09 Procedimiento de Revisión de PlanosDocumento51 pagineUIF-P-02-POI-09 Procedimiento de Revisión de PlanosnilolovoNessuna valutazione finora
- Plan de Mantenimiento de LaboratorioDocumento14 paginePlan de Mantenimiento de LaboratorioRamón Veliz Bravo100% (1)
- F-Ac-001 Formato de Acta de Capacitacion Del Laboratorio Clinico Juan Pablo IIDocumento1 paginaF-Ac-001 Formato de Acta de Capacitacion Del Laboratorio Clinico Juan Pablo IIjoseNessuna valutazione finora
- Presentacion Benceno, Tolueno y XilenoDocumento32 paginePresentacion Benceno, Tolueno y XilenoMauricio Campuzano100% (1)
- Registro de MantenimientoDocumento2 pagineRegistro de MantenimientoMargarita Rosa Manga CaballeroNessuna valutazione finora
- Instructivo de Lavado de Material de Vidrio y PlásticoDocumento9 pagineInstructivo de Lavado de Material de Vidrio y PlásticoLina Chavez OrtegaNessuna valutazione finora
- Matriz Laboratorio ClínicoDocumento5 pagineMatriz Laboratorio ClínicoKatherine CuestaNessuna valutazione finora
- Aspectos Generales de Bioseguridad en El Laboratorio ClínicoDocumento35 pagineAspectos Generales de Bioseguridad en El Laboratorio ClínicoLuis Emiliano MorenoNessuna valutazione finora
- RE-GG-01 Formato Registro Sugerencias y Quejas Ver 00Documento1 paginaRE-GG-01 Formato Registro Sugerencias y Quejas Ver 00Diego MenciasNessuna valutazione finora
- Manual de Limpieza y Desinfeccion Del Material LaboratorioDocumento29 pagineManual de Limpieza y Desinfeccion Del Material LaboratorioNewton Lizcano DuranNessuna valutazione finora
- Verificación de TermometrosDocumento3 pagineVerificación de TermometrosAlan ContrerasNessuna valutazione finora
- Manual de Procedimientos Técnicos deDocumento105 pagineManual de Procedimientos Técnicos deRichard Crespo Pérez100% (1)
- Iso 17025Documento23 pagineIso 17025taniacuadraNessuna valutazione finora
- Tema 18 Requisitos Tecnicos Iso 17025Documento5 pagineTema 18 Requisitos Tecnicos Iso 17025monitriNessuna valutazione finora
- Iec 62271-200-2021Documento108 pagineIec 62271-200-2021diezarNessuna valutazione finora
- Normas y ParametrosDocumento3 pagineNormas y ParametrosErlin EspinalNessuna valutazione finora
- Manual de Sistema Integrado de GestionDocumento20 pagineManual de Sistema Integrado de GestionPam CGNessuna valutazione finora
- Formatos Preparar Auditoria Entregable. Con Lista de Chequeo para Calidad IniciadoDocumento14 pagineFormatos Preparar Auditoria Entregable. Con Lista de Chequeo para Calidad IniciadoAngel Daian DaphreriNessuna valutazione finora
- Iso 26000-2010Documento10 pagineIso 26000-2010deiby arangoNessuna valutazione finora
- Historia Del Dibujo TécnicoDocumento36 pagineHistoria Del Dibujo TécnicoJuan Carlos JuarezNessuna valutazione finora
- Referencias Bibliográficas Con ISO 690 - HSEDocumento35 pagineReferencias Bibliográficas Con ISO 690 - HSEHarukaHigeyoshiNessuna valutazione finora
- Iram 29401-1-1999Documento24 pagineIram 29401-1-1999NicolásNessuna valutazione finora
- Calidad en El Software: ActividadDocumento14 pagineCalidad en El Software: ActividadJulieta Macías DelgadoNessuna valutazione finora
- Capacitaciones en Gestión Del Riesgo ISO 31000Documento3 pagineCapacitaciones en Gestión Del Riesgo ISO 31000gustavo colodroNessuna valutazione finora
- Iso 14067 2018Documento15 pagineIso 14067 2018Carlos Fernando Gonzales OrtizNessuna valutazione finora
- Proyecto ISO 9001 2008 (E. Logística Sanitaria)Documento113 pagineProyecto ISO 9001 2008 (E. Logística Sanitaria)MarioSilva88Nessuna valutazione finora
- Avaluo de Lotes PDFDocumento48 pagineAvaluo de Lotes PDFPIER ANGELI QUIROGA CÁRDENASNessuna valutazione finora
- 1 2020Documento4 pagine1 2020Pit zajot80% (10)
- Aenor 2020 Aparatos Sanitarios PDFDocumento20 pagineAenor 2020 Aparatos Sanitarios PDFsdasdsaNessuna valutazione finora
- Gestion de RiesgosDocumento1 paginaGestion de Riesgosjose alberto tupa quispeNessuna valutazione finora
- Normas Técnicas en El Comercio InternacionalDocumento25 pagineNormas Técnicas en El Comercio Internacionaljunior.ksNessuna valutazione finora
- Practica Grupal 3 Instrucciones Teoria Norma 45001-2018 FinalDocumento4 paginePractica Grupal 3 Instrucciones Teoria Norma 45001-2018 FinalDanielNessuna valutazione finora
- Procedimiento Del Manejo Adecuado Del Taller CNC.Documento3 pagineProcedimiento Del Manejo Adecuado Del Taller CNC.christian alvaradoNessuna valutazione finora
- Qué Son Normas Internacionales Del Dibujo TécnicoDocumento9 pagineQué Son Normas Internacionales Del Dibujo TécnicoJose Manuel Arredondo Acosta100% (2)
- Gestion Del Riesgo Documental 1Documento39 pagineGestion Del Riesgo Documental 1oscar100% (1)
- Iso 10019 TraducidaDocumento22 pagineIso 10019 TraducidaJuanManuelArgudinNessuna valutazione finora
- Iatf 16949Documento2 pagineIatf 16949Mauricio EstradaNessuna valutazione finora
- The Seventh Seal - 1957 - BDRIP - UHD - HEVC - 2160p - Sueco - IdentiDocumento8 pagineThe Seventh Seal - 1957 - BDRIP - UHD - HEVC - 2160p - Sueco - IdentiEmanuel Alejandro MacielNessuna valutazione finora
- Iso 9001 CalidadDocumento4 pagineIso 9001 CalidadJennifer PerellóNessuna valutazione finora
- IsoDocumento5 pagineIsomanchichiNessuna valutazione finora
- Guia Didactica 4-ASG (F)Documento34 pagineGuia Didactica 4-ASG (F)Mario SantanaNessuna valutazione finora
- Aetos WG 2 Recomendaciones Gt32esp Revupiraud Borrador Jornada 17 de JunioDocumento45 pagineAetos WG 2 Recomendaciones Gt32esp Revupiraud Borrador Jornada 17 de JunioTeofilo_Nessuna valutazione finora
- Guia Uso Iso 19011Documento3 pagineGuia Uso Iso 19011Raul Israel ValtierraNessuna valutazione finora
- Resumen ISO 19011Documento4 pagineResumen ISO 19011jmrobledoc75% (4)