Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Accel
Caricato da
xato_18_05Titolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Accel
Caricato da
xato_18_05Copyright:
Formati disponibili
Mejor respuesta: Para estudiar los efectos qumicos trmicos que acompaan a las reacciones qumicas, la
formulacin de soluciones y los cambios fsicos como la fusin o la evaporizacin. Los cambios fisicoquimicos se
clasifican como:
Endotrmicos:
Acompaados por la absorcin de calor.
Exotrmicos:
Acompaados por desprendimiento de calor.
El calor de una reaccin qumica depende de la condicin en que se lleva a cabo el proceso.
Existen dos condiciones particulares en que se desarrollan los procesos, en donde los calores de reaccin son iguales
a cambios en funciones termodinmicas.
El primer proceso corresponde a un volumen constante, en donde ningn trabajo se realiza sobre el sistema,
obtenindose a partir de la Primera Ley de la Termodinmica.
QV = E....................(1)
Lo que significa que el calor de una reaccin medido a volumen constante es exactamente igual al cambio de energa
del sistema reaccionante.
El segundo proceso corresponde a la presin constante, como los efectuados en sistema abiertos a la atmsfera, para
los cuales:
QP = H....................(2)
Lo que significa que el calor de reaccin medido a presin constante es igual al cambio de energa del sistema de
reaccin.
Es necesario emplear datos obtenidos con bombas calormetricas, en las cuales se obtiene el cambio de energa (E) y
corregirla para calcular H.
Esto se obtiene a partir de la definicin de la entalpa (H).
H = E + PV....................(3)
H = E + (PV)....................(4)
Entendindose por (PV) la diferencia entre los productos PV de productos reactivos.
Como en reacciones a temperatura constante el (PV) depende del cambio de moles gaseosos entre productos y
reactivos, se tiene:
(PV) = nRT....................(5)
obtenindose as la reaccin entre el cambio de entalpa y el de energa,
H = E + nRT
Donde n se toma como el nmero de moles de producto menos el de reactivos que se encuentran en estado gaseoso.
Ya que E y H son funciones punto, el H el E para cualquier reaccin qumica es indispensable de las posibles
reacciones intermedias que puedan ocurrir.
Este es el principio de G.H. Hess; y se conoce con el nombre de la Ley de Hess.
Calor de Formacin Molar.- Es el calor de reaccin para la formulacin de un mol de compuesto a partir de los
elementos que lo constituyen por su forma ms estable.
Las mediciones de H se llevan a cabo en vasos aislados trmicamente (DEWAR) bajo condiciones de presin
constante y las determinaciones de E a volumen constante, empleando una bomba calorimtrica de tipo Parr.
Los procesos de reaccin trmicos desempean un papel de gran importancia, especialmente en qumica inorgnica
y tienen lugar frecuentemente acoplados con reacciones de oxidacin y reduccin, As sucede en la tostacin,
calcinacin, caustificacin, etc. En qumica orgnica se presentan en la preparacin de combustibles gaseosos, en
coqueras, en procesos de craquing, etc.
La gran cantidad de calor necesaria para su realizacin, se toma muchas veces de la reaccin misma, pero tambin es
frecuente suministrarlo desde el exterior con empleo de combustibles, slidos, lquidos o gaseosos, de energa
elctrica y, algunos casos, utilizando directamente hornos de arco elctrico.
En los numerosos procesos trmicos se desprende durante la reaccin suficiente calor para que la reaccin pueda
tener lugar sin el suministro exterior de calor; muchas veces es incluso necesario eliminar parte del calor de reaccin.
Este es el caso por ejemplo en la fabricacin de cianamida de calcio a partir de carburo, en la produccin de amonaco
sinttico o de cido sulfrico de contacto, etc. Por lo contrario otras reacciones necesitan suministro de calor durante
todo su transcurso, como en la calcinacin de caliza, la produccin de carburos, etc.
Los procesos de reaccin que transcurren a alta temperatura se realizan en hornos, calentadores, reactores, etc. Las
reacciones que desprenden calor se denominan procesos exotrmicos, y las que consumen calor endotrmicos.
Se denomina reaccin endotrmica a cualquier reaccin qumica que absorbe energa.1
Si hablamos de entalpa (H), una reaccin endotrmica es aquella que tiene un incremento de entalpa (H) positivo.
Es decir, la energa que poseen los productos es mayor a la de los reactivos.2
Las reacciones endotrmicas y especialmente las relacionadas con el amonaco impulsaron una prspera industria de
generacin de hielo a principios del siglo XIX. Actualmente el fro industrial se genera con electricidad en mquinas
frigorficas.
Ejemplo de reaccin endotrmica
Un ejemplo de reaccin endotrmica es la produccin del ozono (O3). Esta reaccin ocurre en las capas altas de
la atmsfera, gracias a la radiacin ultravioleta proporcionada por laenerga del Sol. Tambin se produce esta reaccin
en las tormentas, en las proximidades de las descargas elctricas.
3O2 2O3 ; H > 0
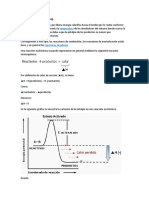
Reaccin exotrmica
Se denomina reaccin exotrmica a cualquier reaccin qumica que desprenda energa, ya sea como luz o calor,1 o lo
que es lo mismo: con una variacin negativa de la entalpa; es decir: -H. El prefijo exo significa hacia fuera. Por lo
tanto se entiende que las reacciones exotrmicas liberan energa. Considerando que A, B, C y D representen
sustancias genricas, el esquema general de una reaccin exotrmica se puede escribir de la siguiente manera:
A + B C + D + calor
Ocurre principalmente en las reacciones de oxidacin. Cuando estas son intensas pueden generar fuego. Si dos
tomos de hidrgeno reaccionan entre s e integran una molcula, el proceso es exotrmico.
H + H = H2
H = -104 kcal/mol
Son cambios exotrmicos las transiciones de gas a lquido (condensacin) y de lquido a slido (solidificacin).
Un ejemplo de reaccin exotrmica es la combustin.
La reaccin contraria, que consume energa, se denomina reaccin endotrmica.
Potrebbero piacerti anche
- Trabajo de TermodinamicaDocumento15 pagineTrabajo de TermodinamicaMary CelesteNessuna valutazione finora
- Termoquímica y EspontaneidadDocumento13 pagineTermoquímica y EspontaneidadKarla Lizeth Bogarin RaygozaNessuna valutazione finora
- Cal or CombDocumento2 pagineCal or CombLee Stevens Hernandez RiveraNessuna valutazione finora
- Bases Teórica de TermoquímicaDocumento4 pagineBases Teórica de TermoquímicaRODOLFO QUISPE SALAZARNessuna valutazione finora
- Reporte de EhusDocumento10 pagineReporte de EhusAgüita De CocoNessuna valutazione finora
- Cuestionario TermoqiomicaDocumento3 pagineCuestionario TermoqiomicaPaola RiinaNessuna valutazione finora
- Contenido Teórico de La Practica N°4 - Laboratorio de Química IIDocumento66 pagineContenido Teórico de La Practica N°4 - Laboratorio de Química IIpartcarlaNessuna valutazione finora
- Tema 52rDocumento20 pagineTema 52rJorge López PalaciosNessuna valutazione finora
- CALOR DE REACCIÓN InformeDocumento4 pagineCALOR DE REACCIÓN InformeTATIANA MARCELA BERMEJO ARAUJONessuna valutazione finora
- Reacción ExotérmicaDocumento12 pagineReacción ExotérmicaRYUMASUNessuna valutazione finora
- Practica 4Documento16 paginePractica 4Equipo NonNessuna valutazione finora
- PRACTICA 3 Equipo PhyweDocumento11 paginePRACTICA 3 Equipo Phyweangel ruiz gutierrezNessuna valutazione finora
- Introduccion A La Termodinamica (Termoquimica)Documento5 pagineIntroduccion A La Termodinamica (Termoquimica)chorch_correa100% (1)
- Publicar Un Estado 2 PDFDocumento22 paginePublicar Un Estado 2 PDFAmy Elizabeth GomezNessuna valutazione finora
- Disc 3.1 Final Aprobada Acdf Version 1 - 22 Abril de 2021 (Subida Estu v1)Documento15 pagineDisc 3.1 Final Aprobada Acdf Version 1 - 22 Abril de 2021 (Subida Estu v1)William J. MoralesNessuna valutazione finora
- P5-Termoquimica FQDocumento6 pagineP5-Termoquimica FQBryan Giovanny Vasquez FrancoNessuna valutazione finora
- Termoquímica ReporteDocumento9 pagineTermoquímica ReportePaoli RuizNessuna valutazione finora
- Resumen TQ 2022Documento9 pagineResumen TQ 2022Mauricio Aramis BrunoNessuna valutazione finora
- TermoquímicaDocumento6 pagineTermoquímicavaneNessuna valutazione finora
- Consulta Leonardo TermoquimicaDocumento5 pagineConsulta Leonardo TermoquimicaLeonardo DelgadoNessuna valutazione finora
- TermoquímicaDocumento8 pagineTermoquímicaArletteNessuna valutazione finora
- Informe de TermoquimicaDocumento12 pagineInforme de TermoquimicaAntony Angel Vicente DueñasNessuna valutazione finora
- LFQC - Prelab P3. Calores de ReacciónDocumento10 pagineLFQC - Prelab P3. Calores de ReacciónDana GómezNessuna valutazione finora
- Instituto Tecnológico de México: Campus ColimaDocumento7 pagineInstituto Tecnológico de México: Campus ColimaMartin Gomez MnedozaNessuna valutazione finora
- INFORME-10Documento16 pagineINFORME-10Ailen LeydaNessuna valutazione finora
- Exposicion TermoquimicaDocumento6 pagineExposicion TermoquimicaAlejandra baezNessuna valutazione finora
- Informe de TermoquimicaDocumento12 pagineInforme de TermoquimicaMax Gerson Fer FernandezNessuna valutazione finora
- Efectos Termicos en Procesos Que Intervienen Reacciones QuimicasDocumento21 pagineEfectos Termicos en Procesos Que Intervienen Reacciones QuimicasElizabeth Sandoval MartinezNessuna valutazione finora
- Guia TermoquimicaDocumento7 pagineGuia TermoquimicaJosefina OrtizNessuna valutazione finora
- Termoqu Mica 2017Documento45 pagineTermoqu Mica 2017Sarita Reina MartínezNessuna valutazione finora
- Concepto de Entalpía de Reacción EstándarDocumento9 pagineConcepto de Entalpía de Reacción EstándarguiovanaNessuna valutazione finora
- Principio de INGDocumento5 paginePrincipio de INGKaterine RomanNessuna valutazione finora
- TERMOQUÍMICADocumento26 pagineTERMOQUÍMICAFredy López MedinaNessuna valutazione finora
- TermoquimicaDocumento64 pagineTermoquimicaPamela Herrera ZamarripaNessuna valutazione finora
- Unidad Didáctica NoDocumento11 pagineUnidad Didáctica Nolorena narvaezNessuna valutazione finora
- Cuestionario TermoquímicaDocumento5 pagineCuestionario TermoquímicaEfrain CuellarNessuna valutazione finora
- Entalpia y Proceso Isotropico.... Proceso IsobaricoDocumento5 pagineEntalpia y Proceso Isotropico.... Proceso IsobaricoFredy Flores Meres0% (1)
- Calor de NeutralizaciónDocumento22 pagineCalor de NeutralizaciónCruz Torrez Jhenny MichelNessuna valutazione finora
- QUIMICA 3 - Termoquímica y ElectroquímicaDocumento73 pagineQUIMICA 3 - Termoquímica y ElectroquímicaTiago MorochoNessuna valutazione finora
- Práctica 5 TermoquímicaDocumento8 paginePráctica 5 TermoquímicaYetzein Mariana MonteroNessuna valutazione finora
- Curso de Quimica Electricidad 7. Pilas GalvánicasDocumento13 pagineCurso de Quimica Electricidad 7. Pilas GalvánicasLUIS ANTONIO BU�AY ALLAICONessuna valutazione finora
- Guía TermoquímicaDocumento11 pagineGuía Termoquímicac.mendez.quimicaNessuna valutazione finora
- La EntalpíaDocumento6 pagineLa EntalpíaStefaniaNessuna valutazione finora
- Termodinamica TCM TrabajoDocumento37 pagineTermodinamica TCM TrabajoNikiMgNessuna valutazione finora
- Entalpia de CombustionDocumento5 pagineEntalpia de Combustionluis EscartinNessuna valutazione finora
- TermoquímicaDocumento8 pagineTermoquímicaDani CrNessuna valutazione finora
- Tema 5 - TermoquímicaDocumento20 pagineTema 5 - TermoquímicaGuillermo BredaelNessuna valutazione finora
- HessDocumento10 pagineHessLópez Alamilla Gerardo JairNessuna valutazione finora
- Independencia Del Cambio de Entalpia de La Reaccion.Documento5 pagineIndependencia Del Cambio de Entalpia de La Reaccion.Diana Carolina Buitrago TorresNessuna valutazione finora
- Calor de Disolucion de SolidosDocumento5 pagineCalor de Disolucion de SolidosAdrii Tirao LizecaNessuna valutazione finora
- Procesos de Combustión A Volumen y Presión ConstanteDocumento15 pagineProcesos de Combustión A Volumen y Presión ConstanteJuan Rodriguez RomeroNessuna valutazione finora
- R.A 4.1 Reacciones Endotermicas y ExotermicasDocumento4 pagineR.A 4.1 Reacciones Endotermicas y ExotermicasJOSHUA MANUEL ZARATE CARDENASNessuna valutazione finora
- Termodinámica, Leyes y TermoquimicaDocumento6 pagineTermodinámica, Leyes y Termoquimicaivansandes84Nessuna valutazione finora
- Termo QUIMICADocumento10 pagineTermo QUIMICAAlexa YañezNessuna valutazione finora
- Calor de NeutralizaciónDocumento24 pagineCalor de NeutralizaciónJadr29930% (1)
- Práctica 9Documento14 paginePráctica 9Isaac GuillenNessuna valutazione finora
- TERMOQUIMICADocumento8 pagineTERMOQUIMICACatalina Angélica Ulloa FritzNessuna valutazione finora
- Calor de Neutralizacion FinDocumento31 pagineCalor de Neutralizacion Finliana hiNessuna valutazione finora
- Calor Entalpia y Entropia Ccbysa4Documento5 pagineCalor Entalpia y Entropia Ccbysa4Ivana Guadalupe Castro ZabalaNessuna valutazione finora
- Bioquímica Cinetica EnzimaticaDocumento3 pagineBioquímica Cinetica EnzimaticaJhoan Andres Cordoba BuitronNessuna valutazione finora
- Clase Enzimas Completa (Autoguardado)Documento68 pagineClase Enzimas Completa (Autoguardado)Valmore Jose BermudezNessuna valutazione finora
- Práctica de Equilibrio QuímicoDocumento20 paginePráctica de Equilibrio QuímicoMOISES DAVID HUAMAN TORRESNessuna valutazione finora
- QI - Clase 5 - U3 (Termodinámica - Rédox) - 20 Abril 2020Documento18 pagineQI - Clase 5 - U3 (Termodinámica - Rédox) - 20 Abril 2020arwen25Nessuna valutazione finora
- EnzimasDocumento34 pagineEnzimasBelen Del Rio100% (2)
- Metodo Por TanteoDocumento2 pagineMetodo Por TanteoAlexis PérezNessuna valutazione finora
- 3 1 2IntrodQuimiIIMFernanGDocumento270 pagine3 1 2IntrodQuimiIIMFernanGmauricio.mallma.200576Nessuna valutazione finora
- Actividad 4 Cuestionario de Introducción A La QuímicaDocumento8 pagineActividad 4 Cuestionario de Introducción A La QuímicaFERNANDO RAFAEL LECHUGA MELENDRESNessuna valutazione finora
- Snacks de Zanahoria y Betarraga PDFDocumento4 pagineSnacks de Zanahoria y Betarraga PDFOlivia Tapia LagunaNessuna valutazione finora
- Inversion de La Sacarosa - Informe 1Documento11 pagineInversion de La Sacarosa - Informe 1Rafael CardenasNessuna valutazione finora
- Práctica 1. Oxidación de N-Butanol A N-ButiraldehidoDocumento10 paginePráctica 1. Oxidación de N-Butanol A N-ButiraldehidoJuan Pablo GómezNessuna valutazione finora
- PracticasLabQuimicaGeneral PDFDocumento30 paginePracticasLabQuimicaGeneral PDFMarielena PerozoNessuna valutazione finora
- Velocidad de ReaccionesDocumento11 pagineVelocidad de ReaccionesJose Alfredo Garcia VelaNessuna valutazione finora
- Alcohol EsDocumento3 pagineAlcohol EsAldair Hernandez SantosNessuna valutazione finora
- Planeacion Tercer Trimestre. QuimicaDocumento10 paginePlaneacion Tercer Trimestre. Quimicamiguel ordoñez100% (1)
- Practica - 9 - Reaccion - Quimica - II - 2022-1 (Rev)Documento6 paginePractica - 9 - Reaccion - Quimica - II - 2022-1 (Rev)Denisse BaezaNessuna valutazione finora
- Preinforme Practica No. 7Documento12 paginePreinforme Practica No. 7OMAIRA LAYTONNessuna valutazione finora
- Practica 5Documento7 paginePractica 5Alejandro de la RosaNessuna valutazione finora
- Reacción Con HaloácidosDocumento2 pagineReacción Con HaloácidosRuben FonsecaNessuna valutazione finora
- Procesos QuímicosDocumento3 pagineProcesos QuímicosTeresaEsparragozaNessuna valutazione finora
- ESTEQUIOMETRIADocumento44 pagineESTEQUIOMETRIAalexNessuna valutazione finora
- Caracteristicas Reacciones QcasDocumento19 pagineCaracteristicas Reacciones QcasSonia SanhuezaNessuna valutazione finora
- Desarrollo Del Fuego en Compartimentos 1Documento7 pagineDesarrollo Del Fuego en Compartimentos 1Formación Manuela ChamorroNessuna valutazione finora
- Actividad 10 - Informe de Laboratorio - Grupo 6Documento8 pagineActividad 10 - Informe de Laboratorio - Grupo 6SAUL JOSUE ALCANTARA FLORESNessuna valutazione finora
- Cuadernillo de Ciencias Naturales-Segundo AñoDocumento40 pagineCuadernillo de Ciencias Naturales-Segundo AñoEdgardo Orellana51% (70)
- 12 ElectrocatálisisDocumento30 pagine12 ElectrocatálisisEder CruzadoNessuna valutazione finora
- PRACTICA #1 QII Influencia de La Naturaleza de Las Sustancias en La VelocidadDocumento4 paginePRACTICA #1 QII Influencia de La Naturaleza de Las Sustancias en La VelocidadCamila RodriguezNessuna valutazione finora
- Prueba Icfes 1 1Documento9 paginePrueba Icfes 1 1Fait CarrilloNessuna valutazione finora
- Cuál Es El Objeto de Estudio de La Cinética QuímicaDocumento11 pagineCuál Es El Objeto de Estudio de La Cinética QuímicaseralvagaNessuna valutazione finora
- 01 (TP - Reacciones Químicas I) EA - ABDocumento12 pagine01 (TP - Reacciones Químicas I) EA - ABDavid Alva AlbaNessuna valutazione finora