Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Los Números Cuánticos Son Valores Numéricos Que Nos Indican Las Características de Los Electrones de Los Átomos
Caricato da
JHOVANNY0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
355 visualizzazioni4 pagineTitolo originale
Los números cuánticos son valores numéricos que nos indican las características de los electrones de los átomos.docx
Copyright
© © All Rights Reserved
Formati disponibili
DOCX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
355 visualizzazioni4 pagineLos Números Cuánticos Son Valores Numéricos Que Nos Indican Las Características de Los Electrones de Los Átomos
Caricato da
JHOVANNYCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 4
Los nmeros cunticos son valores numricos que nos
indican las caractersticas de los electrones de los
tomos. Estn basados, desde luego, en la teora
atmica de Neils Bohr que es el modelo atmico ms
aceptado y utilizado en los ltimos tiempos.
Pero adems, la propuesta de Schorodinger,
considerado como el 5 modelo atmico, radica en
describir las caractersticas de todos los electrones de
un tomo, y esto es lo que conocemos como nmero
cunticos.
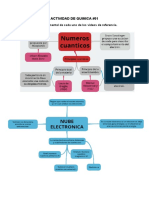
Los nmeros cunticos ms importantes son 4:
Nmero Cuntico Principal.
Nmero Cuntico Secundario.
Nmero Cuntico Magntico.
Nmero Cuntico de Spin.
Nmero Cuntico Principal (n): El nmero cuntico
principal nos indica en que nivel se encuentra el
electrn y por lo tanto tambin el nivel de energa.
Este nmero cuntico toma valores enteros 1, 2, 3, 4,
5, 6, 7.
Nmero Cuntico Secundario (l): Este nmero cuntico
nos indica en que subnivel se encuentra el electrn.
Este nmero cuntico toma valores desde 0 hasta (n 1). Segn el nmero atmico tenemos los valores
para l:
n=1 l = (n-1) = 0 = s "sharp"
n=2 l = (n-1) = 0, 1 = p "principal"
n=3 l = (n-1) = 0, 1, 2 = d "diffuse"
n=4 l = (n-1) = 0, 1, 2, 3 = f "fundamental"
n=5 l = (n-1) = 0, 1, 2, 3, 4 = g
n=6 l = (n-1) = 0, 1, 2, 3, 4, 5 = h
n=7 l = (n-1) = 0, 1, 2, 3, 4, 5, 6 = i
Nmero Cuntico Magntico (m): El nmero cuntico
magntico nos indica las orientaciones de los
orbitalesmagnticos en el espacio. Los orbitales
magnticos son las regiones de la nube electrnica
donde se encuentran los electrones. Este nmero
cuntico depende de l y toma valores desde
-l pasando por cero hasta +l. La frmula para
encontrar cuntos orbitales posee un subnivel es: m =
2l +1
Nmero Cuntico de Spin (s): El nmero cuntico
de spinnos indica el sentido de rotacin en el propio
eje de los electrones en un orbital. Ya sea si se mueve
al igual que las manecillas del reloj, o en sentido
contrario, este nmero cuntico toma los valores de
-1/2 y de +1/2.
Utilizando los 4 nmeros cunticos se puede
especificar dnde se encuentra un determinado
electrn, y los niveles de energa del mismo. Este
tema es importante en el estudio de las radiaciones, la
energa de ionizacin, as como de la energa liberada
por un tomo en una reaccin.
Al utilizar los nmeros cunticos debemos tomar en
cuenta lo siguiente:
El Principio de Exclusin de Pauli dice que un electrn
que ha sido asignado a cierto orbital, es capaz de
existir en 2 estados, que se puede explicar admitiendo
que el electrn puede rotar alrededor de un eje en
cierto sentido o en el sentido opuesto. Estos 2 estados
se describen mediante el nmero cuntico ms que
puede tomar 1 de los 2 valores siguientes: +1/2 y
1/2. Se dice entonces que en un tomo, no puede
haber ms de un electrn con los mismos valores de
los nmeros cunticos n, l , ml y ms.
Potrebbero piacerti anche
- Numeros Cuanticos QuimicaDocumento3 pagineNumeros Cuanticos QuimicaVictor RodriguezNessuna valutazione finora
- Números CuánticosDocumento3 pagineNúmeros CuánticosAshly Gianella Cameron HanncoNessuna valutazione finora
- Números CuánticosDocumento16 pagineNúmeros CuánticosJuanmanuel ValderramaNessuna valutazione finora
- Números Cuánticos PDFDocumento25 pagineNúmeros Cuánticos PDFJorgeNessuna valutazione finora
- Modelo Atómico de BohrDocumento13 pagineModelo Atómico de BohrCarlos SoberanesNessuna valutazione finora
- Quimica Inorganica - Config ElectronicaDocumento2 pagineQuimica Inorganica - Config ElectronicaMaria Florencia AlbarelloNessuna valutazione finora
- Numero Cuantico JENNIFER MAYADocumento15 pagineNumero Cuantico JENNIFER MAYAveronica rieraNessuna valutazione finora
- Química General: 2.3. Configuración Electrónica de Los Átomos y Números CuánticosDocumento3 pagineQuímica General: 2.3. Configuración Electrónica de Los Átomos y Números Cuánticosvictor1080Nessuna valutazione finora
- Clase 3 CienciasQuímica Global 2023 PresentaciónDocumento25 pagineClase 3 CienciasQuímica Global 2023 PresentaciónMillaray BarrosNessuna valutazione finora
- Sesión 4 Números CuánticosDocumento47 pagineSesión 4 Números CuánticosJavl TW Inversiones DevalverdeNessuna valutazione finora
- Numeros CuanticosDocumento4 pagineNumeros CuanticosAlex GeassNessuna valutazione finora
- Trabajo de Quimica 1Documento6 pagineTrabajo de Quimica 1CAMILO ERNESTO HERRAN TORONessuna valutazione finora
- Teoria Cuantica Del AtomoDocumento2 pagineTeoria Cuantica Del AtomoCarlos Alexander L. Hernandez100% (2)
- Modelo Atomico de La Mecanica Cuantica OndulatoriaDocumento13 pagineModelo Atomico de La Mecanica Cuantica Ondulatoriapnada007100% (2)
- Materia y Energía. Estructura Atómica. (Segunda Parte) .Documento25 pagineMateria y Energía. Estructura Atómica. (Segunda Parte) .Fabricio RodríguezNessuna valutazione finora
- Cuestionario de TeoriaDocumento17 pagineCuestionario de TeoriaAna Cristina Ruiz NovoaNessuna valutazione finora
- Guia de Ejercicios de Los Numeros Cuanticos PDFDocumento3 pagineGuia de Ejercicios de Los Numeros Cuanticos PDFJennifer MachiguaNessuna valutazione finora
- Estructura ElectronicaDocumento4 pagineEstructura ElectronicaAnonymous c9vSsdBPNessuna valutazione finora
- Modelo Mecanico Cuántico Del Átomo Semana 2Documento15 pagineModelo Mecanico Cuántico Del Átomo Semana 2Neyib fadul100% (1)
- 1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Documento6 pagine1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Julio Eduardo CiodaroNessuna valutazione finora
- S02 S3+-+materiDocumento28 pagineS02 S3+-+materialejandrozeballos.sjbNessuna valutazione finora
- DiagonalesDocumento5 pagineDiagonalesfbian cirneNessuna valutazione finora
- Guia de Estudio Configuración ElectronicaDocumento10 pagineGuia de Estudio Configuración ElectronicaPaula R. TarifeñoNessuna valutazione finora
- JEDC Numeros CuanticosDocumento3 pagineJEDC Numeros CuanticosJorge DelgadoNessuna valutazione finora
- Laboratorio ElectronesDocumento4 pagineLaboratorio ElectronesJulio Cesar Maldonado CalderonNessuna valutazione finora
- Números Cuánticos y Configuración ElectrónicaDocumento4 pagineNúmeros Cuánticos y Configuración ElectrónicaOrozco Villegas ArlimNessuna valutazione finora
- Números CuánticosDocumento1 paginaNúmeros CuánticosCarlosNessuna valutazione finora
- ppt.S02.s3 - VFDocumento28 pagineppt.S02.s3 - VFEllviss NinamaqueNessuna valutazione finora
- Configuración ElectrónicaDocumento10 pagineConfiguración ElectrónicaJaime Borja SalazarNessuna valutazione finora
- Química Tema 10Documento13 pagineQuímica Tema 102468027Nessuna valutazione finora
- Guía Fisicoquímica Septimo (2126) PDFDocumento3 pagineGuía Fisicoquímica Septimo (2126) PDFRogerus AntoniusNessuna valutazione finora
- Dualidad Onda MateriaDocumento34 pagineDualidad Onda MateriaPablo Ricardo PeressottiNessuna valutazione finora
- Guia Modelo Mecano Cuantico y Configuracion ElectronicaDocumento8 pagineGuia Modelo Mecano Cuantico y Configuracion ElectronicaLily baeza galvezNessuna valutazione finora
- Quimica 2Documento6 pagineQuimica 2Sebastian FrancoNessuna valutazione finora
- Modelo Mecano Cuantico Del Atomo y Configuracion ElectronicaDocumento34 pagineModelo Mecano Cuantico Del Atomo y Configuracion Electronicaveronica gonzalezNessuna valutazione finora
- Lectura 2.2-Números CuánticosDocumento6 pagineLectura 2.2-Números CuánticosAlanis PonceNessuna valutazione finora
- Lectura 2.2-Números Cuánticos EspolDocumento7 pagineLectura 2.2-Números Cuánticos EspolLeyver MartinezNessuna valutazione finora
- Mecanica CuanticaDocumento13 pagineMecanica CuanticaYoSoyChinoNessuna valutazione finora
- Guía Mecánica CuánticaDocumento5 pagineGuía Mecánica CuánticaMarcos Anguita SNessuna valutazione finora
- Tema 1.el Atomo Mecano-CuánticoDocumento9 pagineTema 1.el Atomo Mecano-CuánticojavierNessuna valutazione finora
- TALLER LL QUIMICA PERIODODocumento4 pagineTALLER LL QUIMICA PERIODOMarshald BruhNessuna valutazione finora
- Numeros Cuanticos (Clase 6)Documento5 pagineNumeros Cuanticos (Clase 6)Almonte NabilNessuna valutazione finora
- QUIMICA CinvestavDocumento107 pagineQUIMICA CinvestavBerenice Acevedo HerreraNessuna valutazione finora
- Modelo Mecánico Cuántico Del ÁtomoDocumento8 pagineModelo Mecánico Cuántico Del ÁtomoDaniel Sopla CubasNessuna valutazione finora
- Modelo Mecano Cuc3a1ntico Taller Psu 2018Documento31 pagineModelo Mecano Cuc3a1ntico Taller Psu 2018insaurraldeleonel53Nessuna valutazione finora
- I02N Material S02.s1Documento37 pagineI02N Material S02.s1Aarón M. ReyesNessuna valutazione finora
- Blanco Dorado Beige Ilustrado Líneas Estados de Materia Química InfografíaDocumento1 paginaBlanco Dorado Beige Ilustrado Líneas Estados de Materia Química InfografíaAndrea GarciaNessuna valutazione finora
- TEORIA CUANTICA Configuracion ElectronicaDocumento17 pagineTEORIA CUANTICA Configuracion ElectronicaMaría elizabeth Díaz DíazNessuna valutazione finora
- Guia Deconfiguracion Electronica y Numeros CuanticosDocumento7 pagineGuia Deconfiguracion Electronica y Numeros CuanticosJaviera Isidora Barra AcostaNessuna valutazione finora
- RESUMENDocumento1 paginaRESUMENcastrotovarangel22Nessuna valutazione finora
- Configuración Electrónica (O Periódica) : Modelo Atómico GeneralDocumento15 pagineConfiguración Electrónica (O Periódica) : Modelo Atómico GeneralDaimely GonzalezNessuna valutazione finora
- Número CuánticoDocumento5 pagineNúmero CuánticoMariaCristinaSepulvedaNessuna valutazione finora
- Origen de Los Numeros CuanticosDocumento3 pagineOrigen de Los Numeros CuanticosEmily Gonzales50% (2)
- 1.4 El Átomo de Varios ElectronesDocumento10 pagine1.4 El Átomo de Varios Electronesfuellenin539Nessuna valutazione finora
- Calculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFDocumento17 pagineCalculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFjovaldez64Nessuna valutazione finora
- Calculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFDocumento17 pagineCalculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFJuanita CarrionNessuna valutazione finora
- Calculalos de Numero Cuanticos Quimica InorganicaDocumento17 pagineCalculalos de Numero Cuanticos Quimica InorganicaSidalia Mercedes Taveras100% (1)
- Calculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFDocumento17 pagineCalculaloscuatronmeroscunticosdelorbital 130111162616 Phpapp02 PDFMaría Gonzales PérezNessuna valutazione finora
- TP1 - Números CuánticosDocumento2 pagineTP1 - Números CuánticosEsteban AndradaNessuna valutazione finora
- Inestabilidad de Los Átomos ClásicosDocumento3 pagineInestabilidad de Los Átomos ClásicosWalter Cano100% (1)
- Afaquia y PseudofaquiaDocumento25 pagineAfaquia y PseudofaquiaMaria C.Nessuna valutazione finora
- Imagen Ilustrando La Reflexión Interna Total en Un Vidrio Semicilíndrico de LaboratorioDocumento20 pagineImagen Ilustrando La Reflexión Interna Total en Un Vidrio Semicilíndrico de LaboratorioHenry Smith Núñez VillegasNessuna valutazione finora
- Q 5 Nivel Pamer UNIDocumento554 pagineQ 5 Nivel Pamer UNIAngelaNessuna valutazione finora
- Institución Educativa "San Carlos" Ficha de Trabajo III SecDocumento1 paginaInstitución Educativa "San Carlos" Ficha de Trabajo III SecNataly PACHECO LORENZONessuna valutazione finora
- AlimentosDocumento11 pagineAlimentosGuillermo HerreraNessuna valutazione finora
- MicroscopiosDocumento19 pagineMicroscopiosAquiles ParraNessuna valutazione finora
- Atomo 2023Documento72 pagineAtomo 2023Sebastian PintadoNessuna valutazione finora
- Modelo Atomico de RutherfordDocumento10 pagineModelo Atomico de RutherfordSantiago Vera Milca JehieliNessuna valutazione finora
- Docente 8vo Modelos Atomicos PDFDocumento10 pagineDocente 8vo Modelos Atomicos PDFCarol Ibacache Vera0% (1)
- Informe 01 Fisica IVDocumento9 pagineInforme 01 Fisica IVjfhdrshdjfNessuna valutazione finora
- Tarea 3 - Participación en Simulador de MicrosDocumento21 pagineTarea 3 - Participación en Simulador de MicrosKELLY DE LA HOZNessuna valutazione finora
- Tarea N°4-2Documento4 pagineTarea N°4-2Carlos León PalominoNessuna valutazione finora
- Aplicación de Los Rayos X en CristalografíaDocumento24 pagineAplicación de Los Rayos X en CristalografíaMartinez Morales Natalia AlejandraNessuna valutazione finora
- Punto Por PuntoDocumento34 paginePunto Por PuntoVAlidacion ValNessuna valutazione finora
- Unidad 3 Optica GeometricaDocumento39 pagineUnidad 3 Optica GeometricaInti gonzales de la fuenteNessuna valutazione finora
- Segundo Año Nube ElectronicaDocumento3 pagineSegundo Año Nube Electronicaalexandra lucanoNessuna valutazione finora
- El TelescopioDocumento11 pagineEl TelescopioEdmer SheNessuna valutazione finora
- Optica Full PraxisDocumento4 pagineOptica Full Praxisalberto edwin condori quispeNessuna valutazione finora
- Ciencia s15Documento6 pagineCiencia s15NOHEMY JoyaNessuna valutazione finora
- Actividad #02Documento2 pagineActividad #02Bruno UrteagaNessuna valutazione finora
- Tabla PeriodicaDocumento25 pagineTabla PeriodicaJosé Carlos Torres VarillasNessuna valutazione finora
- Practica 6 - Fisica 4 LabDocumento5 paginePractica 6 - Fisica 4 LabRubén AntonioNessuna valutazione finora
- S16.s2 MaterialDocumento31 pagineS16.s2 MaterialAprende A ConducirNessuna valutazione finora
- 3 Cualidad de La LuzDocumento2 pagine3 Cualidad de La Luzjuliom hernandNessuna valutazione finora
- Ejercicios de Óxidos BásicosDocumento48 pagineEjercicios de Óxidos BásicosNICOLL ITALA VILCA YUCRANessuna valutazione finora
- INFORME LEY DE MOSELEYKarina PDFDocumento3 pagineINFORME LEY DE MOSELEYKarina PDFkarina huayhuaNessuna valutazione finora
- Wuolah Free Tema 1Documento4 pagineWuolah Free Tema 1sergio rocamoraNessuna valutazione finora
- Guia Practica 3 - Quìmica 4tosDocumento7 pagineGuia Practica 3 - Quìmica 4tosManuel MartínezNessuna valutazione finora
- Jal Práctica 2Documento8 pagineJal Práctica 2Luis CaudilloNessuna valutazione finora