Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Informe Qímica UNALM
Caricato da
Saúl Daniel Garrido JacobiTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Informe Qímica UNALM
Caricato da
Saúl Daniel Garrido JacobiCopyright:
Formati disponibili
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA
FACULTAD DE CIENCIAS
DEPARTAMENTO ACADMICO DE QUMICA
CURSO: QUMICA GENERAL LABORATORIO
INFORME DE LA PRCTICA N 3
TTULO DE LA PRCTICA: Determinacin de pureza del carburo de
calcio
DATOS:
Apellidos y nombres
N de matrcula
Facultad
Calvimontes Eguiluz, Daniella Mara
20160466
Ciencias
Biolo
De la Cruz Izarra, Solange
20160096
Ciencias
Biolo
Garrido Jacobi, Mariel
20160102
Ciencias
Biolo
Zapana Caldern, Katherine
20106117
Ciencias
Biolo
PROFESOR DE LABORATORIO: Elizabeth Fuentes
FECHA DEL EXPERIMENTO: 25/ 05/ 16
FECHA DEL INFORME: 31/ 05/ 16
Especi
LA MOLINA LIMA PER
CONTENIDO:
1. Introduccin
2. Revisin de literatura
2.1. Velocidad de reaccin
Para que exista la velocidad de reaccin primero se deben generar colisones
entre las especies qumicas que funcionan como reactantes. As mientras mayor
sea la concentracin, ocurrirn ms colisiones en la reaccin por unidad de
tiempo.
Es as que asegurando su funcionamiento, los reactantes deben tener la energa
mnima para la formacin y ruptura de los enlaces.
2.2. Factores que afectan la velocidad de reaccin
Naturaleza de los reactantes: se refiere a que el tipo de elemento o
compuesto y el medio en el que ocurre la reaccin influyen en su
velocidad.
Concentracin de reactantes: segn la teora de las colisiones la
velocidad de reaccin disminuye mientras la concentracin de los
reactivos disminuye de igual manera.
Temperatura: La velocidad aumenta en medida su temperatura aumente
ya que si incrementa la temperatura la energa cintica es mayor de tal
modo las colisiones que se presenten seran ms constantes y con rangos
de tiempo ms cortos.
Catalizadores: Estas sustancias se encargan de aumentar las velocidades
pero disminuyendo la energa de activacin. Estos no alteran el producto
y tampoco aparecen en la ecuacin.
Presin: Nos indica que la velocidad de reaccin se incrementa si es que
la presin y cambio de volumen son negativas, tambin si es que el
volumen es positivo y la presin negativa.
Ph: Los niveles de ph varan la velocidad ya que pueden desnaturalizar a
los catalizadores biolgicos (enzimas).
2.3. Ley de rapidez
Expresa la rapidez en relacin a su constante y a la concentracin de los
reactantes, elevados a un exponente (no es el coeficiente estequiomtrico)
dicho exponente indica el orden de cada reactante y su suma indica el orden
total de la reaccin.
3. Materiales y mtodos
3.1. Materiales
Equipos y materiales:
- Bagueta o varilla de agitacin
- Bao de hielo
- Cronmetro
- Equipo de bao mara
- Piceta
- Pipeta graduada de 5 mL
- Probeta graduada de 25 mL
- Termmetro de alcohol a escala centgrada
- Tubos de ensayo en gradilla
- Vaso precipitado (baker) de 150 mL
- Vaso precipitado (beaker) de 50 mL
Reactivos:
- cido sulfrico concentrado
- Agua destilada
- Almidn
- Bisulfito de sodio (NaHSO3)
- Yodato de potasio (KIO3)
3.2. Mtodos
A. Determinar el tiempo de reaccin de las disoluciones de yodato de
potasio (KIO3 (ac))a temperatura ambiente
Se colocan en varios tubos de ensayo distintas concentraciones de yodato de
potasio, demostrando que la concentracin hace que la velocidad de
reaccin vare.
La reaccin observada es:
KIO3 (ac)
NaHSO3 (ac) + H2SO4 (ac) I2 (ac) + NaHSO4 (ac) + K2SO4 (ac) + H2O
(l)
Donde el ion yodato reacciona con el ion bisulfito en medio cido y producen
yodo molecular. El tiempo de reaccin se cuantifica desde el momento en
que se vierte el reactivo hasta cuando la coloracin se torna de un azul
oscuro. Esto ocurre ya que el almidn se junta con el yodo formando un
complejo con dicha coloracin.
I2 (ac) + almidn complejo yodo- almidn (color azul oscuro)
B. Determinar el efecto de la temperatura sobre la velocidad de reaccin:
-
4.
5.
6.
7.
8.
A los tubos de ensayo 1 y 2 se les agrega 5 mL de KIO 3 a 0,020 M
A los tubos de ensayo 3 y 4 se les agrega 5 mL de NaHSO 3 a 0,005 M
Se coloca el tubo 1 en el sistema de calentamiento a bao mara, por
30 segundos, posteriormente se toma su temperatura para luego
verter el contenido del tubo 3 en l y se cuantifica el tiempo que
demora en reaccionar, es decir hasta que se torne de color azul oscuro
por la formacin del complejo yodo almidn.
Se coloca el tubo 2 en el sistema de enfriamiento por 3 minutos, se
calcula la temperatura y posteriormente se vierte el contenido del
tubo 4. Se cuantifica el tiempo transcurrido hasta que se forme el
complejo yodo - almidn.
Se toma en cuenta el caso control, de igual modo se calcula su
temperatura y se le agrega el NaHSO3 a 0,005 M, tomando el tiempo
que demora en reaccionar con el yodo.
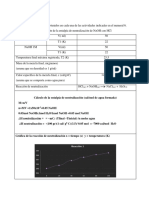
Resultados y discusin
Conclusiones
Recomendaciones
Bibliografa
Anexos
9. Cuestionario
Potrebbero piacerti anche
- Informe Qimica UNALMDocumento4 pagineInforme Qimica UNALMFrank CajahuaringaNessuna valutazione finora
- Factores que afectan la velocidad de reacción químicaDocumento3 pagineFactores que afectan la velocidad de reacción químicaFabiola CuñaNessuna valutazione finora
- INFORME-8 de Quimica GeneralDocumento12 pagineINFORME-8 de Quimica GeneralRaul LlanosNessuna valutazione finora
- INFORME Laboratorio Quimica Pedro FloresDocumento9 pagineINFORME Laboratorio Quimica Pedro FloresJoelDeLaCruzGonzales100% (2)
- Informe 11Documento11 pagineInforme 11Ricky PrudencioNessuna valutazione finora
- Unalm Quim Info 7Documento17 pagineUnalm Quim Info 7Claudio Tajadillo0% (1)
- Informe 11Documento19 pagineInforme 11Lemon Tea75% (4)
- Informe 3Documento16 pagineInforme 3Jhosep Palomino BustinzaNessuna valutazione finora
- Bio Cuestionario 9Documento2 pagineBio Cuestionario 9Lemon TeaNessuna valutazione finora
- Quimica InformeDocumento8 pagineQuimica InformeWilliam CuriNessuna valutazione finora
- TermoquímicaDocumento18 pagineTermoquímicaGianlucca Arbocco Bottger0% (2)
- INFORME-7Documento7 pagineINFORME-7AnaisBriggitJacintoChavezNessuna valutazione finora
- Determinación de la concentración de ácido acético en vinagre comercial mediante titulación ácido-baseDocumento14 pagineDeterminación de la concentración de ácido acético en vinagre comercial mediante titulación ácido-baseRosmery Gonzales100% (1)
- Informe de Laboratorio 9-Grupo 5JDocumento21 pagineInforme de Laboratorio 9-Grupo 5JKaren Esperanza Alvarez GomezNessuna valutazione finora
- Unalm Quim Info 6Documento17 pagineUnalm Quim Info 6Claudio Tajadillo33% (3)
- Informe # 10 UNALMDocumento18 pagineInforme # 10 UNALMXiomara Navarro100% (2)
- Reproducción celular y molecular en plantasDocumento9 pagineReproducción celular y molecular en plantasYulizza TallNessuna valutazione finora
- Informe 11 UnalmDocumento13 pagineInforme 11 UnalmMaria Fe CubaNessuna valutazione finora
- Informe 9 Bioquimica UnalmDocumento5 pagineInforme 9 Bioquimica UnalmJesus Miguel Velarde Valqui0% (1)
- Informe 2 OrgánicaDocumento11 pagineInforme 2 OrgánicaEstefany Moreno Valenzuela0% (1)
- Kps de Ca(OH)2 y efecto de ion comúnDocumento18 pagineKps de Ca(OH)2 y efecto de ion comúnKaren Esperanza Alvarez Gomez100% (1)
- Informe 8 PDFDocumento20 pagineInforme 8 PDFXiomara NavarroNessuna valutazione finora
- Informe Buffer (Química General) - UNALMDocumento12 pagineInforme Buffer (Química General) - UNALMAndres Atilio Durand CrucesNessuna valutazione finora
- Informe 3 - Determinación Experimental de Biomoléculas IIDocumento11 pagineInforme 3 - Determinación Experimental de Biomoléculas IIRicardo CarrilloNessuna valutazione finora
- Informe 6Documento7 pagineInforme 6Manayay EverNessuna valutazione finora
- Informe Diversidad de La VidaDocumento23 pagineInforme Diversidad de La Vidaleonardo aquino100% (1)
- Informe Práctica 1-Determinación de Algunas Constantes Físicas de Compuestos OrgánicosDocumento9 pagineInforme Práctica 1-Determinación de Algunas Constantes Físicas de Compuestos OrgánicosSergio Andres Rincon RodriguezNessuna valutazione finora
- Informe Constantes Físicas (Química Orgánica) - UNALMDocumento11 pagineInforme Constantes Físicas (Química Orgánica) - UNALMAndres Atilio Durand CrucesNessuna valutazione finora
- Informe de Quimica Orgánica #5 ExtracciónDocumento8 pagineInforme de Quimica Orgánica #5 Extracciónxmarioxx100% (1)
- Informe de Laboratorio 2 UNALMDocumento27 pagineInforme de Laboratorio 2 UNALMXiomara Navarro67% (3)
- Informe Destilación (Química Orgánica) - UNALMDocumento19 pagineInforme Destilación (Química Orgánica) - UNALMAndres Atilio Durand CrucesNessuna valutazione finora
- Hid Ro Carb UrosDocumento7 pagineHid Ro Carb UrosTANIA DAMARIS CABRERA SALASNessuna valutazione finora
- Preparación de Soluciones Ácidas y Básicas.Documento6 paginePreparación de Soluciones Ácidas y Básicas.SINTIA LUQUE CARRIONNessuna valutazione finora
- Informe 4. AnalíticaDocumento37 pagineInforme 4. AnalíticaJhon Cesar Paucar FigueroaNessuna valutazione finora
- Estudio Experimental de AlcoholesDocumento10 pagineEstudio Experimental de AlcoholesBENITES BETETA LUIS FERNANDONessuna valutazione finora
- Determinación de la Constante de Solubilidad (Kps) del Hidróxido de Calcio y Efecto del Ión ComúnDocumento11 pagineDeterminación de la Constante de Solubilidad (Kps) del Hidróxido de Calcio y Efecto del Ión ComúnRaul Llanos100% (1)
- Informe Ciclo CelularDocumento9 pagineInforme Ciclo CelularAnthony Jeferson Quispe CondoriNessuna valutazione finora
- Sociedad y Cultura, 2022-IDocumento7 pagineSociedad y Cultura, 2022-IJose Humberto Esquivel CurichimbaNessuna valutazione finora
- Tipos de Enlaces y Reacciones-UnalmDocumento21 pagineTipos de Enlaces y Reacciones-UnalmCielo TeránNessuna valutazione finora
- Informe 7 TermoquímicaDocumento18 pagineInforme 7 TermoquímicaSusana Belen Rojas HinojosaNessuna valutazione finora
- Informe Cristalización - Mesa 3 - Grupo JuevesDocumento15 pagineInforme Cristalización - Mesa 3 - Grupo JuevesLyli QuirozNessuna valutazione finora
- Practica #1: Desnaturalización y Precipitación de ProteínasDocumento13 paginePractica #1: Desnaturalización y Precipitación de ProteínasAivanjo Nuñez Paulino50% (2)
- Soluciones Amortiguadoras y Capacidad AmortiguadoraDocumento6 pagineSoluciones Amortiguadoras y Capacidad AmortiguadoraJaviipaz CarvajalNessuna valutazione finora
- EXPERIMENTO 6 Reacciondes de HidrocarburosDocumento6 pagineEXPERIMENTO 6 Reacciondes de HidrocarburosSergio Bazan Salinas0% (1)
- OrgánicaDocumento10 pagineOrgánicaDey DeyNessuna valutazione finora
- Informe 05Documento8 pagineInforme 05Ronal AH100% (1)
- Pca 7 Mesa 1 Lunes (2-4) PMDocumento9 paginePca 7 Mesa 1 Lunes (2-4) PMSergio Santillan100% (1)
- Reaccion Del Zinc Con El Acido ClorhiDocumento3 pagineReaccion Del Zinc Con El Acido ClorhiKaterin Espinoza0% (1)
- Práctica #3 de BiologíaDocumento8 paginePráctica #3 de BiologíaMaryoriThaniaGomezNessuna valutazione finora
- Extracción de antocianinas del maíz moradoDocumento15 pagineExtracción de antocianinas del maíz moradoGabriel P-changNessuna valutazione finora
- Informe - Constantes FísicasDocumento18 pagineInforme - Constantes FísicasDavid Roncal Romero100% (1)
- Química Informe N10Documento12 pagineQuímica Informe N10Arley GutarraNessuna valutazione finora
- Trabajo Final de Bioquimica PDFDocumento12 pagineTrabajo Final de Bioquimica PDFYoshue Yory Merlin100% (1)
- INFORME Aldehidos y CetonasDocumento16 pagineINFORME Aldehidos y CetonasMacyory Gutierrez100% (1)
- Informe de Lípidos Unalm DesarrolladoDocumento13 pagineInforme de Lípidos Unalm DesarrolladoMarielit Sharid Arredondo Quiroz100% (1)
- Informe Titulación Ácido-Base UNALMDocumento14 pagineInforme Titulación Ácido-Base UNALMAndres Atilio Durand Cruces100% (1)
- PRACTICA #7 de QuimicaDocumento6 paginePRACTICA #7 de QuimicaMarianela Sanga FrancoNessuna valutazione finora
- INFORME 2 - QUIMICA GENERAL. Operaciones y Procesos Unitarios en El LaboratorioDocumento14 pagineINFORME 2 - QUIMICA GENERAL. Operaciones y Procesos Unitarios en El LaboratorioAylin Diaz MonsalveNessuna valutazione finora
- Informe de PracticDocumento8 pagineInforme de PracticRamiro AmariNessuna valutazione finora
- Velocidad de Las Reacciones QuímicasDocumento11 pagineVelocidad de Las Reacciones QuímicasVania Y. Zamudio0% (1)
- Estructura Funcion ProteinasDocumento33 pagineEstructura Funcion ProteinasSaúl Daniel Garrido JacobiNessuna valutazione finora
- TutoriaDocumento2 pagineTutoriaSaúl Daniel Garrido JacobiNessuna valutazione finora
- Estadistica para Biologia y Ciencias de La Salud 3a EdDocumento744 pagineEstadistica para Biologia y Ciencias de La Salud 3a EdKevin Jaico100% (3)
- Guia Norma Vancouver PDFDocumento6 pagineGuia Norma Vancouver PDFelelefanterozadoNessuna valutazione finora
- 04 NeoplasiaDocumento23 pagine04 NeoplasiaSergio Palacios CompeanNessuna valutazione finora
- 0004863952555Documento4 pagine0004863952555Saúl Daniel Garrido JacobiNessuna valutazione finora
- Textos continuos: identifica tipos de textoDocumento4 pagineTextos continuos: identifica tipos de textoAlex MatiasNessuna valutazione finora
- Ciclo KalinaDocumento12 pagineCiclo KalinaLuis Fernando HernándezNessuna valutazione finora
- Cuestionario de Química Orgánica para Ingreso a Medicina de la Universidad Nacional de CaaguazúDocumento2 pagineCuestionario de Química Orgánica para Ingreso a Medicina de la Universidad Nacional de CaaguazúAraceli BarriosNessuna valutazione finora
- Prueba hidrostática cañeríaDocumento5 paginePrueba hidrostática cañeríaGabo ContrerasNessuna valutazione finora
- 6 Transformadores+Documento55 pagine6 Transformadores+cesarchiletNessuna valutazione finora
- Historia Del Equipo de Cómputo PDFDocumento20 pagineHistoria Del Equipo de Cómputo PDFKellyJ.ToledoNessuna valutazione finora
- Interacción Nuclear Fuerte - Wikipedia, La Enciclopedia LibreDocumento26 pagineInteracción Nuclear Fuerte - Wikipedia, La Enciclopedia LibreOmar SánchezNessuna valutazione finora
- Formulario Basico de TermodinamicaDocumento5 pagineFormulario Basico de TermodinamicaJose CedeñoNessuna valutazione finora
- 02 - Problemas Adicionales (Precipitación)Documento2 pagine02 - Problemas Adicionales (Precipitación)tamia.labadie957hidebusiness.xyzNessuna valutazione finora
- Manuales de Cocinas Enxuta 2016Documento32 pagineManuales de Cocinas Enxuta 2016Rony CarroNessuna valutazione finora
- Problemas de Bromatologia II KjeldahlDocumento2 pagineProblemas de Bromatologia II KjeldahlRichard CTNessuna valutazione finora
- Cooper PracticaDocumento1 paginaCooper PracticaWILLIAM YOEL PARI CUTIPANessuna valutazione finora
- MarcoDocumento6 pagineMarcoBriiznaa VtNessuna valutazione finora
- Auto Des ArrolloDocumento76 pagineAuto Des Arrolloroyler lazaroNessuna valutazione finora
- Mini Splits Inverter - Folleto Comercial (Español)Documento4 pagineMini Splits Inverter - Folleto Comercial (Español)Pablo SepulvedaNessuna valutazione finora
- Informe LaboratorioDocumento2 pagineInforme LaboratorioMegatex 1903Nessuna valutazione finora
- Introducción A Interactive PhysicsDocumento7 pagineIntroducción A Interactive PhysicsAlexander TubónNessuna valutazione finora
- Sustancias Puras y MezcladasDocumento25 pagineSustancias Puras y MezcladasAngy HidalgoNessuna valutazione finora
- Ejercicios CroclipDocumento4 pagineEjercicios CroclipJavier Nolasco ArguetaNessuna valutazione finora
- Semana 12 - Física IDocumento2 pagineSemana 12 - Física IAustin de los BackyardigansNessuna valutazione finora
- Ejercicios AutomatismosDocumento7 pagineEjercicios Automatismossamuel baltazar fructuosoNessuna valutazione finora
- LocomotoraDocumento29 pagineLocomotoraFabio RomeroNessuna valutazione finora
- Método Implícito D.F. EDP ParabólicaDocumento2 pagineMétodo Implícito D.F. EDP ParabólicaMito Shi ToaNessuna valutazione finora
- Equilibrio de fases y problemas de equilibrio líquido-vaporDocumento23 pagineEquilibrio de fases y problemas de equilibrio líquido-vapornicolNessuna valutazione finora
- PDF 1 Desigualdades Lineales 1variable m1 l2Documento17 paginePDF 1 Desigualdades Lineales 1variable m1 l2Fabian Gomez AlvarezNessuna valutazione finora
- Manual Vertor Espa - Ol PDFDocumento70 pagineManual Vertor Espa - Ol PDFadrian MXNessuna valutazione finora
- Practica 5 Elemento RoscadoDocumento12 paginePractica 5 Elemento RoscadoSearch3773 vNessuna valutazione finora
- Taller 2 Grupo 54Documento7 pagineTaller 2 Grupo 54JeissonNessuna valutazione finora
- 4 - Motor SAA6D114E-3 (Modo de Compatibilidad)Documento28 pagine4 - Motor SAA6D114E-3 (Modo de Compatibilidad)Daniel Marx88% (8)
- Ip1 SMDDDocumento3 pagineIp1 SMDDdiego SNessuna valutazione finora