Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Numeros Cuanticos Quimica
Caricato da
Victor Rodriguez0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
167 visualizzazioni3 pagineLos números cuánticos describen las características de los electrones en un átomo y consisten en cuatro números: el número cuántico principal indica el nivel de energía del electrón, el número cuántico secundario indica el subnivel, el número cuántico magnético indica la orientación del orbital, y el número cuántico de spin indica el sentido de rotación del electrón. Los números cuánticos definen la ubicación y configuración de los electrones en un átomo.
Descrizione originale:
teoria acerca de los numeros cuanticos para la materia de quimica
Titolo originale
numeros cuanticos quimica
Copyright
© © All Rights Reserved
Formati disponibili
DOCX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoLos números cuánticos describen las características de los electrones en un átomo y consisten en cuatro números: el número cuántico principal indica el nivel de energía del electrón, el número cuántico secundario indica el subnivel, el número cuántico magnético indica la orientación del orbital, y el número cuántico de spin indica el sentido de rotación del electrón. Los números cuánticos definen la ubicación y configuración de los electrones en un átomo.
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
167 visualizzazioni3 pagineNumeros Cuanticos Quimica
Caricato da
Victor RodriguezLos números cuánticos describen las características de los electrones en un átomo y consisten en cuatro números: el número cuántico principal indica el nivel de energía del electrón, el número cuántico secundario indica el subnivel, el número cuántico magnético indica la orientación del orbital, y el número cuántico de spin indica el sentido de rotación del electrón. Los números cuánticos definen la ubicación y configuración de los electrones en un átomo.
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 3
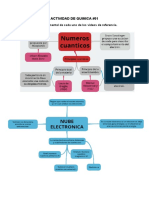
Nmeros Cunticos
Los nmeros cunticos son valores numricos que nos indican las
caractersticas de los electrones de los tomos. Estn basados, desde luego, en
la teora atmica de Neils Bohr que es el modelo atmico ms aceptado y
utilizado en los ltimos tiempos.
Pero adems, la propuesta de Schorodinger, considerado como el 5 modelo
atmico, radica en describir las caractersticas de todos los electrones de un
tomo, y esto es lo que conocemos como nmero cunticos.
Los nmeros cunticos ms importantes son 4:
Nmero Cuntico Principal.
Nmero Cuntico Secundario.
Nmero Cuntico Magntico.
Nmero Cuntico de Spin.
Nmero Cuntico Principal (n): El nmero cuntico principal nos indica en
que nivel se encuentra el electrn y por lo tanto tambin el nivel de energa.
Este nmero cuntico toma valores enteros 1, 2, 3, 4, 5, 6, 7.
Nmero Cuntico Secundario (l): Este nmero cuntico nos indica en
que subnivel se encuentra el electrn. Este nmero cuntico toma valores
desde 0 hasta (n - 1). Segn el nmero atmico tenemos los valores para l:
n=1 l = (n-1) = 0 = s "sharp"
n=2 l = (n-1) = 0, 1 = p "principal"
n=3 l = (n-1) = 0, 1, 2 = d "diffuse"
n=4 l = (n-1) = 0, 1, 2, 3 = f "fundamental"
n=5 l = (n-1) = 0, 1, 2, 3, 4 = g
n=6 l = (n-1) = 0, 1, 2, 3, 4, 5 = h
n=7 l = (n-1) = 0, 1, 2, 3, 4, 5, 6 = i
Nmero Cuntico Magntico (m): El nmero cuntico magntico nos indica
las orientaciones de los orbitalesmagnticos en el espacio. Los orbitales
magnticos son las regiones de la nube electrnica donde se encuentran los
electrones. Este nmero cuntico depende de l y toma valores desde
-l pasando por cero hasta +l. La frmula para encontrar cuntos orbitales
posee un subnivel es: m = 2l +1
Nmero Cuntico de Spin (s): El nmero cuntico de spinnos indica
el sentido de rotacin en el propio eje de los electrones en un orbital. Ya sea si
se mueve al igual que las manecillas del reloj, o en sentido contrario, este
nmero cuntico toma los valores de -1/2 y de +1/2.
Utilizando los 4 nmeros cunticos se puede especificar dnde se encuentra un
determinado electrn, y los niveles de energa del mismo. Este tema es
importante en el estudio de las radiaciones, la energa de ionizacin, as como
de la energa liberada por un tomo en una reaccin.
Al utilizar los nmeros cunticos debemos tomar en cuenta lo siguiente:
El Principio de Exclusin de Pauli dice que un electrn que ha sido asignado
a cierto orbital, es capaz de existir en 2 estados, que se puede explicar
admitiendo que el electrn puede rotar alrededor de un eje en cierto sentido o
en el sentido opuesto. Estos 2 estados se describen mediante el nmero
cuntico ms que puede tomar 1 de los 2 valores siguientes: +1/2 y 1/2. Se
dice entonces que en un tomo, no puede haber ms de un electrn con los
mismos valores de los nmeros cunticos n, l , ml y ms.
La Regla de Hund establece que cuando varios electrones ocupan orbitales
degenerados, lo hacen, en lo posible, ocupando orbitales diferentes y con los
spines desapareados paralelos. En otras palabras cuando se llena orbitales con
un mismo nivel de energa, o en un mismo subnivel, se debe empezar llenando
la mitad del subnivel con electrones de spin +1/2 para luego proceder a llenar
los subniveles con electrones de spin contrario (-1/2).
Debido a su carcter ondulatorio, no se puede precisar la posicin de un electrn, nicamente
podemos hablar de la probabilidad de hallarlo en un punto determinado del espacio. La regin
en la que hay ms de un 90% de probabilidad de hallar el electrn es lo que conocemos
como orbital atmico. As, obtenemos los nmeros cunticos, n, l y m que definen
totalmente un orbital, mientras que los 4 nmeros cunticos n, l, m y s definen totalmente un
electrn que ocupa un orbital.
Los nmeros cunticos son:
El nmero cuntico principal, n, nos indica el nivel energtico en el que nos hallamos.
El nmero cuntico orbital o azimutal, l, nos indica el tipo de orbital: s, p, d o f.
Orbitales tipo s: tiene un valor de l=0, y presentan simetra esfrica.
Orbitales tipo p: tienen un valor de l=1 y 3 posibles valores de m=-1,0,1, es decir, tres
orientaciones. As, tendremos los orbitales px, py y pz. Como son 3 orbitales cabrn en total 6
electrones (2 en cada uno). Su forma es lobular.
Orbitales tipo d: tienen un valor de l=2 y 5 posibles valores de m=-2,-1,0,1,2, es decir, 5
orientaciones distintas. Caben 10 electrones.
Orbitales tipo f: tienen un valor de l=3 y, por tanto, 7 posibles valores de m=-3,-2,-1,0,1,2,3,
7 orientaciones distintas. Caben 14 electrones.
El nmero cuntico magntico, m, nos indica la orientacin de los orbitales.
Potrebbero piacerti anche
- Los Números Cuánticos Son Valores Numéricos Que Nos Indican Las Características de Los Electrones de Los ÁtomosDocumento4 pagineLos Números Cuánticos Son Valores Numéricos Que Nos Indican Las Características de Los Electrones de Los ÁtomosJHOVANNYNessuna valutazione finora
- Números CuánticosDocumento3 pagineNúmeros CuánticosAshly Gianella Cameron HanncoNessuna valutazione finora
- Números CuánticosDocumento16 pagineNúmeros CuánticosJuanmanuel ValderramaNessuna valutazione finora
- Números Cuánticos PDFDocumento25 pagineNúmeros Cuánticos PDFJorgeNessuna valutazione finora
- 1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Documento6 pagine1 Guia Numeros Cuanticos 9a - 3P 19-09-2019Julio Eduardo CiodaroNessuna valutazione finora
- Guia de Estudio Configuración ElectronicaDocumento10 pagineGuia de Estudio Configuración ElectronicaPaula R. TarifeñoNessuna valutazione finora
- Quimica Inorganica - Config ElectronicaDocumento2 pagineQuimica Inorganica - Config ElectronicaMaria Florencia AlbarelloNessuna valutazione finora
- Configuración ElectrónicaDocumento10 pagineConfiguración ElectrónicaJaime Borja SalazarNessuna valutazione finora
- Modelo Atómico de BohrDocumento13 pagineModelo Atómico de BohrCarlos SoberanesNessuna valutazione finora
- Química General: 2.3. Configuración Electrónica de Los Átomos y Números CuánticosDocumento3 pagineQuímica General: 2.3. Configuración Electrónica de Los Átomos y Números Cuánticosvictor1080Nessuna valutazione finora
- Química: Cuadro Comparativo de Números CuánticosDocumento2 pagineQuímica: Cuadro Comparativo de Números CuánticosEdgar Ramon Beltran LopezNessuna valutazione finora
- Sesión 4 Números CuánticosDocumento47 pagineSesión 4 Números CuánticosJavl TW Inversiones DevalverdeNessuna valutazione finora
- Teoria Cuantica Del AtomoDocumento2 pagineTeoria Cuantica Del AtomoCarlos Alexander L. Hernandez100% (2)
- Guia de Ejercicios de Los Numeros Cuanticos PDFDocumento3 pagineGuia de Ejercicios de Los Numeros Cuanticos PDFJennifer MachiguaNessuna valutazione finora
- DiagonalesDocumento5 pagineDiagonalesfbian cirneNessuna valutazione finora
- TP1 - Números CuánticosDocumento2 pagineTP1 - Números CuánticosEsteban AndradaNessuna valutazione finora
- Configuración Electrónica (O Periódica) : Modelo Atómico GeneralDocumento15 pagineConfiguración Electrónica (O Periódica) : Modelo Atómico GeneralDaimely GonzalezNessuna valutazione finora
- Estructura ElectronicaDocumento4 pagineEstructura ElectronicaAnonymous c9vSsdBPNessuna valutazione finora
- Números CuánticosDocumento1 paginaNúmeros CuánticosCarlosNessuna valutazione finora
- Guía de Química Evaluada 1Documento3 pagineGuía de Química Evaluada 1Mónica Figueroa VargasNessuna valutazione finora
- Guia Deconfiguracion Electronica y Numeros CuanticosDocumento7 pagineGuia Deconfiguracion Electronica y Numeros CuanticosJaviera Isidora Barra AcostaNessuna valutazione finora
- Niveles de EnergíaDocumento9 pagineNiveles de EnergíaDaniel Hernandez ClaroNessuna valutazione finora
- S3 Numeros CuanticosDocumento5 pagineS3 Numeros CuanticosVA FANessuna valutazione finora
- Tema 1.el Atomo Mecano-CuánticoDocumento9 pagineTema 1.el Atomo Mecano-CuánticojavierNessuna valutazione finora
- Guía 8°básico QuimicaDocumento23 pagineGuía 8°básico QuimicaJessicaValdivia100% (1)
- Que Son Los Números CuánticosDocumento4 pagineQue Son Los Números CuánticosMoisesNessuna valutazione finora
- Química Tema 10Documento13 pagineQuímica Tema 102468027Nessuna valutazione finora
- Origen de Los Numeros CuanticosDocumento3 pagineOrigen de Los Numeros CuanticosEmily Gonzales50% (2)
- Guía Mecánica CuánticaDocumento5 pagineGuía Mecánica CuánticaMarcos Anguita SNessuna valutazione finora
- Numeros Cuanticos (Clase 6)Documento5 pagineNumeros Cuanticos (Clase 6)Almonte NabilNessuna valutazione finora
- QUIMICA CinvestavDocumento107 pagineQUIMICA CinvestavBerenice Acevedo HerreraNessuna valutazione finora
- Ecuación de SchrodingerDocumento8 pagineEcuación de SchrodingerVideosNessuna valutazione finora
- Configuración Electrónica y Uniones Químicas PDFDocumento41 pagineConfiguración Electrónica y Uniones Químicas PDFRennaki EstudiosNessuna valutazione finora
- JEDC Numeros CuanticosDocumento3 pagineJEDC Numeros CuanticosJorge DelgadoNessuna valutazione finora
- Qué Son Los Niveles de EnergíaDocumento8 pagineQué Son Los Niveles de EnergíaAnthony JG100% (2)
- Guia #3Documento9 pagineGuia #3Santiago Jozef Santiago GutierrezNessuna valutazione finora
- Los Números Cuánticos Se DenominanDocumento5 pagineLos Números Cuánticos Se DenominanManuel MendézNessuna valutazione finora
- Lectura 2.2-Números Cuánticos EspolDocumento7 pagineLectura 2.2-Números Cuánticos EspolLeyver MartinezNessuna valutazione finora
- Modelo Mecanico CuanticoDocumento27 pagineModelo Mecanico CuanticokarinNessuna valutazione finora
- S02 S3+-+materiDocumento28 pagineS02 S3+-+materialejandrozeballos.sjbNessuna valutazione finora
- Materia y Energía. Estructura Atómica. (Segunda Parte) .Documento25 pagineMateria y Energía. Estructura Atómica. (Segunda Parte) .Fabricio RodríguezNessuna valutazione finora
- TEORIA CUANTICA Configuracion ElectronicaDocumento17 pagineTEORIA CUANTICA Configuracion ElectronicaMaría elizabeth Díaz DíazNessuna valutazione finora
- Clase 3 CienciasQuímica Global 2023 PresentaciónDocumento25 pagineClase 3 CienciasQuímica Global 2023 PresentaciónMillaray BarrosNessuna valutazione finora
- Act. Cuestionario #2Documento3 pagineAct. Cuestionario #2Juan SánchezNessuna valutazione finora
- Números CuánticosDocumento11 pagineNúmeros CuánticosJaimeNessuna valutazione finora
- Configuración ElectrónicaDocumento23 pagineConfiguración ElectrónicaJuan HernandezNessuna valutazione finora
- MODELO MECANICO CUANTICO DEL ATOMO fH76bT5Documento9 pagineMODELO MECANICO CUANTICO DEL ATOMO fH76bT5Natha GarciaNessuna valutazione finora
- Guía de Trabajo Configuración Electrónica II Medio QuímicaDocumento9 pagineGuía de Trabajo Configuración Electrónica II Medio Químicaprofesorcienciaslab100% (1)
- Numero Cuantico JENNIFER MAYADocumento15 pagineNumero Cuantico JENNIFER MAYAveronica rieraNessuna valutazione finora
- Teorías Atómicas de Niels Bohr, Sommerfeld, SchrodingerDocumento6 pagineTeorías Atómicas de Niels Bohr, Sommerfeld, SchrodingerBRANDON SANCHEZNessuna valutazione finora
- Cuestionario de TeoriaDocumento17 pagineCuestionario de TeoriaAna Cristina Ruiz NovoaNessuna valutazione finora
- Configuración Electrónica QUIMICA TAREADocumento3 pagineConfiguración Electrónica QUIMICA TAREAGibran MendozaNessuna valutazione finora
- Configuración Electrónica de Un ÁtomoDocumento13 pagineConfiguración Electrónica de Un ÁtomoernestolavNessuna valutazione finora
- Trabajo de Quimica 1Documento6 pagineTrabajo de Quimica 1CAMILO ERNESTO HERRAN TORONessuna valutazione finora
- Laboratorio ElectronesDocumento4 pagineLaboratorio ElectronesJulio Cesar Maldonado CalderonNessuna valutazione finora
- Guia 1 de Quimica Tercer TrimestreDocumento5 pagineGuia 1 de Quimica Tercer TrimestreBrayam RamirezNessuna valutazione finora
- ADA 1 QuimicaDocumento8 pagineADA 1 QuimicaValente GunterNessuna valutazione finora
- Configuracion ElectronicaDocumento7 pagineConfiguracion ElectronicaNAHOMY ALEXANDRA MEZA ALFARONessuna valutazione finora
- Modelos AtómicosDocumento8 pagineModelos AtómicosLeilaNessuna valutazione finora
- SubestacionesDocumento9 pagineSubestacionesVictor RodriguezNessuna valutazione finora
- Aplicaciones de La Estequiometria en La IndustriaDocumento1 paginaAplicaciones de La Estequiometria en La Industriarichard_fort100% (1)
- Nanotecnología Aplicada en La Energía SolarDocumento3 pagineNanotecnología Aplicada en La Energía SolarVictor RodriguezNessuna valutazione finora
- Capitulo 4 TermodinamicaDocumento9 pagineCapitulo 4 TermodinamicaVictor RodriguezNessuna valutazione finora
- ALIPOtec DudasDocumento5 pagineALIPOtec DudasVictor RodriguezNessuna valutazione finora
- Dos Barras S+ Lidas Cil+¡ndricas AB y BC (EJERCICIOS RESUELTOS RM)Documento24 pagineDos Barras S+ Lidas Cil+¡ndricas AB y BC (EJERCICIOS RESUELTOS RM)piervich97% (105)
- Principio de DualidadDocumento3 paginePrincipio de DualidadVictor RodriguezNessuna valutazione finora
- El Transformador TrifasicoDocumento7 pagineEl Transformador TrifasicoVictor RodriguezNessuna valutazione finora
- Fuego y PrevencionDocumento21 pagineFuego y PrevencionYENIFER ANDREA PAVANessuna valutazione finora
- COTIZACION Jorge AltuzarraDocumento5 pagineCOTIZACION Jorge Altuzarracandresfigueroa21Nessuna valutazione finora
- Ensayo de CapilaridadDocumento2 pagineEnsayo de CapilaridadfabianpadillavNessuna valutazione finora
- HidraulicaDocumento9 pagineHidraulicaWuilly SotoNessuna valutazione finora
- 1414-L Práctica 9 Síntesis de BaTiO3 Por Método de Sol-GelDocumento6 pagine1414-L Práctica 9 Síntesis de BaTiO3 Por Método de Sol-GelJonathan Saviñon de los SantosNessuna valutazione finora
- Xdocs - PL Guia Termodinamica Aplicada I 4Documento5 pagineXdocs - PL Guia Termodinamica Aplicada I 4elpilanNessuna valutazione finora
- Juntas y SoldadurasDocumento112 pagineJuntas y SoldadurasRoni Ovalle VegaNessuna valutazione finora
- Informe de Constante de AcidezDocumento8 pagineInforme de Constante de Acidezjulian david lopez labradaNessuna valutazione finora
- Ejercicios de Auxiliatura Termodinámica - Segundo Parcial (Alvaro Lazo) PDFDocumento17 pagineEjercicios de Auxiliatura Termodinámica - Segundo Parcial (Alvaro Lazo) PDFAlvaro LazoNessuna valutazione finora
- Separacion Por MembranasDocumento2 pagineSeparacion Por MembranasClau Julio RodeloNessuna valutazione finora
- Ex InoDocumento2 pagineEx InoPatricio RosalinNessuna valutazione finora
- Informe 7 - Grupo 9 LeónDocumento12 pagineInforme 7 - Grupo 9 Leónjuan BarretoNessuna valutazione finora
- Tema4. Estudio de Aldehídos y Cetonas. Tarea 3 y 4Documento6 pagineTema4. Estudio de Aldehídos y Cetonas. Tarea 3 y 4García Romero MelanieNessuna valutazione finora
- FISICADocumento4 pagineFISICAWilson Marconi100% (1)
- Dopado de SemiconductoresDocumento11 pagineDopado de SemiconductoresLalo JMNessuna valutazione finora
- ApuntesDocumento123 pagineApuntesMontserrat ArvizuNessuna valutazione finora
- C Sem18 QuímicaDocumento5 pagineC Sem18 QuímicaEG YasadiNessuna valutazione finora
- HvacDocumento14 pagineHvacSamanta ChxvezNessuna valutazione finora
- Motores de Combustión Interna IDocumento49 pagineMotores de Combustión Interna IFranklin BoadaNessuna valutazione finora
- Unidad 4 InvestigaciónDocumento9 pagineUnidad 4 InvestigaciónJocy ZamoraNessuna valutazione finora
- Informe PracticoDocumento3 pagineInforme PracticoMishell LemacheNessuna valutazione finora
- Evaluacion de Columnas de Fraccionamiento Con Platos PerforadosDocumento12 pagineEvaluacion de Columnas de Fraccionamiento Con Platos PerforadosChiaraGrassoNessuna valutazione finora
- CCHP DatosDocumento21 pagineCCHP DatosManuel MedinaNessuna valutazione finora
- Determinación de CO2 Prueba de LaboratorioDocumento4 pagineDeterminación de CO2 Prueba de LaboratorioCesarIsacupeNessuna valutazione finora
- Ciclo de Carnot y La Segunda LeyDocumento7 pagineCiclo de Carnot y La Segunda LeyAlvaro MoryNessuna valutazione finora
- ..Documento6 pagine..JaritzaNessuna valutazione finora
- PH de Mezcla de AcidosDocumento6 paginePH de Mezcla de AcidosDaniel PrepaNessuna valutazione finora
- Laboratorio de Química Básica Numro 6Documento16 pagineLaboratorio de Química Básica Numro 6AnnaAncietaNessuna valutazione finora
- 7-Equilibrios Acido Base IIDocumento33 pagine7-Equilibrios Acido Base IIGabriela Margarita Loza CasaNessuna valutazione finora
- Elementos y ÁtomosDocumento40 pagineElementos y Átomosvidama92% (13)