Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Lista de Exercicios Potenciometria e Condutimetria
Caricato da
Iuri GorneCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Lista de Exercicios Potenciometria e Condutimetria
Caricato da
Iuri GorneCopyright:
Formati disponibili
QUI 221 - Anlise Instrumental A
Fernando Barboza Egreja Filho
ICEx Departamento de Qumica
LISTA DE EXERCCIO - POTENCIOMETRIA
1) Defina e exemplifique:
a- eletrodo de referncia;
b- eletrodo indicador;
c- eletrodo de 3a classe;
d- coeficiente de seletividade.
2) O que potencial de juno lquida e como pode ser minimizado?
3) Mostre como o potencial de um eletrodo de Cu/CuS varia com a atividade do on S 2- e
calcule o E0 para a seguinte semi-reao:
CuS + 2e
Dados: Cu2+ + 2e
Cu
Cu + S2-
E0 = +0,337V; KpsCUS = 8x10-37
4) Fale sobre o erro cido e o erro alcalino na determinao de pH com eletrodo de vidro
(causas, limitaes, minimizao).
5) Liste as vantagens e desvantagens de uma titulao potenciomtrica com relao s
titulaes com indicadores visuais.
6) Quais os eletrodos indicadores, teoricamente, adequados para a seguinte titulao
potenciomtrica?
Pb(NO3)2(aq) + Na2S(aq)
PbS(s) + 2NaNO3(aq)
Admitindo-se que o Na2S seja o titulante, esboce a curva de titulao (E x V) para
cada caso.
A troca de eletrodos de referncia provocaria alguma alterao na curva de titulao?
E no volume do ponto de equivalncia?
7) Uma amostra de medicamento contm um analito A e uma outra substncia B. Um
eletrodo de membrana slida sensvel espcie A apresenta o seguinte coeficiente de
seletividade, em relao espcie B: KB,A = 0,56. Pergunta-se:
a) Para uma [A] = 0,003 mol/L, qual deve ser a concentrao mxima de B, para que o
erro da determinao de A, por potenciometria direta, seja de 2%?
b) Admitindo-se que a [B] seja a metade da [A], seria possvel determinar a concentrao
de A por potenciometria direta, sem a retirada ou mascaramento de B? E por titulao
potenciomtrica? Se a resposta for positiva, explicar em quais situaes isso se daria.
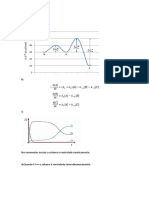
8) As seguintes leituras de pH foram obtidas durante uma titulao potenciomtrica de uma
alquota de
25,00 mL de um cido fraco monoprtico com soluo padro de NaOH 0,1165 N.
VOLUME
(mL)
0,00
2,00
4,00
10,00
pH
2,89
4,52
5,06
5,89
VOLUME
(mL)
12,00
14,00
15,00
15,50
pH
6,15
6,63
7,08
7,75
VOLUME
(mL)
15,60
15,70
15,80
16,00
pH
8,40
9,29
10,07
10,65
VOLUME
(mL)
17,00
18,00
20,00
24,00
pH
11,34
11,63
12,00
12,41
a- Construa a curva de pH em funo do volume de titulante;
b- Construa a curva da primeira derivada (pH/V) em funo do VNaOH
c- Construa a curva da segunda derivada (2pH/V2) em funo do VNaOH
d- Qual o valor do pH no ponto de equivalncia ?
e- Qual o volume de NaOH gasto at o ponto de equivalncia ?
f- Calcule a concentrao da soluo original do cido
g- Determine a constante de dissociao para este cido, por interpolao grfica.
9) Um comprimido de CaCO 3, para o tratamento de osteoporose, foi convenientemente
dissolvido e diludo em balo volumtrico de 100,0 mL. Uma alquota de 5,00 mL da soluo
diluda foi transferida para um segundo balo de 100,0 mL, que aps ter o volume
completado, foi analisado potenciometricamente, com um eletrodo seletivo para clcio,
fornecendo uma leitura de potencial de 22,5 mV. Uma srie de padres de Ca 2+ foram lidos
nas mesmas condies, fornecendo os valores da tabela abaixo.
[Ca2+] (mol/L)
3,38x10-5
3,38x10-4
3,38x10-3
3,38x10-2
3,38x10-1
E (mV)
-74,8
-46,4
-18,7
+10,0
+37,7
Admitindo-se que a fora inica da amostra e dos padres foi mantida constante, em 2 mol/L,
e que a bula do medicamento informa que cada comprimido contm 500 mg de CaCO 3,
pede-se:
a) a curva de calibrao E vs log[Ca2+];
b) o teor de CaCO3 da amostra e o erro relativo.
c) Avaliao sobre a confiabilidade do resultado e/ou do valor da bula.
ICEx Departamento de Qumica
QUI 221 - Anlise Instrumental A
Fernando Barboza Egreja Filho
LISTA DE EXERCCIO - CONDUTIMETRIA
1) Defina:
a- condutncia;
b- condutncia especfica;
c- condutncia equivalente.
2) Porque a condutncia equivalente aumenta com a diluio da soluo de:
a- eletrlitos fortes;
b- eletrlitos fracos.
3) O que condutncia equivalente diluio infinita e qual a sua utilidade na anlise
condutomtrica?
4) Quais os fatores que afetam a condutncia equivalente diluio infinita para ons
diferentes? Como isso se aplica para os ons H3O+ e OH-?
5) Liste algumas aplicaes da condutimetria direta e da titulao condutimtrica. Em Quais
casos necessrio conhecer-se a constante da clula condutimtrica (l/A)? Justifique.
6) Como se determina a constante da clula condutimtrica (calibrao do condutivmetro)?
7) Na condutimetria direta obrigatria a calibrao do condutivmetro? Justifique.
8) Quais os princpios da condutimetria direta e da titulao condutimtrica? Como podem
ser usadas na determinao de um analito?
9) Porque a condutometria direta mais limitada que a titulao condutomtrica, para a
determinao de uma mesma espcie em uma amostra real?
10) A titulao de cidos fracos com bases fracas mais exata por titulao condutomtrica
ou potenciomtrica? Justifique.
11) Porque, numa titulao condutomtrica, a soluo titulante deve estar muito mais
concentrada que a soluo do titulado? Como se corrigem os valores de condutividade, em
virtude da diluio causada pelo processo? Porque no se faz o mesmo na titulao
potenciomtrica?
12) Uma titulao condutimtrica de 0,2000 g de uma amostra que contm Fe(OH) 3, em 50
mL de gua, com HCl 1,080 mol/L forneceu os seguintes dados experimentais. Sabendo-se
que o Kps Fe(OH)3 = 1,6x10-39 e com os dados ao final da questo, pede-se:
a) Faa o grfico da curva de titulao, e calcule o teor de Fe(OH) 3 na amostra.
b) Explique o formato da curva de titulao.
V (mL)
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
Massas molares (g mol-1)
Cond. Eq. Dil. Inf. (S.cm2.equiv-1)
k (mS cm-1)
69,8
72,7
75,2
77,5
80,2
91,5
106,2
119,4
131,9
143,8
Fe = 56,0
H = 1,0
O = 16,0
Fe3+ = 68,4 Cl- = 76
H+ = 350
OH- = 198
Potrebbero piacerti anche
- Eletroanálises: aspectos teóricos e práticosDa EverandEletroanálises: aspectos teóricos e práticosNessuna valutazione finora
- Quimica AnaliticaDocumento7 pagineQuimica AnaliticanildeciNessuna valutazione finora
- Potenciometria: aspectos teóricos e práticosDa EverandPotenciometria: aspectos teóricos e práticosNessuna valutazione finora
- Volumetria de Oxidação e ReduçãoDocumento8 pagineVolumetria de Oxidação e ReduçãoKarol RochaNessuna valutazione finora
- Equilíbrio iônico: aplicações em química analíticaDa EverandEquilíbrio iônico: aplicações em química analíticaNessuna valutazione finora
- Conceitos Sobre Volumetria de NeutralizaçãoDocumento5 pagineConceitos Sobre Volumetria de NeutralizaçãosergiodelbiancofilhoNessuna valutazione finora
- Fixa de Exercicios Sobre SolucoesDocumento2 pagineFixa de Exercicios Sobre SolucoesBebeto TandaneNessuna valutazione finora
- Titulometria e Formação de ComplexosDocumento26 pagineTitulometria e Formação de ComplexosHenrique Fernandes100% (2)
- Métodos Electroquímicos de AnáliseDocumento80 pagineMétodos Electroquímicos de AnáliseAlito De Alima SupeteNessuna valutazione finora
- 5 - Relatorio Acidez Suco de LimãoDocumento3 pagine5 - Relatorio Acidez Suco de LimãoSidney Sillas50% (2)
- 03 Exercícios UV VisDocumento4 pagine03 Exercícios UV VisLeonardo Pereira100% (1)
- PR Tica 12 Caracteriza o de Complexos Via An Lise Condutom TricaDocumento5 paginePR Tica 12 Caracteriza o de Complexos Via An Lise Condutom TricaBeatriz ViannaNessuna valutazione finora
- Relatório Titulação de ComplexaçãoDocumento5 pagineRelatório Titulação de ComplexaçãoJulio Marcos CremonesiNessuna valutazione finora
- Aula 01 - Introdução Formulas MolecularesDocumento42 pagineAula 01 - Introdução Formulas MolecularesFabio WuNessuna valutazione finora
- Exercícios Com Resolução - Físico-Química PDFDocumento33 pagineExercícios Com Resolução - Físico-Química PDFLuara Lima50% (2)
- Relatório Método de Mohr (Padronização e Dosagem)Documento18 pagineRelatório Método de Mohr (Padronização e Dosagem)Júlia MatioliNessuna valutazione finora
- ListaEx 04 Quanti 2015 1Documento3 pagineListaEx 04 Quanti 2015 1ramiro_grivotNessuna valutazione finora
- CQ136 Reacão Entre Ácido Oxálico e Permangatato. Fatores Cinéticos...Documento3 pagineCQ136 Reacão Entre Ácido Oxálico e Permangatato. Fatores Cinéticos...atare_messiasNessuna valutazione finora
- Relatório - Fosfato Refrigerante (Coca-Cola)Documento6 pagineRelatório - Fosfato Refrigerante (Coca-Cola)Bruna FariasNessuna valutazione finora
- Potenciometria e CondutimetriaDocumento118 paginePotenciometria e Condutimetriaogeid.ar@gmail.com100% (1)
- Exercícios de Química Analítica QuantitativaDocumento21 pagineExercícios de Química Analítica QuantitativaLídia LeiteNessuna valutazione finora
- Aula 01Documento34 pagineAula 01pablojorgesilva100% (1)
- Analexp 2 - Experimento 8 - IodometriaDocumento6 pagineAnalexp 2 - Experimento 8 - IodometriaSamuel AguiarNessuna valutazione finora
- Determinação do λ máximo de uma solução padrão KMnO4Documento11 pagineDeterminação do λ máximo de uma solução padrão KMnO4antoniaroseluciaNessuna valutazione finora
- Fisicoquimica BDocumento57 pagineFisicoquimica BGisa Jacques50% (2)
- Resolução Comentada de Exercícios de Química AnalíticaDocumento26 pagineResolução Comentada de Exercícios de Química AnalíticaJulierme LisianeNessuna valutazione finora
- Relatorio 9Documento7 pagineRelatorio 9Flavio SousaNessuna valutazione finora
- Volumetria de Complexação - Análise de CA em Leite em PóDocumento13 pagineVolumetria de Complexação - Análise de CA em Leite em PóEvandro Serafim Morais100% (1)
- Relatório VITAMINA CDocumento7 pagineRelatório VITAMINA CRaylson CoelhoNessuna valutazione finora
- Lista Volumetria Complexação e Oxido-Redução1Documento2 pagineLista Volumetria Complexação e Oxido-Redução1Mariana GarciaNessuna valutazione finora
- Exercícios Com RespostaDocumento28 pagineExercícios Com Respostahelena76760% (5)
- Testo de Apoio Equilibrio QuimicoDocumento18 pagineTesto de Apoio Equilibrio QuimicoMira Luis BasilioNessuna valutazione finora
- Lista 02 - Volumetria de ComplexacaoDocumento2 pagineLista 02 - Volumetria de ComplexacaoAna Raquel MartinsNessuna valutazione finora
- Prática 7 e 8 - VOLUMETRIA DE PRECIPITACAO.1Documento11 paginePrática 7 e 8 - VOLUMETRIA DE PRECIPITACAO.1VANESSA ZIMERMANN DE OLIVEIRA ILLA FONTNessuna valutazione finora
- Físico Química I Calor de DissoluçãoDocumento6 pagineFísico Química I Calor de DissoluçãoProst Mohamed0% (1)
- Hidrólise Catalisada Por Um ÉsterDocumento11 pagineHidrólise Catalisada Por Um ÉsterHenrique Fernandes100% (2)
- Titulação Potenciometrica de NeutralizaçãoDocumento13 pagineTitulação Potenciometrica de NeutralizaçãoAndressa CarvalhoNessuna valutazione finora
- 2015 - 04 - 19 REsolucaoDocumento20 pagine2015 - 04 - 19 REsolucaoMariana SilvaNessuna valutazione finora
- Listadeexe Txtrcicios3unidade3Documento4 pagineListadeexe Txtrcicios3unidade3Andressa BarcellosNessuna valutazione finora
- 3 - Análise Gravimétrica Por Prec 2Documento11 pagine3 - Análise Gravimétrica Por Prec 2Luan ModestoNessuna valutazione finora
- Determinação de CloretosDocumento14 pagineDeterminação de CloretosIldemarFernandesNessuna valutazione finora
- Solucao TampaoDocumento22 pagineSolucao TampaoYorladyNessuna valutazione finora
- Relatório Da AspirinaDocumento13 pagineRelatório Da AspirinaSuzany ToledoNessuna valutazione finora
- Postagem 1 IcfDocumento9 paginePostagem 1 IcfBreno BlogsNessuna valutazione finora
- Dosagem de AçúcarDocumento4 pagineDosagem de AçúcarThiagoV_Nessuna valutazione finora
- TampãoDocumento3 pagineTampãoNeiliane Souza100% (1)
- Química AnalíticaDocumento97 pagineQuímica Analíticajulianaquimica9034Nessuna valutazione finora
- Impresso Quimica Analitica QualitativaDocumento126 pagineImpresso Quimica Analitica QualitativaSan Carvalho100% (3)
- Determinação de Cobre em Cachaça Por Absorção AtômicaDocumento16 pagineDeterminação de Cobre em Cachaça Por Absorção AtômicaMariErculanoNessuna valutazione finora
- Titulação de Oxi-ReduçãoDocumento19 pagineTitulação de Oxi-ReduçãoDaniel LemosNessuna valutazione finora
- NBR 13856 (Maio 1997) - Aguardente de Cana - Determinação de Acidez Titulável Total, Volátil Total e FixaDocumento4 pagineNBR 13856 (Maio 1997) - Aguardente de Cana - Determinação de Acidez Titulável Total, Volátil Total e FixaYuri Bahia de VasconcelosNessuna valutazione finora
- Potenciometria Curva de Calibracao e Adição PadraoDocumento49 paginePotenciometria Curva de Calibracao e Adição PadraoMaxNessuna valutazione finora
- Relatório Química AnalíticaDocumento13 pagineRelatório Química AnalíticaMiriely TorresNessuna valutazione finora
- Lista de Exercícios Equivalente Grama e NormalidadeDocumento1 paginaLista de Exercícios Equivalente Grama e NormalidadeCristianeNessuna valutazione finora
- Lista Potencio e CondutoDocumento2 pagineLista Potencio e CondutoWelma Lima0% (1)
- Relatorio PotenciometriaDocumento10 pagineRelatorio PotenciometriarjeovanNessuna valutazione finora
- Relatorio PotenciometriaDocumento10 pagineRelatorio PotenciometriafranciscosaintclairNessuna valutazione finora
- 1 Lista de Exercícios - Análise Instrumental - Ciência Da InstrumentaçãoDocumento4 pagine1 Lista de Exercícios - Análise Instrumental - Ciência Da InstrumentaçãoDanny CiciliotteNessuna valutazione finora
- Af Eq2021Documento3 pagineAf Eq2021pedro.studart82Nessuna valutazione finora
- AdhbhskDocumento3 pagineAdhbhskKatia FonsecaNessuna valutazione finora
- CAREPADocumento9 pagineCAREPAIuri GorneNessuna valutazione finora
- 3 AbcdDocumento1 pagina3 AbcdIuri GorneNessuna valutazione finora
- Corrosão Causada Por MO - Iuri GorneDocumento8 pagineCorrosão Causada Por MO - Iuri GorneIuri GorneNessuna valutazione finora
- Apre. Ciclones e HidrociclonesDocumento31 pagineApre. Ciclones e HidrociclonesIuri GorneNessuna valutazione finora
- BiolixiviaçãoDocumento15 pagineBiolixiviaçãoIuri GorneNessuna valutazione finora
- 4 AbcDocumento2 pagine4 AbcIuri GorneNessuna valutazione finora
- 1 BDocumento2 pagine1 BIuri GorneNessuna valutazione finora
- Lista de Exercicios de Pesquisa Operacional Com RespostasDocumento14 pagineLista de Exercicios de Pesquisa Operacional Com RespostasArnaldo Araújo87% (119)
- 2 AbcDocumento2 pagine2 AbcIuri GorneNessuna valutazione finora
- 1 AbcDocumento4 pagine1 AbcIuri GorneNessuna valutazione finora
- Lista de Exercicios de Pesquisa Operacional Com RespostasDocumento14 pagineLista de Exercicios de Pesquisa Operacional Com RespostasArnaldo Araújo87% (119)
- Condicionamento Do GN-DesidrataçãoDocumento31 pagineCondicionamento Do GN-DesidrataçãoIuri GorneNessuna valutazione finora
- Apostila - Inorg - Exp - 2004.2 - UFPEDocumento45 pagineApostila - Inorg - Exp - 2004.2 - UFPEIuri GorneNessuna valutazione finora
- RESUMODocumento1 paginaRESUMOIuri GorneNessuna valutazione finora
- Cadernoi 17 09 2012Documento33 pagineCadernoi 17 09 2012Iuri GorneNessuna valutazione finora
- Algoritmo Por FluxogramaDocumento24 pagineAlgoritmo Por Fluxogramanegro1000gralNessuna valutazione finora
- Tratamento Biologico de EfluentesDocumento2 pagineTratamento Biologico de EfluentesAbrão JuniorNessuna valutazione finora
- BiolixiviaçãoDocumento15 pagineBiolixiviaçãoIuri GorneNessuna valutazione finora
- Processos de TratamentoDocumento4 pagineProcessos de TratamentoIuri GorneNessuna valutazione finora
- Conhe 8Documento77 pagineConhe 8Iuri GorneNessuna valutazione finora
- Conhe 8Documento77 pagineConhe 8Iuri GorneNessuna valutazione finora
- Lista 03Documento1 paginaLista 03Iuri GorneNessuna valutazione finora
- PráticaDocumento16 paginePráticaIuri GorneNessuna valutazione finora
- Arq 667Documento20 pagineArq 667Jaqueline SantosNessuna valutazione finora
- TC030 PolimerosDocumento180 pagineTC030 PolimerosinvocatlunaNessuna valutazione finora
- Slago PascalDocumento16 pagineSlago PascalAndréa GrucciNessuna valutazione finora
- FlorDocumento29 pagineFlorIuri GorneNessuna valutazione finora
- Atlas de Energia Elétrica No BrasilDocumento236 pagineAtlas de Energia Elétrica No BrasilPablo BarretoNessuna valutazione finora
- 9ex8-2010 Analise ConformacionalDocumento2 pagine9ex8-2010 Analise ConformacionalIuri GorneNessuna valutazione finora
- Belzer Chaves de Fenda e Phillips EtorxDocumento9 pagineBelzer Chaves de Fenda e Phillips EtorxZeBocaoNessuna valutazione finora
- Aula PráTica 4 - Osmose e CicloseDocumento12 pagineAula PráTica 4 - Osmose e CicloseLEONARDO LOTTINessuna valutazione finora
- Como Capturar AbelhasDocumento50 pagineComo Capturar AbelhasGuilherme BessaNessuna valutazione finora
- Ficha de EmergenciaDocumento1 paginaFicha de EmergenciaalvinhobrNessuna valutazione finora
- Oculto em Branco NovoDocumento129 pagineOculto em Branco NovoVinicius FerreiraNessuna valutazione finora
- Corrosão AtmosféricaDocumento55 pagineCorrosão AtmosféricaNicolas MamedeNessuna valutazione finora
- Controle Físico Da Mente v1-3Documento41 pagineControle Físico Da Mente v1-3Hi Deys Per100% (1)
- Lombalgia e Discopatia Degenerativa 2015Documento61 pagineLombalgia e Discopatia Degenerativa 2015Renan Scalon MachadoNessuna valutazione finora
- BRG - Lista de Alarmes e Possíveis CausasDocumento8 pagineBRG - Lista de Alarmes e Possíveis CausasSBLOK GERADORESNessuna valutazione finora
- Sons Harmónicos e Sons Complexos - Aula de 6 de DezembroDocumento2 pagineSons Harmónicos e Sons Complexos - Aula de 6 de DezembroSonia CoelhoNessuna valutazione finora
- Cronograma ENEM - BiologiaDocumento5 pagineCronograma ENEM - BiologiaEmanuel OkamaMasterNessuna valutazione finora
- Roteiro SNC TelencéfaloDocumento4 pagineRoteiro SNC TelencéfaloThiago OliveiraNessuna valutazione finora
- SangueDocumento5 pagineSangueJúlia LimaNessuna valutazione finora
- Intervenção Psicossocial em Desastres e CatástrofesDocumento6 pagineIntervenção Psicossocial em Desastres e CatástrofesLuan NasaNessuna valutazione finora
- Casos Clinicos de Transtornos Do HumorDocumento3 pagineCasos Clinicos de Transtornos Do HumorAntonio Smith MullerNessuna valutazione finora
- Lista Exercícios Hidraulica SolosDocumento4 pagineLista Exercícios Hidraulica SolosGuilherme RamosNessuna valutazione finora
- Cardápios para Dieta BHCGDocumento4 pagineCardápios para Dieta BHCGAlexandreBellaCruzNessuna valutazione finora
- Ficha AtendimentoDocumento4 pagineFicha AtendimentoGiovanna CarpintieriNessuna valutazione finora
- TrabalhoDocumento6 pagineTrabalhoLucasBruxelNessuna valutazione finora
- Volume 2 - Ebook AtivamenteDocumento111 pagineVolume 2 - Ebook AtivamenteNathalia SanzNessuna valutazione finora
- IRASSemana1 Aula1 Introducao PT-231001-181119Documento9 pagineIRASSemana1 Aula1 Introducao PT-231001-181119Igor SilvaNessuna valutazione finora
- Importancia Da Agua No Laboratorio PDFDocumento7 pagineImportancia Da Agua No Laboratorio PDFWadson Leite BarbosaNessuna valutazione finora
- Modelo de Laudo Autismo em PDF AtdocxDocumento3 pagineModelo de Laudo Autismo em PDF AtdocxProfessora Claudia100% (2)
- C04010005 - 003 - Ventilador Pulmonar - Vento Neo PlusDocumento230 pagineC04010005 - 003 - Ventilador Pulmonar - Vento Neo PlusVicente FerreiraNessuna valutazione finora
- Princípios Gerais de PsicofarmacologiaDocumento28 paginePrincípios Gerais de PsicofarmacologiaMariana MarinhoNessuna valutazione finora
- Crioterapia1 1Documento5 pagineCrioterapia1 1Mirelly MirllysNessuna valutazione finora
- Farmácia: Psu-Resmulti/Ce - 2023Documento17 pagineFarmácia: Psu-Resmulti/Ce - 2023Nay LimaNessuna valutazione finora
- Apostila Classificação de Polímeros PDFDocumento82 pagineApostila Classificação de Polímeros PDFErickNessuna valutazione finora
- Histórico Da Terapia Cognitiva - KeyDocumento17 pagineHistórico Da Terapia Cognitiva - Keyraysa klasenerNessuna valutazione finora
- 1° Exercício de Fixação - Semana 4 - Francis AlvarengaDocumento3 pagine1° Exercício de Fixação - Semana 4 - Francis AlvarengaRenatta RenattinhaNessuna valutazione finora
- Focar: Supere a procrastinação e aumente a força de vontade e a atençãoDa EverandFocar: Supere a procrastinação e aumente a força de vontade e a atençãoValutazione: 4.5 su 5 stelle4.5/5 (53)
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisDa EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisValutazione: 4.5 su 5 stelle4.5/5 (169)
- Os Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaDa EverandOs Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaNessuna valutazione finora
- Técnicas Proibidas de Manipulação Mental e PersuasãoDa EverandTécnicas Proibidas de Manipulação Mental e PersuasãoValutazione: 5 su 5 stelle5/5 (3)
- Bololô: contém ferramentas de treinamento para pais e filhosDa EverandBololô: contém ferramentas de treinamento para pais e filhosNessuna valutazione finora
- Psicologia sombria: Poderosas técnicas de controle mental e persuasãoDa EverandPsicologia sombria: Poderosas técnicas de controle mental e persuasãoValutazione: 4 su 5 stelle4/5 (92)
- Técnicas De Terapia Cognitivo-comportamental (tcc)Da EverandTécnicas De Terapia Cognitivo-comportamental (tcc)Nessuna valutazione finora
- Diálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisDa EverandDiálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisValutazione: 5 su 5 stelle5/5 (1)
- Treinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)Da EverandTreinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)Valutazione: 4.5 su 5 stelle4.5/5 (29)
- 35 Técnicas e Curiosidades Mentais: Porque a mente também deve evoluirDa Everand35 Técnicas e Curiosidades Mentais: Porque a mente também deve evoluirValutazione: 5 su 5 stelle5/5 (3)
- Freud no século XXI: Volume 1: O que é psicanálise?Da EverandFreud no século XXI: Volume 1: O que é psicanálise?Nessuna valutazione finora
- Treino de Habilidades Sociais: processo, avaliação e resultadosDa EverandTreino de Habilidades Sociais: processo, avaliação e resultadosValutazione: 5 su 5 stelle5/5 (2)
- Biomecânica Básica dos Exercícios: Membros InferioresDa EverandBiomecânica Básica dos Exercícios: Membros InferioresValutazione: 3.5 su 5 stelle3.5/5 (8)
- Elaboração de programas de ensino: material autoinstrutivoDa EverandElaboração de programas de ensino: material autoinstrutivoNessuna valutazione finora
- Psicanálise de boteco: O inconsciente na vida cotidianaDa EverandPsicanálise de boteco: O inconsciente na vida cotidianaValutazione: 5 su 5 stelle5/5 (1)
- Cartas de um terapeuta para seus momentos de criseDa EverandCartas de um terapeuta para seus momentos de criseValutazione: 4 su 5 stelle4/5 (11)
- Simplificando o Autismo: Para pais, familiares e profissionaisDa EverandSimplificando o Autismo: Para pais, familiares e profissionaisNessuna valutazione finora